La ciclofosfamida (CFM) estabiliza los parámetros del estudio funcional respiratorio (EFR) de los pacientes con esclerosis sistémica (ES) y enfermedad pulmonar intersticial (EPI) tratados durante 12 meses. Existe poca información acerca del tratamiento a largo plazo (24 meses). El objetivo del estudio es analizar el efecto de la CFM endovenosa en los parámetros del EFR de los pacientes con ES y EPI tratados durante 24 meses.
Pacientes y métodoEstudio retrospectivo de 37 pacientes con EPI asociada a esclerodermia, tratados con CFM endovenosa durante 24 meses y evaluados de forma periódica mediante EFR (basal, a los 6, 12 y 24 meses). En este se evaluó la capacidad vital forzada (FVC) y la capacidad de transferencia de monóxido de carbono (DLCO).
ResultadosLas diferencias entre los valores de FVC y DLCO basales y los realizados a los 6, 12 y 24 meses fueron menores del 10%, lo que significa que la CFM estabilizó los parámetros funcionales. Tampoco se detectaron diferencias en la FVC ni en la DLCO cuando se valoró a los pacientes tratados durante 6 meses de acuerdo al tipo de afectación cutánea de la ES (difusa o limitada), o según el tiempo de evolución de la EPI antes del inicio del tratamiento. Si bien los pacientes con restricción grave (FVC<70%) al inicio mostraron mayor mejoría, esta fue en todos los casos inferior al 10%.
ConclusiónEn esta serie de pacientes con EPI asociada a ES, la CFM endovenosa estabilizó los parámetros funcionales respiratorios en el tratamiento a largo plazo.
Cyclophosphamide (CYC) stabilizes the parameters of lung function tests (LFT) of patients with (SSc) and interstitial lung disease (ILD) treated for 12 months. There is little information about long-term treatment (24 months). The aim of this study is to analyze the effect of intravenous CYC in LFT parameters in patients with SSc and ILD treated for 24 months.
Patients and methodRetrospective study of 37 patients with ILD associated with scleroderma treated with intravenous CYC for 24 months and regularly assessed by LFT (at baseline, 6, 12 and 24 months) including forced vital capacity (FVC) and transfer capacity of carbon monoxide (DLCO). To evaluate response to treatment the recommendations of the ATS and SEPAR were considered.
ResultsThe difference between FVC and DLCO values performed at baseline and those performed at 6, 12, and 24 months were less than 10%, which meant that CYC stabilized LFT. There were no differences in LFT when patients treated for 6 months were evaluated according to the type of skin involvement of the SSc (diffuse or limited) and the duration of the ILD. Although patients with severe restriction (FVC<70%) showed more improvement, it was less than 10% in all cases.
ConclusionIn this series of patients with ILD associated with SSc intravenous CYC was effective in stabilizing LFT in long-term treatment.
La esclerosis sistémica (ES) es una enfermedad que se caracteriza por la coexistencia de una base autoinmune, una afectación microvascular y un incremento de la producción y depósito de colágeno en la piel (esclerodermia) y en diferentes órganos (pulmones, tracto digestivo, corazón y riñones)1. Las dos manifestaciones pulmonares más importantes son la enfermedad pulmonar intersticial (EPI) y la hipertensión arterial pulmonar2 (HTAP), que constituyen la primera causa de muerte de estos pacientes3. En concreto, alrededor de un 16% de estas muertes son debidas de forma directa a la EPI2.
La EPI es más frecuente en pacientes con afectación cutánea difusa. La lesión anatomopatológica más característica, presente en más del 75% de los pacientes, es la neumonía intersticial no específica4. El mecanismo fisiopatológico de la EPI en la ES no se conoce con exactitud, pero incluye procesos inmunológicos, inflamatorios y de daño vascular. Se ha propuesto que el depósito de colágeno se produce por las interacciones entre las células endoteliales, mononucleares (linfocitos y monocitos) y los fibroblastos. Todo esto desencadenaría la producción de citocinas activadoras de fibrosis en el contexto de hiperreactividad vascular e hipoxia tisular5.
El estudio funcional respiratorio (EFR) tiene un papel clave en el diagnóstico de la EPI en pacientes con ES. Se trata de un procedimiento poco invasivo y de fácil realización, útil en la valoración de la existencia, intensidad y progresión de la EPI en estos pacientes6. El EFR debe incluir una gasometría arterial, la espirometría forzada (FVC) y la capacidad de transferencia del monóxido de carbono (DLCO). El patrón restrictivo con disminución de la FVC y normalidad del cociente FEV1/ FVC es el más frecuente.
En la actualidad el objetivo más realista del tratamiento de la EPI asociada a la ES es evitar la progresión de la EPI, sobre todo en aquellos pacientes con una afectación más extensa del parénquima pulmonar7. El inmunodepresor del que se dispone una mayor experiencia es la ciclofosfamida (CFM). Los resultados de tres estudios prospectivos, aleatorizados y controlados, tomando como variables de estudio la FVC y la DLCO sugieren que el tratamiento con CFM, tanto por vía oral8,9 como endovenosa10 durante 12 meses, puede estabilizar la EPI en pacientes con ES. Un metaanálisis que recogió los resultados de estos estudios y de 6 observacionales confirmó este hallazgo, con una baja incidencia de efectos secundarios con el uso de dicho fármaco11. Además, algunos estudios en los que el tratamiento con CFM se administró durante sólo 6 meses también han demostrado eficacia12,13. Por todo ello, en la actualidad se recomienda el uso de CFM para el tratamiento de la EPI en los pacientes con ES14,15.
La mayoría de los estudios incluidos en el metaanálisis valoraron el efecto del tratamiento inmunodepresor a los 12 meses y en sólo dos de ellos, el seguimiento fue de 1816 y 2417 meses respectivamente.
El objetivo del presente estudio es analizar de forma retrospectiva mediante la medición seriada de la FVC y DLCO, el efecto a corto (6 meses), medio (12 meses) y largo plazo (24 meses) del tratamiento con pulsos endovenosos de CFM sobre la evolución de la EPI en una cohorte de pacientes con ES.
2Material y métodos2.1PacientesSe ha llevado a cabo un análisis retrospectivo de todos los pacientes con ES y EPI que han realizado tratamiento con pulsos endovenosos de CFM en el Servicio de Enfermedades Autoinmunes del Hospital Clinic (HCB), y en el Servicio de Medicina Interna del Hospital Vall d’Hebron (HVH) de Barcelona durante el periodo comprendido entre diciembre de 1996 y febrero de 2007. Se excluyeron los pacientes que presentaron otras lesiones pulmonares y aquellos que no pudieron ser controlados durante el seguimiento. Todos los pacientes incluidos estaban afectos de ES según los criterios clasificatorios aceptados18. La presencia de EPI asociada se confirmó ante un cuadro clínico compatible y/o la existencia de un patrón restrictivo en el EFR y hallazgos compatibles con EPI en la tomografía computarizada torácica de alta resolución19. En los casos dudosos se descartaron otros diagnósticos como infección o neoplasia mediante las exploraciones complementarias correspondientes. Además se descartó la coexistencia de HTAP mediante ecocardiografía y cateterismo derecho en aquellos casos en que estuvo indicado.
Se recogieron otros datos epidemiológicos y clínicos que no se incluyeron en los objetivos del estudio como son la edad, el sexo, el tipo de esclerodermia y el grado de disnea según la clasificación de la New York Heart Association (NYHA)20, previo al inicio del tratamiento. El proyecto fue aprobado por los comités éticos de los dos hospitales participantes en el estudio.
2.2Esquema de tratamientoEl esquema del tratamiento consistió en pulsos endovenosos de CFM previa pauta establecida de hidratación. En el caso de los pacientes tratados en el HVH la dosis de CFM fue de 600mg/ m2, con una periodicidad mensual durante los primeros 6 meses, bimensual hasta cumplir 12 meses y trimestral hasta los 24 meses de tratamiento. La pauta utilizada en el HCB fue de 750mg/ m2 de superficie corporal, los primeros 6 pulsos se administraron de forma mensual seguidos de un régimen trimestral hasta completar los 24 meses de tratamiento. A este se asoció en todos los casos una pauta de glucocorticoides a dosis descendente. Para los pacientes tratados en el HVH la dosis de prednisona inicial fue de 50mg/ día y se continuó con una pauta descendente de 5mg/ semana hasta alcanzar una dosis de 5-7,5mg/ día que se mantuvo durante todo el tratamiento. Para los pacientes tratados en el HCB la dosis inicial fue de 1mg/ kg/ día con dosis máxima de 60mg/ día y pauta descendente de 10mg/ mes hasta una dosis de 5mg/ día que se mantuvo hasta los dos años. Todos los pacientes recibieron tratamiento con suplementos de calcio y vitamina D con el fin de prevenir la osteoporosis inducida por glucocorticoides.
2.3Estudios funcionales respiratoriosLos EFR se realizaron en el periodo comprendido entre octubre de 1996 y septiembre de 2008. En todos los pacientes se realizaron determinaciones de espirometría forzada, volúmenes pulmonares por pletismografía y DLCO. Los resultados se expresaron en un porcentaje con respecto al esperado para cada paciente. Según los valores de la FVC y DLCO se clasificó la gravedad de la EPI en leve (entre 70 y 79%), moderada (entre 50 y 69%) y grave (por debajo del 50% de los valores teóricos)21. Para valorar la respuesta al tratamiento mediante los valores del EFR se siguieron las recomendaciones de la American Thoracic Society (ATS) y de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR)22,23. Según estas recomendaciones se considera que existe mejoría si se da un aumento de la FVC ≥ 10% o la DLCO ≥ 15%, estabilización si los cambios en la FVC son menores al 10 o al 15% en la DLCO y empeoramiento si la FVC disminuye ≥ 10% o la DLCO ≥ 15%. En todos los enfermos se realizó un EFR antes de iniciar el tratamiento (en el momento del diagnóstico de la EPI) y se repitieron a los 6, 12 y 24 meses de iniciado el tratamiento (el último correspondió al momento en el que se completaban los pulsos de CFM).
2.4Análisis estadísticoPara el análisis estadístico de la comparación de los parámetros del EFR al inicio y a los 6, 12 y 24 meses se seleccionaron los pacientes que en cada punto temporal hubieran completado el tratamiento y se les hubiera realizado el EFR correspondiente. Para la comparación de variables categóricas entre los diferentes grupos se utilizó el test exacto de Fisher. El test de McNemar (entre dos grupos) y el Q de Cochran (más de dos grupos) se utilizaron para la comparación de variables intragrupales. Para variables continuas con dos grupos se utilizó la “t” de Student y la ANOVA para más de dos grupos.
3Resultados3.1Características generalesSe incluyeron en el estudio 37 pacientes (21 en el HCB y 16 en el HVH) cuyas características generales aparecen reflejadas en la tabla 1. Todos los pacientes recibieron al menos 6 pulsos mensuales de CFM, 32 (86%) completaron el tratamiento de un año y 26 (70%) pacientes recibieron tratamiento hasta completar los dos años.
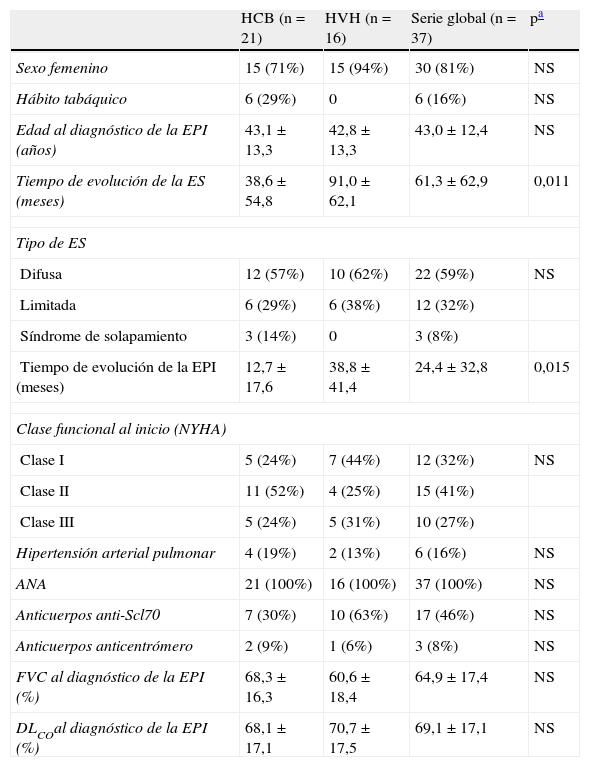
Características demográficas, clínicas e inmunológicas de los pacientes con esclerosis sistémica y enfermedad pulmonar intersticial asociada
| HCB (n=21) | HVH (n=16) | Serie global (n=37) | pa | |
| Sexo femenino | 15 (71%) | 15 (94%) | 30 (81%) | NS |
| Hábito tabáquico | 6 (29%) | 0 | 6 (16%) | NS |
| Edad al diagnóstico de la EPI (años) | 43,1±13,3 | 42,8±13,3 | 43,0±12,4 | NS |
| Tiempo de evolución de la ES (meses) | 38,6±54,8 | 91,0±62,1 | 61,3±62,9 | 0,011 |
| Tipo de ES | ||||
| Difusa | 12 (57%) | 10 (62%) | 22 (59%) | NS |
| Limitada | 6 (29%) | 6 (38%) | 12 (32%) | |
| Síndrome de solapamiento | 3 (14%) | 0 | 3 (8%) | |
| Tiempo de evolución de la EPI (meses) | 12,7±17,6 | 38,8±41,4 | 24,4±32,8 | 0,015 |
| Clase funcional al inicio (NYHA) | ||||
| Clase I | 5 (24%) | 7 (44%) | 12 (32%) | NS |
| Clase II | 11 (52%) | 4 (25%) | 15 (41%) | |
| Clase III | 5 (24%) | 5 (31%) | 10 (27%) | |
| Hipertensión arterial pulmonar | 4 (19%) | 2 (13%) | 6 (16%) | NS |
| ANA | 21 (100%) | 16 (100%) | 37 (100%) | NS |
| Anticuerpos anti-Scl70 | 7 (30%) | 10 (63%) | 17 (46%) | NS |
| Anticuerpos anticentrómero | 2 (9%) | 1 (6%) | 3 (8%) | NS |
| FVC al diagnóstico de la EPI (%) | 68,3±16,3 | 60,6±18,4 | 64,9±17,4 | NS |
| DLCOal diagnóstico de la EPI (%) | 68,1±17,1 | 70,7±17,5 | 69,1±17,1 | NS |
Las variables continuas se presentan como media±desviación estándar. Las variables categóricas como el número absoluto y el porcentaje entre paréntesis.
Se refiere a la comparación entre los pacientes según el hospital de procedencia. DLCO: capacidad de transferencia de CO; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; FVC: capacidad vital forzada; HCB: Hospital Clinic de Barcelona; NS: no significativa; HVH: Hospital de Vall d’Hebrón; NYHA: New York Heart Association.
De los 21 pacientes tratados en el HCB, 12 (57%) completaron los dos años de tratamiento, mientras 19 (91%) completaron el tratamiento hasta el año por indicación del médico responsable. Los dos pacientes restantes sólo recibieron 6 pulsos mensuales de CFM. Una de las pacientes prefirió seguir el tratamiento de mantenimiento con ácido micofenólico, y en el otro caso se decidió no proseguir el tratamiento inmunodepresor debido a su avanzada edad. De los 16 pacientes tratados en el HVH, 11 (69%) completaron el tratamiento de dos años. Trece (81%) completaron el tratamiento bimensual hasta el año. Las causas de su suspensión fueron en un caso por linfopenia, hipogammaglobulinemia e infecciones respiratorias de repetición, y en el otro por cambio de domicilio de la enferma, respectivamente. Los 3 (19%) restantes sólo realizaron el tratamiento con 6 pulsos mensuales debido al resultado de la FVC superior al 80% en el EFR, a un fallecimiento por insuficiencia respiratoria secundaria a HTAP y al desarrollo de linfopenia, respectivamente.
No existieron diferencias en la distribución por sexos, en el tipo de ES ni en la distribución de los anticuerpos entre los pacientes según el hospital de procedencia (tabla 1). Es destacable que los pacientes tratados en el HCB presentaban un menor tiempo de evolución de su ES (38,6±54,8 meses vs 91,0±62,1 meses; p=0,011) en el momento del diagnóstico de la EPI. Además, también presentaban un menor tiempo de evolución de su EPI al inicio del tratamiento (12,7±17,6 meses vs 38,8±41,4 meses; p=0,015). En cuanto a la disnea al inicio del tratamiento 10 (27%) pacientes presentaban disnea de clase III, 15 (41%) de clase II y 12 (32%) estaban en clase funcional I.
Seis pacientes presentaban HTAP en el momento del inicio del tratamiento con CFM, aunque las cifras de presión arterial pulmonar media fueron menores de 35mm Hg.
La dosis media de glucocorticoides al inicio del tratamiento fue de 52,1±18,9mg/ día, a los 6 meses de 13,3±10,3mg/ día, a los 12 meses de 8,3±4,6mg/día y a los 24 meses de 7,2±4,4mg/ día, respectivamente, sin diferencias entre los dos hospitales. La dosis acumulada de CFM en el global de la serie fue de 10,1±3,7g sin diferencias entre los dos hospitales.
3.2Estudios funcionales respiratoriosEn la serie global los pacientes presentaron una EPI moderada-leve con FVC y DLCO de 64,9%±17,4% y 69,1%±17,1%, respectivamente. Como se ha indicado en el apartado del análisis estadístico, para realizar la valoración de la respuesta al tratamiento se seleccionaron los pacientes que en cada punto temporal (6, 12 y 24 meses) hubieran recibido el tratamiento y en los que se había realizado el correspondiente EFR. Con esta premisa 31 (84%) pacientes completaron los 6 meses de tratamiento con EFR posterior, 21 (57%) completaron el año de tratamiento con el EFR correspondiente y 17 (46%) pacientes recibieron tratamiento durante dos años con EFR al final de este. En la serie global el EFR correspondiente a los 6 meses se realizó a los 6,1±1,6 meses, el correspondiente al año a los 13,6±3,6 meses y el de los dos años a los 23,6±4,4 meses, sin detectarse diferencias entre los dos hospitales.
Las determinaciones de FVC y de DLCO en las diferentes mediciones temporales están reflejadas en las tablas 2, 3 y 4. En la serie global no hubo diferencias significativas en ninguno de los parámetros funcionales en los diferentes puntos temporales (6, 12 y 24 meses). De hecho, las diferencias entre la FVC y la DLCO al inicio y al final de cada tratamiento fueron inferiores al 5% en todas las determinaciones.
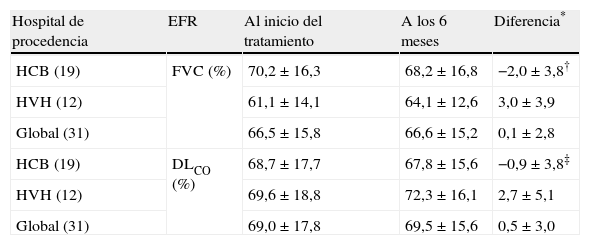
Estudio funcional respiratorio basal y a los 6 meses de los pacientes con ES y EPI tratados con pulsos mensuales de ciclofosfamida durante 6 meses
| Hospital de procedencia | EFR | Al inicio del tratamiento | A los 6 meses | Diferencia* |
| HCB (19) | FVC (%) | 70,2±16,3 | 68,2±16,8 | −2,0±3,8† |
| HVH (12) | 61,1±14,1 | 64,1±12,6 | 3,0±3,9 | |
| Global (31) | 66,5±15,8 | 66,6±15,2 | 0,1±2,8 | |
| HCB (19) | DLCO (%) | 68,7±17,7 | 67,8±15,6 | −0,9±3,8‡ |
| HVH (12) | 69,6±18,8 | 72,3±16,1 | 2,7±5,1 | |
| Global (31) | 69,0±17,8 | 69,5±15,6 | 0,5±3,0 |
Las variables continuas se presentan como media±desviación estándar. Los números entre paréntesis indican los pacientes analizados en cada grupo.
*Diferencia positiva significa mejoría respecto al inicio, diferencia negativa significa empeoramiento respecto al inicio.
†p=0,001 entre la diferencia de FVC entre el EFR inicial y a los 6 meses de los pacientes según el hospital de procedencia; ‡p=0,032 entre la diferencia de DLCO entre el EFR inicial y a los 6 meses de los pacientes según el hospital de procedencia; DLCO: capacidad de transferencia; EFR: estudio funcional respiratorio; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; FVC: capacidad vital forzada; HCB: Hospital Clinic de Barcelona; HVH: Hospital Vall d’Hebrón.
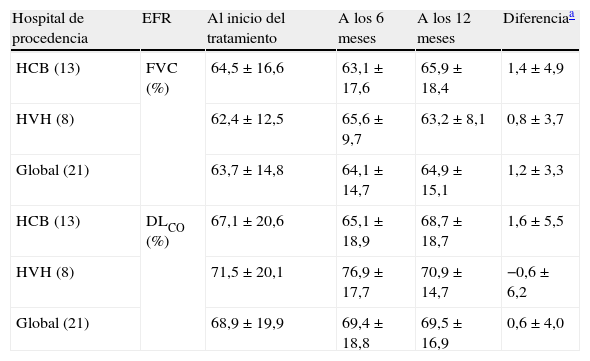
Estudio funcional respiratorio basal, a los 6 y a los 12 meses, de los pacientes con ES y EPI tratados con pulsos mensuales de ciclofosfamida durante un año
| Hospital de procedencia | EFR | Al inicio del tratamiento | A los 6 meses | A los 12 meses | Diferenciaa |
| HCB (13) | FVC (%) | 64,5±16,6 | 63,1±17,6 | 65,9±18,4 | 1,4±4,9 |
| HVH (8) | 62,4±12,5 | 65,6±9,7 | 63,2±8,1 | 0,8±3,7 | |
| Global (21) | 63,7±14,8 | 64,1±14,7 | 64,9±15,1 | 1,2±3,3 | |
| HCB (13) | DLCO (%) | 67,1±20,6 | 65,1±18,9 | 68,7±18,7 | 1,6±5,5 |
| HVH (8) | 71,5±20,1 | 76,9±17,7 | 70,9±14,7 | −0,6±6,2 | |
| Global (21) | 68,9±19,9 | 69,4±18,8 | 69,5±16,9 | 0,6±4,0 |
Las variables continuas se presentan como media±desviación estándar. Los números entre paréntesis indican los pacientes analizados en cada grupo.
Diferencia positiva significa mejoría respecto al inicio, diferencia negativa significa empeoramiento respecto al inicio. DLCO: capacidad de transferencia de CO; EFR: estudio funcional respiratorio; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; FVC: capacidad vital forzada; HCB: Hospital Clinic de Barcelona; HVH: Hospital Vall d’Hebrón.
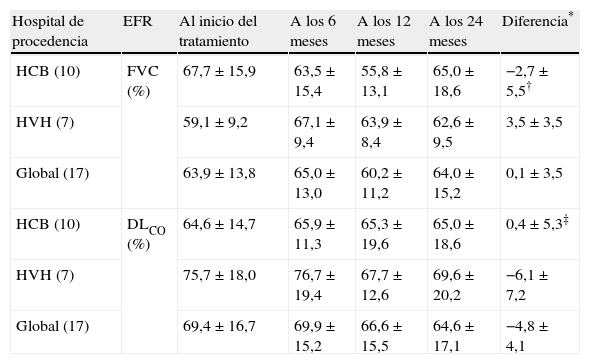
En los pacientes tratados durante 6 meses se detectó una diferencia significativa, tanto en la FVC como en la DLCO según el hospital de procedencia (FVC: -2,0% para los pacientes del HCB versus 3,0% para aquellos del HVH; p=0,001 y DLCO: -0,9% para los pacientes del HCB versus 2,7% para los del HVH; p=0,032) (tabla 2). En los pacientes tratados 12 meses no existieron diferencias entre los dos hospitales (tabla 3). Finalmente, en los tratados 24 meses se detectó una diferencia significativa en la FVC (-2,7% en los pacientes del HCB versus 3,5% en los del HVH; p=0,019) y en la DLCO (0,4% en los pacientes del HCB versus -6,1% para los del HVH; p=0,048) (tabla 4). Sin embargo, y tal como se ha indicado, los valores finales para cada parámetro funcional en los diferentes puntos temporales fueron similares.
Estudio funcional respiratorio basal, a los 6, a los 12 y a los 24 meses, de los pacientes con ES y EPI tratados con pulsos mensuales de ciclofosfamida durante dos años
| Hospital de procedencia | EFR | Al inicio del tratamiento | A los 6 meses | A los 12 meses | A los 24 meses | Diferencia* |
| HCB (10) | FVC (%) | 67,7±15,9 | 63,5±15,4 | 55,8±13,1 | 65,0±18,6 | −2,7±5,5† |
| HVH (7) | 59,1±9,2 | 67,1±9,4 | 63,9±8,4 | 62,6±9,5 | 3,5±3,5 | |
| Global (17) | 63,9±13,8 | 65,0±13,0 | 60,2±11,2 | 64,0±15,2 | 0,1±3,5 | |
| HCB (10) | DLCO (%) | 64,6±14,7 | 65,9±11,3 | 65,3±19,6 | 65,0±18,6 | 0,4±5,3‡ |
| HVH (7) | 75,7±18,0 | 76,7±19,4 | 67,7±12,6 | 69,6±20,2 | −6,1±7,2 | |
| Global (17) | 69,4±16,7 | 69,9±15,2 | 66,6±15,5 | 64,6±17,1 | −4,8±4,1 |
Las variables continuas se presentan como media±desviación estándar. Los números entre paréntesis indican los pacientes analizados en cada grupo.
* Diferencia positiva significa mejoría respecto al inicio, diferencia negativa significa empeoramiento respecto al inicio. †p=0,019 entre la diferencia de FVC entre el EFR inicial y a los 24 meses de los pacientes según el hospital de procedencia; ‡p=0,048 entre la diferencia de DLCO entre el EFR inicial y a los 6 meses de los pacientes según el hospital de procedencia; DLCO: capacidad de transferencia de CO; EFR: estudio funcional respiratorio; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; CVF: capacidad vital forzada; HCB: Hospital Clinic de Barcelona; HVH: Hospital Vall d’Hebrón.
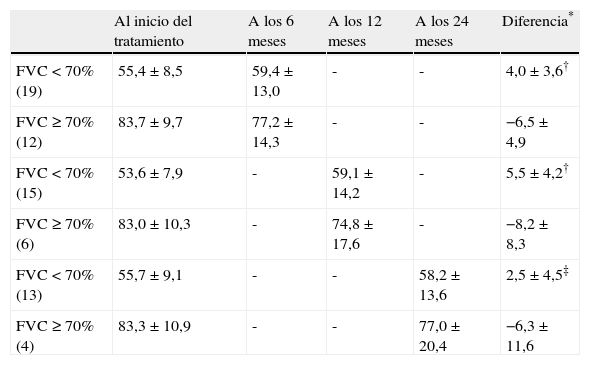
Con la intención de evaluar la respuesta al tratamiento de acuerdo a la gravedad inicial de la EPI medida por la FVC, se dividió a los pacientes en dos grupos: con una restricción grave antes de iniciar el tratamiento (FVC<70%) y aquellos con una restricción moderada o leve (FVC ≥ 70%). Se eligió este rango al tomar como ejemplo el estudio prospectivo de Tashkin et al9. Los pacientes con FVC<70% al inicio del tratamiento experimentaron una mejoría significativa con respecto a aquellos con FVC ≥ 70%, tanto en los tratados durante 6, 12 como 24 meses (tabla 5) . De hecho, en los enfermos con restricción leve o moderada la tendencia es al empeoramiento en los tres puntos temporales evaluados. De todas maneras, y a pesar de esta significación, las diferencias no superaron el 10% en ninguno de los casos.
Estudio funcional respiratorio basal y a los 6, 12 y 24 meses de los pacientes tratados con 6, 12 y 24 pulsos mensuales de ciclofosfamida de acuerdo a la gravedad de la afectación de la EPI medida por la FVC
| Al inicio del tratamiento | A los 6 meses | A los 12 meses | A los 24 meses | Diferencia* | |
| FVC<70% (19) | 55,4±8,5 | 59,4±13,0 | - | - | 4,0±3,6† |
| FVC ≥ 70% (12) | 83,7±9,7 | 77,2±14,3 | - | - | −6,5±4,9 |
| FVC<70% (15) | 53,6±7,9 | - | 59,1±14,2 | - | 5,5±4,2† |
| FVC ≥ 70% (6) | 83,0±10,3 | - | 74,8±17,6 | - | −8,2±8,3 |
| FVC<70% (13) | 55,7±9,1 | - | - | 58,2±13,6 | 2,5±4,5‡ |
| FVC ≥ 70% (4) | 83,3±10,9 | - | - | 77,0±20,4 | −6,3±11,6 |
Las variables continuas se presentan como media±desviación estándar. Los números entre paréntesis indican los pacientes analizados en cada grupo.
* Diferencia positiva significa mejoría respecto al inicio, diferencia negativa significa empeoramiento respecto al inicio. †p<0,0005 en la diferencia de FVC entre el EFR inicial y a los 6 y 12 meses de los pacientes de acuerdo a la gravedad de la afectación de la EPI medida por la FVC; ‡ p=0,033 en la diferencia de FVC entre el EFR inicial y a los 24 meses de los pacientes de acuerdo a la gravedad de la afectación de la EPI medida por la FVC; EPI: enfermedad pulmonar intersticial; FVC: capacidad vital forzada.
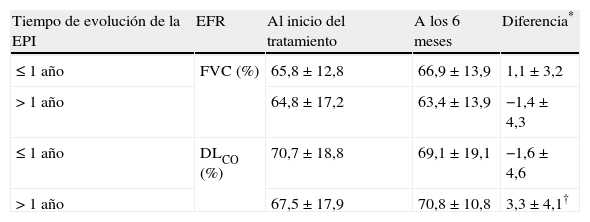
No se detectaron diferencias significativas en la FVC ni en la DLCO al inicio ni a los 6 meses entre los pacientes con o sin HTAP añadida. No se detectaron diferencias en la FVC ni en la DLCO cuando se valoró a los pacientes tratados durante 6 meses de acuerdo al tipo de afectación cutánea de la ES (difusa o limitada). Finalmente, tampoco existieron diferencias según el tiempo de evolución de la EPI antes del inicio del tratamiento, ni cuando se consideró aquellos pacientes con una evolución menor o igual a un año frente a los que tenían una evolución superior al año (tabla 6), ni cuando el punto de corte fueron los dos años de evolución (no se muestran estos datos).
Estudio funcional respiratorio basal y a los 6 meses de los pacientes tratados con 6 pulsos mensuales de ciclofosfamida de acuerdo al tiempo de evolución de la EPI en el momento del inicio del tratamiento y de la extensión de la afectación cutánea
| Tiempo de evolución de la EPI | EFR | Al inicio del tratamiento | A los 6 meses | Diferencia* |
| ≤ 1 año | FVC (%) | 65,8±12,8 | 66,9±13,9 | 1,1±3,2 |
| > 1 año | 64,8±17,2 | 63,4±13,9 | −1,4±4,3 | |
| ≤ 1 año | DLCO (%) | 70,7±18,8 | 69,1±19,1 | −1,6±4,6 |
| > 1 año | 67,5±17,9 | 70,8±10,8 | 3,3±4,1† |
| Tipo de afectación cutánea | EFR | Inicio | 6 meses | Diferencia* |
| ES difusa | FVC (%) | 68,6±15,3 | 69,7±13,1 | 1,1±3,4 |
| ES limitada | 64,5±17,0 | 62,0±16,5 | −2,5±5,1 | |
| ES difusa | DLCO (%) | 71,9±15,6 | 68,9±10,6 | −3,0±3,1 |
| ES limitada | 64,9±22,1 | 70,2±22,9 | 5,3±6,8 |
Número de pacientes analizados: tiempo de evolución de la EPI ≤ 1 año: 17 pacientes; tiempo de evolución de la EPI > 1 año: 13 pacientes; ES difusa: 18 pacientes; ES limitada: 11 pacientes.
Las variables continuas se presentan como media±desviación estándar.
* Diferencia positiva significa mejoría respecto al inicio, diferencia negativa significa empeoramiento respecto al inicio. †p=0,005 entre la diferencia de DLCO entre el EFR inicial y a los 6 meses de los pacientes según el tiempo de evolución de la EPI; DLCO: capacidad de transferencia de CO; EFR: estudio funcional respiratorio; EPI: enfermedad pulmonar intersticial; ES: esclerosis sistémica; FVC: capacidad vital forzada.
Diecinueve (51%) pacientes presentaron algún efecto adverso durante el tratamiento. Por orden de frecuencia 14 (38%) tuvieron alguna infección y en sólo una paciente fue el motivo de la suspensión del tratamiento. Tres (8%) pacientes presentaron leucopenia, tres (8%) linfopenia y tres (8%) presentaron amenorrea. Sólo una paciente murió durante el tratamiento, concretamente, a los 6 meses de iniciado debido a HTAP.
4DiscusiónEl presente estudio demuestra que la CFM endovenosa es eficaz para estabilizar los parámetros funcionales respiratorios de la EPI asociada a la ES. Esta afirmación se basa en el hecho de que la diferencia en los valores de la FVC y la DLCO entre el inicio del tratamiento y a la finalización del mismo fueron inferiores al 10% en todos los casos. Por otra parte, esta estabilización se mantuvo durante el tratamiento a largo plazo en los pacientes tratados durante 24 meses.
La CFM se considera el tratamiento de elección de la EPI relacionada con la ES14,15. Esta afirmación es cierta a pesar de las conclusiones del metaanálisis realizado por Nannini et al11. Según este estudio, la CFM no produjo una mejora significativa de los parámetros funcionales respiratorios (FVC y DLCO) de los pacientes con EPI asociada a ES que fueron tratados durante 12 meses. Sin embargo, la CFM se mostró eficaz en la estabilización de estos parámetros. Hoy en día se considera que el objetivo más realista del tratamiento de la EPI asociada a la ES es evitar la progresión de la enfermedad.
Cabe tener en cuenta que los pacientes incluidos presentaban una EPI moderada-leve según los valores de la FVC y DLCO, respectivamente. Ello ha podido influir en el hecho de que no existan diferencias superiores al 10% entre los valores basales y los obtenidos tras 6, 12 o 24 meses de tratamiento. Este hecho se repite en los estudios controlados con placebo, en los que hasta la mitad de los pacientes incluidos tenían valores de FVC superiores al 70%24. Por otra parte, el tratamiento de la EPI durante 12 meses puede ser insuficiente. El análisis temporal de dos estudios prospectivos ha demostrado que, una vez concluido el tratamiento, se produce un deterioro funcional, sobre todo en aquellos pacientes con enfermedad más grave al inicio25,26. Los resultados de nuestro estudio muestran que la CFM es capaz de mantener esta estabilización hasta los 24 meses de tratamiento. Sin embargo, dada la potencial toxicidad de esta, y de forma similar al tratamiento de otras enfermedades autoinmunes, como el caso de la nefropatía lúpica, en el tratamiento de mantenimiento a largo plazo es probable que se deban utilizar otros inmunodepresores menos tóxicos, como la azatioprina. En este sentido, dos estudios prospectivos han analizado el efecto del tratamiento con 6 pulsos mensuales de CFM seguidos de azatioprina por vía oral. En ambos esta pauta terapéutica consiguió mantener la estabilización de la FVC y DLCO10,27.
En este mismo sentido de disminuir la toxicidad de la CFM, varios estudios han evaluado la eficacia y la seguridad del micofenolato mofetil (MMF) en el tratamiento de la EPI en pacientes con ES28,29. En dos estudios retrospectivos que incluyeron 13 y 10 enfermos, respectivamente, el MMF mejoró los valores de la FVC tras 12 meses de tratamiento. En cambio, la DLCO no se modificó.
En el presente estudio la estabilización funcional respiratoria no parece variar en función del tiempo de evolución de la EPI ni del tipo de afectación cutánea (difusa o limitada). De hecho, la progresión de la EPI se ha relacionado con un inicio precoz y grave de la ES30 y con las formas restrictivas más graves en el momento del diagnóstico25. En relación con ello, los pacientes con formas graves al inicio representados por FVC<70% fueron los que presentaron mayor mejoría al final del tratamiento, tanto a los 6, 12 como a los 24 meses, si bien la diferencia no fue significativa. Este dato está en la línea del sistema de estratificación propuesto por Goh et al31, en el que los pacientes con EPI extensa (>20% en la tomografía torácica de alta resolución) o aquellos con extensión indeterminada pero FVC<70% son los que presentan una mayor mortalidad y, por tanto, los que se beneficiarían de un tratamiento más agresivo. Respecto a esto también existe cierta controversia, pues al menos un estudio ha demostrado una mejor respuesta en pacientes con formas precoces y leves de la enfermedad26.
Respecto a los glucocorticoides no está establecido su papel en el tratamiento de la EPI ni la dosis inicial. En un estudio prospectivo las dosis elevadas (1mg/ kg/ día) se relacionaron con una mejoría de la FVC, de la DLCO y de la disnea al año de tratamiento32. Sin embargo, en un estudio retrospectivo las dosis altas aisladas no aportaron ningún beneficio33. Además, se considera que los glucocorticoides a dosis iguales o superiores a 15mg/ día incrementan el riesgo de crisis renal esclerodérmica34. Ningún paciente del estudio presentó clínica sugestiva de crisis renal esclerodérmica a pesar del tratamiento inicial a dosis altas de prednisona.
El presente estudio tiene algunas limitaciones dado su diseño retrospectivo. En primer lugar, no todos los pacientes tenían EFR en los diferentes puntos temporales, lo que ha disminuido el número de pacientes que se han podido analizar. El momento del inicio del tratamiento se basó en el criterio del médico responsable en cada caso, lo que disminuye la homogeneidad de la muestra de pacientes. A pesar de analizar dos cohortes de pacientes, el número de estos es limitado con las consiguientes limitaciones de las comparaciones efectuadas y de la generalización de los resultados. Finalmente, carecimos de un grupo control sin tratamiento, lo que hubiera permitido conocer la evolución natural a largo plazo de la EPI en pacientes no tratados.
En conclusión, la CFM endovenosa administrada junto a corticoides en esta serie de pacientes ha estabilizado los parámetros funcionales respiratorios en el tratamiento a largo plazo de la EPI asociada a ES. Los pacientes con restricción grave al inicio mostraron mayor mejoría, pero esta fue en todos los casos inferior al 10%.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.