El metotrexato (MTX) se emplea para tratar el cáncer, varias formas de artritis y otras patologías reumáticas, pero puede causar toxicidad pulmonar debido a la producción de radicales libres del oxígeno y varias citocinas. Infliximab (IB) es un potente inhibidor del factor de necrosis tumoral-alfa (TNF-α) e inhibe también la liberación de endotelina-1 (ET-1). Nos propusimos investigar si IB reduce el daño pulmonar inducido por una sobredosis de MTX.
MétodoLas ratas se dividieron en 3 grupos de 8 animales. Al grupo control solamente se le administró solución salina. Al grupo MTX se le administró una dosis intraperitoneal de 20mg/kg de MTX. Al grupo de MTX+IB (MI) se le administraron 7mg/kg de IB. Tres días después de la administración de IB se administraron 20mg/kg de MTX. Todas las ratas se sacrificaron 5días después de la administración de MTX.
ResultadosLas concentraciones de TNF-α, ET-1, malondialdehído (MDA), mieloperoxidasa (MPO) y caspasa-3 fueron significativamente más altas en el grupo MTX que en el grupo control: TNF-α (p<0,001), ET-1 (p<0,001), MDA (p<0,001), MPO (p<0,001) y caspasa-3 (p<0,001) y en el grupo MI: TNF-α (p<0,009), ET-1 (p<0,001), MDA (p<0,047), MPO (p<0,007) y caspasa-3 (p<0,003). El grupo MI mostró menos daño histopatológico en el tejido pulmonar que en el grupo MTX.
ConclusiónLa sobredosis de MTX induce la liberación de citocinas y la formación de especies reactivas de oxígeno, además de una mayor secreción de ET-1 que provoca daño pulmonar. IB es un agente proinflamatorio potente, bloquea el TNF-α, puede reducir la liberación de ET-1 y el estrés oxidativo y mostrar importantes efectos protectores del tejido pulmonar frente al daño causado por una sobredosis de MTX.
Methotrexate (MTX) is used to treat cancers, several forms of arthritis and other rheumatic conditions, although MTX may cause pulmonary toxicity related to the production of free oxygen radicals, various cytokines. Infliximab (IB) with its potent effect on tumor necrosis factor-alpha (TNF-α) inhibition also inhibits the release of endothelin-1 (ET-1). We aimed to investigate whether IB reduces pulmonary damage induced by an overdose of MTX.
MethodThe rats were divided into 3 groups of 8 animals. The control group was given only saline. One dose of 20mg/kg MTX intraperitoneal was administered in the MTX group. IB 7mg/kg was given to the MTX+IB (MI) group. Three days after IB was administered, 20mg/kg MTX was given. Five days after MTX was administered, all rats were sacrificed.
ResultsThe TNF-α, ET-1, malondialdehyde (MDA), myeloperoxidase (MPO) and caspase-3 levels in MTX group were significantly higher than in control groups of TNF-α (P=.001), ET-1 (P=.001), MDA (P=.001), MPO (P=.001) and caspase-3 levels (P=.001) and MI groups of TNF-α (P=.009), ET-1 (P=.001), MDA (P=.047), MPO (P=.007) and caspase-3 levels (P=.003). The MI group had less histopathological damage in lung tissue than the MTX group.
ConclusionOverdose of MTX leads to cytokine release and the formation of reactive oxygen species in addition to increased ET-1 secretion release that causes lung damage. IB, as a potent proinflammatory agent, TNF-α blocker, can decrease ET-1 release and oxidative stress, it may show significant protective effects in lung tissue against damage caused by MTX overdose.
El metotrexato (MTX) es un análogo del ácido fólico que se utiliza de forma general para tratar enfermedades inflamatorias sistémicas tales como el lupus eritematoso sistémico, patologías del pulmón y la mama, la artritis reumatoide, la psoriasis y muchos tipos de cáncer1,2. Las dosis farmacológicas de MTX suprimen las citocinas proinflamatorias y tienen también un débil efecto supresor del factor de necrosis tumoral-alfa (TNF-α). Se han notificado importantes efectos colaterales pulmonares dependientes de la dosis con el uso a largo plazo de dosis terapéuticas o la sobredosis de MTX. Estos efectos incluyen insuficiencia respiratoria aguda y subaguda, tos no productiva, disnea, fiebre, neumonitis, enfermedad pulmonar intersticial y fibrosis pulmonar2,3.
Aunque el efecto tóxico del MTX en los pulmones es todavía incierto, se han propuesto algunas explicaciones. La supresión del sistema inmunitario con MTX causa infecciones víricas o bacterianas recurrentes y reacciones de hipersensibilidad. También puede producir un efecto tóxico directo en el epitelio de la pared alveolar4. Asimismo, el MTX muestra un efecto tóxico en el tejido pulmonar, aumentando la apoptosis y la fibrosis5. A pesar de que no se han efectuado estudios en humanos, los estudios experimentales han mostrado que el MTX puede causar toxicidad pulmonar aguda, debido a un incremento en la secreción de citocinas como el TNF-α, la interleucina-1 (IL-1), la interleucina-8 (IL-8) y la proteína quimiotáctica-1 de los monocitos6,7. Además, las sobredosis de MTX pueden producir la liberación de citocinas proinflamatorias al aumentar el estrés oxidativo y la formación de especies reactivas de oxígeno (ROS)8. La sobredosis también produce daño en el tejido pulmonar al incrementar el sistema de la enzima caspasa y activar la formación de ROS5,9.
El infliximab (IB), un anticuerpo monoclonal quimérico, se emplea como agente anti-TNF-α y en patologías reumatológicas, gastrointestinales y dermatológicas, así como en enfermedades oculares crónicas y en la sarcoidosis10-12. En bioensayos in vitro efectuados con fibroblastos, células endoteliales, neutrófilos, linfocitos y células epiteliales humanas se ha observado que el IB limita la actividad útil del TNF-α13. El IB disminuye la secreción de citocinas proinflamatorias y reduce la formación de ROS mediante la inhibición del TNF-α. El IB previene el daño tisular inhibiendo la liberación excesiva de citocinas y reduciendo la formación de ROS, lo que reduce el daño tisular al disminuir la estimulación de la apoptosis14. Se ha descrito que el IB, junto con el bloqueo del TNF-α y la inhibición de la endotelina-1 (ET-1), tiene un efecto protector en el tejido pulmonar. La ET-1, una potente sustancia vasoconstrictora y broncoconstrictora, se libera en el epitelio bronquial y está implicada en la fibrosis15. La ET-1 fomenta la liberación de citocinas proinflamatorias y su liberación aumenta al elevarse la concentración de citocinas en el tejido pulmonar16.
El objetivo de este estudio fue cuantificar las principales citocinas proinflamatorias, la ET-1 y el TNF-α, las concentraciones de malondialdehído (MDA) y la actividad enzimática de la mieloperoxidasa (MPO) en lesiones del tejido pulmonar inducidas por dosis altas de MTX, con el objetivo de evaluar el papel de la formación de ROS y de la apoptosis. Además, pretendimos investigar si el IB afecta a estos parámetros y si tiene un rol protector en la toxicidad pulmonar causada por la sobredosis de MTX.
Materiales y métodosAnimalesEl estudio se llevó a cabo en 24 ratas albinas Wistar. En promedio, las ratas tenían de 12 a 15 semanas de edad y pesaban 250-300g. Los animales experimentales se dividieron de forma aleatoria en 3 grupos: grupo control (n=8), grupo MTX (n=8) y grupo MTX+IB (MI) (n=8). El estudio se realizó cumpliendo la Guía de cuidado y uso de animales de laboratorio (NIH, 1985) y fue aprobado por el comité de ética del centro (número de aprobación: 2014/12).
Diseño experimentalEl grupo control únicamente recibió solución salina intraperitoneal (mismo volumen que en el caso de MTX intraperitoneal). Al grupo MTX se le administró una dosis única de 20mg/kg de MTX (Emthexat-s, ampolla de 50mg) mediante inyección intraperitoneal. A las ratas del grupo MI se les administró una dosis única intraperitoneal de 7mg/kg de IB y 3días más tarde recibieron una dosis única de 20mg/kg de MTX. Todas las ratas se sacrificaron el mismo día, 5días después de la administración de MTX en todos los grupos. Todos los animales se anestesiaron con hidrocloruro de ketamina (50mg/kg de ketamina por vía intramuscular, Parke-Davis Eczacibasi, Estambul, Turquía) antes del sacrificio. El tejido pulmonar de las ratas se conservó a −80°C hasta su análisis.
Homogeneizados tisularesLas muestras de tejido pulmonar se homogeneizaron con solución salina tamponada con fosfato (PBS; pH 7,4). Las muestras se centrifugaron a 10.000g durante 20min. Se retiró el sobrenadante, se alicuotaron, se conservaron a −80°C y durante el mes siguiente se analizaron los parámetros.
Determinación de proteínasPara determinar las concentraciones de proteínas en los homogeneizados tisulares se utilizó el protocolo de Lowry. Este método está basado en la reacción de Biuret, por la que en condiciones alcalinas los enlaces peptídicos de las proteínas reaccionan con el cobre para producir Cu+, que reacciona con el reactivo Folin (reacción de Folin-Ciocalteu)17.
Tumor necrosis factor alpha tisularLas concentraciones de TNF-α se determinaron por el método de inmunoabsorción enzimática (ELISA) mediante kits comerciales ELISA TNF-α de rata (eBioscience, Viena, Austria).
Malondialdehído tisularLas concentraciones de MDA se determinaron mediante el método de doble calentamiento de Draper y Hadley, cuyo principio es la determinación espectrofotométrica del color generado por la reacción del ácido tiobarbitúrico (TBA) con MDA. Las concentraciones de MDA se expresan en μmol/l18.
Endotelina-1 tisularLas concentraciones de ET-1 se determinaron por el método ELISA mediante kits comerciales ELISA ET-1 de rata (Elabscience, Wuhan, China).
Mieloperoxidasa tisularLas concentraciones de MPO se determinaron por el método ELISA mediante kits comerciales ELISA MPO de rata (Elabscience, Wuhan, China).
Evaluación inmunohistológicaPara la tinción inmunohistoquímica se hicieron cortes de tejido pulmonar de 3μm de grosor que se procesaron con xilol durante 20min antes de rehidratar en soluciones de alcohol (50-100%). A continuación, las muestras se sumergieron en una solución de H2O2 durante 30min. Tras lavarlas con PBS, las muestras se calentaron durante 5min en una solución con tampón citrato a 800W (2 veces) y se sumergieron en una sustancia bloqueante secundaria durante 30min. Cada corte permaneció con diferentes diluciones del anticuerpo primario (anticuerpo anticaspasa-3 [ab4051], Abcam, Cambridge, Reino Unido) durante 60min. Como cromógeno se usó una solución de diaminobenzidina (DAB Substrate Kit, ab64238, Abcam), como contratinción se empleó hematoxilina de Mayer durante 3-5min. Se usó PBS como control negativo. Tras aplicarles materiales de cobertura, las preparaciones se fotografiaron. Tras la tinción inmunohistoquímica, las preparaciones se dividieron en 4 categorías según el porcentaje de tejido en cada área de reacción inmunopositiva: débil (+), moderada (++), intensa (+++) y muy intensa (++++). Los bloques de tejido se cortaron en secciones de 4μm de grosor antes de teñirlas con hematoxilina y eosina (HyE) y tricrómico de Masson. A continuación, los campos (150 zonas en total) se fotografiaron para su valoración histopatológica. Un grupo de 2 histólogos y un patólogo expertos evaluaron los tejidos, con el grado enmascarado.
Análisis estadísticoPara el análisis estadístico se usó la versión 17 del programa SPSS para Windows (SPSS, EE.UU.). Las variables continuas se presentan con la media±desviación estándar. Para las comparaciones de los parámetros bioquímicos de los grupos, como TNF-α, ET-1, MPO y MDA se usaron análisis ANOVA unilaterales y pruebas retrospectivas de Bonferroni. La prueba de la U de Mann-Whitney se usó para comparar los parámetros histopatológicos de los grupos. Las diferencias se consideraron significativas cuando el valor de p era<0,05.
ResultadosDatos bioquímicosLos valores de TNF-α, ET-1, MDA y MPO del grupo de MTX fueron significativamente más altos que los de los grupos control y MI. Los valores de TNF-α y MPO en el grupo MI fueron significativamente mayores a los del grupo control. Las concentraciones de ET-1 y MDA fueron algo mayores que en el grupo control, aunque sin significación estadística. Todos los resultados bioquímicos se presentan en la tabla 1.
Resultados bioquímicos de los 3 grupos
| Control | MTX | MI | |
|---|---|---|---|
| TNF-α pg/mg de proteína | 115,7±10,7 | 169,9±29,3*,a | 138,2±26,4e |
| ET-1pg/mg de proteína | 5,5±2,0 | 11,8±4,0*,b | 7,0±1,9 |
| MDA nmol/mg de proteína | 2,11±0,4 | 2,97±0,2*,c | 2,49±0,7 |
| MPO ng/mg de proteína | 0,4±0,1 | 0,8±0,1*,d | 0,6±0,2f |
ET-1: endotelina-1; MDA: malondialdehído; MI: metotrexato+infliximab; MPO: mieloperoxidasa; MTX: metotrexato; TNF-α: factor de necrosis tumoral-alfa.
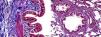
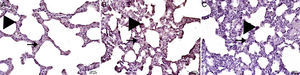
El examen histopatológico del grupo control mostró un tejido sano con morfología histológica normal. Aunque el intervalo de la puntuación de inflamación intersticial y congestión del tejido pulmonar de aspecto histológico normal era cero, había una ligera pérdida de células epiteliales. No obstante, el tejido conectivo y las estructuras vasculares también fueron normales (fig. 1).
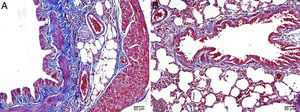
En las ratas tratadas con MTX solo se observó edema intersticial, daño epitelial alveolar, infiltración de leucocitos polimorfonucleares e infiltrados crónicos de células inflamatorias (fig. 2). En el tejido pulmonar de los animales del grupo MTX, que no presentaba un aspecto histológico normal, se observaron puntuaciones de inflamación intersticial y congestión de 2+, 3+ y 4+. A pesar de que la puntuación de inflamación fue más intensa en el intervalo 2-3, la proporción de congestión fue más intensa en el intervalo de 3+ a 4+.
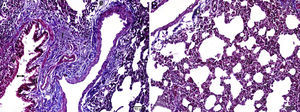
En el grupo MI la congestión disminuyó en comparación con el grupo MTX. Aunque la intensidad de la fibrosis cambió poco, la pérdida epitelial y la infiltración de leucocitos polimorfonucleares disminuyeron. En las ratas pretratadas con IB se observó una disminución significativa del daño epitelial alveolar, del edema, de la infiltración de leucocitos polimorfonucleares y de la infiltración crónica de células inflamatorias. En los pulmones de los animales del grupo tratado con IB se observó menos edema intersticial, daño epitelial alveolar, infiltración de leucocitos polimorfonucleares e infiltración crónica de células inflamatorias (p<0,05) (fig. 3).
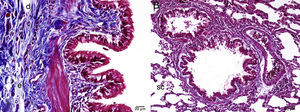
Caspasa-3La concentración de caspasa-3 fue significativamente mayor en el grupo MTX que en los grupos control y MI. En el grupo MI, la concentración de caspasa-3 fue significativamente más elevada que la del grupo control, pero muy inferior a la del grupo MTX. Todos los resultados histopatológicos se muestran en la tabla 2 y en la figura 4.
Examen histopatológico del tejido pulmonar
| Control | MTX | MI | |
|---|---|---|---|
| Inflamación | 0,00±0,35 | 3,00±0,76*,c | 1,00±0,64* |
| Congestión | 0,00±0,46 | 3,50±0,53*,d | 2,00±0,00* |
| Edema | 0,00±0,35 | 2,00±0,52*,e | 1,00±0,35* |
| Vacuolización | 0,00±0,35 | 3,00±0,52*,e | 1,00±0,35* |
| Degeneración epitelial | 0,00±0,46 | 3,00±0,46*,f | 1,50±0,53a |
| Caspasa-3 | 1,00±0,71 | 3,00±0,70*,g | 2,00±0,61b |
MI: metotrexato+infliximab; MTX: metotrexato.
Nuestro estudio muestra que en el grupo con toxicidad pulmonar inducida por MTX las concentraciones de TNF-α (una citocina proinflamatoria), MDA (un buen marcador del estrés oxidativo), MPO (un componente del sistema de defensa antioxidante) y ET-1 (un potente vasoconstrictor) fueron significativamente más elevadas que en los demás grupos. En comparación con los otros 2 grupos, en el examen histopatológico con HyE se observó daño histológico en el tejido pulmonar. La concentración de caspasa-3, un buen indicador de apoptosis, fue significativamente más alta en el grupo MTX comparado con los otros grupos. Sin embargo, las concentraciones de TNF-α, MDA, MPO y ET-1 en el grupo MI fueron significativamente más bajas que en el grupo MTX. Las concentraciones de ET-1 y MDA en el grupo de MI fueron algo mayores que en el grupo control; no obstante, las concentraciones de TNF-α y MPO fueron significativamente mayores en el grupo MI que en el grupo control. Según los resultados del examen histopatológico, el daño histológico fue menor en el grupo MI que en el grupo MTX. Además, la concentración de caspasa-3 fue significativamente más baja en el grupo MI que en el grupo MTX.
El MTX inhibe la infiltración tisular de macrófagos, afectando así la síntesis de interleucinas. Sin embargo, el MTX no afecta la infiltración tisular de linfocitosT y, dado que el TNF-α se expresa en los linfocitosT, este fármaco no puede bloquear las concentraciones de TNF-α19. Por otro lado, el MTX puede provocar neumonitis al incrementar la secreción de IL-8 en el epitelio de las vías aéreas20. Dosis tóxicas de MTX y la interleucina-1 beta (IL-1β) fomentan la secreción de citocinas proinflamatorias, como TNF-α y MDA21-23, y la secreción de IL-1β y de TNF-α aumentan la toxicidad pulmonar al inducir la secreción de IL-86. El TNF-α es uno de los principales sustratos responsables de la patogenia de las enfermedades inflamatorias crónicas y el estrés oxidativo. Tiene diversas funciones, que incluyen la regulación del crecimiento, proliferación, diferenciación y viabilidad de los leucocitos activados. También provoca la liberación celular de otras citocinas, quimiocinas o mediadores de la inflamación24. La inhibición de TNF-α juega un papel fundamental y exclusivo en la cascada de eventos de muchas enfermedades reumatológicas, inhibiendo el proceso inflamatorio. El TNF-α no solamente aumenta la producción de ROS sino que también activa el sistema de la enzima caspasa, lo que induce apoptosis excesiva que causa un daño tisular. Así, consideramos que, para este estudio, el análisis de las concentraciones de TNF-α serían suficientes para evaluar el estatus de citocinas. Algunos estudios han demostrado que el IB bloquea la IL-1β y el TNF-α25. En otro estudio se halló que el IB protegía frente al daño de la peroxidación lipídica y la liberación de citocinas en tejidos sólidos mediante la supresión del TNF-α y la reducción de ROS y MDA26. En este estudio, la concentración de TNF-α en el grupo tratado con MTX fue significativamente más alta, y las ratas presentaron un importante daño tisular. Posiblemente, la mayor liberación de citocinas debido al aumento de los fenómenos de apoptosis (liberación excesiva de citocinas y más ROS) y la mayor liberación de IL-8 podrían haber dañado el tejido pulmonar. Por el contrario, en el grupo MI se observó supresión del TNF-α y menos daño tisular. En este grupo, el IB podría haber prevenido el daño pulmonar mediante el bloqueo del TNF-α y la peroxidación lipídica, y la reducción de la apoptosis. Corrado et al.27 también describieron que el MTX y el IB inducían la supresión de citocinas, como la interleucina-6 (IL-6) y prevenían los efectos negativos del MTX sobre el metabolismo óseo. Concluyeron que, si se emplearan conjuntamente, supondrían una buena combinación. En este estudio, los efectos negativos de las sobredosis de MTX sobre el equilibrio de citocinas se redujeron con el uso de IB.
La peroxidación lipídica causa daño celular y tisular, lo que produce a su vez ROS altamente tóxicas, tanto por efecto tóxico directo como por inducción de la apoptosis. El estrés oxidativo también daña los pulmones y causa fibrosis pulmonar28. Por su lado, el MTX causa neumonitis pulmonar aguda y también conduce a la fibrosis pulmonar crónica1. Las sobredosis de MTX fomentan la liberación excesiva de citocinas y la formación de ROS, lo que incrementa más aún el daño del estrés oxidativo y debilita el sistema de defensa antioxidante. Sin embargo, el IB reduce el estrés oxidativo y potencia el sistema de defensa antioxidante. El MDA, el producto final del proceso de peroxidación lipídica, se usa con frecuencia para determinar el daño oxidativo causado por los radicales libres en los lípidos29. Por consiguiente, consideramos que el análisis de las concentraciones de MDA fue un indicador suficiente para evaluar el estrés oxidativo. En este estudio, la concentración de MDA fue significativamente más elevada en el grupo MTX. Sin embargo, dicha concentración fue significativamente inferior a la del grupo de MTX en el grupo IB. Según los resultados de este estudio, a pesar de que el MTX dañó el tejido pulmonar al incrementar el daño producido por el estrés oxidativo, el IB fue capaz de prevenirlo al reducir dicho estrés.
La MPO, secretada por monocitos y neutrófilos y activada en respuesta a un aumento del estrés oxidativo, es una enzima que contiene un grupo hemo. Usando el óxido nítrico como sustrato, la MPO altera la estructura proteica y provoca una disfunción endotelial. La MPO causa daño tisular mediante la activación de las metaloproteinasas de matriz a través del sustrato que forma. Además, el aumento de MPO es un indicador directo del estrés oxidativo30. En relación con este tema, la concentración de MPO se considera un excelente marcador del estrés oxidativo. La actividad de la MPO aumenta en la toxicidad por MTX22. Sin embargo, el aumento de la actividad de la MPO participa en el daño del tejido pulmonar31. El IB reduce el estrés oxidativo y previene el daño tisular pulmonar suprimiendo la actividad de la enzima MPO26,32. Este estudio ha mostrado que, a pesar de la elevación de las concentraciones de MPO en el grupo MTX, la actividad de la MPO estaba regulada en el grupo IB. La sobredosis de MTX dañó el tejido pulmonar aumentando el estrés oxidativo y la actividad de la MPO, pero el IB podría haber prevenido dicho daño, reduciendo el estrés oxidativo y regulando la actividad de la MPO.
La ET-1, producida por las células musculares lisas, el epitelio de las vías aéreas y las células epiteliales alveolares, contribuye de manera significativa al desarrollo de la fibrosis pulmonar33. Además, la ET-1 causa daño pulmonar aumentando la tensión tangencial, estimulando la secreción de trombina, angiotensinaii y citocinas, y promoviendo la producción de radicales libres34. El MTX daña las células endoteliales6. No obstante, no se han publicado estudios sobre el efecto directo del MTX sobre la ET-1. En este estudio se observó una concentración significativa de ET-1 en el grupo MTX. El MTX podría haber causado disfunción y daño endotelial a través de una liberación excesiva de citocinas y formación de ROS, y podría haber causado una mayor secreción de ET-1 en el endotelio. No obstante, la secreción de ET-1 podría haber empeorado el daño pulmonar debido a una mayor liberación de citocinas y formación de ROS. La ET-1 causa una inhibición dependiente de la dosis de la apoptosis y tiene un efecto mitogénico16. Sin embargo, en el caso de la disfunción mitocondrial, la secreción de ET-1 y la expresión génica aumentan, y la sobreproducción del ET-1 induce la apoptosis aumentando la concentración de caspasa-335. Este estudio ha demostrado que la mayor liberación de citocinas y formación de ROS pueden inducir la expresión génica de la ET-1; en consecuencia, esto podría causar una liberación excesiva de ET-1, lo que estimularía la actividad de la enzima caspasa-3; el resultado sería la aparición de daño pulmonar debido a la apoptosis inducida. El TNF-α estimula la liberación de ET-136 y el IB alivia el asma, bloqueando el TNF-α37 y reduciendo las concentraciones de ET-138. En este estudio, el bloqueo del TNF-α causado por en IB podría haber reducido la concentración de ET-1 y el daño pulmonar.
Como resultado del daño en el tejido pulmonar causado por las ROS, se produce inflamación celular, edema alveolar y congestión. La inflamación aguda se mantiene, junto con el edema y la migración de neutrófilos, y la liberación de un mediador químico por parte de los neutrófilos estimula la formación de ROS y el daño tisular. Asimismo, la peroxidación lipídica provoca daño orgánico y celular. El TNF-α es una citocina pleiotrópica eficaz, un mediador de la inflamación y la respuesta inmunitaria celular que afecta no solamente al crecimiento de muchos tipos celulares sino también a su diferenciación y su función. Esta citocina garantiza la destrucción de las células dañadas fomentando la apoptosis. Sin embargo, la secreción excesiva de TNF-α causa daño tisular por inducción del estrés oxidativo e inducción directa de la apoptosis.
Existen pocos métodos fiables y específicos para detectar la apoptosis, pero la caspasa-3 señala la inducción de muerte celular, siendo un elemento clave de dicho proceso. Su activación a menudo conduce a apoptosis celular irreversible, por lo que se ha descrito que esta activación es un valioso marcador de la apoptosis39. En este estudio, evaluamos la actividad de la caspasa-3 con ese objetivo y observamos que la concentración de caspasa-3 y el daño histológico eran mucho mayores en el grupo MTX que en el grupo de tratamiento. La secreción excesiva de citocinas y ET-1 y la formación de ROS en el grupo MTX podría haber causado el daño pulmonar por activación de la vía de la caspasa-3. Los niveles de activación de la caspasa-3 y el daño histológico fueron bajos en el grupo de tratamiento con IB, y es bien sabido que el IB regula la apoptosis40. De acuerdo con los resultados de este estudio, el probable bloqueo del TNF-α por parte del IB podría haber prevenido la secreción excesiva de citocinas inducida por la sobredosis de MTX y haber reducido así la secreción de ET-1 y la formación de ROS. En consecuencia, IB podría haber prevenido el daño pulmonar impidiendo de la activación de la caspasa-3.
ConclusiónLa sobredosis de MTX causó una importante liberación de citocinas y formación de ROS y provocó un daño pulmonar agudo. Asimismo, el MTX podría haber inducido una mayor secreción de ET-1 y el exceso de ET-1 podría haber contribuido al daño tisular. El bloqueo del TNF-α por parte de IB podría haber protegido el tejido pulmonar reduciendo la secreción de ET-1 y la formación de ROS e inhibiendo la inducción de la apoptosis. El IB y el MTX podrían constituir una buena combinación, puesto que el IB reduce los efectos tóxicos del MTX.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.