Debe sospecharse tuberculosis pulmonar en pacientes con síntomas respiratorios durante más de 2–3 semanas. La inmunodepresión puede modificar la presentación clínica y radiológica. La radiografía de tórax presenta manifestaciones muy sugerentes de tuberculosis, aunque en ocasiones atípicas. Las pruebas radiológicas complejas (tomografía computarizada, resonancia magnética) son más útiles en la tuberculosis extrapulmonar.
En el diagnóstico, siempre que sea posible, se utilizarán al menos 3 muestras seriadas representativas de la localización clínica. La baciloscopia y el cultivo con medios líquidos deben realizarse en todos los casos. Las técnicas de amplificación genética son coadyuvantes en la sospecha moderada o alta de tuberculosis.
En los casos nuevos de tuberculosis, se recomienda administrar isoniacida, rifampicina, etambutol y piracinamida (HREZ) durante 2 meses e isoniacida más rifampicina durante 4 meses más, con las excepciones de los casos de meningitis, en que se alargará hasta 12 meses, y de la tuberculosis espinal con afección neurológica y la silicosis, hasta 9 meses. Se recomiendan las formulaciones combinadas. En pacientes con infección por el VIH deben realizarse los ajustes necesarios con el tratamiento antirretroviral. Debe realizarse antibiograma para fármacos de primera línea a todos los aislamientos iniciales de pacientes nuevos. El control del tratamiento es una de las actividades más importantes en el abordaje de la tuberculosis.
En la infección tuberculosa la prueba de tuberculina (PT) es positiva cuando es ≥5mm y los métodos de detección de producción de interferón gamma (IGRA) se recomiendan en combinación con la prueba de la tuberculina. La pauta estándar de tratamiento de la infección es de 6 meses con isoniacida. En la tuberculosis pulmonar se aplicará aislamiento respiratorio durante 3 semanas o hasta obtener 3 muestras con baciloscopia negativa.
Pulmonary TB should be suspected in patients with respiratory symptoms longer than 2–3 weeks. Immunosuppression may modify clinical and radiological presentation. Chest X-ray shows very suggestive, albeit sometimes atypical, signs of TB. Complex radiological tests (CT scan, MR) are more useful in extrapulmonary TB.
At least 3 serial representative samples of the clinical location are used for diagnosis whenever possible. Bacilloscopy and liquid medium cultures are indicated in all cases. Genetic amplification techniques are coadjuvant in moderate or high TB suspicion.
Administration of isoniazid, rifampicin, ethambutol and pyrazinamide (HREZ) for 2 months and HR for 4 additional months is recommended in new cases of TB, except in cases of meningitis in which treatment should continue for up to 12 months and up to 9 months in spinal TB with neurological involvement, and in silicosis. Appropriate adjustments with antiretroviral treatment should be made in HIV patients. Combined therapy is recommended to avoid development of resistance. An antibiogram to first line drugs should be performed in all the initial isolations of new patients. Treatment control is one of the most important activities in TB management.
The Tuberculin Skin Test (TST) is positive in TB infection when ≥5mm, and Interferon-Gamma Release Assays (IGRA) are recommended in combination with TT. The standard treatment schedule for infection is 6 months with isoniazid. In pulmonary TB, respiratory isolation is applied for 3 weeks or until 3 negative bacilloscopy samples are obtained.
La tuberculosis (TB) continúa siendo una de las enfermedades infecciosas con mayor morbilidad en el mundo y causa de mortalidad en países pobres con elevada incidencia1. España es, desde hace años, uno de los países de Europa occidental con mayor número de casos2. Desde la segunda mitad de la década de 1990, con la instauración de los tratamientos antirretrovirales de alta eficacia, se ha asistido a una disminución progresiva de los casos de TB con coinfección por el VIH. Durante la última década se han producido cambios demográficos en la población, que explican que en las comunidades con mayor proporción de inmigrantes estos lleguen a suponer hasta el 35–40% de los pacientes diagnosticados de TB. Este hecho comporta nuevos retos en el abordaje y el seguimiento de estos pacientes, entre los que destacan la necesidad de diagnósticos tempranos, de vigilancia de las resistencias3,4, de instauración de pautas de tratamiento adecuadas, así como de un seguimiento que garantice el cumplimiento del tratamiento. Desde este punto de vista, el presente documento de consenso de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) pretende realizar una revisión de los aspectos actuales más relevantes del diagnóstico, el tratamiento y la prevención de la infección tuberculosa y de la TB pulmonar y extrapulmonar. Al final de cada una de las secciones del documento se ha incluido un cuadro de recomendaciones basadas en la constatación científica y de acuerdo a la clasificación de la Infectious Diseases Society of America5. Respecto a la potencia de cada una de las recomendaciones se han considerado las siguientes categorías:
A: buena potencia, apoya la recomendación.
B: potencia moderada. Apoya la recomendación.
C: escasa potencia que no permite apoyar ni rechazar la recomendación.
Respecto a la calidad científica de la recomendación:
- •
Grado I: recomendación basada en al menos un ensayo clínico bien diseñado, controlado y aleatorizado.
- •
Grado II: recomendación basada en al menos un ensayo clínico bien diseñado, pero no aleatorizado, en estudios de cohortes, múltiples series o resultados muy evidentes de ensayos no controlados.
- •
Grado III: recomendación basada en la opinión de expertos, en estudios descriptivos o en la experiencia clínica.
La TB es una de las enfermedades contagiosas causantes de mayor morbilidad y mortalidad. Su incidencia y su prevalencia, relacionadas directamente con el grado de pobreza, han disminuido en el mundo desarrollado al tiempo que aumentan progresivamente en muchos países pobres o en vías de desarrollo. Su erradicación precisa prevención, diagnóstico temprano, tratamiento efectivo de la infección y de la enfermedad, y apoyo institucional. Algunas circunstancias, como la coinfección por el VIH, el incremento de la resistencia a fármacos, la movilidad geográfica relacionada con la inmigración económica actual y el hacinamiento de la población más desfavorecida en las grandes urbes, dificultan el esfuerzo de los organismos internacionales para controlarla.
En su informe de 20091, la Organización Mundial de la Salud (OMS) estimó la incidencia de TB en 2007 en algo más de 9 millones de nuevos casos (139/105 habitantes), de los cuales el 44% eran bacilíferos, el 15% infectados por el VIH y en 500.000 pacientes se detectó multirresistencia (MDR-TB, resistencia simultánea al menos a isoniacida [H] y rifampicina [R]). La mortalidad global fue de 1,3 millones de pacientes sin infección con el VIH y otros 456.000 con coinfección por el VIH.
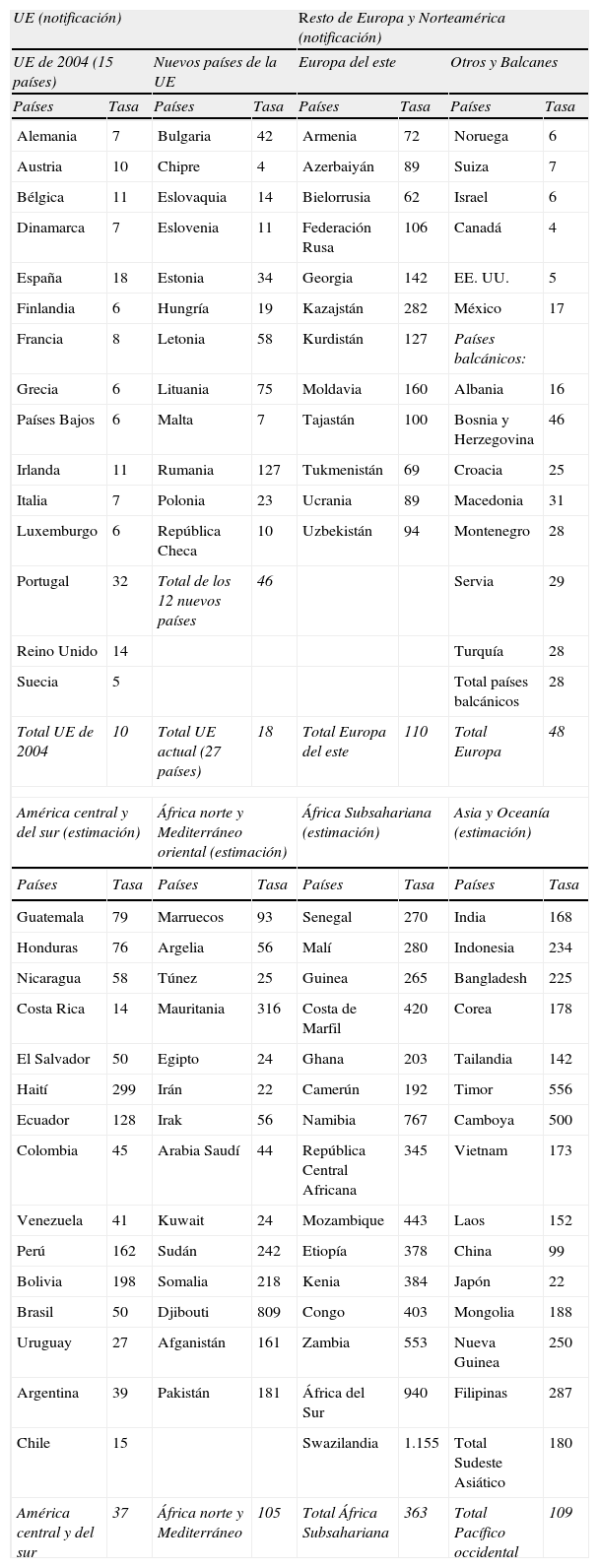
En Europa, durante 2006 se declararon 48 casos/105 habitantes, con una gran variabilidad entre naciones2 (tabla 1). Así, en los países más industrializados se observó una incidencia media de 10/105 habitantes, con un incremento en la proporción de pacientes extranjeros superior al 40% en muchos casos, mientras que en los países situados en las regiones más orientales del continente la incidencia media fue de 110 casos/105 habitantes.
Incidencia anual (n/105 habitantes) de tuberculosis (TB) en Europa y en las restantes regiones de la Organización Mundial de la Salud (OMS) en 20061,2
| UE (notificación) | Resto de Europa y Norteamérica (notificación) | ||||||
| UE de 2004 (15 países) | Nuevos países de la UE | Europa del este | Otros y Balcanes | ||||
| Países | Tasa | Países | Tasa | Países | Tasa | Países | Tasa |
| Alemania | 7 | Bulgaria | 42 | Armenia | 72 | Noruega | 6 |
| Austria | 10 | Chipre | 4 | Azerbaiyán | 89 | Suiza | 7 |
| Bélgica | 11 | Eslovaquia | 14 | Bielorrusia | 62 | Israel | 6 |
| Dinamarca | 7 | Eslovenia | 11 | Federación Rusa | 106 | Canadá | 4 |
| España | 18 | Estonia | 34 | Georgia | 142 | EE. UU. | 5 |
| Finlandia | 6 | Hungría | 19 | Kazajstán | 282 | México | 17 |
| Francia | 8 | Letonia | 58 | Kurdistán | 127 | Países balcánicos: | |
| Grecia | 6 | Lituania | 75 | Moldavia | 160 | Albania | 16 |
| Países Bajos | 6 | Malta | 7 | Tajastán | 100 | Bosnia y Herzegovina | 46 |
| Irlanda | 11 | Rumania | 127 | Tukmenistán | 69 | Croacia | 25 |
| Italia | 7 | Polonia | 23 | Ucrania | 89 | Macedonia | 31 |
| Luxemburgo | 6 | República Checa | 10 | Uzbekistán | 94 | Montenegro | 28 |
| Portugal | 32 | Total de los 12 nuevos países | 46 | Servia | 29 | ||
| Reino Unido | 14 | Turquía | 28 | ||||
| Suecia | 5 | Total países balcánicos | 28 | ||||
| Total UE de 2004 | 10 | Total UE actual (27 países) | 18 | Total Europa del este | 110 | Total Europa | 48 |
| América central y del sur (estimación) | África norte y Mediterráneo oriental (estimación) | África Subsahariana (estimación) | Asia y Oceanía (estimación) | ||||
| Países | Tasa | Países | Tasa | Países | Tasa | Países | Tasa |
| Guatemala | 79 | Marruecos | 93 | Senegal | 270 | India | 168 |
| Honduras | 76 | Argelia | 56 | Malí | 280 | Indonesia | 234 |
| Nicaragua | 58 | Túnez | 25 | Guinea | 265 | Bangladesh | 225 |
| Costa Rica | 14 | Mauritania | 316 | Costa de Marfil | 420 | Corea | 178 |
| El Salvador | 50 | Egipto | 24 | Ghana | 203 | Tailandia | 142 |
| Haití | 299 | Irán | 22 | Camerún | 192 | Timor | 556 |
| Ecuador | 128 | Irak | 56 | Namibia | 767 | Camboya | 500 |
| Colombia | 45 | Arabia Saudí | 44 | República Central Africana | 345 | Vietnam | 173 |
| Venezuela | 41 | Kuwait | 24 | Mozambique | 443 | Laos | 152 |
| Perú | 162 | Sudán | 242 | Etiopía | 378 | China | 99 |
| Bolivia | 198 | Somalia | 218 | Kenia | 384 | Japón | 22 |
| Brasil | 50 | Djibouti | 809 | Congo | 403 | Mongolia | 188 |
| Uruguay | 27 | Afganistán | 161 | Zambia | 553 | Nueva Guinea | 250 |
| Argentina | 39 | Pakistán | 181 | África del Sur | 940 | Filipinas | 287 |
| Chile | 15 | Swazilandia | 1.155 | Total Sudeste Asiático | 180 | ||
| América central y del sur | 37 | África norte y Mediterráneo | 105 | Total África Subsahariana | 363 | Total Pacífico occidental | 109 |
UE: Unión Europea.
En este mismo período se notificaron en España 8.029 casos (18,3/105 habitantes)2, aunque, según estimaciones de la OMS1, correspondería a nuestro país una incidencia de 30/105 habitantes, por lo que podría existir una falta de declaración del 39%. El 4,4% de los casos notificados eran pacientes infectados por el VIH y el 19,3%, pacientes extranjeros. El 82,2% de los casos fueron de localización pulmonar2.
Respecto a la situación de la resistencia a los fármacos en España, se conocen únicamente datos parciales de diversas fuentes. Así, los casos notificados a EuroTB en 2006 incluyeron un 3,8% de casos de MDR-TB. Un estudio llevado a cabo en España3, en el que participaron 120 laboratorios de 16 comunidades autónomas y en que se analizaron 1.083 casos de TB recogidos durante un mes de 2006, reveló una tasa de resistencia primaria del 8,3% (4,9% a H) y de MDR-TB del 1,3%. El 33,6% de los casos resistentes correspondieron a extranjeros.
Otra fuente de información de casos resistentes en España son los comunicados a la OMS4, que aportan datos parciales, y en los que se observa para 2006 un 0,1% de MDR primaria y 4,3 de MDR secundaria, porcentajes inferiores a los calculados para los países de la Unión Europea (un 0,8 y un 8,2%, respectivamente) y muy distantes de la MDR-TB primaria entre un 6–23% en los países más al este de Europa4.
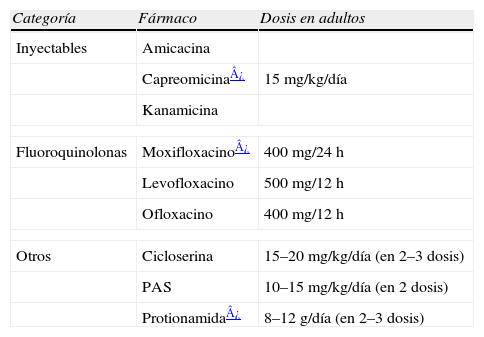
En 2006 la OMS6 definió la TB extremadamente resistente (XDR-TB) como la MDR-TB que es, además, resistente a al menos a uno de los fármacos de segunda línea administrados por vía parenteral (amikacina, kanamicina o capreomicina) y a alguna de las fluoroquinolonas. Hasta junio de 2008, la OMS ha recibido notificaciones de XDR-TB procedentes de 49 países diferentes, entre ellos España. Aunque únicamente se han descrito en pacientes aislados, es posible que no todos se hayan descubierto, ya que el estudio de la sensibilidad a fármacos de segunda línea no es sistemático en todos los casos resistentes.
Diagnóstico de la infección tuberculosaFactores de riesgo de la infección tuberculosaEn nuestro entorno, salvo en los casos de punción accidental manipulando micobacterias, la transmisión de la TB se realiza prácticamente siempre por vía aérea. Para infectarse, en general, se requiere un contacto intenso y prolongado con un paciente bacilífero. En el contagio influyen diversos factores, entre los que se debe destacar: a) la capacidad contagiante del paciente, que está relacionada con la cantidad de bacilos presentes en el esputo, la intensidad y la frecuencia de la tos, y la existencia de cavitación en la radiografía de tórax, y b) el grado de intimidad y la duración de la exposición. En este sentido, los convivientes con pacientes bacilíferos tienen un mayor riesgo de infectarse que las personas con relación esporádica o casual7–9.
Prueba de la tuberculinaLa prueba estándar para el diagnóstico de la infección tuberculosa es la prueba de la tuberculina (PT), en la que se utiliza un extracto obtenido del filtrado del cultivo de bacilos tuberculosos, esterilizado y concentrado. Actualmente el tipo de antigeno que se utiliza en la tuberculina es el PPD (purified protein derivative). En España se emplea la variante RT-23, con Tween 80 como antiadsorbente8,9. La técnica más común para realizar la PT es la intradermorreacción, conocida como técnica de Mantoux. Se practica mediante la inyección intradérmica en la cara ventral del antebrazo de 0,1ml de PPD, a la dosis de 2UT. Para evitar errores y garantizar que se administra intradérmicamente, es importante que, tras la inyección, aparezca un habón que se desvanece poco tiempo después. La lectura se realiza a las 48–72h, aunque puede ser válida en los primeros 7 días. Se debe medir el diámetro transversal respecto al eje longitudinal del antebrazo exclusivamente de la induración.
El PPD contiene proteínas que son comunes a Mycobacterium tuberculosis, al bacilo de la vacuna BCG y a algunas micobacterias ambientales, lo que resta especificidad a la PT. Para considerar una PT como positiva e indicativa de infección tuberculosa se debe tener en cuenta la probabilidad de que el individuo se haya infectado por el bacilo tuberculoso y el riesgo que tenga para desarrollar la enfermedad. Para poder interpretar de forma adecuada la PT es conveniente buscar la cicatriz de la vacuna BCG.
En España la prueba se considera positiva cuando la induración es ≥5mm en las personas que no han sido vacunadas con BCG. En las vacunadas con BCG la interpretación de la PT es complicada por la interferencia de la vacunación en la PT y la dificultad de discernir entre el efecto de la vacuna y la infección tuberculosa. En la práctica clinica, se acepta que en los colectivos con elevado riesgo de enfermar tras infección no se tenga en cuenta el antecedente de vacunación. Con este criterio, en los vacunados una PT≥5mm se considera positiva cuando se trata de contactos íntimos o frecuentes de pacientes tuberculosos bacilíferos, así como en las personas con lesiones residuales compatibles con TB en la radiografia de tórax con bacteriología negativa y control evolutivo que descarta enfermedad. En los vacunados con BCG, no contemplados en las características anteriores, aunque se estima que a mayor diámetro de la induración, mayor es la posibilidad de que la respuesta se deba a infección tuberculosa, no es posible establecer con certeza el efecto de la vacuna10,11.
En personas con inmunodepresión importante (infectados por el VIH, trasplantados, tratamientos biológicos y con corticoides), se acepta como positiva cualquier induración de la PT8,9.
La PT no sensibiliza aunque se practique más de una vez, aunque puede actuar como estímulo en personas que se infectaron anteriormente por M. tuberculosis, en las que con el paso del tiempo se ha debilitado, pero no desaparecido, la capacidad de respuesta a esta. Este fenómeno se conoce como efecto empuje o booster y puede conducir al error de interpretar como conversión de la tuberculina, lo que en realidad corresponde a la inducción o restablecimiento de la capacidad de respuesta. Tiene importancia el tener en cuenta esta reacción, sobre todo en los colectivos con riesgo de infección tuberculosa a los que se realizan PT anuales8,9.
El efecto booster se observa en personas mayores 55 años y en vacunados con BCG. En estos casos, se aconseja que cuando la PT sea negativa se repita a los 7–10 días tomando como definitivo el resultado de la segunda PT. Con esta práctica se puede saber si se trata de un falso negativo de la prueba y evitar futuros falsos diagnósticos de conversión cuando se repita la PT. Se define como conversión de la tuberculina el paso de negativa a positiva en un plazo inferior a 2 años.
Se debe tener presente que tras la infección por M. tuberculosis han de transcurrir entre 2–12 semanas para que los linfocitos T sensibilizados pasen al torrente circulatorio y puedan reconocer la tuberculina depositada en la epidermis. Durante este tiempo, aunque se haya producido la infección, puede que no se detecte respuesta a la PT. Por tanto, ante una PT negativa y elevado riesgo de infección, como en el caso de los convivientes con tuberculosos bacilíferos, se debe repetir la prueba a las 8–12 semanas para garantizar que no ha habido infección8,9.
No es necesario repetir la PT si se dispone de una prueba previa positiva confirmada. En general, no se observa la positividad de una PT hasta pasados los 6 meses de vida. Por otra parte, la PT no permite distinguir entre infección y enfermedad, ya que en ambos casos suele ser positiva.
Los resultados falsos negativos de la PT pueden deberse a defectos de la técnica, errores en la lectura o a enfermedades y situaciones que provoquen inmunodepresión, incluida la TB grave (tabla 2).
Causas de resultado falso negativo de la prueba de tuberculina (PT)
| Infecciones |
| Virales: VIH, sarampión, varicela, parotiditis |
| Bacterianas: tuberculosis (formas graves y una proporción de localización en serosas), fiebre tifoidea, brucelosis, tos ferina, lepra |
| Vacunación con virus vivos: sarampión, parotiditis, poliomielitis |
| Insuficiencia renal crónica |
| Desnutrición grave |
| Enfermedad de órganos linfoides: linfomas, leucemias, sarcoidosis |
| Corticoterapia prolongada (≥15mg de prednisona más de 1 mes) |
| Quimioterapia y cualquier medicación inmunosupresora |
| Menores de 6 meses y ancianos |
| Técnica y/o lectura incorrectas |
| Exposición de la tuberculina a la luz o el calor o desnaturalización por caducidad |
| Período ventana en la positivización de la PT |
La PT continúa siendo el método de elección para el diagnóstico de infección, aunque presenta algunas limitaciones como son su baja sensibilidad en las personas inmunodeprimidas que provoca resultados falsos negativos, las dificultades para su abordaje en niños de corta edad, los errores en su administración, la subjetividad en la interpretación de los resultados, la necesidad de una segunda visita para la lectura de la prueba y su ausencia de privacidad.
Para intentar superar estos problemas, recientemente se han desarrollado diferentes técnicas de laboratorio para el diagnóstico de la infección tuberculosa. Las técnicas se basan en la detección del interferón gamma en sangre (interferon gamma release assay [IGRA]), una citocina fundamental en el control de la infección tuberculosa, que se libera como respuesta a la estimulación in vitro de las células T sensibilizadas con antígenos específicos de M. tuberculosis. En la actualidad se emplean para la estimulación de las células T los antígenos de la región genética RD1: early secretory antigen target 6 (ESAT-6) y culture filtrate protein 10 (CFP-10), y el antígeno de la región genética RD11: RV2654, presentes en el complejo M. tuberculosis pero ausentes tanto en la vacuna BCG como en la mayoría de las restantes micobacterias (excepto en Mycobacterium kansasii, Mycobacterium marinum y Mycobacterium szulgai).
Las técnicas IGRA permiten discriminar a los individuos infectados por M. tuberculosis de los vacunados por BCG y de los infectados por otras micobacterias, excluyendo las mencionadas12–14. Además, incorporan controles para detectar anergia y excluir, así, a los falsos negativos. Por otra parte, pueden repetirse inmediatamente sin el riesgo de estimulación de la inmunidad, con lo que se evita el efecto booster.
Las IGRA presentan ventajas adicionales respecto a la PT12–14, ya que son objetivas, la determinación puede repetirse en caso necesario, se elimina la visita de lectura, se evita la pérdida de individuos que no acuden a dicha visita, son fáciles de estandarizar y aplicar en el laboratorio, permiten la inclusión de controles positivos para detectar a los pacientes anérgicos y, al realizarse en el laboratorio, se respeta la intimidad del individuo. El principal inconveniente de las IGRA es su mayor coste económico respecto a la PT.
Aún se necesitan más estudios en los distintos grupos de riesgo para determinar su nivel de eficiencia. No obstante, se acepta que en países con elevada prevalencia de TB su empleo es la opción más coste-efectiva.
En la actualidad se dispone de 2 pruebas comercializadas: QuantiFERON-TB Gold In-Tube, que utiliza técnicas de ELISA, y T-SPOT-TB, basado en la técnica ELISPOT. Ambas pruebas presentan ventajas operacionales respecto a la tuberculina y son significativamente más específicas en la población vacunada12–14. En los niños se ha constatado que permiten identificar un exceso de PT positivas atribuibles a infecciones por especies de micobacterias distintas a M. tuberculosis14. La concordancia entre ambas es muy elevada, si bien parece que T-SPOT-TB es algo más sensible que QuantiFERON-TB Gold. Su utilización en la práctica clínica está todavía en fases iniciales. Sin embargo, algunas sociedades científicas de neumología como la británica, la italiana y la española, entre otras, ya las han introducido en sus guías. Los Centers for Desease Control and Prevention (CDC) recomiendan el uso indistinto de la tuberculina o de QuantiFERON-TB Gold para el diagnóstico de la infección tuberculosa, mientras que las demás sociedades aconsejan el empleo de la nueva tecnología en combinación con la tuberculina.
Protocolo de actuación e indicacionesComo norma, no debería practicarse la PT ni las pruebas de determinación de interferón gamma si no se va a derivar una actuación posterior. Las indicaciones para llevar a cabo la PT se exponen en la tabla 3.
Indicaciones de la prueba de tuberculina (PT)14
| Convivientes y contactos de enfermos tuberculosos |
| Personas cuya radiografía de tórax presente imágenes compatibles con tuberculosis inactiva |
| Personas con sospecha clínica y/o radiológica de padecer enfermedad tuberculosa |
| Personas que si están infectadas tienen mayor riesgo para el desarrollo de enfermedad tuberculosa |
| Infección por el VIH |
| Adictos a drogas por vía parenteral |
| Marginados sociales |
| Extranjeros procedentes de países de alta incidencia |
| Enfermedades inmunosupresoras: leucosis, linfomas, neoplasias y otras |
| Terapia inmunosupresora prolongada, anti-TNFα y candidatos a trasplante |
| Personas que constituyen un riesgo social y epidemiológico si desarrollan una TB activa |
| Cuidadores de guarderías infantiles |
| Personal docente |
| Personal sanitario |
| Personal de prisiones |
| Estudios epidemiológicos y control de programas antituberculosos |
TNF: factor de necrosis tumoral.
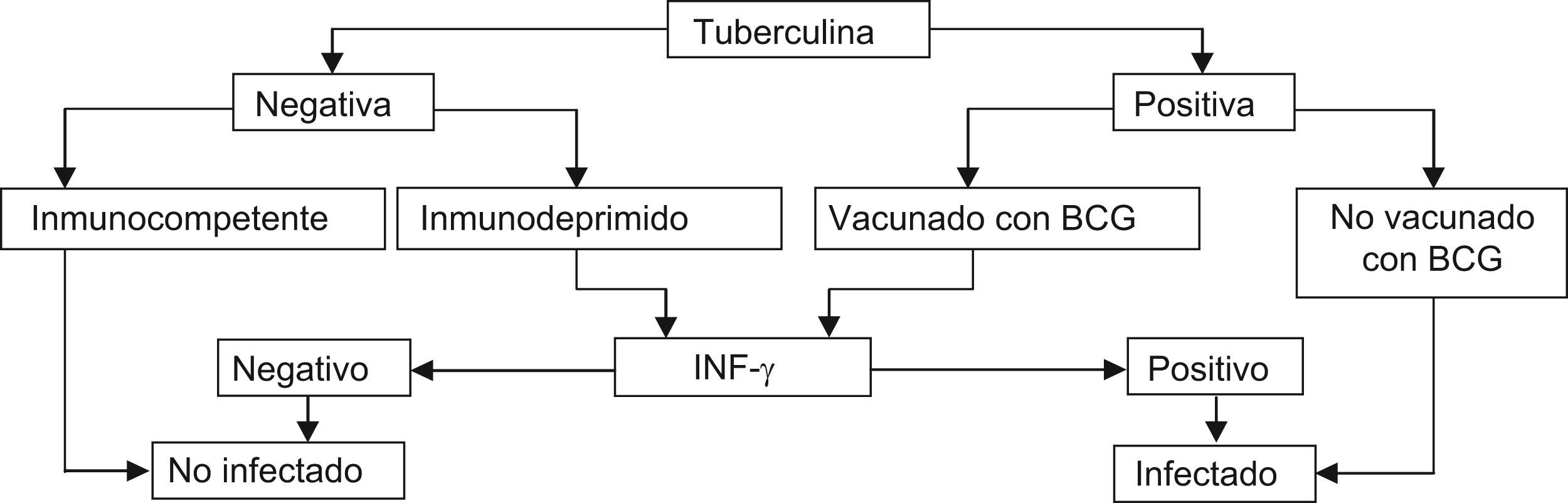
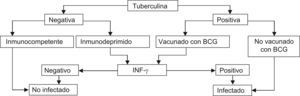
En la figura 1 se expone el algoritmo (modificado del propuesto por la SEPAR)9 para la utilización e interpretación de los resultados de la PT en combinación con las técnicas de detección de interferón gamma. En síntesis, con la información actual, la recomendación consiste en emplear la PT como técnica de base. Si esta resulta positiva y el individuo está vacunado con BCG, se emplearía la técnica de detección de interferón gamma para descartar el efecto vacuna. Si la PT resulta negativa pero el individuo está inmunodeprimido, para excluir un falso negativo se llevaría a cabo la determinación de interferón gamma, dada su mayor sensibilidad respecto a la PT9.
Algoritmo de utilización conjunta de la prueba de tuberculina (PT) y las técnicas de determinación del interferón gamma (IGRA) para el diagnóstico de la infección tuberculosa14.BCG: Bacilo de Calmette-Guérin.
Recomendaciones respecto a la infección tuberculosa:
- 1.
La prueba estándar para el diagnóstico de la infección tuberculosa es la PT. Se considera positiva cuando es ≥5mm, con independencia de la vacunación con BCG, en los contactos de personas con TB, en personas con lesiones residuales de TB en la radiografía de tórax y en personas con inmunodepresión y riesgo de desarrollar TB (principalmente infección por el VIH) (AIII).
- 2.
El papel de los nuevos métodos de diagnóstico de la infección de tuberculosa basados en la liberación de interferón gamma por los linfocitos T sensibilizados por antígenos específicos de M. tuberculosis no está bien establecido, y en el momento actual se recomienda su utilización en combinación con la PT en estudios protocolizados con el fin de poder establecer, en el futuro, su utilidad en el diagnóstico de la infección (BII).
- 3.
Las pruebas diagnósticas de infección tuberculosa han de practicarse solamente cuando, dependiendo de sus resultados, se vaya a determinar una actuación (AIII).
Las personas infectadas por M. tuberculosis con mayor riesgo de desarrollar la enfermedad tuberculosa pueden agruparse en 2 categorías: individuos infectados recientemente y pacientes con condiciones clínicas que aumentan el riesgo de progresión, en general por deficiencia del sistema inmunitario.
En el primer grupo se incluyen: contactos íntimos de pacientes tuberculosos contagiosos, conversores de la PT en los 2 años previos, sobre todo en el primer año, inmigrantes recientes (<5 años) de países con tasas altas de TB, niños de hasta 5 años de edad, sobre todo en los primeros 2 años de vida, y en menor grado adolescentes y adultos jóvenes, y residentes y empleados de lugares que congregan a pacientes de alto riesgo.
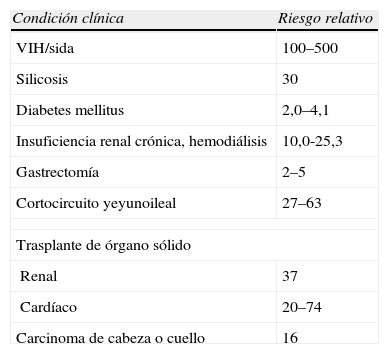
En el segundo grupo están: infectados por el VIH, pacientes con TB previa o lesiones fibróticas no tratadas, individuos con déficit ponderal superior al 5%, usuarios de drogas por vía parenteral, pacientes tratados con antagonistas del factor de necrosis tumoral alfa (TNF-α), tratamiento mantenido con corticoides u otros inmunodepresores y otras situaciones clínicas (tabla 4)7.
Riesgo relativo respecto a la población general para desarrollar tuberculosis activa7
| Condición clínica | Riesgo relativo |
| VIH/sida | 100–500 |
| Silicosis | 30 |
| Diabetes mellitus | 2,0–4,1 |
| Insuficiencia renal crónica, hemodiálisis | 10,0-25,3 |
| Gastrectomía | 2–5 |
| Cortocircuito yeyunoileal | 27–63 |
| Trasplante de órgano sólido | |
| Renal | 37 |
| Cardíaco | 20–74 |
| Carcinoma de cabeza o cuello | 16 |
La TB pulmonar tiene manifestaciones clínicas inespecíficas, e incluso puede detectarse en personas asintomáticas en el curso de estudios de contactos u otras exploraciones. Lo habitual es que el paciente presente síntomas de varias semanas de duración consistentes en tos, expectoración, en ocasiones hemoptoica, dolor torácico y sintomatología general (febrícula o fiebre, sudoración, astenia, anorexia y pérdida de peso). La exploración torácica puede ser anodina, o bien pueden auscultarse ruidos o estertores localizados o asimetrías en los ruidos respiratorios. Es primordial sospechar la enfermedad, y en todo paciente con síntomas respiratorios y/o síntomas generales de más de 2–3 semanas de duración iniciar los procedimientos diagnósticos, así como en todo paciente con hemoptisis, con independencia de la duración.
La TB pleural puede presentarse de forma aislada o concomitante a una TB pulmonar. Su clínica consiste en dolor torácico, sensación de disnea, fiebre o febrícula, con o sin sintomatología general. Su aparición puede ser aguda, de días o semanas, o bien más prolongada, semanas o meses. La exploración física muestra asimetría en la auscultación, palpación y percusión torácica, con semiología de derrame pleural. La radiografía de tórax presenta la imagen típica de derrame pleural que suele ser unilateral y de tamaño variable. Por toracocentesis se obtiene un líquido pleural de color amarillento, generalmente con características de exudado linfocitario, que deberá utilizarse para los distintos procedimientos diagnósticos. En ocasiones, el derrame pleural, especialmente si se cronifica, se puede presentar como un empiema. Muy excepcionalmente puede fistulizar a través de la pared torácica.
La TB también puede afectar a los ganglios hiliares y mediastínicos, y asociarse o no a otras formas torácicas y/o linfadenitis cervical. La afectación ganglionar es más frecuente en niños, en quienes la afectación hiliar es una manifestación frecuente y única de TB. Las formas únicamente ganglionares son más raras en adultos, por lo que debe hacerse al diagnóstico diferencial con linfomas y sarcoidosis.
Otra forma de manifestación de la TB en el tórax es la afectación endobronquial que al igual que las anteriores, puede presentarse sola o combinada con otras. Esta forma de TB se diagnostica durante la broncoscopia realizada para el estudio de TB o de otras enfermedades respiratorias. Se manifiesta como lesiones localizadas y en ocasiones puede haber afectación endobronquial derivada de una perforación bronquial por una adenopatía. En estos casos los procedimientos habituales de la broncoscopia proporcionan la confirmación diagnóstica.
Otra estructura torácica que puede verse afectada por la TB es el pericardio, que se manifiesta como un derrame pericárdico o pericarditis constrictiva, que puede aparecer solo o asociado a una pleuritis u otra forma de TB torácica. La presentación clínica es habitualmente insidiosa. Debe considerarse de manera especial la etiología tuberculosa en las pericarditis de larga evolución que no respondan a tratamiento antiinflamatorio. El ECG es patológico en prácticamente todos los casos en los que haya derrame pericárdico, aunque la elevación del segmento S-T, característica de la pericarditis aguda, se presenta sólo en el 10% de los casos15. La presencia de edema, pulso paradójico y aumento de presión venosa central son signos clínicos de alarma que deben hacer descartar taponamiento pericárdico. En estos casos, el diagnóstico debe establecerse apoyándose en datos clínicos y analíticos, si es posible la obtención de líquido pericárdico.
En definitiva, la sintomatología de la TB pulmonar y torácica no es específica de la enfermedad, por lo que es preciso un alto índice de sospecha en pacientes con sintomatología sugerente con el fin de realizar un diagnóstico lo más temprano posible e instaurar el tratamiento adecuado.
Tuberculosis extratorácicaM. tuberculosis es un patógeno que asienta preferentemente en lugares del pulmón bien oxigenados. Sin embargo, por vía hematógena, puede implantarse en cualquier otro lugar del organismo y allí multiplicarse para dar lugar a distintas manifestaciones clínicas que dependerán del lugar de afección. Del mismo modo que en la TB pulmonar, la TB extratorácica puede verse acompañada de sintomatología sistémica, aunque se observa con menor frecuencia. La pérdida de peso es más habitual en la TB diseminada y en la localización gastrointestinal. No es frecuente encontrar leucocitosis ni alteraciones bioquímicas16. La TB, en cualquiera de sus localizaciones, debe considerarse siempre en el diagnóstico diferencial de fiebre de origen desconocido. Los pacientes coinfectados por el VIH o con otro tipo de inmunodepresión, las mujeres y las personas de razas no caucásicas tienen mayor predisposición a manifestar formas extratorácicas de TB17.
Una vez realizado el diagnóstico de TB extrapulmonar, se debe investigar siempre la asociación con TB pulmonar, ya que pueden coexistir y, aunque la base del tratamiento sea la misma, el diagnóstico de TB pulmonar implica contagiosidad que obliga a la realización de estudios de contactos18,19.
- •
TB del sistema nervioso central (SNC): se produce como consecuencia de la diseminación hematógena desde un foco distante, o en el contexto de una TB diseminada. Rara vez es consecuencia de invasión por contigüidad. La meningitis tuberculosa es la forma más frecuente de presentación de TB en el SNC. De pronóstico fatal sin tratamiento, este debe iniciarse tan pronto como se tenga una sospecha diagnóstica fundada, ya que el pronóstico funcional y vital depende de la precocidad en la instauración del tratamiento. La aparición y la progresión de los signos y los síntomas en la TB meníngea son más insidiosos que en otras formas de meningitis bacteriana. Los síntomas de inicio son inespecíficos (astenia, anorexia, cefalea) y pueden durar varias semanas. Si se deja sin tratamiento, aparece descenso del nivel de conciencia y signos de focalidad neurológica. Si hay afección de los pares craneales, el nervio óptico y los oculomotores (iii, iv y vi pares) son los implicados con mayor frecuencia. El British Medical Council (BMC) propuso en 1947 una clasificación evolutiva de la enfermedad en 3 estadios, desde la ausencia de afección neurológica y de la conciencia hasta el coma, que aún hoy mantiene su valor pronóstico20. Los tuberculomas, abscesos cerebrales, la hidrocefalia con hipertensión intracraneal y los infartos isquémicos secundarios a vasculitis son otras formas graves de presentación de la TB en el SNC.
- •
TB osteoarticular: generalmente es consecuencia de diseminación hematógena bacilar. La localización vertebral es la más frecuente. La sintomatología inicial es muy inespecífica, de evolución lenta y falta de sintomatología constitucional, por lo que el retraso diagnóstico habitualmente es elevado. El paciente presenta dolor y molestias inespecíficas localizadas. Si el cuadro progresa da lugar a la extensión de la lesión a vértebras vecinas y cifosis progresiva por destrucción de la parte anterior del cuerpo vertebral. En casos avanzados la infección se extiende a las partes blandas adyacentes, ocasiona abscesos fríos o hacia la parte posterior de la vértebra y puede afectar al canal medular y originar compresión medular, que en ocasiones precisa cirugía urgente. Las localizaciones más frecuentes son la columna torácica en los pacientes jóvenes y la lumbar en los mayores. Con menor frecuencia la TB ósea afecta a otras regiones, y destaca la porción metafisaria de los huesos largos. Desde este punto puede también extenderse al espacio articular adyacente provocando artritis de origen tuberculoso. Una forma especial de afección articular es el llamado síndrome de Poncet. En este, el paciente presenta rigidez, dolor poliarticular y, en ocasiones, inflamación y edema. El diagnóstico es por exclusión.
- •
TB urinaria: causada por diseminación hematógena, la sintomatología es inespecífica o incluso asintomática en fases iniciales de la localización renal. Si la enfermedad se extiende por el uréter y la vejiga los signos y síntomas de inicio más frecuentes son polaquiuria, disuria y hematuria. Solo el 20% de los pacientes presentan síntomas sistémicos. En los uréteres y la vejiga puede producir fibrosis, estrechamiento o incluso obstrucción del trayecto urinario. Pueden aparecer cólicos y con el tiempo generar hidronefrosis que puede requerir cirugía de derivación o incluso la nefrectomía.
- •
TB genital: en varones se pueden afectar la próstata, el epidídimo y con menor frecuencia los testículos y las vesículas seminales. Con frecuencia se asocia con TB del tracto urinario. La localización prostática se manifiesta en forma de molestias locales, polaquiuria, urgencia miccional o hematospermia. En la exploración física la epididimitis provoca dolor localizado, inflamación escrotal y nodulación irregular. Si no se trata puede originarse una fístula escrotal. En las mujeres, la trompa de Falopio es la localización ginecológica presente en más de las 80% de las TB genitales femeninas. Habitualmente es bilateral y se afecta también el endometrio. Las pacientes inician la clínica con dolor abdominopélvico sin fiebre. Aunque de escasa prevalencia en España, es una de las causas más frecuentes de infertilidad en el mundo.
- •
TB ganglionar: la localización más frecuente es en los ganglios linfáticos cervicales y de la región supraclavicular. La TB en esta localización se desarrolla tras diseminación por vía hematógena o linfática desde un foco distante, aunque puede ser también por vía linfática directamente desde la mucosa orofaríngea y las estructuras relacionadas. La tumoración cervical es la forma de presentación más frecuente. No suele acompañarse de sintomatología constitucional ni fiebre16,21. Las adenopatías tienden a crecer gradualmente y en principio son de consistencia rígida e indolora. Con el tiempo puede sufrir necrosis, fluctuar y presentar signos inflamatorios con fistulización y drenaje de caseum al exterior, lo que se conoce como escrófula. Las adenopatías pueden permanecer e incluso aumentar de tamaño a pesar de un tratamiento eficaz. Las razas orientales presentan una mayor predisposición a presentar TB de esta localización.
- •
TB miliar: ocurre una diseminación hematógena a múltiples órganos. Se producen pequeños nódulos que se pueden ver en los órganos afectados. El cuadro clínico es variable, con síntomas insidiosos como fiebre o febrícula y malestar general, con un examen físico anodino. La radiología torácica puede presentar el típico patrón «en grano de mijo» con pequeños nódulos pulmonares, aunque también puede ser normal. La tomografía computarizada (TC) es útil para demostrar lesiones no visibles en la radiología convencional. Esta forma de presentación es grave en cualquier persona, principalmente en pacientes con inmunodepresión y más concretamente en pacientes con sida. Es importante la sospecha clínica con el fin de realizar un diagnóstico y tratamiento lo más temprano posible. Puede ir asociada a meningitis tuberculosa, por lo que en caso de sospecha clínica debe confirmarse o descartarse su diagnóstico.
- •
TB laríngea: actualmente ocurre en menos del 1% de pacientes con TB. Se produce fundamentalmente por extensión local procedente del árbol bronquial. El signo más frecuente es la disfonía que debe hacer sospechar esta afección, aunque también puede cursar con disfagia, tos, estridor, hemoptisis. De forma local puede producir masas, úlceras y nódulos, que pueden ser indistinguibles de una neoplasia laríngea, lo que requiere estudio histológico y bacteriológico. La TB laríngea se suele asociar a TB pulmonar bacilífera, y por lo tanto es una forma altamente contagiosa.
- •
TB cutánea: generalmente es una manifestación de enfermedad sistémica, aunque puede adquirirse por inoculación directa o por extensión de un foco contiguo, como es el caso de la escrófula. Las manifestaciones de la TB cutánea dependen de la situación inmunitaria del paciente. El lupus vulgaris es una forma de presentación en pacientes inmudeprimidos y puede dar lugar a deformidades crónicas. La tuberculosis verrucosa cutis es una forma habitualmente más indolente en pacientes con inmunodepresión moderada o ligera. Las tuberculides (eritema indurado de Bazin, liquen escrofuloso y tuberculides papulonecróticas) son otras formas de presentación en pacientes habitualmente inmunocompetentes. Aunque tradicionalmente estas últimas se atribuían a reacciones inmunológicas, en ocasiones ha podido demostrarse la presencia de ADN de M. tuberculosis.
- •
TB gastrointestinal: puede comprometer cualquier parte del tracto digestivo, desde la boca hasta el ano. La localización ileocecal es la más frecuente. En la endoscopia puede visualizarse una imagen ulcerada que en ocasiones sugiere un carcinoma. Puede presentarse también como imágenes verrugosas o fístulas. El páncreas, las vías biliares y el hígado también se pueden afectar. La TB es aún en nuestro medio una causa frecuente de hepatitis granulomatosa.
La inmunodepresión asociada a algunas enfermedades (neoplasias sólidas y hematológicas tratadas con quimioterapia, trasplante de órgano sólido e infección por el VIH, entre otras) puede modificar la localización —puede afectar a cualquier órgano—, la presentación clínica y radiológica, así como la gravedad y la evolución de la TB. Las diferencias son especialmente llamativas en el caso de la infección por el VIH, que se ha utilizado como paradigma de la influencia de la inmunodepresión en estos aspectos de la enfermedad tuberculosa.
La presentación clínica de la TB en el paciente infectado por el VIH difiere de la clásicamente reconocida en la población general. La mayor virulencia de M. tuberculosis respecto a otros patógenos oportunistas que complican la infección por el VIH determina que la mayoría de pacientes que desarrollan una TB no haya padecido todavía infecciones definitorias de sida. La afección pulmonar exclusiva se da en menos del 50% de los casos, y el resto presenta afección extrapulmonar exclusiva o mixta. El estado de inmunosupresión del sujeto es el principal condicionante de la presentación clínica, de modo que los pacientes con mayor inmunodepresión tienden a presentar con mayor frecuencia formas extrapulmonares y, sobre todo, diseminadas. Por otra parte, dentro de las formas pulmonares, aquellas presentaciones más parecidas a las clásicas son más frecuentes en los pacientes con estado inmunitario más conservado.
Los síntomas y signos de la TB en los pacientes infectados por el VIH suelen ser inespecíficos y no permiten distinguir claramente la enfermedad de otras infecciones oportunistas. La fiebre es un signo prácticamente constante, mucho más frecuente que en los pacientes inmunocompetentes. El paciente puede acudir con un cuadro agudo de pocas horas o días de evolución, similar a una infección bacteriana clásica, o con cuadros de varios días o semanas, caracterizados por fiebre y síntomas sistémicos inespecíficos (anorexia, astenia, pérdida de peso), que pueden acompañarse, o no, de datos de afectación de un órgano focal. La localización más frecuente es el tracto respiratorio, pero se afectan también con gran frecuencia los ganglios linfáticos, el sistema urinario, el sistema nervioso central y el hígado.
La presentación radiológica de la TB pulmonar es muy variable, desde la radiografía de tórax normal hasta extensos patrones bilaterales que pueden llevar a confusión con la neumonía por Pneumocystis jiroveci22. Cabe destacar la elevada frecuencia de adenopatías intratorácicas que se observan en todas las series. Entre los órganos extrapulmonares la afectación de los ganglios linfáticos, tanto periféricos como intratorácicos o intraabdominales es muy frecuente, hasta el punto de que, en nuestro entorno, la presencia de adenopatías significativas en cualquier territorio junto con fiebre u otras manifestaciones en pacientes positivos al VIH debe sugerir como primera posibilidad diagnóstica la TB. La detección de adenopatías con centros hipodensos y captación de contraste en anillo en la TC se ha sugerido como de alta especificidad en el diagnóstico de TB.
Tras la introducción de los tratamientos antirretrovirales de alta eficacia, se han reconocido presentaciones clínicas, previamente no observadas. Se ha comunicado el desarrollo de formas explosivas de TB tras el inicio del tratamiento antirretroviral, incluyendo pacientes con diagnóstico y tratamiento de la TB anteriores al inicio del tratamiento antirretroviral (síndromes inflamatorios por reconstitución inmunológica, IRIS23). Estas formas también pueden observarse en inmunodeprimidos no infectados por el VIH e incluso en algunas ocasiones en pacientes sin enfermedad de base. El principal factor de riesgo parece ser la administración simultánea del tratamiento antirretroviral y antituberculoso, apareciendo en los primeros 2 meses del inicio de estos24. Las manifestaciones clínicas incluyen fiebre elevada, exacerbación y extensión de la afección pulmonar y extrapulmonar, sobre todo afección ganglionar en múltiples territorios. Estos cuadros de exacerbación se consideran una consecuencia de la recuperación de la inmunidad celular25. Estas manifestaciones de exacerbación de la TB no implican peor evolución o pronóstico y no precisan tratamiento específico, aunque puede ser útil la administración de esteroides26.
En pacientes con causas de inmunosupresión distintas a la infección por el VIH, con frecuencia la TB tiene afectación extrapulmonar exclusiva o es diseminada. En los pacientes que han recibido órganos trasplantados y que desarrollan TB, aproximadamente entre el 25 y el 48% de los casos tienen localización extrapulmonar o diseminada. En estos pacientes el único factor con el que se ha asociado la presentación como enfermedad diseminada es el uso de anticuerpos monoclonales anti-CD3 (OKT3) para evitar el rechazo. También se ha asociado con formas diseminadas la administración de fármacos anti-TNF. Debe señalarse, además, que en ocasiones la TB se diagnostica en pacientes asintomáticos durante la vigilancia rutinaria de la enfermedad inmunosupresora y que con cierta frecuencia es un diagnóstico de necropsia. La radiología muestra hallazgos más próximos a los de pacientes inmunocompetentes (infiltrados focales o miliares, nódulos, derrame pleural, raramente adenopatías intratorácicas) que a los de pacientes infectados por el VIH.
Recomendaciones respecto a las manifestaciones clínicas
- 1.
Debe sospecharse TB pulmonar, e iniciar los procedimientos diagnósticos, en todo paciente con síntomas respiratorios de más de 2–3 semanas de duración, así como en pacientes con hemoptisis, independientemente de la duración. En muchas ocasiones la sintomatología clínica es inespecífica, por lo que se ha de tener siempre en cuenta en el diagnóstico diferencial de las enfermedades pulmonares no diagnosticadas (AIII).
- 2.
La TB extrapulmonar en cualquiera de sus localizaciones puede presentar síntomas generales inespecíficos y los derivados del órgano afecto. Es importante la sospecha clínica cuando existe un proceso inflamatorio en estos órganos y debe considerarse siempre en el diagnóstico diferencial de fiebre de origen desconocido. La afectación del SNC y la TB miliar son de especial gravedad y precisan un diagnóstico y tratamiento lo más temprano posible (AIII).
- 3.
Debe tenerse en cuenta que la inmunodepresión, cuyo paradigma es la infección por el VIH, puede modificar la localización, la presentación clínica y radiológica, así como la gravedad y evolución de la TB, siendo más frecuentes las manifestaciones atípicas pulmonares y las formas extrapulmonares y diseminadas que en las personas inmunocompetentes. La fiebre es un síntoma prácticamente constante y es muy frecuente la afectación ganglionar en diversos territorios (AIII).
- 4.
En pacientes inmunodeprimidos, sobre todo en coinfectados por el VIH, debe considerarse la posibilidad de formas clínicas explosivas debidas al síndrome de reconstitución inmune, principalmente cuando se inicia el tratamiento antirretroviral en los primeros 2 meses del tratamiento antituberculoso (AIII).
En la TB pulmonar y torácica. Los hallazgos en la radiografía y la TC torácicas, aunque inespecíficos, son un fiel reflejo de las alteraciones estructurales del pulmón y del resto del tórax, lo que permite sospechar la existencia de TB. Los patrones radiológicos se corresponden con la patogenia de la enfermedad y el predominio en cada momento de la inmunidad celular o de la hipersensibilidad retardada27,28.
Los hallazgos radiológicos fundamentales relacionados con la TB primaria, aislados o combinados, son: a) infiltrados u opacidades parenquimatosas: corresponden al foco neumónico inicial, segmentario de pequeño tamaño y en ocasiones lobar, que en el niño y adolescente se acompaña de adenopatías; b) adenopatías: sobre todo paratraqueales e hiliares, de preferencia en el hemitórax derecho donde suele localizarse el foco inicial; en el niño son la base del diagnóstico; c) atelectasia segmentaria: por compresión ganglionar de la luz bronquial o por TB endobronquial, sobre todo en el lóbulo medio, condicionando bronquiectasias; d) derrame pleural: que suele ser unilateral; es más frecuente en jóvenes y puede ser el único hallazgo radiológico, y e) TB miliar: es poco frecuente; corresponde a una diseminación hematógena inicial autolimitada.
Los hallazgos radiológicos fundamentales de la TB de reactivación, secundaria o postprimaria son: a) condensaciones de tipo bronconeumónico, parcheadas sin broncograma aéreo, de localización preferente en segmentos posteriores de lóbulos superiores; b) cavitación, única o múltiple, de diversos tamaños, con o sin nivel hidroaéreo; se suele localizar en segmentos posteriores de lóbulos superiores; c) derrame pleural secundario a fístula broncopleural; si el foco está cavitado resultará en neumotórax o pioneumotórax; d) diseminación miliar, hematógena y difusa, de micronódulos de 1–3mm de diámetro que pueden ser imperceptibles en su inicio o coalescentes y coexistir con lesiones cavitadas en fases más tardías; e) tuberculomas: nódulos o masas seudotumorales de diverso tamaño, con calcificaciones, y f) fibrosis: corresponde al intento de curación de infiltrados y cavidades mediante calcificación y retracción fibrosa del segmento o lóbulo afectado, con distorsión de su estructura. Origina bronquiectasias y puede llegar al patrón de pulmón destruido.
En pacientes inmunocompetentes, los hallazgos radiológicos habituales en el niño, adolescente y adulto joven suelen ser los propios de la TB primaria, mientras que en adultos y ancianos son los de la TB postprimaria. En los pacientes inmunodeprimidos, como sucede en la infección por el VIH, los hallazgos varían en función del grado de depresión: en pacientes con cifras normales de CD4+ son similares a los descritos para el individuo inmunocompetente, pero cuando la depresión inmune es intensa, la radiografía puede incluso ser normal. La TC puede ser útil en niños y en algunas situaciones dudosas.
En la TB extratorácica. La dificultad para la obtención de confirmación microbiológica de la TB de localización extrapulmonar hace que con frecuencia el diagnóstico deba basarse en otras pruebas. La radiología y otras técnicas de imagen pueden ayudar a la aproximación diagnóstica de la TB extratorácica. Por otra parte, la TC y/o la resonancia magnética (RM) también pueden ser útiles para localizar los territorios afectados accesibles a una punción diagnóstica.
La TB del SNC, aun no siendo la forma más frecuente de localización extrapulmonar, es la más grave, por lo que una aproximación diagnóstica rápida es de vital importancia para el pronóstico del paciente. Las manifestaciones de la TB en el SNC son diversas, lo que se refleja en las imágenes radiológicas tanto en la TC como en la RM. La RM es la técnica de imagen que detecta más precozmente las lesiones y, por tanto, es de elección cuando esté disponible. En la meningitis TB se ha descrito clásicamente la presencia de una triada consistente en hipercaptación de contraste en las meninges basales, hidrocefalia e imágenes de infartos de origen vascular. No obstante, ninguna de ellas es patognomónica de TB y sólo un pequeño porcentaje de las meningitis de origen TB presentan los 3 signos. La TB que afecta al parénquima cerebral puede presentarse en forma de tuberculoma, absceso o tuberculomas en placa. La TC y la RM pueden ser de ayuda, aunque no hay signos específicos para su diagnóstico diferencial con otras lesiones ocupantes de espacio del SNC29. Los tuberculomas suelen ser de localización supratentorial, presentan realce periférico en anillo y aparecen con señal hipo o isointensa en secuencia T1 e hiperintensa en T2 o hipointensa, en el caso de tuberculomas caseificantes. Pueden tener grados variables de edema alrededor. La RM-espectroscopia muestra picos lipídicos prominentes, hecho bastante característico de los tuberculomas intracraneales30. Sin embargo, pueden también aparecer en otro tipo de lesiones intracraneales como abscesos piogénicos o tumores.
En la TB ósea, la columna vertebral es la localización más frecuente, especialmente en las regiones lumbares o torácicas. Habitualmente, la enfermedad afecta a la parte anterior del cuerpo vertebral pudiendo extenderse al espacio intervertebral y partes blandas paravertebrales, formando abscesos. La desmineralización periarticular es un signo radiológico precoz, aunque inespecífico. Al igual que con la TB del SNC, la RM tiene una mayor sensibilidad que la TC para detectar lesiones de origen tuberculoso.
En la TB urogenital, la afección de los cálices renales es, con frecuencia, la primera manifestación radiológica objetiva. La lesión puede progresar produciendo deformidad calicial, ulceraciones, fibrosis y estenosis que ocasionan finalmente caliectasias, hidronefrosis y ureterohidronefrosis con destrucción secundaria del parénquima renal. Las técnicas sonográficas pueden ser de ayuda diagnóstica en la epididimitis tuberculosa y otras formas de localización genital. La TB genital muestra focos de hipoecogenicidad y bajo grado de flujo sanguíneo en el estudio Doppler31.
Respecto a la TB ganglionar, los ganglios cervicales o supraclaviculares son los afectados con más frecuencia, aunque puede presentarse en cualquier localización. El realce periférico con centro de baja atenuación en la TC es sugestivo de etiología tuberculosa aunque no patognomónico.
En otras localizaciones de la TB, como en la intestinal, se pueden detectar signos radiológicos consecuencia de fibrosis, estenosis o retracción intestinal.
Las técnicas isotópicas, como la gammagrafía y la tomografía por emisión de positrones (PET), que estiman la actividad inflamatoria, detectan la enfermedad en fases tempranas, aunque los hallazgos resultantes son inespecíficos para el diagnóstico de la TB de localización extratorácica.
Recomendaciones respecto a las técnicas de imagen
- 1.
En el diagnóstico de sospecha de la TB pulmonar debe utilizarse la radiografía simple de tórax (AIII).
- 2.
En pacientes inmunocompetentes, si bien no lo descarta totalmente, una radiografía de tórax normal va en contra del diagnóstico de TB (BIII).
- 3.
La radiografía de tórax suele presentar manifestaciones muy sugerentes de TB, aunque en ocasiones son atípicas, por lo que la TB ha de estar en el diagnóstico diferencial de alteraciones radiológicas no explicadas (AIII).
- 4.
Las pruebas radiológicas más complejas (TC, RM) son de gran utilidad en las formas de TB extrapulmonar. En la TB pulmonar se han de reservar para los casos en los que haya sospecha clínica y los resultados de la radiografía simple y la microbiología no lleven a un diagnóstico (AIII).
El diagnóstico clínico de la TB se basa en signos y síntomas característicos. Sin embargo, el diagnóstico diferencial puede ser a veces difícil. Este hecho, junto con las implicaciones epidemiológicas y de salud pública del diagnóstico de TB, hace necesario el empleo de los medios necesarios para obtener la confirmación microbiológica, que constituye el diagnóstico de certeza. No obstante, el empleo de dichos medios deberá realizarse de acuerdo con la carga de trabajo y la experiencia de cada laboratorio, considerando la derivación a centros de referencia cuando sea necesario.
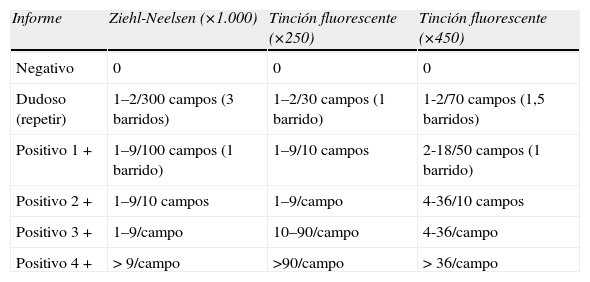
Técnicas de microscopia. En el momento actual, la técnica más rápida, sencilla y accesible para realizar el diagnóstico rápido de la TB es la tinción ácido-alcohol resistente32. Permite la detección en muestras clínicas de todos los miembros del género Mycobacterium33,34, pero para que sean detectables deben existir entre 5.000–10.000 bacilos/ml en la muestra33,34. Esto hace que un porcentaje variable (30–50%) de los casos de TB no sean bacilíferos, por lo que una baciloscopia negativa nunca descarta la enfermedad. En nuestro medio, la detección de bacilos ácido-alcohol resistentes en muestras clínicas suele ser sinónimo de TB, sobre todo en muestras respiratorias. Las técnicas de tinción más empleadas son las tinciones de Ziehl-Neelsen y la fluorescente de Auramina-Rodamina. Se ha demostrado que la especificidad de ambas es pareja, si bien la tinción fluorescente posee la ventaja de ser examinada con un menor número de aumentos, lo que redunda en un menor tiempo de evaluación de cada extensión32,33. La visualización de al menos 3 bacilos ácido-alcohol resistentes por cada 300 campos de 100 aumentos debe considerarse siempre como positiva32. Se recomienda además la realización de un recuento del número de bacilos presente en la muestra (tabla 5) para valorar el seguimiento del tratamiento. Debido al elevado número de falsos positivos descrito en diversos estudios, no se recomienda en la actualidad la técnica de Kinyoun en el diagnóstico directo35.
Interpretación de los resultados de la baciloscopia
| Informe | Ziehl-Neelsen (×1.000) | Tinción fluorescente (×250) | Tinción fluorescente (×450) |
| Negativo | 0 | 0 | 0 |
| Dudoso (repetir) | 1–2/300 campos (3 barridos) | 1–2/30 campos (1 barrido) | 1-2/70 campos (1,5 barridos) |
| Positivo 1 + | 1–9/100 campos (1 barrido) | 1–9/10 campos | 2-18/50 campos (1 barrido) |
| Positivo 2 + | 1–9/10 campos | 1–9/campo | 4-36/10 campos |
| Positivo 3 + | 1–9/campo | 10–90/campo | 4-36/campo |
| Positivo 4 + | > 9/campo | >90/campo | > 36/campo |
Modificado de Alcaide et al32.
La identificación de casos bacilíferos es de especial importancia, puesto que se trata de los pacientes más contagiosos, y su detección es prioritaria en todos los programas de lucha contra la TB como paso esencial en la rotura de la cadena de transmisión de la enfermedad. Por ello, todo paciente sospechoso de TB debe ser estudiado mediante tinción. Además, debido a que la eliminación de bacilos en secreciones respiratorias es irregular, deben estudiarse al menos 3 muestras de buena calidad y obtenidas en días distintos antes de considerar al paciente como no bacilífero32.
En las presentaciones clínicas extrapulmonares, el rendimiento de la microscopia está en relación con la muestra obtenida, siendo elevada en muestras obtenidas por biopsia o exéresis de tejidos (>70–80%) y manifiestamente baja en líquidos biológicos (5–20%)32,33.
Aparte de su papel fundamental en el diagnóstico, la microscopía es esencial para realizar un seguimiento de la eficacia del tratamiento. En este sentido, deben obtenerse muestras para baciloscopia y cultivo coincidiendo con las visitas de seguimiento. El número de bacterias presentes en la tinción disminuirá si el tratamiento es eficaz, aunque la conversión de la tinción puede tardar en función de la carga bacilar inicial de las lesiones34.
Técnicas de cultivo. Se debe realizar el cultivo para micobacterias en todo paciente con sospecha de TB. El cultivo, considerado la prueba de referencia, posee mucha mayor sensibilidad que la tinción, siendo capaz de detectar entre 10–100 bacterias/ml de muestra. Además, permite aislar la micobacteria presente en la muestra, y hace posible su identificación de especie y el estudio de sensibilidad a los antibióticos. El principal inconveniente del cultivo es la lentitud en la obtención de resultados positivos, hecho que está determinado por las características metabólicas del patógeno. M. tuberculosis, así como el resto de especies del complejo, son micobacterias de crecimiento lento, lo que implica que son necesarias de 2–6 semanas, dependiendo del número de bacterias presentes en la muestra, para dar lugar a crecimiento visible macroscópicamente en medios de cultivo sólidos33. Con el objetivo de minimizar este período de incubación se han empleado diversas estrategias, y en el momento actual la más seguida es el empleo de medios líquidos automatizados. Estos medios permiten detectar la presencia de crecimiento bacteriano entre 7–10 días antes que los medios sólidos32–34. Además, al combinarse el inóculo de una mayor cantidad de muestra con las características del medio, son en general más sensibles que los medios sólidos. Sin embargo, dado que en algún caso el cultivo resulta positivo en el medio sólido y negativo en el medio líquido, en el momento actual se recomienda utilizar ambos medios.
La negativización del cultivo es el principal criterio de curación microbiológica. Para evaluar esta, se recomienda realizar cultivos bimensuales de esputo, coincidiendo con las visitas de seguimiento, siempre que pueda obtenerse una muestra emitida desde el tracto respiratorio inferior. En pacientes bacilíferos y cuando por criterios clínicos se considere necesario, se obtendrán también muestras para cultivo y baciloscopia a los 15 días y al mes de inicio del tratamiento. Si la emisión de esputo desaparece a lo largo del tratamiento, no deberán indicarse cultivos de la saliva, puesto que carecen totalmente de utilidad.
Antibiograma. El estudio de sensibilidad de M. tuberculosis se basa en la detección en el cultivo de un porcentaje superior al 1% de bacterias resistentes en comparación con un control de crecimiento sin antibiótico36. La existencia de estas bacterias resistentes se debe a la elevada tasa de mutaciones de resistencia que presentan frente a los distintos antibióticos utilizados en el tratamiento37. En el momento actual, en el mercado se dispone varios sistemas comerciales estandarizados, basados en los mismos medios líquidos automatizados o semiautomatizados utilizados en el cultivo. Permiten la realización del antibiograma de forma relativamente sencilla en la mayoría de los laboratorios de micobacteriología34,38–40. No obstante, deberá ser realizado por laboratorios con experiencia que posean una carga de trabajo suficientemente elevada, y que se sometan de forma repetida a diversos controles de calidad, tanto internos como externos. En el momento actual se recomienda la realización de antibiograma a fármacos de primera línea a todos los aislamientos de muestras iniciales de pacientes nuevos o tratados previamente, con el objetivo de conocer la respuesta de los aislados clínicos frente a los mismos y ajustar el tratamiento cuando sea necesario32,34. Cuando se detectan resistencias es importante confirmarlas, si es preciso repitiendo el ensayo o remitiendo el aislado a un centro de referencia, así como descartar falsas resistencias debidas a contaminación por otras micobacterias o por bacterias convencionales. Ante la presencia de resistencia, sobre todo a H y/o R, estará indicada la realización de antibiograma frente a fármacos de segunda línea. Debido a que no existe en la actualidad una estandarización ampliamente aceptada41, se recomienda derivar el aislamiento a un centro de referencia o con suficiente experiencia en su realización.
Métodos moleculares en el diagnóstico directo. Se basan en la amplificación de fragmentos genéticos específicos de M. tuberculosis directamente en las muestras clínicas. Actualmente su principal interés teórico es su potencialidad en el diagnóstico rápido de enfermedad tuberculosa con una sensibilidad superior a la baciloscopia, considerada la técnica rápida de referencia. No obstante, a pesar de que durante los últimos 15 años se han realizado numerosos estudios para establecer su papel en el protocolo diagnóstico de la TB, el principal obstáculo para valorar su eficacia reside en la ausencia de una estandarización universal, ya que existe una amplia variedad metodológica en los diferentes niveles de la técnica, dificultando la comparación de los diferentes estudios. Al mismo tiempo, están disponibles aplicaciones comercializadas y métodos de desarrollo casero (home made)42–44.
La mayoría de estudios se han aplicado a la TB pulmonar, utilizando la técnica de reacción en cadena de la polimerasa (PCR) y la IS6110 como diana genética. Aunque se han descrito aislamientos carentes de esta secuencia, en general su rendimiento ha sido superior a otras dianas propuestas. En las mejores condiciones de ensayo la sensibilidad es menor que el cultivo y está relacionada con la carga bacteriana, de forma que en muestras con baciloscopia positiva oscila entre el 90–100%, mientras que en aquellas con baciloscopia negativa se sitúa entre 60–70%. La sensibilidad global, con independencia de la baciloscopia, de los métodos comercializados sería menor, alrededor del 50%, respecto al 80% de los caseros, aunque tendrían una especificidad mayor (el 95 vs. al 80%)42.
En las formas extrapulmonares, se ha estudiado sobre todo en las TB pleural45 y meníngea, mayoritariamente con baciloscopia negativa. La sensibilidad media oscila entre el 50–70%, con especificidad cercana al 90–95%, por lo que tiene un valor de exclusión escaso, pero confirmaría la enfermedad con un alto grado de certeza. Respecto a otras localizaciones, no hay evidencias suficientes que permitan establecer de forma razonable su rentabilidad. A este respecto, la escasa literatura existente podría indicar que en las localizaciones ganglionar y ósea la sensibilidad estaría alrededor del 80%, con especificidad superior al 90%, y que en la TB urinaria, peritoneal y pericárdica tendría una rentabilidad similar a las descritas para las formas pleural y meníngea42.
La aplicación de las técnicas de amplificación al diagnóstico asistencial de la TB exige como requisito previo una mayor estandarización que tenga en cuenta factores técnicos y factores clínicos. Entre los factores técnicos están la diana genética elegida y el método de extracción del ADN, la técnica y la variedad de amplificación elegida, así como el sistema de revelado. En la especificidad es crucial la elección de los iniciadores y el control de contaminaciones cruzadas. Incluir más de una diana genética, usar controles internos de inhibición, así como evaluar adecuadamente los métodos de extracción contribuyen a aumentar la sensibilidad. La utilización de métodos que combinen una extracción automatizada con amplificación por PCR a tiempo real, ofrecería una alternativa versátil y realizable en condiciones de rutina asistencial, aunque no se dispone de suficientes datos que contrasten su utilidad respecto a otras estrategias. Respecto a los factores clínicos, el grado de sospecha tiene un efecto directo en la utilidad de la técnica. La mayoría de los estudios considera la baciloscopia y el cultivo como los métodos de referencia por lo que en la práctica el valor diagnóstico de los resultados de los tests de amplificación debe decidirse después de un análisis conjunto de los datos clínicos y el resto de las pruebas disponibles. Así, cuando el grado de sospecha de TB es moderado o alto (superior al 40%), un resultado positivo indicará TB en el 80% o más de los casos, mientras que si la sospecha es baja, reduce la especificidad a un máximo del 50%42.
En conclusión, los datos existentes avalan la utilización de las técnicas de amplificación como coadyuvantes en el diagnóstico de la TB, juntamente con la clínica y resto de exploraciones, sin que esté indicada su aplicación en casos con bajo nivel de sospecha clínica debido a su escasa especificidad.
Métodos moleculares en la identificación y en la detección de resistencias. Durante los últimos años, en los laboratorios se ha observado un aumento del porcentaje de aislamientos correspondientes a micobacterias no pertenecientes al complejo M. tuberculosis. Contribuyen a este incremento mejoras técnicas, como el uso de los medios de cultivo líquidos semiautomatizados y los nuevos métodos de identificación, y por otra parte, posiblemente una elevación de la incidencia real, relacionado con nuevas situaciones epidemiológicas como el mayor número de pacientes inmunodeprimidos o con enfermedades crónicas y de las infecciones vinculadas a manipulaciones y dispositivos invasores.
Las micobacterias distintas al complejo M. tuberculosis son generalmente ubicuas en el medio ambiente y poseen un poder patógeno inferior a este, que además es distinto entre ellas. Su simple aislamiento no implica enfermedad, por lo que es crucial dilucidar en cada caso su significación clínica, razón por la cual se dispone de guías elaboradas por diversas sociedades científicas que ayudan a su interpretación. Por ello, es imprescindible alcanzar una identificación de especie en todos los aislamientos de muestras clínicas. Tradicionalmente, M. tuberculosis se ha identificado con pruebas bioquímicas basadas en la producción de niacina y en la reducción de nitratos. Durante los últimos años se ha utilizado con éxito la identificación utilizando un método comercial basado en sondas de hibridación quimioluminiscentes. Recientemente están teniendo difusión en los laboratorios diversos métodos de identificación basados en hibridación con sondas inmovilizadas en tiras de nitrocelulosa y revelado enzimático (line probe assay) capaces de identificar de 10–15 especies distintas, con especificidad cercana al 100%46. Por otra parte, la secuenciación de zonas variables de genes comunes al género, como el gen 16S rDNA permite la identificación teórica de prácticamente todas las especies micobacterianas. Raramente es necesario identificar específicamente las distintas especies integrantes del complejo M. tuberculosis debido a que no presentan diferencias clínicas relevantes y a que en nuestro medio más del 95% de los aislamientos corresponden a M. tuberculosis. No obstante, existen diversos métodos capaces de diferenciarlas, ya sean basados en PCR, en hibridación con sondas inmovilizadas en tiras de nitrocelulosa o en técnicas de tipado molecular.
En conclusión, las técnicas genéticas poseen una elevada eficacia en la identificación del complejo M. tuberculosis. Combinadas con características bioquímicas y morfológicas permiten la identificación de la mayoría de especies que se aíslan a partir de muestras clínicas.
El arsenal terapéutico frente a la TB es muy limitado, y representa un importante problema en los pacientes afectados por cepas resistentes a los fármacos, sobre todo en los casos multirresistentes. El antibiograma por el método de las proporciones es la técnica de referencia para la detección in vitro de la resistencia de los aislados de M. tuberculosis a los fármacos antituberculosos de primera línea. No obstante, el tiempo de incubación necesario para obtener resultados (4–8 semanas desde la obtención de la muestra) limita el margen de maniobra para diseñar alternativas terapéuticas.
El desarrollo de métodos de detección molecular de la resistencia se basa en la demostración de mutaciones en determinados genes. Se conocen mutaciones relacionadas con la resistencia a los distintos fármacos de primera línea, aunque hay una proporción de aislados en que se no se observan y, por tanto, no son detectables por esta metodología47. Esta proporción es variable según los fármacos. Así, más del 95% de las resistencias a R son debidas a mutaciones localizadas en un corto fragmento de 81 nucleótidos del gen rpoB. En el 60–65% de los casos la resistencia a la H se ha relacionado fundamentalmente con mutaciones en el gen katG y con la región intergénica mabA-inhA. En cuanto a los restantes fármacos de primera línea, se hallan mutaciones en el gen embB en el 50% de las resistencias a etambutol (E), en los genes rrs y rpsL en el 55% de los aislados resistentes a estreptomicina y en el gen pncA en el 94% de los casos con resistencia a la piracinamida (Z). La mayoría de los protocolos de detección se basan en el análisis simultáneo de la mutación y de su secuencia silvestre correspondiente, lo que le confiere una especificidad muy elevada.
Cuando la detección genética de resistencias se aplica sobre aislamientos de cultivo, la sensibilidad es cercana al 100%, siempre que la mutación causal esté incluida en el diseño de la técnica. En muestras clínicas sólo se utiliza cuando la baciloscopia es intensamente positiva, ya que de lo contrario la sensibilidad es baja.
En los últimos años se está generando un importante impulso en la detección genética de resistencias, sobre todo mediante la tecnología de amplificación por PCR y detección fluorimétrica a tiempo real48,49, así como los métodos basados en la detección de sondas inmovilizadas sobre tiras de nitrocelulosa. Por ser los fármacos más importantes en el tratamiento estándar, la mayoría de las estrategias se aplican a la detección de resistencia frente a R e H. Más recientemente se están desarrollando aplicaciones basadas en microarrays capaces de detectar simultáneamente un número importante de mutaciones de todos los fármacos50.
La detección de mutaciones de resistencia a H y R está indicada en aislamientos de cultivo positivo o directamente en muestras con baciloscopia intensa (3+/4+) en las siguientes situaciones: fracaso terapéutico, sospecha de contagio de pacientes resistentes y en pacientes procedentes de países con elevada incidencia de resistencia. En pacientes con antecedentes de tratamiento previo debería analizarse individualmente su indicación, que es clara en aquellos pacientes con sospecha de haber seguido tratamientos incompletos.
No obstante, la realización del antibiograma es obligada, ya que estas técnicas no detectan todas las resistencias ni tampoco la CMI, por lo que su principal utilidad se la confiere el proporcionar una información preliminar y rápida del antibiograma, especialmente cuando se detectan mutaciones.
Otros métodos de diagnósticoHistología. En la enfermedad tuberculosa es posible observar lesiones características que pueden ser útiles en el diagnóstico cuando se dispone de biopsias o piezas quirúrgicas. La lesión típica de TB en los tejidos es la inflamación granulomatosa con necrosis central51. Se considera un hallazgo de elevada especificidad y justifica iniciar tratamiento antituberculoso. También pueden observarse con frecuencia granulomas sin necrosis. En un contexto de sospecha elevada de TB, estos últimos sugieren diagnóstico probable, aunque hay otras causas infecciosas y no infecciosas por las que se pueden presentar, como puede ser la sarcoidosis.
La observación de bacilos ácido-alcohol resistentes en el centro necrótico confirma el diagnóstico, pero únicamente se observan bacterias en alrededor del 10% de los casos con granulomatosis necrótica. Por ello, es necesario realizar un cultivo de las piezas histológicas. Con frecuencia las muestras obtenidas se han conservado con formol, resultando inviables los cultivos. Diversos estudios en que se ha llevado a cabo la amplificación en muestras fijadas con formol e incluidas en parafina, indican que la sensibilidad oscilaría entre el 30–65% según las condiciones metodológicas. No obstante, la recomendación más importante es obtener porciones de las biopsias adecuadas para el cultivo, conservadas en agua destilada.
Determinación de adenosina desaminasa (ADA) y otros parámetros bioquímicos y citológicos. De la misma forma que la respuesta tisular granulomatosa es típica de TB, cuando esta se localiza en serosas se desarrolla una respuesta inflamatoria característica. Diversos parámetros citológicos y bioquímicos producto de esta reacción tienen utilidad en el diagnóstico, siendo la determinación de ADA el que aporta más información. La ADA es una enzima que interviene en el catabolismo de las purinas, producida por monocitos y macrófagos y que se encuentra en concentración elevada en la TB. Se encuentra en 3 formas, siendo la más específica de TB la isoenzima ADA2, producida por los monocitos, aunque en la mayoría de las técnicas se analiza la ADA de forma global; se expresa en UI/l y se considera un punto de corte para cada tipo de muestra (generalmente 8–10UI/l para líquido cefalorraquídeo y 40U/l para líquido pleural).
La determinación de ADA se ha utilizado ampliamente en la TB pleural52, por ser una de las causas más frecuentes de derrame pleural, y en menor grado en las formas meníngeas. La experiencia en localizaciones peritoneal, articular y pericárdica es mucho menor.
La sensibilidad en general es elevada, entre el 75–98%, y es la prueba más sensible en todas las formas de TB en serosas. Así sucede en las formas pleurales, donde la sensibilidad de la baciloscopia sería inferior al 5%, la del cultivo estaría entre el 25–40% y la de la histología de la biopsia se situaría entre el 50–80%.
La especificidad está en relación directa a la incidencia de TB, por lo que en áreas de baja incidencia disminuirá al aumentar la proporción relativa de causas de falsos positivos y tendrá valor de exclusión en los negativos. En la localización pleural, con falsos positivos por empiema, linfoma, neoplasia o pleuritis reumatoidea, se considera que está alrededor del 90%. También se han descrito falsos positivos en líquido cefalorraquídeo relacionados con linfomas y meningitis por Crytococcus neoformans, citomegalovirus (CMV) y Candida, por lo que en esta localización su especificidad sería menor, alrededor del 80%.
Su máxima rentabilidad, más del 90% de los diagnósticos, se consigue cuando se combina con parámetros bioquímicos favorables (porcentaje de linfocitos superior al 50%, proteínas y LDH elevadas y glucosa inferior a 25mg/dl), tuberculina positiva (o una de las 2 pruebas de determinación de la producción de interferón gamma positiva) y/o amplificación genética positiva. En esta situación podría evitar la realización de biopsia pleural confirmatoria. Se ha descrito que segundas determinaciones realizadas en casos de sospecha elevada aumentarían la sensibilidad en TB pleural.
Recomendaciones respecto al diagnóstico microbiológico y de laboratorio
- 1.
En el diagnóstico de la TB pulmonar deben estudiarse al menos 3 muestras seriadas de secreciones respiratorias de buena calidad y obtenidas en días distintos (AII).
- 2.
En la TB extrapulmonar también se obtendrán muestras seriadas si no ha de hacerse de forma invasiva. Cuando sea necesario utilizar métodos invasivos, deberá valorarse la obtención de más de una muestra si el grado de sospecha clínica es elevado. Asimismo, es importante asegurar que el método de obtención de la muestra permita la realización del cultivo (BIII).
- 3.
En todos los pacientes con sospecha de TB deben estudiarse muestras de la localización clínica mediante tinción ácido-alcohol resistente (Ziehl-Neelsen, Auramina) y cultivo (AIII). En los cultivos deberán emplearse siempre medios líquidos automatizados, siendo recomendable añadir también un medio sólido (AIII).
- 4.
Las técnicas de amplificación genética son coadyuvantes de la baciloscopia y del aislamiento por cultivo. Deben utilizarse únicamente en casos con sospecha de TB moderada o alta para evitar resultados falsos positivos (BIII).
- 5.
La detección genética de las mutaciones más conocidas de resistencia a H (codón 315 del gen katG) y a R (zona RRDR del gen rpoB) es altamente específica de resistencia. Se recomienda su utilización en situaciones clínicas y epidemiológicas concretas (AIII).
- 6.
Deberá realizarse antibiograma a fármacos de primera línea a todos los aislamientos iniciales de M. tuberculosis. Los antibiogramas deberán ser realizados por laboratorios con experiencia en estos y las resistencias detectadas deberán ser confirmadas. Ante la aparición de resistencias a H y R (multirresistencia) deberá realizarse un estudio de sensibilidad a fármacos de segunda línea (AIII).
El tratamiento actual de la TB inicial o nunca tratada (tablas 6–8) se rige por las bases bacteriológicas y por los numerosos ensayos terapéuticos controlados realizados durante más de 30 años por diversas sociedades científicas y organizaciones sanitarias internacionales. Se considera que un régimen terapéutico reúne condiciones para ser utilizado cuando cura a más del 95% de los pacientes y ocasiona menos del 5% de intolerancias graves que obliguen a su modificación. El mejor tratamiento será el formado por fármacos que tengan un alto poder bactericida y esterilizante, con bajo número de recidivas, buena aceptación y tolerancia, pocos efectos secundarios, administrados simultáneamente y en preparados que contengan todos los fármacos combinados. Esto facilitará el cumplimiento y evitará los fracasos y la creación de resistencias.
Tratamientos iniciales de la tuberculosis
| Situación | Pauta |
| Pulmonar y extrapulmonar | 2HRZE/4HR¿/¿¿ |
| Tratamientos iniciales alternativos | 2HRZS/4HR |
| 2HRE/7HR | |
| Situaciones especiales (gota, hepatopatía crónica grave) | 2HRE/7HR |
| Meningitis, tuberculomas | 2HRZE/10HR |
| Silicosis, espondilitis TB con afección neurológica | 2HRZE/7HR |
E: etambutol; H: isoniacida; R: rifampicina; S: estreptomicina; TB: tuberculosis; Z: piracinamida.
Dosificación orientativa de los fármacos de primera línea
Posología de los preparados en combinación fija en el tratamiento de la tuberculosis
| Fase inicial: 2 meses | ||||
| Rifater® | Rimcure® | Rimstar® | ||
| Peso (kg) | (R 120+H 50+Z 300) | Peso (kg) | (R 150+H 75+Z 400) | (R 150+H 75+Z 400+E 275) |
| Envase de 100 comprimidos | Envase de 100 comprimidos | Envase de 60 comprimidos | ||
| <40 | 3 | 30-50 | 3 | 3 |
| 40–50 | 4 | 50-70 | 4 | 4 |
| 50–70 | 5 | > 70 | 5 | 5 |
| >70 | 6 | |||
| Fase de continuación: 4 meses | ||||
| Rifinah® | Rimactazid® | Tisobrif® | ||
| Peso (kg) | (R 300+H 150) | (R 300+H 150)) | (R 600+H 300) | |
| Envase de 60 comprimidos | Envase de 60 comprimidos | Envase de 30 sobres | ||
| 40-90 | 2 | 2 | 1 | |
E: etambutol; H: isoniacida; R: rifampicina; Z: piracinamida.
Los tratamientos antituberculosos no deberían tener un coste muy elevado para que puedan utilizarse incluso en países con bajo poder adquisitivo. En España se debería ofrecer tratamiento gratuito a todos los pacientes.
Los esquemas de tratamiento que reúnen todos los requisitos favorables y que han sido recomendados universalmente son los de 6 meses de duración: 2 meses con R, H, Z y E, seguidos de 4 meses con R y H (2RHZE/4RH). Cuando se identifique que el aislamiento es sensible a estos fármacos se podrá retirar E. Excepcionalmente, en casos paucibacilares podría utilizarse tratamiento con tres fármacos (RHZ) en la fase inicial9,53–55.
Los niños suelen tener una buena tolerancia a los fármacos. Su tratamiento debe ser igual que en los adultos ajustando las dosis al peso. Tampoco debe modificarse la pauta durante el embarazo o la lactancia; no obstante, debe evitarse la utilización de aminoglucósidos, así como de protionamida.
Las pacientes que tomen anovulatorios deben ser advertidas de la inducción de estos fármacos por la R (tabla 10), recomendando preparados con dosis bajas de estrógenos o métodos alternativos de contracepción.
Aunque en España se utilizan con poca frecuencia, hay pautas intermitentes ampliamente contrastadas, en las que se administran los fármacos 2 o 3 veces por semana, adaptando adecuadamente las dosis53.
Se recomienda utilizar siempre los preparados farmacológicos en combinación fija. Actualmente se dispone de preparados con 4 fármacos (RHZE), 3 fármacos (RHZ) y 2 fármacos (RH) (tabla 8).
Tratamiento en situaciones especialesEntre las situaciones de características especiales que pueden modificar la pauta estándar de tratamiento se incluyen las siguientes:
- 1.
Pacientes con hepatopatía crónica: se debe intentar el tratamiento con un régimen estándar, realizando una vigilancia estrecha clínica y analítica de la función hepática. En casos de hepatopatía avanzada, se optará por la retirada de uno de los 3 fármacos con potencial hepatotóxico (H, R, Z), preferentemente Z, procurando mantener la R (tabla 6). Solo en casos de hepatitis aguda o fases terminales de hepatopatía crónica se optará por un tratamiento sin fármacos con potencial de toxicidad hepática y que incluya una quinolona, un inyectable (aminoglucosido o capreomicina) y E o cicloserina. La duración del tratamiento deberá ajustarse a la pauta utilizada.
- 2.
Insuficiencia renal crónica: no es necesario modificar el tratamiento estándar. Únicamente en pacientes con aclaramiento de creatinina menor de 30ml/min o en pacientes en programas de hemodiálisis se recomienda administrar el tratamiento 3 veces por semana (siempre después de la hemodiálisis) manteniendo las mismas dosis de la pauta diaria. En general debe considerarse la medición de los valores séricos de los fármacos.
Si es necesario introducir la S en el tratamiento, debe pautarse a 12–15mg/kg 2 o 3 veces por semana. La H, E y sobre todo la Z son fármacos que se dializan, por lo que en pacientes en tratamiento con hemodiálisis es recomendable la administración de los fármacos tras la finalización de esta.
- 3.
Formas extrapulmonares: las evidencias sobre la duración del tratamiento en algunas localizaciones extrapulmonares no son suficientemente claras y las recomendaciones de diversas guías no son unánimes. No obstante, se recomienda utilizar las mismas pautas que en la TB pulmonar y prolongar la duración del tratamiento en algunas situaciones, especialmente en la meningitis tuberculosa y en la espondilitis tuberculosa con afectación neurológica (tabla 6).
- 4.
También se recomienda alargar el tratamiento en la TB pulmonar que afecta a pacientes con silicosis.
- 5.
Dificultades para la administración oral por pérdida de conciencia: además de la estreptomicina, hay formulaciones parenterales de H, R y E de dosis equivalentes a las presentaciones orales. La administración a través de sonda nasogástrica o gastrostomía percutánea se ofrecen como otras alternativas.
- 6.
Administración de corticoides: se indicarán en las primeras semanas de tratamiento de las formas meníngeas (especialmente en los estadios 2 y 3 del BMC20) y en la pericarditis. Por su acción antiinflamatoria puede considerarse su uso ocasionalmente en otras localizaciones (pleural, ganglionar, estenosis urinarias y de trompas de Falopio, peritonitis, uveítis, formas miliares de mala evolución y formas muy extensas y diseminadas) La dosis aconsejada es de 0,5–1mg/kg/día de metilprednisolona durante 1 mes, con disminución progresiva hasta retirarla a los 2 meses.
- 7.
Administración de piridoxina: la H puede producir neuropatía periférica por déficit de esta sustancia en ciertas situaciones. Es recomendable la administración profiláctica de suplementos de piridoxina (10–50mg/día) en pacientes alcohólicos, desnutridos, embarazadas, diabéticos, insuficiencia renal y en pacientes con coinfección por el VIH.
Los pacientes que deben recibir tratamiento antirretroviral y antituberculoso de forma concomitante suponen una situación especial por las interacciones de la R y los fármacos antirretrovirales. La R es un potente inductor del citocromo P450 y acelera el metabolismo de muchos de los fármacos antirretrovirales, y disminuye significativamente los valores plasmáticos de los mismos (tabla 9). Por este motivo, la R no puede coadministrarse con los inhibidores de la proteasa (excepto ritonavir)56. Aunque la R interacciona con los inhibidores de la transcriptasa inversa no análogos de nucleósidos, los valores plasmáticos de estos fármacos pueden superar la concentración inhibitoria del 50% (IC50) frente al virus, a pesar de la reducción57–60. Existen datos favorables que apoyan el uso concomitante de R y nevirapina, pero la mayor experiencia se ha acumulado con el uso de efavirenz. De hecho, efavirenz, administrado a dosis habituales (600mg/día), constituye el fármaco de elección para tratar a paciente infectados por el VIH que también deben recibir R. No existe interacción entre R y los análogos de nucleósidos o los inhibidores de la fusión (enfuvirtida). Se ha estudiado la interacción farmacocinética con las nuevas familias de antirretrovirales (antagonistas de correceptores CCR5, inhibidores de la integrasa). Se ha recomendado, según estos estudios, que se podrían coadministrar con R doblando la dosis habitual tanto de maraviroc como raltegravir. No se dispone, sin embargo, de datos clínicos que apoyen esta recomendación.
Interacciones entre fármacos antirretrovirales y rifamicinas
| Antirretroviral | Uso con rifampicina | Uso con rifabutina | Comentarios |
| ITIN | Sí | Sí | |
| ITINN | |||
| Efavirenz | Sí (primera elección) | Sí | Dosis habitual de R y efavirenz, excepto 800mg en >60kg |
| Aumentar RB a 450–600mg/día | |||
| Nevirapina | Sí (alternativa a efavirenz) | Sí | Dosis habitual RBR ↓ 37% nevirapina. No de primera elección |
| Etravirina | No hay información | Sí | No ajuste de dosis con RB |
| Rilpivirina | Contraindicado | No hay datos | |
| IP | |||
| Atazanavir | Contraindicado | Sí | RB 150mg, 3 veces/semana |
| Darunavir | |||
| Fosamprenavir | |||
| Indinavir | |||
| Lopinavir | |||
| Nelfinavir | |||
| Ritonavir | Sí | Sí | Dosis habitual de R |
| Reducir RB a 150mg 3 veces/semana | |||
| Saquinavir | Contraindicado por toxicidad | Sí | RB 150mg 3 veces/semana |
| Tipranavir | Contraindicado | Sí | RB 150mg 3 veces/semana |
| Inh fusión | |||
| Enfuvirtida | Sí | Sí | |
| Inh integrasa | Contraindicado a dosis habituales | Sí | RB a dosis habitual diaria |
| Raltegravir | R disminuye valores de raltegravir. No hay estudios clínicos. Estudios farmacocinéticos en voluntarios sanos sugieren que se puede utilizar R aumentando dosis de raltegravir a 800mg/12h | ||
| Inh CCR5 | Contraindicado a dosis habituales | No hay estudios | R disminuye los niveles de Maraviroc. No hay estudios clínicos. Estudios farmacocinéticos en voluntarios sanos sugieren que se puede utilizar R aumentando dosis de Maraviroc a 600mg/12h |
| Maraviroc |
Inh CCR5: antagonistas de correceptores CCR5; Inh fusión: inhibidores de la fusión; Inh integrasa: inhibidores de la integrasa; IP: inhibidores de las proteasas; ITIN: inhibidores de la transcriptasa inversa análogos de nucleósidos; ITINN: inhibidores de la transcriptasa inversa no análogos de nucleósidos; RB: rifabutina; R: rifampicina.
Hoy se recomienda que el tratamiento de la TB en pacientes infectados por el VIH que deben recibir tratamiento antirretroviral se realice con el esquema estándar HRZE, siempre que se administre dos análogos de nucleósido en combinación con efavirenz, nevirapina o enfuvirtida (la administración a dosis plenas de ritonavir no es, en la actualidad, una opción práctica). En caso de no poder utilizarse estas combinaciones, puede sustituirse R por rifabutina, cuya interacción con los inhibidores de la proteasa es menor y puede coadministrarse con todos los inhibidores de la proteasa potenciados, con el correspondiente ajuste de dosis de rifabutina61.
Efectos adversos de la medicación8,53,54El efecto adverso más frecuente es la intolerancia digestiva inicial, que puede inducir al abandono o cumplimiento irregular si no se toman medidas para solucionarla. Generalmente es suficiente con repartir la medicación en varias tomas durante unos días. En otros casos se deberá añadir metoclopramida u omeprazol, convenientemente alejados unas horas de los antituberculosos para evitar interacciones, y manteniéndolos durante un período corto hasta conseguir la tolerancia. En casos más difíciles es preciso recurrir a la medicación por vía parenteral, R y H, junto con E o S. Estas medidas deben ser lo más breves posible, e introducir progresivamente la toma habitual hasta conseguir en pocas semanas que toda la medicación se tome conjuntamente, media hora antes del desayuno.
También son frecuentes las toxicidades hepática y cutánea. La toxicidad hepática puede estar causada por H, R o Z. Cuando se presenta colostasis el fármaco causante suele ser la R. En cambio, si hay citolisis los causantes pueden ser H y/o Z. La frecuencia y gravedad de la toxicidad aumentan en presencia de factores de riesgo hepático como son el abuso de alcohol y otras drogas, hepatopatías, consumo de fármacos hepatotóxicos y también con la edad, aunque las formas graves pueden aparecer en cualquier edad y momento del tratamiento.
La toxicidad leve se presenta sin clínica y con un aumento de las transaminasas inferior a 5 veces, o de 3 veces la fosfatasa alcalina. No está indicado suprimir la medicación, pero si aumentar la frecuencia de los controles clínicos y analíticos para detectar precozmente un empeoramiento. Los parámetros suelen normalizarse sin modificar el tratamiento (fig. 2).
En la toxicidad grave, que se acompaña de clínica de hepatitis, con o sin ictericia, y alteración importante de la analítica, después de descartar otras causas de hepatitis, debe retirarse toda la medicación durante una semana o sustituirla por fármacos no hepatotóxicos. Tras la mejora clínica y analítica, se reintroduce progresivamente una pauta con fármacos de primera línea, averiguando el fármaco causante y cambiándolo por otro no hepatotóxico.
Las reacciones cutáneas leves con las características de acné, exantema o urticaria son frecuentes, sobre todo durante el primer mes. Generalmente no precisan tratamiento o únicamente una cura tópica o con antihistamínicos y remiten a las pocas semanas. Raramente las reacciones de hipersensibilidad generalizadas requieren la retirada y sustitución temporal de los fármacos y la toma de corticoides.
Otra complicación es la aparición de fiebre persistente por los fármacos. Una vez excluidas otras causas, debe determinarse el fármaco causante y sustituirlo. En ocasiones puede ser necesario añadir temporalmente pautas descendentes de corticoides.
Menos frecuente es la polineuritis por H, sobre todo en los colectivos mencionados anteriormente.
Otros efectos secundarios menos frecuentes son plaquetopenia, hemólisis e insuficiencia renal aguda por R, artralgias o fotosensibilidad por Z y neuritis óptica por E.
En todos los cambios sucesivos de medicación que se precisen para superar los efectos iatrogénicos, debe seguirse estrictamente la norma de mantener al menos una pauta de 3 fármacos durante la fase inicial del tratamiento y de 2 fármacos en la fase de continuación, evitando la monoterapia que podría provocar una selección de mutantes resistentes. Es recomendable disponer de un antibiograma adecuado que oriente los fármacos a elegir. Cuando se reintroduce la R, debe hacerse progresivamente en 4 días, 150, 300, 450 y 600mg, para evitar hemólisis e insuficiencia renal aguda.
En los casos en que es preciso suspender o cambiar el tratamiento estándar conviene tener experiencia en el manejo de la enfermedad.
Interacciones medicamentosasLa R induce de manera muy potente distintos isoenzimas del citocromo P-450. Otros fármacos que se metabolicen por esta vía pueden ver su catabolismo acelerado, con lo que disminuyen sus niveles en sangre. La asociación de R con estos fármacos da lugar a interacciones que son clínicamente significativas. En la tabla 10 se muestran las interacciones de la R de mayor significación clínica. Por otra parte, la efectividad de la R puede verse disminuida por algunos azoles. La H inhibe algunos isoenzimas del sistema P-450 lo que en ocasiones puede dar lugar a interacciones medicamentosas significativas. Es recomendable monitorizar los niveles de fenitoína y carbamazepina si se toman conjuntamente con H.
Interacciones medicamentosas más significativas de la rifampicina (R)
| Fármaco | Manejo |
| Anticonceptivos orales | Medidas alternativas |
| Haloperidol | |
| Antiarrítmicos (quinidina, verapamil) | |
| Bloqueadores beta | |
| Corticoides | |
| Enalapril, losartán | Monitorización clínica |
| Benzodiacepinas y antidepresivos | Subir dosis si es preciso |
| Digoxina | |
| Antiepilépticos | Monitorizar niveles |
| Levotiroxina | Subir dosis si es preciso |
| Inmunosupresores (ciclosporina, tacrolimus) | Monitorizar niveles |
| Subir dosis si es preciso o sustituir R | |
| Hipolipemiantes | Monitorizar niveles de lípidos |
| Sulfonilureas | Subir dosis si es preciso o insulinoterapia |
| Azoles (ketoconazol, fluconazol) | Separar dosis |
| Subir dosis si es preciso y/o bajar dosis de R | |
| Anticoagulantes orales | Monitorizar INR¿ |
| Subir dosis o sustituir por heparina de bajo peso molecular | |
| Metadona | Subir dosis según necesidad |
Sus principales indicaciones son los pacientes con intolerancia o resistencia a uno o más de los fármacos. En el diseño de las pautas deben tenerse en cuenta los siguientes criterios generales basados en la experiencia: el régimen empleado debe constar de al menos 3–4 fármacos eficaces; si no se puede administrar H la duración del tratamiento debe ser de 12 meses, cuando se trate de R deberá alargarse hasta 18 meses y en el caso de Z hasta 9 meses; si no es posible pautar H y R, el tratamiento deberá prolongarse hasta 18–24 meses; en todos los casos la pauta de tratamiento no estándar debe cubrir un mínimo de 6 meses después de la negativización de los cultivos; antes de indicar una pauta debe disponerse de un antibiograma frente los fármacos de primera línea y los que hayan sido administrados al paciente en tratamientos previos. Por otra parte, debe tenerse en cuenta que los fármacos de segunda línea son, en general, escasos y menos eficaces, lo que puede plantear serios problemas de tratamiento en los pacientes con intolerancia grave o resistencia a más de un fármaco, sobre todo si están incluidos H y R. Las pautas propuestas se basan a menudo en la experiencia y en recomendaciones de expertos, ya que, por razones obvias, no se dispone de suficientes estudios aleatorizados que establezcan cuales son las más adecuadas. Las más utilizadas se exponen a continuación.
- •
Pacientes con resistencia o toxicidad por H: se debe sustituir este fármaco por E y prolongar el tratamiento hasta un total de 12 meses (segunda fase de 10RE).
- •
Pacientes con resistencia o toxicidad por R: la resistencia aislada a R es una situación infrecuente que requiere una mayor duración del tratamiento para que este sea eficaz. En general, se debe sustituir la R por E y mantener el tratamiento durante 18 meses (segunda fase de 16HE)62.
- •
Pacientes con resistencia o toxicidad por Z: La pauta de tratamiento de 9 meses de duración (2HRE+7HR) fue utilizada ampliamente antes de la introducción de la Z. Con ella se logra una eficacia similar a la pauta estándar de 6 meses.
- •
Pacientes con TB multirresistente (MDR-TB): en la medida de lo posible, el tratamiento farmacológico debe ser individualizado, guiado por antibiograma y teniendo en cuenta el historial farmacológico del paciente. Es recomendable la utilización de un agente inyectable durante los primeros 6 meses e incluir una fluoroquinolona durante todo el tiempo de tratamiento. Si la cepa es sensible al E, también debe mantenerse a lo largo de todo el tratamiento. El régimen empleado debe constar de al menos 4 fármacos eficaces. Su duración debe prolongarse hasta cumplir 18 meses de cultivos consecutivamente negativos63.
En la tabla 11 se exponen los principales fármacos de segunda línea eficaces frente a M. tuberculosis. Existen otros fármacos que han mostrado cierta eficacia en el tratamiento de la TB y que se han empleado cuando no hay otras alternativas, como son: clofazimina, amoxicilina-clavulánico, tiacetazona y, sobre todo, linezolid.
Fármacos de segunda línea en el tratamiento de la tuberculosis
| Categoría | Fármaco | Dosis en adultos |
| Inyectables | Amicacina | |
| Capreomicina¿ | 15mg/kg/día | |
| Kanamicina | ||
| Fluoroquinolonas | Moxifloxacino¿ | 400mg/24h |
| Levofloxacino | 500mg/12h | |
| Ofloxacino | 400mg/12h | |
| Otros | Cicloserina | 15–20mg/kg/día (en 2–3 dosis) |
| PAS | 10–15mg/kg/día (en 2 dosis) | |
| Protionamida¿ | 8–12g/día (en 2–3 dosis) | |
PAS: ácido para-amino-salicílico.
El tratamiento de la TB es largo, incluye varios fármacos potencialmente tóxicos y para que sea eficaz, debe hacerse de forma regular y sin interrupciones. Por estos motivos el control debe ser estricto puesto que pueden aparecer numerosas incidencias que deben ser evaluadas y tratadas por equipos expertos.
Los objetivos más importantes que se plantean una vez instaurado un tratamiento correcto son: asegurar el cumplimiento, evaluar la eficacia curativa, y detectar y manejar correctamente la intolerancia, las interacciones y los efectos secundarios de los fármacos.
Nunca debe indicarse un tratamiento sin organizar un sistema de controles periódicos por un médico experto o por un centro especializado en el abordaje de la TB. En muchos enfermos sería suficiente un sistema de controles a los 15 días, al mes y a los 2, 4 y 6 meses con información adecuada, y medidas incentivadoras de un correcto cumplimiento y controles clínicos, analíticos, radiológicos y microbiológicos cuando se considere necesario.
En pacientes de especial riesgo de abandono precoz de la medicación (indigentes, presos, toxicómanos, etc.) y en todos los casos en que se sospeche la posibilidad de incumplimiento, es preciso aplicar un sistema de tratamiento directamente observado (TDO), propugnado como clave en el abordaje de la TB en los países en desarrollo por las organizaciones internacionales y nacionales de control de la enfermedad. El TDO consistente en la toma de la medicación observada por un sanitario o parasanitario, puede llevarse a cabo en el hospital durante el ingreso del paciente, en un centro sanitario al que acuda diariamente el enfermo o en su domicilio o lugar de trabajo donde es visitado diariamente por el sanitario. Debe recomendarse su uso cuando el incumplimiento es previsible o cuando el fracaso puede representar un grave impacto para la comunidad. En enfermos contagiosos que rechacen el tratamiento, debería procederse al TDO obligatorio en un centro cerrado, ordenado por la autoridad sanitaria y ratificado por el juez, si es preciso, teniendo en cuenta las responsabilidades y los riesgos sanitarios y sociales de estos casos excepcionales.
Es importante recoger en la historia clínica el resultado final del tratamiento de acuerdo con las categorías establecidas internacionalmente53,55.
Recomendaciones respecto al tratamiento de la TB
- 1.
En todos los casos nuevos de TB, en los que no exista contraindicación para alguno de los fármacos, la pauta administrada es la que incluye HREZ durante 2 meses y HR durante cuatro meses más (AI). Ésta es la pauta actualmente recomendada en España (BIII).
- 2.
El esquema terapéutico recomendado es el mismo durante el embarazo (BII), la lactancia (BII), en los niños (AII), en la hepatopatía e insuficiencia renal crónicas no severas (BIII) y en las formas extrapulmonares, con la excepción de los casos de meningitis (AII), en que se alargará la segunda fase hasta 12 meses, y de la TB raquídea con afectación neurológica (AII) y en la silicosis (BIII), hasta cumplir un total de 9 meses.
- 3.
Se recomienda la administración del tratamiento utilizando formulaciones combinadas que impidan la monoterapia y en dosis única (AIII).
- 4.
Se recomienda la administración de corticoesteroides en la meningitis (AI) y en la pericarditis (AI). También pueden administrarse en otras localizaciones con componente inflamatorio importante (CIII).
- 5.
Se recomienda que en pacientes infectados por el VIH que deben recibir tratamiento antirretroviral, se realice el tratamiento de la TB con el esquema estándar HREZ, siempre que se administren 2 análogos de nucleósido en combinación con efavirenz, nevirapina o enfuvirtida (BIII). En caso de no poder utilizarse estas combinaciones, puede sustituirse R por rifabutina, que debidamente ajustada, puede coadministrarse con todos los inhibidores de la proteasa.
- 6.
La toxicidad hepática es uno de los efectos adversos más importantes del tratamiento estándar, ya que este incluye 3 fármacos hepatotóxicos (H, R, Z). Cuando se observa alteraciones de las transaminasas por encima de 5 veces su valor normal y/o de la fosfatasa alcalina por encima de 3 veces, debe suspenderse el tratamiento durante una semana substituyéndolo por fármacos no hepatotóxicos y reintroduciéndolos posteriormente de forma progresiva (BIII).
- 7.
Antes de instaurar el tratamiento se debe realizar una anamnesis completa de los fármacos que recibe el paciente y evaluar sus interacciones con el tratamiento (AIII).
- 8.
Las principales indicaciones de las pautas no estándar son la resistencia y la intolerancia a uno o más de los fármacos de elección. Deben instaurarse y supervisarse por expertos, siguiendo los siguientes preceptos básicos: el régimen empleado debe constar de al menos 3–4 fármacos eficaces, debe cubrir un mínimo de 6 meses después de la negativización de los cultivos, debe disponerse de un antibiograma frente los fármacos de primera línea y los que hayan sido administrados al paciente en tratamientos previos (AIII).
- 9.
El control del tratamiento es una de las actividades más importantes en el abordaje de la TB. Sus objetivos son asegurar el cumplimento y evaluar la eficacia del tratamiento, así como la aparición de efectos no deseados. Debe realizarse de forma estricta y por personas experimentadas. En pacientes de especial riesgo de abandono precoz de la medicación y en todos los casos en que se sospeche la posibilidad de incumplimiento, es preciso aplicar un sistema de tratamiento directamente observado (TDO) (AI).
El tratamiento de la infección tuberculosa (TIT) se iniciará una vez descartada la enfermedad. Si por la situación clínica se han indicado cultivos es necesario esperar hasta que sean considerados negativos. El estudio de la posible infección debe hacerse con vistas a la posibilidad de iniciar tratamiento en los casos en que mejor se ha demostrado su efectividad7: a) infección reciente (contactos infectados y personas que presentan una conversión de la PT); b) infección por el VIH; c) lesiones residuales en la radiografía de tórax y sin tratamiento previo, y d) pacientes infectados que han de iniciar tratamiento con fármacos anti-TNFα o candidatos a trasplante.
En el caso de contactos íntimos y frecuentes con PT negativa, la prueba debe repetirse a las 8–12 semanas indicando TIT si hay conversión de la PT. La quimioprofilaxis primaria (tratamiento de personas no infectadas) se indicará en contactos niños y adolescentes y en personas con infección por el VIH e inmunodeprimidos por ser las más susceptibles a desarrollar TB grave y rápidamente progresiva. Debe repetirse la PT a las 8–12 semanas8,18 continuando el tratamiento si se positiviza y retirándolo si sigue siendo negativa, a no ser que exista una causa de resultado falso negativo de la tuberculina (VIH, inmunodepresión intensa).
El TIT más estudiado y con eficacia demostrada es con H7. Su efectividad es mayor si se utiliza 6 meses o más. Aumentaría la eficacia prolongar el tratamiento más de 6 meses (hasta 9 o 12 meses) si bien no está claramente demostrado en la práctica clínica64. Tampoco está definida cuál es la mejor duración del TIT con H en la coinfección con el VIH65, aunque la recomendación habitual es prolongarlo de 6–9 meses. Una alternativa a la H es la R, especialmente cuando hay resistencia a H, siendo utilizada durante 4 meses. Por último, existe la posibilidad de utilizar R y H durante 3 meses, con una eficacia similar a la pauta de H y un mejor cumplimiento66,67.
En contactos de TB multirresistente no existe ningún esquema recomendado y demostrado efectivo, por lo que es recomendable mantener una vigilancia con visitas periódicas.
Respecto a los controles a realizar durante el TIT, se debe vigilar al paciente clínicamente hasta su finalización, observando la aparición de efectos secundarios de la medicación. Los controles analíticos no son absolutamente necesarios, aunque nuestra recomendación es realizarlos antes del inicio del tratamiento y al mes, valorando repetirlos al finalizarlo y siempre que haya síntomas. Debe extremarse la vigilancia de la aparición de síntomas en pacientes con riesgo de presentar efectos secundarios (hepatopatía, etilismo, infección por el VIH, 3 meses posparto)9.
Recomendaciones respecto al tratamiento de la infección
- 1.
El tratamiento de la infección tuberculosa (TIT) se iniciará una vez descartada la enfermedad y en los casos en que mejor se ha demostrado su efectividad (infección reciente, infección por el VIH, lesiones radiológicas residuales no tratadas, pacientes que han de iniciar tratamiento con fármacos anti-TNFα o candidatos a trasplante) (AIII).
- 2.
La quimioprofilaxis primaria se indicará en niños principalmente menores de cinco años, en adolescentes y en personas con infección por el VIH e inmunodeprimidos (AIII).
- 3.
El TIT más estudiado y con eficacia demostrada es con H. Se considera pauta estándar el tratamiento de 6 meses (AI). Prolongar el tratamiento hasta 9 o 12 meses aumentaría la eficacia, si bien no está claramente demostrado en la práctica clínica.
- 4.
En los niños, en infectados por el VIH y en personas con lesiones radiológicas residuales de TB, se recomienda prolongar el tratamiento de 6–9 meses (AII).
- 5.
Cuando no pueda utilizarse H debe utilizarse la R como alternativa, administrada durante 4 meses (BII).
- 6.
En contactos de TB multirresistente no se dispone de ninguna pauta recomendada y demostrada que sea efectiva, y se cree preferible la vigilancia (CIII).
El carácter de enfermedad fundamentalmente respiratoria hace que, en el momento actual, la principal medida que permite cortar la cadena epidemiológica de la enfermedad es el diagnóstico temprano de los pacientes con TB pulmonar o laríngea y el aislamiento de los mismos hasta que dejen de ser contagiosos. En este último sentido cobra especial importancia el seguimiento de las medidas de aislamiento respiratorio recomendadas. Estas medidas se basan fundamentalmente en la permanencia de los pacientes en habitaciones individuales de aislamiento, tanto en el hospital como en el domicilio, y el empleo de sistemas de protección individual (mascarillas, respiradores de seguridad biológica) que eviten la llegada de las micobacterias en suspensión procedentes de las secreciones respiratorias del paciente, al aparato respiratorio de las personas expuestas68.
Si el paciente precisa ingreso hospitalario, está ampliamente reconocida la importancia de la habitación individual. Ésta deberá tener, de forma ideal, una antecámara que permita establecer un sistema de esclusas que evite la salida de las micobacterias procedentes de las secreciones respiratorias al exterior de la misma. Las puertas de la misma deberán estar permanentemente cerradas, En condiciones ideales, se recomienda que estas habitaciones tengan presión negativa, con una frecuencia de intercambio de aire de 6 volúmenes/h como mínimo. El aire extraído deberá ser filtrado a través de filtros HEPA antes de ser eliminado al exterior. En caso de que esta medida no pueda ser llevada a cabo, se procurará que la habitación dé a un área soleada y que esté bien ventilada. El régimen de visitas deberá ser restringido al mínimo, y se les explicará la necesidad de mantener las normas de aislamiento lo más estrictamente posible.
El empleo de sistemas de filtro para el aire respirado es una medida, asimismo, fundamental en el aislamiento respiratorio de estos pacientes. Las guías de diversos organismos recomiendan el empleo por parte del personal y visitas de respiradores de seguridad biológica N95, con una capacidad de filtrado superior al 95%. Estos sistemas han demostrado su eficacia para evitar el acceso de partículas de 5–10μ3 al tracto respiratorio inferior. Solo en caso de ausencia de estos dispositivos se emplearán mascarillas quirúrgicas. En el caso del paciente ingresado, cuando este deba salir de la habitación de aislamiento, deberá llevar puesta una mascarilla quirúrgica mientras se encuentre fuera de la habitación. En ese sentido, es especialmente importante explicar al paciente las características de su enfermedad y las razones de su aislamiento, con el objetivo de que colabore al máximo posible en dichas medidas68.
El resto de medidas de aislamiento respiratorio recomendadas (empleo de bata, precauciones universales) serán también de aplicación obligatoria, si bien su importancia es menor que las anteriormente descritas. De especial importancia es la consideración como material infeccioso de las secreciones respiratorias. Esta consideración se extenderá al material contaminado por estas, puesto que existe la posibilidad de contagio de la enfermedad mediante contacto con material contaminado.
Estas medidas se aplicarán a todo paciente que ingrese en un hospital con sospecha de TB mientras no se descarte dicho diagnóstico, en particular a los pacientes bacilíferos. Muy recientemente9 se ha recomendado que el aislamiento se mantenga como mínimo durante 3 semanas, ampliándose si es necesario hasta tener 3 esputos con baciloscopia negativa obtenidos en días distintos, siempre que exista además respuesta clínica al tratamiento. El mismo periodo mínimo de aislamiento se aplicará si la expectoración ha desaparecido o si las baciloscopias iniciales fueron negativas. De todas formas, ya que no hay TB cuándo deja de ser contagioso un paciente con TB, parece prudente huir de plazos fijos para levantar el aislamiento, siendo la situación ideal la de no compartir habitación durante su estancia hospitalaria. En cualquier caso, si el paciente está estable y existe una mejoría clínica, la necesidad de aislamiento no impide el alta de dichos pacientes si esta es posible68.
Medidas de prevención en sanitarios y contactosEl personal sanitario que trabaje en un centro donde se atiendan pacientes tuberculosos presenta un riesgo de contagio entre 2–10 veces mayor que el de la población general, dependiendo de las series69. Cabe destacar que no todas las unidades del hospital presentan el mismo riesgo, siendo este mucho mayor en las unidades de urgencias y laboratorios (en particular, anatomía patológica y microbiología), y menor en otras unidades69,70. Con el objetivo de minimizar dicho riesgo se deberá entrenar al personal en las medidas de aislamiento respiratorio anteriormente descritas. Dicho entrenamiento deberá repetirse periódicamente para asegurar el conocimiento de dichas medidas por parte de todo el personal.
Por otra parte, con el objetivo de controlar el contagio y establecer medidas de tratamiento de la infección tuberculosa latente, el personal sanitario deberá estudiarse periódicamente mediante la PT. Esta periodicidad deberá ser anual en todos los casos, plazo que podrá acortarse en aquellos miembros del personal que se encuentren particularmente expuestos al contagio (áreas de urgencias, endoscopia respiratoria, salas de enfermedades infecciosas y laboratorios de microbiología y anatomía patológica). Este estudio se repetirá mientras que el resultado de la prueba sea negativo. En caso de conversión, el personal afectado será estudiado para descartar una enfermedad activa y se tratará con el protocolo adecuado en función de su estado (enfermedad o infección)70,71.
Cuando se diagnostique un caso de TB se deberá llevar a cabo el estudio de los contactos del mismo para determinar la existencia de casos de infección como consecuencia del contagio a partir del caso índice18. En este sentido, es de especial relevancia el caso de la TB infantil, puesto que la mayoría de las veces el foco de infección suele encontrarse entre los convivientes cercanos. El estudio de contactos se realizará en el momento actual mediante la PT y la radiografía de tórax. Ésta deberá realizarse de forma sistemática a los contactos más cercanos del paciente (esto es, a los que convivan con este un mínimo de 6h diarias), pudiendo ampliarse este estudio a otras personas en función de la existencia de contactos especiales (colectivos de riesgo especial, etc.) o si el número de conversiones detectadas entre los convivientes cercanos supera el porcentaje previsto18. En el caso de que la PT inicial fuese negativa, esta se repetirá a las 8–12 semanas para detectar contagios que no hubiesen convertido aún dicha prueba en el primer estudio. En cualquier caso, los contactos tuberculina-negativos de un paciente con TB que vayan a seguir viéndolo durante su estancia hospitalaria deberán seguir las mismas normas de aislamiento respiratorio que el personal sanitario, con especial énfasis en la restricción del número de visitas al mínimo posible.
VacunaciónLa única vacuna disponible hoy en día frente a la TB es la vacuna BCG. Esta vacuna es eficaz en la prevención de la TB meníngea y diseminada en población pediátrica, pero su utilidad frente a los casos de TB pulmonar es discutible, aproximadamente de un 50%72. Uno de los inconvenientes asociado a esta vacuna es la conversión de la PT en un porcentaje variable de la población vacunada. Aunque dicha positividad se va perdiendo con el tiempo en la mayoría de los casos, puede dar lugar a falsas conversiones en estudios de contactos posteriores. Debido a este hecho, y a que en poblaciones con baja incidencia de TB la principal estrategia de prevención se basa en la detección temprana de contagios a partir de pacientes con enfermedad, no se recomienda en el momento actual la vacunación sistemática de la población pediátrica en España.
Recomendaciones respecto a medidas de prevención y aislamiento
- 1.
En pacientes con TB pulmonar se aplicarán las normas de aislamiento respiratorio durante un mínimo de tres semanas. En los casos bacilíferos podrá ampliarse este periodo hasta obtener tres muestras de expectoración de días distintos con baciloscopia negativa (AIII).
- 2.
Deberá estudiarse al personal sanitario mediante la PT al menos una vez al año mientras que el resultado sea negativo (BIII).
- 3.
Deberán estudiarse, mediante la PT, los contactos de los pacientes tuberculosos de acuerdo con el principio de los círculos concéntricos (BIII).
- 4.
En el momento actual, no se recomienda la vacunación masiva de la población pediátrica mediante la vacuna BCG (AII).
Los autores declaran no tener ningún conflicto de intereses.
Documento publicado simultáneamente en Enfermedades infecciosas y microbiología. Enferm Infecc Microbiol Clin. 2010;28(5):297.e1–297.e20.
Documento de consenso conjunto de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR).