El diagnóstico y tratamiento de los trasudados pleurales ha sido poco estudiado, sobre todo si se compara con el de los exudados, especialmente los malignos, en que diversos ensayos clínicos informan con relativa frecuencia sobre cuál es el manejo óptimo de estos pacientes en la práctica clínica.
La etiología de los trasudados pleurales es amplia, heterogénea, a veces corresponde a enfermedades raras y, en ocasiones, constituye un auténtico reto diagnóstico. El análisis del líquido pleural puede ser una herramienta básica para poder establecer el diagnóstico. El tratamiento debe dirigirse no solamente a la enfermedad subyacente, sino también al propio derrame pleural.
En los casos refractarios al tratamiento médico, habrá que recurrir a procedimientos invasivos como la toracocentesis terapéutica, la pleurodesis con talco, o la inserción de un catéter pleural tunelizado. Sin embargo, en la actualidad, hay muy poca evidencia al respecto y no existen recomendaciones firmes que establezcan en qué situaciones hay que utilizar alguna de estas técnicas invasivas y cuál sería la más eficaz y con menos efectos secundarios para cada una de las enfermedades responsables.
El propósito de este artículo es describir el espectro de enfermedades que causan un trasudado pleural, revisar la aportación diagnóstica del análisis del líquido pleural y poner de manifiesto la escasa evidencia que existe sobre la eficacia de los procedimientos invasivos en el manejo y control del derrame pleural en estos pacientes.
Various clinical trials have been published on the optimal clinical management of patients with pleural exudates, particularly those caused by malignant tumors, while little information is available on the diagnosis and treatment of pleural transudates.
The etiology of pleural transudates is wide and heterogeneous, and they can be caused by rare diseases, sometimes constituting a diagnostic challenge. Analysis of the pleural fluid can be a useful procedure for establishing diagnosis. Treatment should target not only the underlying disease, but also management of the pleural effusion itself.
In cases refractory to medical treatment, invasive procedures will be necessary, for example therapeutic thoracentesis, pleurodesis with talc, or insertion of an indwelling pleural catheter. Little evidence is currently available and no firm recommendations have been made to establish when to perform an invasive procedure, or to determine the safest, most efficient approach in each case.
This article aims to describe the spectrum of diseases that cause pleural transudate, to review the diagnostic contribution of pleural fluid analysis, and to highlight the lack of evidence on the efficacy of invasive procedures in the management and control of pleural effusion in these patients.
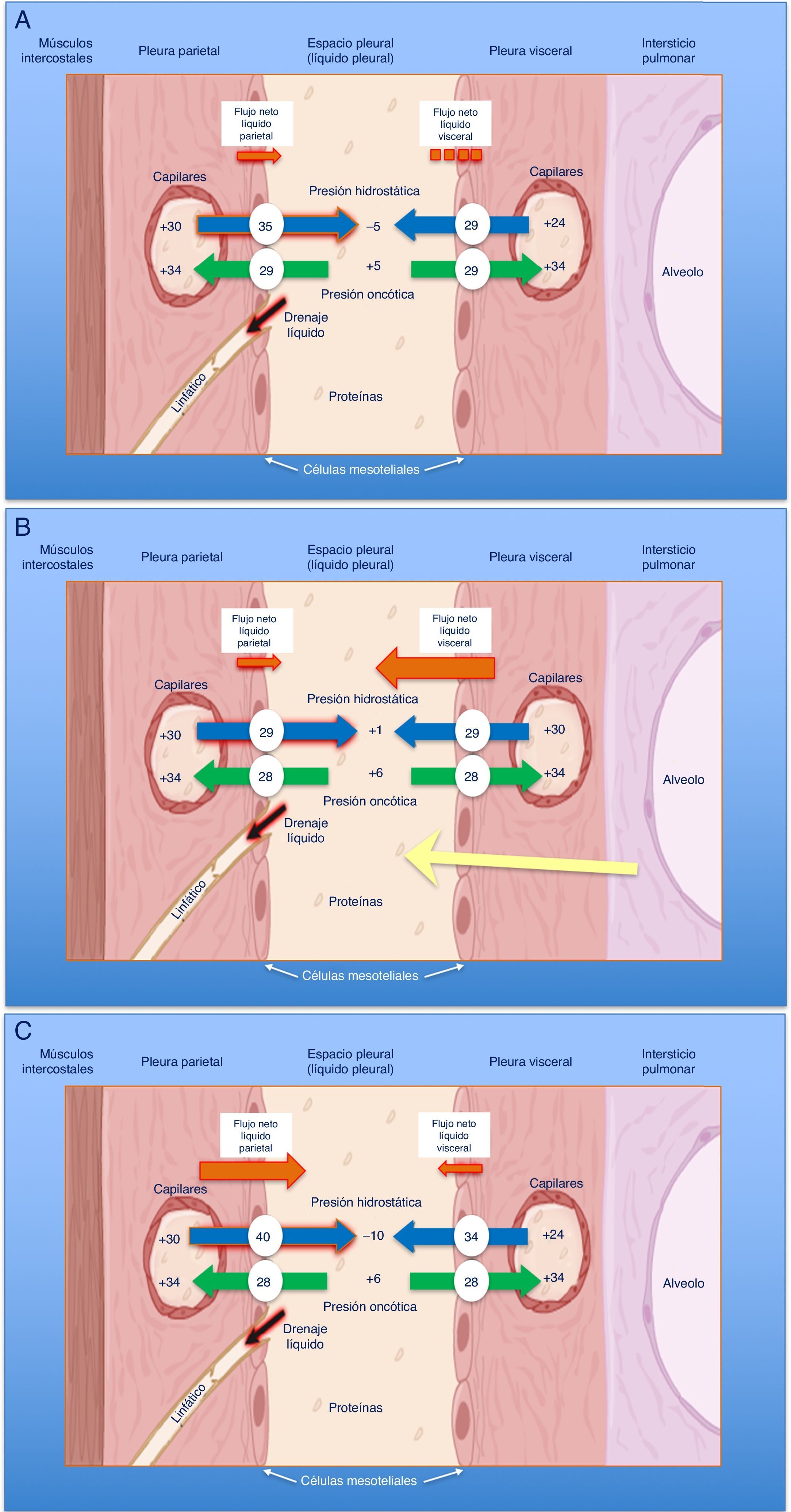
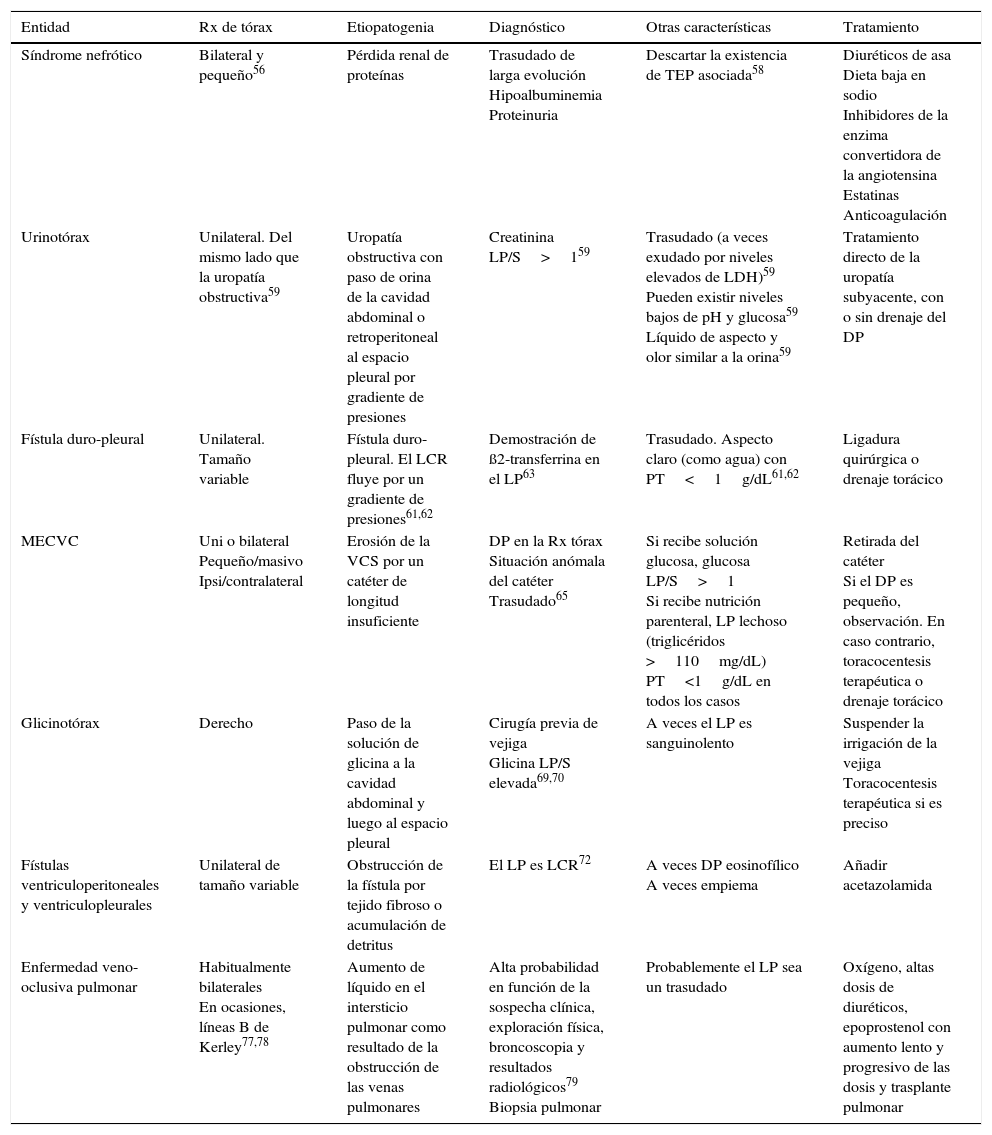
En condiciones normales, el espacio pleural contiene una pequeña cantidad de líquido que separa ambas hojas pleurales cuya función es permitir el deslizamiento de una membrana sobre la otra. Este líquido entra en el espacio pleural a través de los vasos sistémicos, debido a la diferencia de presiones hidrostáticas y oncóticas entre los capilares de ambas hojas pleurales y el espacio pleural, y se absorbe por los linfáticos, situados en las partes más declives de la pleura parietal, de forma similar a lo que sucede en otros espacios intersticiales del organismo1 (fig. 1A). El volumen y las características del líquido pleural (LP) están determinados por una combinación de fenómenos dinámicos que afectan a la circulación sistémica y pulmonar, al drenaje linfático y a los movimientos de la caja torácica y el corazón2. La producción de LP normal es de aproximadamente 0,01mL×kg×h, por lo que una persona de 60kg tendría una entrada de 15mL/día3. Por otra parte, los linfáticos pleurales pueden absorber 0,28mL×kg×h, casi 30 veces más que la tasa de entrada4.
Esquemas de movimiento del líquido en el espacio pleural en condiciones normales (A), en la insuficiencia cardiaca (B) y en el pulmón atrapado (C).
En un pulmón y pleura normales (A), el balance de presiones hidrostáticas y oncóticas favorece la formación de líquido pleural. Los gradientes de presiones muestran que existe un flujo neto de líquido desde la pleura parietal y que se mantiene en equilibrio en la pleura visceral (presiones en cm de H2O).
En la insuficiencia cardiaca (B), se produce un aumento del líquido en el intersticio pulmonar debido al aumento de las presiones capilares pulmonares. El líquido que entra en el espacio pleural excede la capacidad de los linfáticos pleurales para drenarlo.
En el pulmón atrapado (C), un proceso inflamatorio previo ha dado lugar a una pleura visceral gruesa y fibrosa. La incapacidad pulmonar para expandirse conduce a una presión pleural hidrostática negativa y esta alteración de las fuerzas de Starling lleva a la formación de un líquido pleural trasudativo. El derrame pleural puede estar al límite del exudado, dependiendo de cuán reciente sea la inflamación activa previa.
Cualquier alteración en este equilibrio de presiones hidrostáticas y oncóticas, tanto del espacio pleural como de los capilares sanguíneos, puede dar lugar a que se acumule líquido en el espacio pleural. En este caso, podemos afirmar que el líquido es un trasudado y que la pleura no está enferma. Por lo tanto, esto tiene unas implicaciones diagnósticas, pronósticas y terapéuticas totalmente distintas a si el derrame pleural (DP) es un exudado.
Desde un punto de vista clínico, la diferenciación entre un trasudado y un exudado se lleva a cabo mediante la determinación de diversos parámetros bioquímicos en el LP y la sangre. Los más utilizados son los clásicos criterios de Light: cociente de proteínas totales LP/suero (LP/S)>0,5; lactato deshidrogenasa (LDH) LP/S>0,6 y LDH en LP>2/3 del valor superior normal en sangre5. El LP será un trasudado si no se cumple ninguna de las condiciones anteriores. También se han utilizado otros parámetros para esta diferenciación, como el colesterol, si bien ninguno ha demostrado superioridad sobre los otros6.
Las causas potenciales de un trasudado son numerosas; algunas muy frecuentes, pero otras poco comunes y, en algunos casos, mal conocidas. Tampoco existen recomendaciones firmes acerca del diagnóstico y manejo de estos derrames. Debido a que en muchos de estos pacientes el DP es la manifestación de una enfermedad de otro órgano y que suelen existir comorbilidades, es habitual que el peso de su manejo recaiga en otros especialistas con los que será necesario establecer alianzas para protocolizar un tratamiento coordinado y optimizado del DP. El propósito de este artículo es describir el espectro de las enfermedades que causan un trasudado pleural, revisar la aportación del análisis del LP a su diagnóstico y actualizar las estrategias de manejo.
Trasudados pleuralesInsuficiencia cardiacaEl 87% de los pacientes hospitalizados por insuficiencia cardiaca (IC) descompensada que requieren tratamiento diurético presentan DP en la tomografía computarizada (TC)7. La IC es la causa más frecuente de trasudado8,9 y, en algunas series, de todos los DP, con una prevalencia que puede llegar al 45%10. El edema pulmonar que se produce en estos pacientes causa un aumento de la presión hidrostática en los capilares de la pleura visceral que origina que el líquido fluya hacia el espacio pleural (fig. 1B).
El DP cardiaco suele comportarse como un trasudado de predominio linfocítico. Sin embargo, como los criterios de Light están diseñados para el diagnóstico de exudados, un 25% de los casos pueden clasificarse erróneamente como exudados, sobre todo si los pacientes están tomando diuréticos11,12. Si estos fármacos corrigen la hipertensión venosa, el LP no solamente drena a través de los linfáticos, sino que puede reabsorberse por los capilares pleurales, lo que incrementaría las concentraciones de proteínas y LDH en el LP lo suficiente como para que se cumplieran las características bioquímicas de un exudado. En estos casos, un gradiente (resta) de albúmina suero-LP >1,2g/dL parece indicar que el DP corresponde a un trasudado, independientemente de si cumple los criterios tradicionales de Light13. No obstante, otros factores como la presencia de una segunda causa de DP14 o un número elevado de hematíes (>10.000células/mm3), a través de la influencia que tienen sobre los niveles de LDH15, pueden hacer que un trasudado se convierta bioquímicamente en exudado.
En este contexto, la determinación de los péptidos natriuréticos en LP o en sangre, moléculas secretadas por los ventrículos cardiacos en respuesta a su distensión aguda, puede ser de utilidad para el diagnóstico de un DP por IC. En un metaanálisis reciente, la rentabilidad diagnóstica del fragmento amino-terminal del propéptido natriurético cerebral (NT-proBNP) del LP fue: sensibilidad del 94%, especificidad del 91%, razón de verosimilitud positiva de 10,9, razón de verosimilitud negativa de 0,07 y odds ratio de 157, con resultados ligeramente inferiores cuando la determinación se hacía en sangre16.
El diagnóstico de DP cardiaco suele establecerse por una clínica compatible y la presencia de cardiomegalia y DP bilateral en la radiografía de tórax, lo que suele ocurrir en el 80% de los casos. En estas condiciones no es necesario hacer una toracocentesis17. Sin embargo, en determinadas circunstancias, el diagnóstico es difícil de establecer. A ello puede contribuir la presencia de una sintomatología clínica (dolor torácico, fiebre) y unos hallazgos radiológicos inhabituales (ausencia de cardiomegalia, o una acentuada asimetría en el tamaño del DP) que justificarían una toracocentesis diagnóstica y la medición de los péptidos natriuréticos. Rabin y Blackman, en una serie de 78 pacientes con un DP bilateral sin cardiomegalia, hallaron que solamente 3 (3,8%) tenían un DP secundario a IC18. El DP unilateral, sin embargo, no descarta una IC. En una revisión de 6 series que incluyeron 783 pacientes con DP por IC, 125 (16%) tenían un DP derecho y 55 (7%), izquierdo19.
Un estudio prospectivo de 60 pacientes con DP secundario a IC demostró que en el 89% de los casos el DP desaparecía tras 2 semanas de tratamiento con diuréticos7. En general, la mayor parte de los enfermos mejorarán con un tratamiento optimizado de la IC que incluirá diuréticos de asa, inhibidores de la enzima convertidora de la angiotensina, β-bloqueantes, o bien procedimientos como la colocación de marcapasos o cirugía si el paciente presenta una disfunción valvular grave.
La pleurodesis con talco es una técnica segura y efectiva en el tratamiento de los DP malignos. Sin embargo, la evidencia que apoye su uso en los DP benignos se limita a unos pocos casos en los que incluso no se llegó a especificar la etiología del DP20-22(tabla 1). Tampoco existe evidencia suficiente para apoyar el uso del catéter pleural tunelizado (CPT) ni existen estudios de coste-efectividad. En un estudio de 5 hospitales británicos, a 9 pacientes con IC se les colocó un CPT y se consiguió una pleurodesis espontánea en 4 (44%)23. En otra serie, se insertaron 43 CPT a 36 pacientes con IC y DP refractario. En el grupo tratado con talco poudrage mediante toracoscopia seguido de la inserción de un CPT, se consiguió una pleurodesis en el 80% de los casos, mientras que en aquellos pacientes que recibieron solo un CPT la pleurodesis se alcanzó en el 25%24. Un metaanálisis reciente evaluó la utilidad de los CPT en pacientes con DP benigno refractario. De los 162 (49,8%) con DP por IC, se consiguió pleurodesis en el 42,1% (rango 0-92,3%) (tabla 1), con una tasa de complicaciones similar a la de los DP malignos. La conclusión de los autores fue que el CPT es una opción eficaz y viable en el manejo de los pacientes con DP benigno refractario25. No obstante, se necesita poner en marcha ensayos clínicos aleatorizados que determinen con mayor precisión la utilidad de estos catéteres.
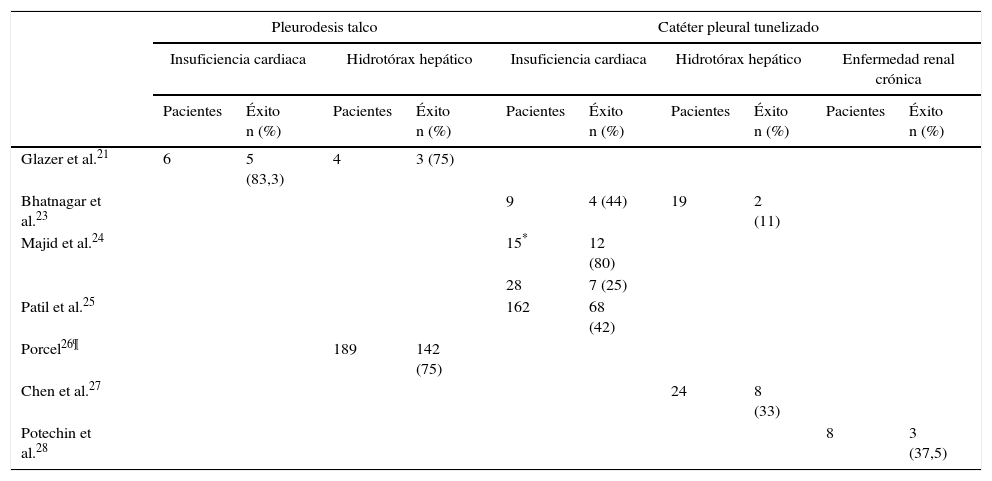
Series de pacientes con distintos tipos de trasudados pleurales, que recibieron tratamiento con pleurodesis con talco o catéter pleural tunelizado
| Pleurodesis talco | Catéter pleural tunelizado | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Insuficiencia cardiaca | Hidrotórax hepático | Insuficiencia cardiaca | Hidrotórax hepático | Enfermedad renal crónica | ||||||
| Pacientes | Éxito n (%) | Pacientes | Éxito n (%) | Pacientes | Éxito n (%) | Pacientes | Éxito n (%) | Pacientes | Éxito n (%) | |
| Glazer et al.21 | 6 | 5 (83,3) | 4 | 3 (75) | ||||||
| Bhatnagar et al.23 | 9 | 4 (44) | 19 | 2 (11) | ||||||
| Majid et al.24 | 15* | 12 (80) | ||||||||
| 28 | 7 (25) | |||||||||
| Patil et al.25 | 162 | 68 (42) | ||||||||
| Porcel26¶ | 189 | 142 (75) | ||||||||
| Chen et al.27 | 24 | 8 (33) | ||||||||
| Potechin et al.28 | 8 | 3 (37,5) | ||||||||
El pulmón atrapado es la secuela de una inflamación del espacio pleural que deriva en la formación de una membrana fibrosa sobre la pleura visceral que impide la expansión pulmonar29, lo que genera un aumento de la presión negativa en el espacio pleural. La diferencia de presiones hidrostáticas entre los capilares sistémicos de la pleura parietal y el espacio pleural será muy elevada, lo que provocará un aumento del flujo neto de líquido hacia este para tratar de disminuirla (fig. 1C).
EL LP cumple generalmente criterios de trasudado29, ya que el DP se genera por la diferencia de presiones hidrostáticas existentes. Sin embargo, las características del LP dependerán del momento en que se lleve a cabo la toracocentesis. Si esta se realiza en una fase temprana, cuando la enfermedad está todavía activa, se podrán encontrar DP con un nivel proteico en el rango de los exudados y, menos frecuentemente, también de LDH30.
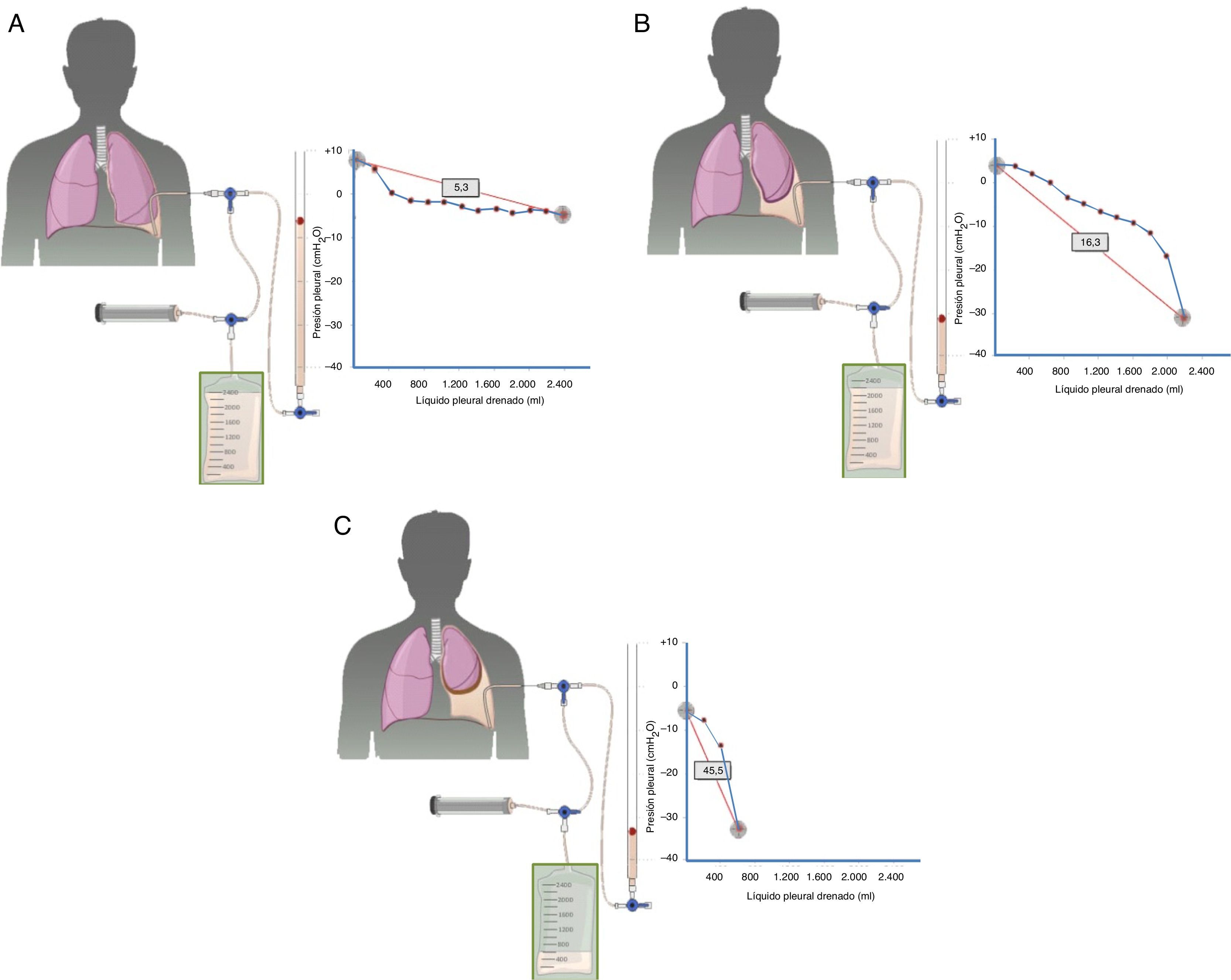
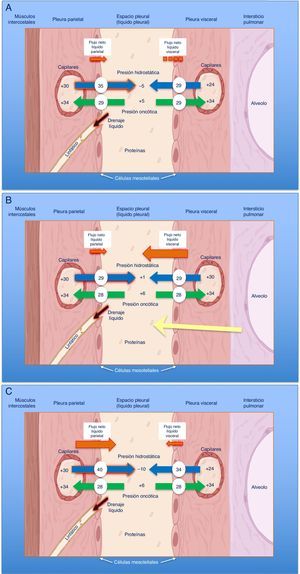
El diagnóstico se basa en 4 hallazgos: 1) hidroneumotórax postoracocentesis o un DP que no se puede drenar por aparición de dolor torácico; 2) LP trasudativo; 3) presión pleural inicial negativa que desciende aún más a medida que se aspira LP, de tal forma que la elastancia pleural será >14,5cmH2O/L (fig. 2A-C), y 4) una TC de tórax con «contraste de aire» (esto es, tras la inducción de un neumotórax iatrogénico durante una manometría pleural) que demuestre un engrosamiento de la pleura visceral29.
Curvas obtenidas por manometría, con su valor de elastancia, en un pulmón normal (A), en un pulmón en proceso de atrapamiento (B) y en un pulmón atrapado (C).
En un derrame pleural con un pulmón normal (A) la presión pleural inicial será ligeramente positiva. A medida que se aspira líquido, la presión pleural descenderá lentamente y el pulmón se irá expandiendo progresivamente. Una vez retirado todo el derrame, el pulmón contactará con la pared torácica y la elastancia obtenida será normal. En el pulmón en proceso de atrapamiento (B) la pleura visceral tendrá un ligero engrosamiento y la presión pleural inicial será, como en el pulmón normal, ligeramente positiva. Al retirar líquido, en un principio, el pulmón se expandirá progresivamente y la presión pleural descenderá lentamente. Llegado un punto el pulmón queda atrapado, no se puede expandir más y la presión caerá rápidamente dando lugar a una elastancia elevada, con una curva presión/volumen bimodal. En el pulmón atrapado la pleura visceral tiene una capa de fibrina más gruesa que impide que el pulmón se expanda, por lo que la presión inicial será negativa (C). La retirada de líquido, por un lado, y la rigidez del pulmón, por otro, provocarán un rápido descenso de la presión pleural y dará lugar a una elastancia elevada.
El pulmón atrapado no suele requerir ningún tratamiento si el paciente está asintomático o paucisintomático. No deben realizarse toracocentesis evacuadoras repetidas, ya que rápidamente se va acumular una cantidad de LP similar a la existente previamente, en un intento de «normalizar» la presión pleural negativa. En los casos en que la disnea sea incapacitante, el CPT sería una opción ya que además de evacuar el líquido, en algunos casos se podría conseguir una pleurodesis. Sin embargo, no existe todavía suficiente evidencia al respecto fuera de su uso en los DP malignos. Como última alternativa, si se excluye que la disnea se debe a otra causa, se podría plantear una decorticación pleural.
Hidrotórax hepáticoSe define como el DP de un paciente con cirrosis hepática e hipertensión portal, sin enfermedad cardiaca, pulmonar o pleural asociadas31. Su prevalencia oscila entre el 5-10% de los pacientes con cirrosis26 y el 80% presentan concomitantemente ascitis26. Dos factores influyen en que el líquido se acumule en el espacio pleural: en primer lugar, un gradiente de presiones entre el espacio peritoneal y el pleural (debido a la presión negativa de este) que favorece el paso unidireccional del líquido ascítico al tórax; y, en segundo lugar, los defectos diafragmáticos que con frecuencia se observan en la porción tendinosa del diafragma derecho. Esto último, más el efecto «pistón» del hígado, hace que la mayoría de estos DP se localicen en el lado derecho (80%)32-37. En pacientes sin ascitis, el mecanismo de formación del LP es el mismo38. En general, la presencia de un hidrotórax hepático se asocia a un mal pronóstico, con una supervivencia al cabo de un año del 43%39.
El DP suele ser un trasudado40 con un pH relativamente alto41, pero en un 18% de los casos puede tener características bioquímicas de exudado42. Se recomienda hacer siempre una toracocentesis y analizar el LP para excluir una enfermedad cardiaca, pulmonar o pleural asociadas y también para detectar la principal complicación del hidrotórax hepático que es el empiema bacteriano espontáneo (infección bacteriana de un hidrotórax previo en el que se ha excluido una neumonía), presente en el 13% de los pacientes con cirrosis y DP. De acuerdo con los estudios existentes, su sospecha no se puede establecer a partir del análisis del líquido ascítico, sino que debe analizarse el LP32. En ocasiones, el LP de los pacientes con cirrosis hepática puede ser un quilotórax43. Esto podría deberse a que estos pacientes presentan una presión capilar hepática elevada, con un aumento proporcional del flujo linfático en el hígado y en el conducto torácico44, lo que podría dar lugar a la formación de ascitis quilosa.
El tratamiento más frecuente incluye la restricción de sodio, los diuréticos y las toracocentesis terapéuticas. En caso de ascitis o hidrotórax refractarios, el tratamiento definitivo es el trasplante hepático45. Si está contraindicado, una alternativa es implantar un shunt portosistémico intrahepático transyugular46 y, como última opción, puede recurrirse a la reparación quirúrgica del diafragma47. La pleurodesis con talco parece tener un riesgo elevado, con una mortalidad periprocedimiento del 45%41. En una revisión de 11 series que incluyó 189 pacientes con hidrotórax hepático refractario tratados con una pleurodesis toracoscópica, mayoritariamente mediante insuflación de talco, se consiguió una sínfisis pleural en 142 pacientes26. En una revisión de la práctica clínica de hospitales británicos, el CPT se utilizó en 19 pacientes con hidrotórax hepático. La pleurodesis espontánea solamente se consiguió en 2 (11%) y además hubo diversas complicaciones23. Por último, en un estudio reciente, Chen et al. obtuvieron una pleurodesis espontánea en 8 (33%) de 24 pacientes tratados con un CPT. El tiempo medio hasta su consecución fue de 132 días; tras la retirada del catéter, el DP no recidivó en ningún caso y solamente 4 pacientes (16,7%) tuvieron un efecto adverso (infección del LP)27 (tabla 1).
Diálisis peritonealLa incidencia de DP entre los pacientes que reciben diálisis peritoneal es del 1,6% y puede desarrollarse entre un día y 8 años después de su inicio48. El tamaño del DP puede llegar a ser tal que obligue a suspender la diálisis. La presión intraabdominal ligeramente positiva que existe en condiciones normales aumenta linealmente en proporción al volumen de la solución de diálisis que se instila49. La presión y el volumen intraabdominales pueden incrementar la tensión de la pared abdominal y, por tanto, de las estructuras de soporte del abdomen, lo que conduce a que la solución de diálisis escape de la cavidad peritoneal, posiblemente a través de defectos diafragmáticos hacia el espacio pleural. El DP suele ser pequeño y del lado derecho, aunque en ocasiones es bilateral. Se han descrito DP masivos en mujeres, siempre del lado derecho50.
En los DP debidos a diálisis peritoneal, el LP es un trasudado con unos niveles de glucosa muy elevados (rango 200-2.000mg/dL)51. El diagnóstico se establece precisamente por la presencia de un trasudado con valores muy bajos de proteínas (<1g/dL) y un cociente de glucosa LP/S>2.
En un estudio retrospectivo de 257 pacientes que recibían hemodiálisis por insuficiencia renal, 52 (20%) desarrollaron DP52. En 9 de los 14 pacientes (64,3%) a los que se les hizo una toracocentesis, el LP fue un trasudado. En 6 de estos 9 enfermos (66,7%), la causa del DP se relacionó con una hipervolemia y en 2 (22,2%), con IC. En el conjunto de los trasudados, el DP fue predominantemente (85,7%) bilateral.
El tratamiento recomendado para los DP debidos a diálisis peritoneal consiste en medidas conservadoras como el cambio temporal a hemodiálisis o el intercambio de volúmenes menores. Recientemente, Potechin et al. insertaron un CPT a 8 pacientes con un DP asociado a enfermedad renal en estadio final y en 3 se obtuvo una pleurodesis espontánea (37,5%), sin complicaciones mayores28 (tabla 1).
Derrames pleurales metastásicosHasta un 10% de los DP malignos pueden comportarse bioquímicamente como trasudados53. Varios mecanismos pueden estar implicados: 1) en una fase inicial el LP se acumula por una obstrucción del drenaje linfático más que por una infiltración tumoral de la pleura. Como el LP fisiológico es un ultrafiltrado con niveles bajos de proteínas, en estas circunstancias se necesitarían varias semanas para que la concentración de proteínas acumuladas fuera mayor del 50% de la concentración sérica54; 2) el trasudado pleural se produce por otra enfermedad concomitante, ya que un tumor que afecta a la pleura no tiene que producir necesariamente DP. En ocasiones, esta segunda enfermedad se ha podido demostrar55; 3) tanto la neoplasia como la otra enfermedad capaz de producir un trasudado pleural contribuyen al desarrollo del DP.
La dificultad radica en saber cuándo, ante un trasudado pleural, debemos solicitar una citología del LP para descartar malignidad. En un estudio reciente se sugiere que si el DP es izquierdo, se observan nódulos/masas pulmonares, atelectasia pulmonar o adenopatías mediastínicas en la radiografía o TC de tórax, el paciente no tiene disnea, el LP es de aspecto serosanguinolento o el antígeno carcinoembrionario del LP está elevado, estaría indicado solicitar una citología para descartar un DP maligno53.
Otras causasExisten otras enfermedades menos frecuentes que pueden producir trasudados, como el síndrome nefrótico9,56-58 (pérdida excesiva de proteínas por el glomérulo), el urinotórax59,60 (acumulación de orina en el espacio pleural como consecuencia de un traumatismo u obstrucción del tracto urinario), la fístula duro-pleural61-64 (el líquido cefalorraquídeo pasa al espacio pleural como consecuencia de un traumatismo penetrante durante una laminectomía), la migración extravascular de un catéter venoso central65-68 (catéteres de insuficiente longitud colocados habitualmente en la vena subclavia izquierda erosionan o perforan la vena cava superior proximalmente al receso de la ácigos), el glicinotórax69,70 (perforación de la pared de la vejiga urinaria durante una prostatectomía transuretral con la administración posterior de una solución de glicina para irrigar la vejiga), las fístulas ventriculoperitoneales y ventriculopleurales71-76 (complicación de una fístula ventriculoperitoneal por la que el líquido cefalorraquídeo pasa al espacio pleural) y la enfermedad veno-oclusiva pulmonar77-79 (obstrucción de las venas y vénulas pulmonares por fibrosis de la íntima). En la tabla 2 se describen los mecanismos etiopatogénicos por los que se producen estos DP, las características radiológicas, sus peculiaridades y el tratamiento de cada uno de ellos.
Características de los trasudados pleurales de causas inhabituales
| Entidad | Rx de tórax | Etiopatogenia | Diagnóstico | Otras características | Tratamiento |
|---|---|---|---|---|---|
| Síndrome nefrótico | Bilateral y pequeño56 | Pérdida renal de proteínas | Trasudado de larga evolución Hipoalbuminemia Proteinuria | Descartar la existencia de TEP asociada58 | Diuréticos de asa Dieta baja en sodio Inhibidores de la enzima convertidora de la angiotensina Estatinas Anticoagulación |
| Urinotórax | Unilateral. Del mismo lado que la uropatía obstructiva59 | Uropatía obstructiva con paso de orina de la cavidad abdominal o retroperitoneal al espacio pleural por gradiente de presiones | Creatinina LP/S>159 | Trasudado (a veces exudado por niveles elevados de LDH)59 Pueden existir niveles bajos de pH y glucosa59 Líquido de aspecto y olor similar a la orina59 | Tratamiento directo de la uropatía subyacente, con o sin drenaje del DP |
| Fístula duro-pleural | Unilateral. Tamaño variable | Fístula duro-pleural. El LCR fluye por un gradiente de presiones61,62 | Demostración de ß2-transferrina en el LP63 | Trasudado. Aspecto claro (como agua) con PT<1g/dL61,62 | Ligadura quirúrgica o drenaje torácico |
| MECVC | Uni o bilateral Pequeño/masivo Ipsi/contralateral | Erosión de la VCS por un catéter de longitud insuficiente | DP en la Rx tórax Situación anómala del catéter Trasudado65 | Si recibe solución glucosa, glucosa LP/S>1 Si recibe nutrición parenteral, LP lechoso (triglicéridos >110mg/dL) PT<1g/dL en todos los casos | Retirada del catéter Si el DP es pequeño, observación. En caso contrario, toracocentesis terapéutica o drenaje torácico |
| Glicinotórax | Derecho | Paso de la solución de glicina a la cavidad abdominal y luego al espacio pleural | Cirugía previa de vejiga Glicina LP/S elevada69,70 | A veces el LP es sanguinolento | Suspender la irrigación de la vejiga Toracocentesis terapéutica si es preciso |
| Fístulas ventriculoperitoneales y ventriculopleurales | Unilateral de tamaño variable | Obstrucción de la fístula por tejido fibroso o acumulación de detritus | El LP es LCR72 | A veces DP eosinofílico A veces empiema | Añadir acetazolamida |
| Enfermedad veno-oclusiva pulmonar | Habitualmente bilaterales En ocasiones, líneas B de Kerley77,78 | Aumento de líquido en el intersticio pulmonar como resultado de la obstrucción de las venas pulmonares | Alta probabilidad en función de la sospecha clínica, exploración física, broncoscopia y resultados radiológicos79 Biopsia pulmonar | Probablemente el LP sea un trasudado | Oxígeno, altas dosis de diuréticos, epoprostenol con aumento lento y progresivo de las dosis y trasplante pulmonar |
DP: derrame pleural; LCR: líquido cefalorraquídeo; LDH: lactato deshidrogenasa; LP: líquido pleural; LP/S: cociente líquido pleural/suero; MECVC: migración extravascular de un catéter venoso central; PT: proteínas totales; Rx: radiografía; TEP: tromboembolia pulmonar; VCS: vena cava superior.
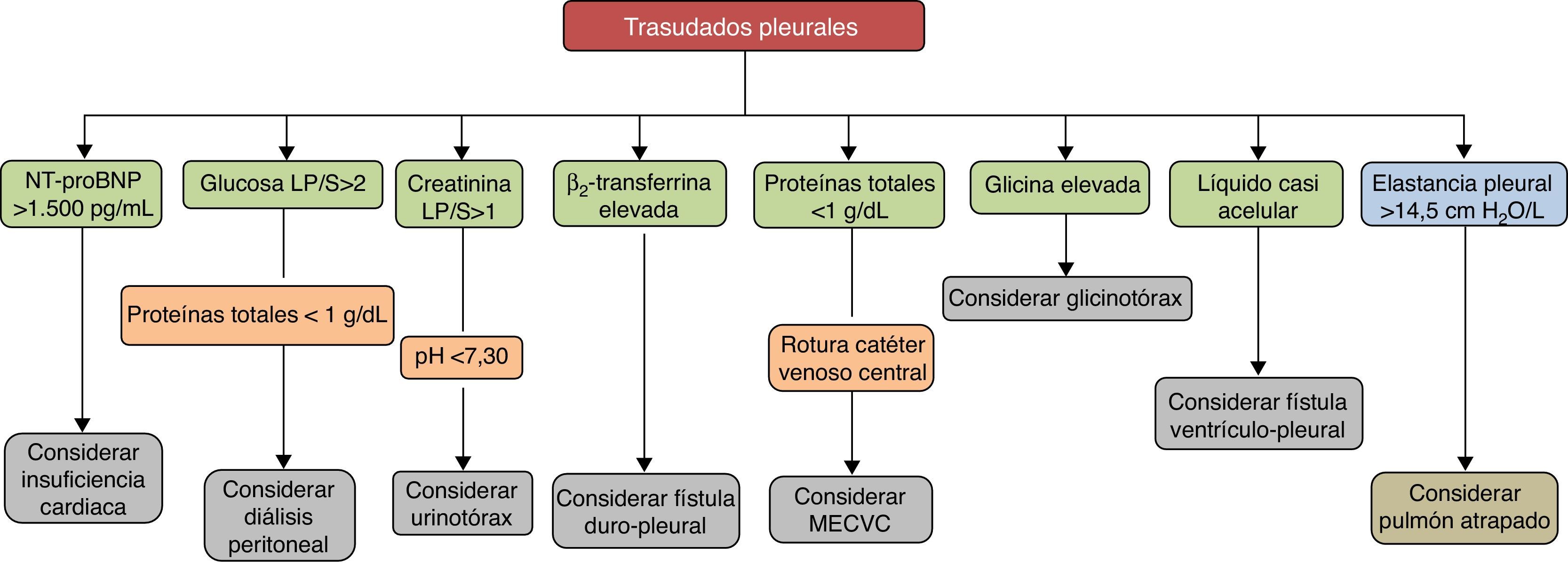
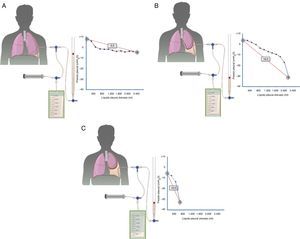
Los trasudados pleurales se deben a un grupo heterogéneo de enfermedades. Su espectro abarca desde la IC hasta entidades muy poco frecuentes. El diagnóstico se establecerá mediante los datos clínicos y el análisis del LP que puede contribuir al mismo de forma decisiva (fig. 3). Aunque el tratamiento médico suele estar bien establecido para cada enfermedad responsable, al menos en las más frecuentes, existen casos refractarios en los que se abre un abanico de posibilidades con la introducción de nuevos procedimientos intervencionistas, aún no suficientemente validados, que hacen que el manejo sea más complejo. Es necesario poner en marcha estudios y ensayos clínicos que aporten datos de calidad y más evidencia para tratar de optimizar el tratamiento de estos pacientes.
AutoríaLucía Ferreiro. Autora y redactora. Concepción y diseño. Aprobación final del manuscrito.
José Manuel Porcel. Coautor. Revisión y aprobación final del manuscrito.
Luis Valdés. Autor y redactor. Concepción y diseño. Aprobación final del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Fernando Vázquez Vázquez por el diseño de las figuras.