Puntos clave:
- •
La EPOC es una enfermedad respiratoria crónica, compleja y heterogénea.
- •
El principal factor etiológico es el tabaco.
- •
La identificación de fenotipos clínicos permite un tratamiento más personalizado.
La EPOC se define como una enfermedad respiratoria caracterizada por síntomas persistentes y limitación crónica al flujo aéreo, causada principalmente por el tabaco.
La limitación al flujo aéreo se suele manifestar en forma de disnea y, por lo general, es progresiva. La EPOC suele presentarse con otros síntomas respiratorios como la tos crónica acompañada o no de expectoración. La EPOC se caracteriza también por la presencia de agudizaciones y por la frecuente presencia de comorbilidades que pueden contribuir a la gravedad en algunos pacientes.
La espirometría no puede considerarse diagnóstica por sí sola, sino que debe utilizarse como prueba de confirmación ante la sospecha diagnóstica en un paciente que presenta síntomas respiratorios crónicos y es o ha sido fumador. En casos menos frecuentes podemos obtener una historia de exposición a otros agentes tóxicos inhalados en el hogar o en el lugar de trabajo.
Etiología de la EPOCConsumo de tabacoDesde la década de 1950 se conoce que el tabaco es el factor de riesgo más importante en el desarrollo de EPOC1,2. Su relación causal se ha establecido a través de numerosos estudios prospectivos de cohortes, entre ellos el del British Medical Research Council3 y del Framingham Heart Study Offspring4.
En estudios de cohortes prospectivos se estima que el riesgo absoluto de desarrollar EPOC entre fumadores es 9 o 10 veces superior que entre no fumadores5,6. Aun así, solo el 50% de fumadores desarrollarán a lo largo de su vida una EPOC diagnosticada mediante espirometría. Además, se ha demostrado que el riesgo es proporcional al consumo acumulado de tabaco, de tal forma que el riesgo pasa del 26% en los fumadores de 15-30 paquetes al año, al 51% en los fumadores de más de 30 paquetes al año7.
El consumo de tabaco está muy extendido tanto en los países industrializados como en los países en vías de desarrollo. En España, según los datos del Informe Anual del Sistema Nacional de Salud de 20158, el 24,0% de la población mayor de 15 años fuma; el 3,1% lo hace ocasionalmente y el 19,6% se declara exfumador (ha dejado de fumar hace al menos un año). Por sexo, el porcentaje de fumadores diarios fue del 27,9% en varones y del 20,2% en mujeres. La prevalencia de fumadores entre los jóvenes de 15 a 24 años es de 21,7%, sin observar diferencias entre varones (22,5%) y mujeres (21%). En el grupo de edad entre 25 y 54 años, la población de varones fumadores supera el 30% y la de mujeres oscila entre el 28 y el 30%. En cuanto al consumo de los fumadores diarios, el 28, 7% consume entre 1 y 9 cigarrillos/día, el 35,8% fuma entre 10 y 19 y el 35,5% consume más de 20 cigarrillos al día.
Tabaquismo pasivoUna proporción de casos de EPOC ocurre en personas que no han fumado nunca. Entre estas personas no fumadoras9, el tabaquismo pasivo es un factor de riesgo que se ha implicado en la patogenia de la EPOC. El tabaquismo pasivo, también llamado humo ambiental de tabaco, es la inhalación involuntaria del humo de otra persona que fuma tabaco. Aunque se produzcan riesgos de salud inferiores a los del tabaquismo activo, obviamente, estos no solo son evitables, sino involuntarios.
Diversos estudios observacionales han demostrado que el tabaquismo pasivo se asocia a un mayor riesgo de EPOC10–13. El estudio más definitivo que relaciona tabaquismo pasivo con EPOC se ha realizado en Guanzhou, China12. Se trata de un estudio en más de 6.000 participantes no fumadores. La mayoría (un 89,6%) eran mujeres y la media de edad fue de 61 años12. Más de la mitad de los participantes afirmó ser fumador pasivo, y la duración del tabaquismo pasivo resultó directamente relacionada con el riesgo de EPOC12.
Un estudio hecho en España que evaluó la repercusión que tiene la exposición pasiva al tabaco sobre la función pulmonar de niños y adolescentes14 concluyó que los parámetros espirométricos son significativamente inferiores entre los niños con algún progenitor fumador y es mayor el efecto negativo del tabaquismo pasivo sobre los parámetros relacionados con la vía aérea distal.
Según datos del Informe Anual del Sistema Nacional de Salud de 20158, la exposición al humo de tabaco se redujo drásticamente en el trabajo (2,6%), en los lugares y transportes públicos cerrados (2,4%) y la más frecuente (17,8%) fue la exposición en el hogar. Un dato destacable encontrado en el segundo estudio nacional de tabaquismo pasivo en España (coordinado y desarrollado desde SEPAR) es el elevado porcentaje de niños menores de 13 años expuestos al humo ambiental de tabaco en el hogar, que llegó hasta el 39,2%15.
Quema de combustible biomasaA nivel mundial, aproximadamente el 50% de todas las casas y el 90% de las casas rurales usan el combustible de biomasa (madera, carbón vegetal, otras materias vegetales y el estiércol) como su fuente principal de energía doméstica9.
En diversas revisiones sistemáticas se ha identificado la biomasa y otros combustibles para uso en calefacción o en cocina en países en vías de desarrollo como factor de riesgo de EPOC en áreas rurales9,16–19. Un ejemplo de estos resultados es la revisión sistemática que analiza 15 estudios epidemiológicos (11 transversales y 4 casos y controles), y estima en las personas expuestas a la biomasa un riesgo de desarrollar EPOC más elevado que en los no expuestos (odds ratio = 2,44; intervalo de confianza del 95%, 1,90-3,33), tanto en varones como en mujeres, en pacientes con EPOC, fumadores y no fumadores17.
En España se ha documentado un riesgo aumentado de ingreso por EPOC en mujeres que habían estado expuestas de forma significativa en su infancia y juventud al humo de leña o de carbón. Este riesgo fue independiente del tabaquismo20. En un estudio reciente en Galicia, hasta un 24% de los pacientes con EPOC tenían como factor etiológico la exposición a humo de biomasa21. Los antecedentes de exposición a humo de leña o carbón deben interrogarse, en particular en personas con obstrucción crónica al flujo aéreo, no fumadoras o con escasa exposición al tabaco.
Factores de riesgo para el desarrollo de la EPOCContaminación atmosféricaLas revisiones recientes concluyen que los factores de riesgo para el desarrollo de EPOC son cada vez mejor identificados, e incluyen también muchas otras exposiciones ambientales, como la exposición ocupacional o ambiental al polvo y humos, tanto en países desarrollados como en vías de desarrollo9,22. Los contaminantes específicos estudiados en relación con la EPOC son el ozono, las partículas en suspensión (PM), el monóxido de carbono (CO), el dióxido de sulfuro (SO2), el dióxido de nitrógeno (NO2) y otros gases9. La alta contaminación atmosférica, sobre todo asociada al tráfico rodado, es un factor desencadenante de exacerbaciones de la EPOC en individuos susceptibles23.
Existen controversias respecto a la contaminación atmosférica como causa directa de EPOC9 y se considera que es cuantitativamente mínima. Un estudio reciente relaciona la exposición a largo plazo a niveles bajos de contaminación atmosférica y el aumento de riesgo de desarrollar EPOC grave; esta asociación se mantuvo significativa al tener en cuenta otros factores, como el tabaquismo23.
Hay varios indicadores multicomponente de la calidad del aire que respiramos, que combinan según pesos variables las partículas PM con los diferentes gases y actualmente se puede realizar una monitorización continua a tiempo real y en muchos casos a pequeña escala geográfica24, lo que permite alertar a individuos EPOC susceptibles, al igual que ocurre con los mapas de dispersión polínica en el asma y la rinitis.
Exposición ocupacionalDiversos estudios de cohortes de trabajadores han identificado que la exposición ocupacional a diversos polvos, gases y humos tóxicos se asocia a un mayor riesgo de EPOC, incluso después de tener en cuenta los factores confusores como el tabaco9,25. Aquellos individuos con EPOC que están expuestos en su lugar de trabajo a polvos minerales o de todo tipo, gases o humos presentan una mayor gravedad de su EPOC comparados con los que no tienen una exposición profesional significativa26. Estos hallazgos justifican la investigación de la exposición profesional en todos los pacientes y adoptar medidas preventivas en el lugar de trabajo siempre que sea posible.
Tuberculosis pulmonarLa tuberculosis pulmonar se asocia a EPOC. En un estudio realizado en China en 8.784 personas mayores de 50 años, los pacientes con radiografías de tórax que evidenciaban haber tenido una tuberculosis pulmonar presentaron un incremento de la obstrucción al flujo aéreo, independientemente de ser fumador, estar expuesto a biomasa o tener antecedentes de asma27. En el estudio epidemiológico de EPOC en América Latina (PLATINO), el antecedente de tuberculosis se asociaba con un riesgo entre 2 y 4 veces mayor de desarrollar una EPOC, de forma independiente a otros factores de riesgo, en particular el tabaquismo28.
Factores genéticosEl enfisema hereditario debido a la deficiencia de alfa-1-antitripsina es el principal ejemplo de un factor genético. El déficit congénito de alfa-1-antitripsina predispone a una destrucción y pérdida acelerada de parénquima pulmonar y al desarrollo de enfisema. Es una enfermedad autosómica de expresión recesiva que causa EPOC y cirrosis hepática29–31. Se estima que es responsable del 1% de los casos de EPOC y del 2-4% de los enfisemas. En importante el diagnóstico precoz por tener un tratamiento específico con la infusión intravenosa de alfa-1-antitripsina procedente de plasma de donantes en los casos que cumplan los estrictos criterios de tratamiento establecidos por las normativas nacionales e internacionales32. Todo paciente con EPOC debe tener al menos una determinación de sus concentraciones plasmáticas de alfa-1-antitripsina para descartar esta deficiencia33.
Otros factoresOtros factores de riesgo que se han descrito son la edad, el sexo, el envejecimiento pulmonar, las infecciones respiratorias repetidas del niño o el adulto en edades tempranas y los factores socioeconómicos34. La mayoría de estos factores asociados con el desarrollo de EPOC no pueden ser modificados.
En general, la prevalencia de EPOC aumenta con la edad y es más frecuente en los varones, aunque este hecho parece estar más relacionado con el efecto acumulativo de otros factores de riesgo a los que se ha expuesto el individuo a lo largo de la vida que con la edad o el sexo34. Sin embargo, nuevos estudios con espirometría realizados en África han obtenido resultados paradójicos, como una mayor prevalencia de limitación al flujo aéreo en jóvenes que en ancianos, y también en mujeres adultas, en relación con la exposición acumulada al humo de biomasa para cocinar y calentar chozas mal ventiladas en áreas rurales35,36. El papel de los antecedentes familiares es una mezcla de factores genéticos y ambientales.
En las clases sociales más desfavorecidas hay un mayor número de factores que se asocian al desarrollo de la enfermedad: mayor consumo de alcohol y tabaco, peores condiciones de las viviendas, infecciones frecuentes en la infancia y menos recursos sanitarios34.
Fenotipos clínicos de la EPOCLa EPOC es una enfermedad muy heterogénea y por ello no es posible describirla utilizando solo el volumen espiratorio forzado durante el primer segundo (FEV1). La denominación de fenotipo se utiliza para referirse a formas clínicas de los pacientes con EPOC37. Un grupo de expertos internacional ha definido el fenotipo clínico de la EPOC como “aquellos atributos de la enfermedad que, solos o combinados, describen las diferencias entre individuos con EPOC en relación con parámetros que tienen significado clínico (síntomas, agudizaciones, respuesta al tratamiento, velocidad de progresión de la enfermedad o muerte)”37. Por tanto, el fenotipo debería ser capaz de clasificar a los pacientes en subgrupos con valor pronóstico que permitan determinar la terapia más adecuada para lograr mejores resultados clínicos37,38.
Los estudios existentes sobre fenotipificación de la EPOC han identificado diversos fenotipos clínicos39. La guía GesEPOC propone cuatro fenotipos que determinan un tratamiento diferenciado:
- 1.
No agudizador, con enfisema o bronquitis crónica.
- 2.
EPOC-asma (ACO del inglés asthma-COPD overlap).
- 3.
Agudizador con enfisema.
- 4.
Agudizador con bronquitis crónica.
Se han propuesto otros posibles fenotipos como el declinador rápido40, las bronquiectasias41,42 o el sistémico43, pero su trascendencia a la hora de dirigir el tratamiento no está establecida, u otros que por su escasa prevalencia (déficit de alfa-1-antitripsina)32 no se consideran de forma específica en esta guía.
La importancia de establecer estos fenotipos es que el tratamiento se dirigirá según las características propias de cada paciente, en lo que constituye un enfoque personalizado del tratamiento farmacológico y de rehabilitación38,44. Las denominaciones de ACO, enfisema y bronquitis crónica se basan en las manifestaciones clínicas predominantes y el cumplimiento de los criterios diagnósticos. Cualquiera de estos tres tipos de pacientes puede ser un agudizador, de manera que estas características se combinan para formar los cuatro fenotipos clínicos con tratamiento diferenciado: ACO, fenotipo agudizador con bronquitis crónica, fenotipo agudizador con enfisema y fenotipo no agudizador45.
Definición de fenotipo agudizadorSe define como fenotipo agudizador a todo paciente con EPOC que presente en el año previo dos o más agudizaciones moderadas, definidas como aquellas que precisan al menos tratamiento ambulatorio con corticosteroides sistémicos y/o antibióticos, o una grave, que precise ingreso hospitalario46. Estas exacerbaciones deben estar separadas al menos 4 semanas desde la finalización del tratamiento de la agudización previa o 6 semanas desde el inicio de la misma en los casos en que no hayan recibido tratamiento, para diferenciar el nuevo evento de un fracaso terapéutico o una recaída47.
La identificación del fenotipo agudizador se basa en la historia clínica y se ha demostrado que el diagnóstico basado en la declaración del paciente sobre su historial de agudizaciones es fiable48. El fenotipo agudizador subraya la importancia de preguntar por la historia de agudizaciones en la entrevista clínica. Los pacientes con fenotipo agudizador son pacientes con mayor riesgo de hospitalización y aquellos con agudizaciones graves, de mortalidad; debido a la diferente respuesta a los tratamientos farmacológicos es importante diferenciar los que tienen un fenotipo enfisematoso o bronquítico crónico.
Definición de fenotipo mixto de solapamiento asma-EPOCP1. ¿Cómo debemos diagnosticar el solapamiento asma-EPOC (ACO)?
Concepto y definiciónEl asma y la EPOC son dos enfermedades respiratorias crónicas diferentes en su etiopatogenia, fisiopatología, epidemiología, diagnóstico y tratamiento49. Sin embargo, en la práctica clínica es relativamente frecuente encontrar pacientes con características comunes50. Se desconoce si esta superposición obedece a la mera coincidencia de dos enfermedades prevalentes o si, por el contrario, subyace algún elemento patogénico común. Estudios longitudinales reconocen al asma infantil como un factor de riesgo independiente para el desarrollo de EPOC, especialmente cuando coincide con el consumo de tabaco51. Sin embargo, en pacientes con EPOC bien caracterizada y sin antecedentes de asma previa, también se han identificado más de 100 genes que habitualmente codifican una señal inmunoinflamatoria Th2 (T helper-2) y que se han vinculado con una mayor reversibilidad en la prueba broncodilatadora, eosinofilia periférica y mejor respuesta al tratamiento con glucocorticoides inhalados (GCI)52. A pesar de estos hallazgos, todavía no existe suficiente evidencia para justificar un origen común, por lo que la denominación que mejor describe la situación de este grupo de pacientes es la de solapamiento asma-EPOC o ACO (asthma-COPD overlap). Por consiguiente, el grupo de pacientes con ACO englobaría tanto a los asmáticos fumadores que desarrollan obstrucción persistente al flujo aéreo, como a los que presentan EPOC con características de asma53.
En líneas generales, este grupo de enfermos con ACO presentan más síntomas, peor calidad de vida y mayor riesgo de exacerbaciones que los pacientes con EPOC, aunque mejor supervivencia (en los pacientes tratados con GCI)54–58. La respuesta al tratamiento con GCI en ACO también se ha mostrado intermedia entre la corticosensibilidad de los fenotipos asmáticos Th2 alto y la corticorresistencia de gran parte de los fenotipos de EPOC59. Las diferencias en los desenlaces clínicos y en la respuesta al tratamiento del ACO respecto al asma y a la EPOC aconsejan un abordaje diferencial.
El documento de consenso GesEPOC-GEMA96 define el ACO como la existencia de una limitación crónica al flujo aéreo persistente, en un paciente fumador o exfumador, que presenta características de asma. Esta definición engloba la necesaria coincidencia de tres aspectos básicos: a) limitación al flujo aéreo persistente en el tiempo, esencial para confirmar la existencia de una obstrucción fija que no se modifica de forma espontánea o tras el tratamiento; b) historia acumulada de tabaquismo (actual o pasado) como principal factor de riesgo, y c) características propias del asma, entre las que se incluyen manifestaciones clínicas, biológicas o funcionales.
EpidemiologíaLa prevalencia de ACO en la población general oscila entre el 1,6 y el 4,5%53,57–60; en los pacientes con EPOC, entre el 12,1 y el 55,2%53,58–61, y en pacientes con asma, entre el 13,3 y el 61%57,62,63. Estas amplias variaciones están relacionadas con el tipo de población analizada (análisis de bases de datos o estudios clínicos), los diferentes criterios empleados para la identificación de ACO y la definición de asma y de EPOC. Así, su prevalencia puede superar el 50% en los estudios retrospectivos que analizaron bases de datos y donde el único criterio diagnóstico de ACO en un paciente con EPOC, fue el haber sido diagnosticado previamente de asma.
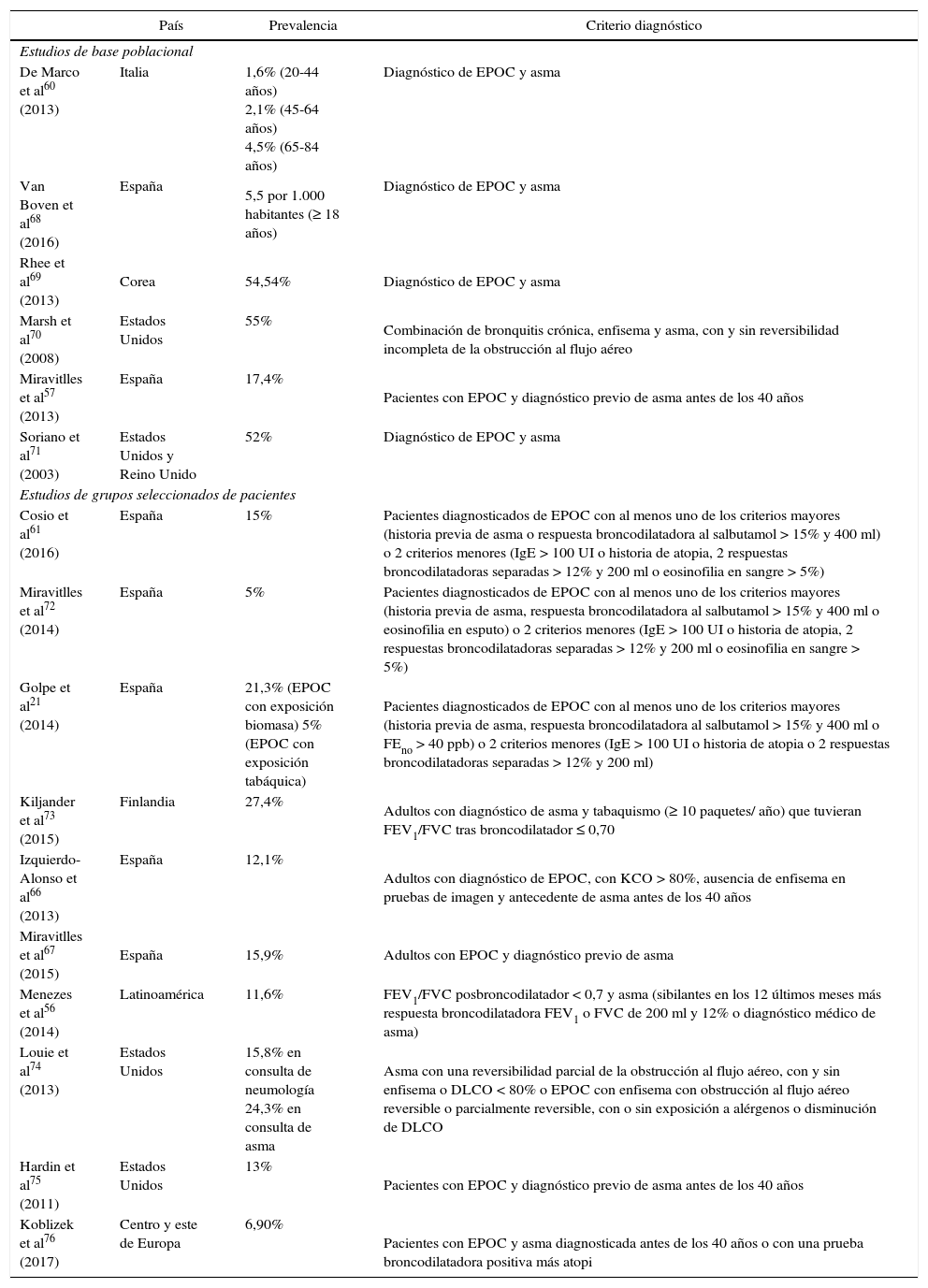
En un metaanálisis publicado recientemente64 que incluyó 19 estudios, la prevalencia de ACO entre los pacientes diagnosticados de EPOC fue del 27% en estudios poblacionales y del 28% en estudios de pacientes hospitalarios. En otros trabajos recientes oscila entre el 11 y el 25% dependiendo de la definición53,65,66. En España los resultados del reciente estudio CHAIN, que incluyó a 831 pacientes con EPOC procedentes de 36 hospitales universitarios, mostraron una prevalencia de ACO (utilizando criterios específicos mayores y menores modificados de GesEPOC) del 15%61. Otros dos estudios observacionales efectuados en poblaciones españolas de 3.125 y 331 pacientes con EPOC constataron prevalencias del 15,9%67 y del 12,1%66, respectivamente. Estos resultados son similares a los del estudio “COPDGene”, que fue del 13%55 y a los de MAJORICA (cohorte poblacional de Baleares), del 18,3%68. En la tabla 1 se muestran los resultados de los principales estudios que han evaluado la prevalencia de ACO21,56,57,60,61,66–76.
Prevalencia de solapamiento asma-EPOC según criterios diagnósticos
| País | Prevalencia | Criterio diagnóstico | |
|---|---|---|---|
| Estudios de base poblacional | |||
| De Marco et al60 (2013) | Italia | 1,6% (20-44 años) 2,1% (45-64 años) 4,5% (65-84 años) | Diagnóstico de EPOC y asma |
| Van Boven et al68 (2016) | España | 5,5 por 1.000 habitantes (≥ 18 años) | Diagnóstico de EPOC y asma |
| Rhee et al69 (2013) | Corea | 54,54% | Diagnóstico de EPOC y asma |
| Marsh et al70 (2008) | Estados Unidos | 55% | Combinación de bronquitis crónica, enfisema y asma, con y sin reversibilidad incompleta de la obstrucción al flujo aéreo |
| Miravitlles et al57 (2013) | España | 17,4% | Pacientes con EPOC y diagnóstico previo de asma antes de los 40 años |
| Soriano et al71 (2003) | Estados Unidos y Reino Unido | 52% | Diagnóstico de EPOC y asma |
| Estudios de grupos seleccionados de pacientes | |||
| Cosio et al61 (2016) | España | 15% | Pacientes diagnosticados de EPOC con al menos uno de los criterios mayores (historia previa de asma o respuesta broncodilatadora al salbutamol > 15% y 400 ml) o 2 criterios menores (IgE > 100 UI o historia de atopia, 2 respuestas broncodilatadoras separadas > 12% y 200 ml o eosinofilia en sangre > 5%) |
| Miravitlles et al72 (2014) | España | 5% | Pacientes diagnosticados de EPOC con al menos uno de los criterios mayores (historia previa de asma, respuesta broncodilatadora al salbutamol > 15% y 400 ml o eosinofilia en esputo) o 2 criterios menores (IgE > 100 UI o historia de atopia, 2 respuestas broncodilatadoras separadas > 12% y 200 ml o eosinofilia en sangre > 5%) |
| Golpe et al21 (2014) | España | 21,3% (EPOC con exposición biomasa) 5% (EPOC con exposición tabáquica) | Pacientes diagnosticados de EPOC con al menos uno de los criterios mayores (historia previa de asma, respuesta broncodilatadora al salbutamol > 15% y 400 ml o FEno > 40 ppb) o 2 criterios menores (IgE > 100 UI o historia de atopia o 2 respuestas broncodilatadoras separadas > 12% y 200 ml) |
| Kiljander et al73 (2015) | Finlandia | 27,4% | Adultos con diagnóstico de asma y tabaquismo (≥ 10 paquetes/ año) que tuvieran FEV1/FVC tras broncodilatador ≤ 0,70 |
| Izquierdo-Alonso et al66 (2013) | España | 12,1% | Adultos con diagnóstico de EPOC, con KCO > 80%, ausencia de enfisema en pruebas de imagen y antecedente de asma antes de los 40 años |
| Miravitlles et al67 (2015) | España | 15,9% | Adultos con EPOC y diagnóstico previo de asma |
| Menezes et al56 (2014) | Latinoamérica | 11,6% | FEV1/FVC posbroncodilatador < 0,7 y asma (sibilantes en los 12 últimos meses más respuesta broncodilatadora FEV1 o FVC de 200 ml y 12% o diagnóstico médico de asma) |
| Louie et al74 (2013) | Estados Unidos | 15,8% en consulta de neumología 24,3% en consulta de asma | Asma con una reversibilidad parcial de la obstrucción al flujo aéreo, con y sin enfisema o DLCO < 80% o EPOC con enfisema con obstrucción al flujo aéreo reversible o parcialmente reversible, con o sin exposición a alérgenos o disminución de DLCO |
| Hardin et al75 (2011) | Estados Unidos | 13% | Pacientes con EPOC y diagnóstico previo de asma antes de los 40 años |
| Koblizek et al76 (2017) | Centro y este de Europa | 6,90% | Pacientes con EPOC y asma diagnosticada antes de los 40 años o con una prueba broncodilatadora positiva más atopi |
DLCO: capacidad de difusión de monóxido de carbono; EPOC: enfermedad pulmonar obstructiva crónica; FEno: fracción exhalada de óxido nítrico; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; IgE: inmunoglobulina E; KCO: coeficiente de transferencia de CO.
En definitiva, si bien la prevalencia de ACO varía ampliamente según la fuente considerada y el criterio utilizado para definirlo, se podría establecer entre el 1,6 y el 4,5% de la población general adulta y entre un 15 a un 25% de la población adulta con obstrucción crónica del flujo aéreo.
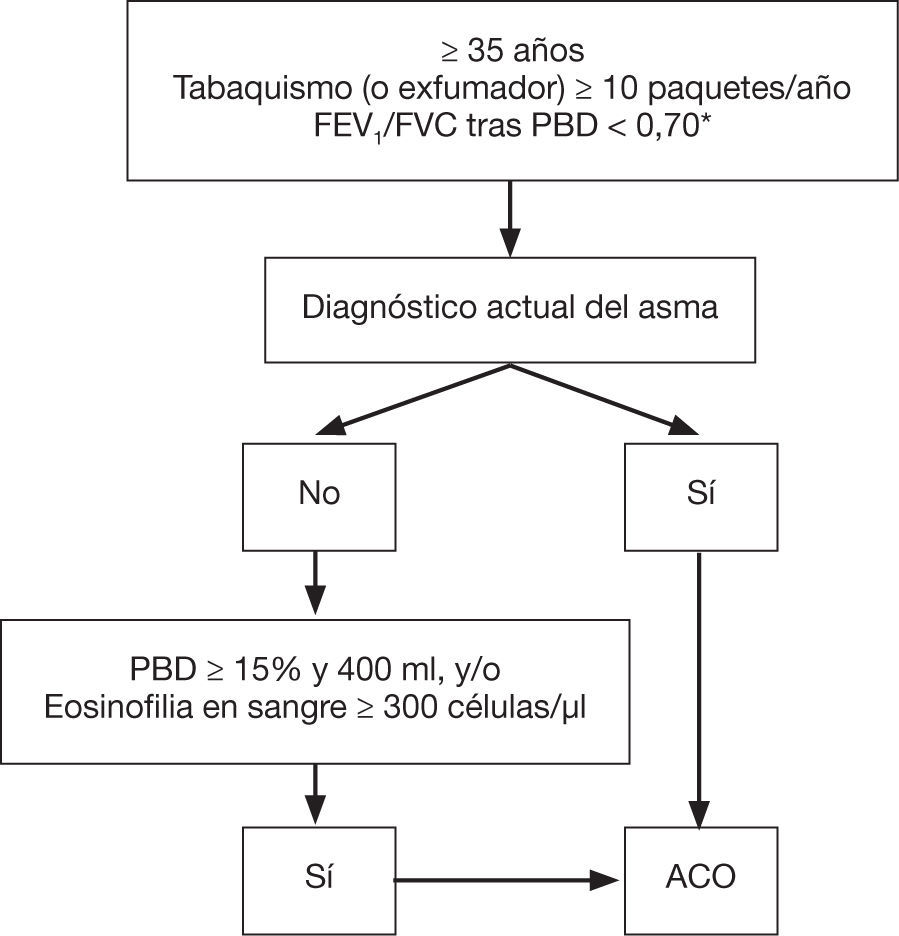
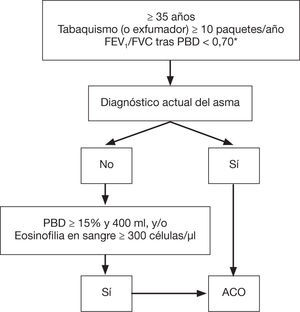
Confirmación diagnósticaEl diagnóstico se confirmará según la siguiente evaluación secuencial (fig. 1):
- 1.
Presencia de limitación crónica al flujo aéreo persistente (FEV1/ capacidad vital forzada tras broncodilatación < 70%) en un paciente ≥ 35 años, fumador o exfumador con una historia tabáquica de al menos 10 paquetes-año77. En pacientes con diagnóstico reciente se revaluará este criterio tras tratamiento con agonistas beta-2 adrenérgicos de acción prolongada (LABA) y GCI y un seguimiento de al menos 6 meses; en algunos casos es recomendable efectuar además una pauta corta (15 días) de glucocorticoides orales (GCO). La reversión de la obstrucción espirométrica tras dichos tratamientos descartará el diagnóstico de ACO en favor del de asma.
- 2.
Diagnóstico de asma actual78. Se deben incluir: a) antecedentes o síntomas de sospecha clínica: antecedentes familiares de asma, antecedentes personales de asma durante la infancia o antecedentes personales de atopia (sensibilización a determinados alérgenos), con síntomas respiratorios (sibilantes, tos, opresión torácica) de curso variable, en ocasiones en forma de crisis de disnea de intensidad también variable, o inflamación de la vía aérea superior (rinosinusitis con o sin poliposis nasal), y b) confirmación diagnóstica objetiva, por reversibilidad de la obstrucción de los flujos espirométricos mediante espirometría o una prueba broncodilatadora (PBD) positiva (≥ 12% y ≥ 200 ml), o una variabilidad circadiana del flujo espiratorio máximo ≥ 20% o una fracción exhalada de óxido nítrico ≥ 50 ppb.
- 3.
En el caso de que no se pueda establecer el diagnóstico de asma, se confirmará el diagnóstico de ACO ante la presencia de una PBD muy positiva (≥ 15% y ≥ 400 ml) o bien ante la presencia de eosinofilia en sangre (≥ 300 eosinófilos/pl), o ambas. Estas características, si bien no son diagnósticas de asma por sí mismas, orientan hacia la existencia de un patrón inflamatorio Th2 alto que, en un paciente fumador con obstrucción crónica del flujo aéreo, permite su clasificación bajo el mismo término de ACO.
Confirmación diagnóstica de ACO. ACO: solapamiento asma y EPOC; GCI: glucocorticoides inhalados; EPOC: enfermedad pulmonar obstructiva crónica; FEV,: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; LABA: agonistas beta-2 adrenérgicos de acción prolongada; PBD: prueba broncodilatadora.
* Mantenida tras tratamiento con GCI/LABA (6 meses). En algunos casos, además, tras ciclo de glucocorticoides orales (15 días). Reproducido con permiso de la European Respiratory Society ©: Eur Respir J 2017;49:1700 068. DOI: 10.1183/13993003.00068-2017.
De este modo, el concepto de ACO englobaría a los pacientes con un verdadero solapamiento de asma y EPOC, ya que comparten ambos diagnósticos, más aquellos pacientes con una EPOC con rasgos asmáticos definidos por un componente inflamatorio eosinofílico y/o una gran reversibilidad de la obstrucción al flujo aéreo79.
TratamientoLos objetivos del tratamiento coinciden con los del asma y los de la EPOC por separado: prevenir las exacerbaciones, alcanzar y mantener un control aceptable de los síntomas y reducir la obstrucción bronquial.
Los GCI constituyen el tratamiento de elección para el asma78, y los pacientes con EPOC y expresión de Th2 alta responden a este tratamiento52. Por lo tanto, todos los pacientes de alto riesgo con ACO recibirán GCI. En pacientes con EPOC se ha observado un incremento notable del riesgo de presentar neumonía con el uso de GCI, particularmente con dosis elevadas80. En el paciente con ACO se desconoce si el riesgo es similar, por lo que parece razonable asumir que la dosis administrada deba ser la mínima clínicamente eficaz. Por otra parte, la monoterapia con un LABA está contraindicada en el asma y la monoterapia con GCI, en la EPOC. Por todo ello, el tratamiento inicial de ACO será una combinación de GCI/LABA. No obstante, son escasos los estudios que han evaluado su eficacia en este contexto81,82 y ninguno ha comparado las diferentes combinaciones entre sí. En consecuencia, no es posible establecer una recomendación sobre cuál es la combinación de elección.
El tiotropio reduce las exacerbaciones de la EPOC83 y del asma en los pacientes insuficientemente controlados con una combinación de GCI/LABA84. Por otra parte, ha demostrado mejorar la función pulmonar en asmáticos en quienes persiste una obstrucción bronquial a pesar de recibir tratamiento con una combinación de GCI/LABA, aunque el impacto sobre los síntomas y sobre la calidad de vida no parece clínicamente relevante84. En consecuencia, se considerará la adición de tiotropio a una combinación de GCI/LABA si persisten exacerbaciones y/o síntomas relevantes. No hay experiencia en asma con otros LAMA (agentes antimuscarínicos de acción prolongada) —como aclidinio, umeclidinio o glicopirronio— que son eficaces en pacientes con EPOC.
Asimismo, se deberá considerar, siempre que estén indicados, el uso de otros tratamientos complementarios como la cesación del tabaquismo, la rehabilitación pulmonar, los antiinflamatorios nasales o la oxigenoterapia.
Por el momento no existe evidencia sólida para recomendar el uso de fármacos biológicos en el tratamiento del ACO, aunque su empleo esté recomendado en algunos casos de asma grave. No obstante, algunos estudios han mostrado resultados prometedores con algunos de ellos85–87.
Definición de fenotipo agudizador con enfisemaEl enfisema se define como la afección de los pulmones caracterizada por un aumento de tamaño de los espacios aéreos situados más allá del bronquiolo terminal y que se acompaña de cambios destructivos en sus paredes. Debido a que el concepto de enfisema es anatómico, el diagnóstico de fenotipo enfisema es un diagnóstico clínico, radiológico y funcional que expresa la probabilidad de que los síntomas y signos del paciente puedan adscribirse a un estado morfológico de enfisema.
El fenotipo enfisema incluye a los pacientes con EPOC con diagnóstico clínico/radiológico/funcional de enfisema que presentan disnea e intolerancia al ejercicio como síntomas predominantes. Los pacientes con fenotipo enfisema tienen tendencia a presentar un índice de masa corporal reducido. No debe confundirse el diagnóstico de fenotipo enfisema con la presencia de enfisema pulmonar. Los signos de enfisema pueden encontrarse en cualquiera de los fenotipos, e incluso en fumadores sin criterios de EPOC.
Este fenotipo de la EPOC se caracteriza por la presencia de datos funcionales de hiperinsuflación88,89, por la detección de enfisema en el estudio por TACAR, y/o por un test de difusión inferior al valor de referencia, medido mediante el cociente DLCO/VA (capacidad de difusión de monóxido de carbono/volumen alveolar) ajustado para la hemoglobina90. La realización de una tomografía computarizada (TC) de tórax será necesaria cuando se piense en la posibilidad de un tratamiento quirúrgico o si presentan agudizaciones frecuentes91.
El fenotipo enfisema suele tener menos agudizaciones que el fenotipo bronquitis crónica, pero es posible que pacientes con enfisema sean también agudizadores, en especial los que presentan formas más graves de la enfermedad91. El enfisema grave, al ser predictor de un mayor descenso anual del FEV1, también se asocia a un mal pronóstico92.
Definición de fenotipo agudizador con bronquitis crónicaPara identificar la bronquitis crónica preguntaremos por la presencia de tos con expectoración al menos tres meses al año en dos años consecutivos93. En el caso del paciente con fenotipo agudizador con bronquitis crónica debemos realizar una TC de alta resolución (TACAR) para comprobar si el paciente tiene bronquiectasias42 y también cultivos de esputo en fase estable, en especial si la expectoración es amarillenta u oscura94. En caso de positividad repetida se considerará que el paciente tiene una infección bronquial crónica95.
Definición del fenotipo no agudizadorEl fenotipo no agudizador se caracteriza por presentar como máximo un episodio de agudización moderada el año previo. Es un paciente de menor riesgo de deterioro de su calidad de vida, de pérdida de función pulmonar o de mortalidad que el agudizador.