Las unidades monográficas de asma (UMA) son consultas hospitalarias implementadas para lograr una mejoría clínica de los pacientes. Este estudio analiza su impacto sobre el control del asma y su coste-efectividad en comparación con las consultas ordinarias.
MétodosEstudio de casos cruzados que incluyó a todos los pacientes que fueron atendidos por primera vez en la UMA de Lugo durante 2012. Se definió el «periodo-caso» como los 365días que siguieron a la primera visita en la UMA, y el «periodo-control» como los 365días que la antecedieron. Se calcularon los cambios en indicadores clínicos relevantes para el control del asma y se estimó la relación de coste-efectividad incremental (RCEI) por cada paciente adicional que fue controlado y por cada año de vida ajustado por calidad (AVAC).
ResultadosEl porcentaje de pacientes (n=83, edad media 49±15,2años; 60,2% mujeres) controlados aumentó del 41 al 86%. El resultado del test de control del asma mejoró desde 18,7±4,6 hasta 22,6±2,3 (p<0,05) y el FEV1 se elevó desde 81,4%±17,5 hasta 84,4%±16,6 (p<0,05). Las exacerbaciones, hospitalizaciones y visitas a urgencias disminuyeron un 75, un 78 y un 75%, respectivamente. La utilización de combinaciones CI/LABA decreció del 79,5% al 41%. El uso de otros fármacos aumentó: anticolinérgicos del 3,6 al 16,9%, CI en monoterapia del 3,6 al 45,8%, y omalizumab del 0 al 6%. Las RCEI por paciente controlado y por AVAC ganado fueron de 1.399 y 6.876€, respectivamente (perspectiva social).
ConclusionesLa atención en una UMA es coste-efectiva y tiene un impacto beneficioso sobre el control del asma.
Asthma clinics (AC) are hospital outpatient services specialising in the management of asthma. In this study, we analysed the impact of these clinics on asthma management and their cost effectiveness in comparison with standard outpatient services.
MethodsA case cross-over study in which all new patients seen in the AC of Lugo in 2012 were included. The case period was defined as one year following the first visit to the AC; the control period was defined as the preceding year. We calculated changes in clinical quality indicators for asthma management, and estimated the incremental cost-effectiveness ratio (ICER) for each additional patient treated and for each quality-adjusted life year (QALY)
ResultsThe number of patients (n=83, mean age 49±15.2years; 60.2% women) managed in the AC increased from 41% to 86%. The Asthma Control Test score increased from 18.7±4.6 to 22.6±2.3 (p<0.05) and FEV1 increased from 81.4%±17.5 to 84.4%±16.6 (p<0.05). The number of exacerbations, hospitalisations and visits to accident and emergency fell by 75%. The number of patients given combination LABA+ICS therapy fell from 79.5% to 41%. The use of other drug therapy increased: anticholinergics, from 3.6% to 16.9%; ICS in monotherapy, from 3.6% to 45.8%; and omalizumab, from 0% to 6%. ICERs per patient managed and per QALY gained were €1,399 and €6,876, respectively (social perspective).
ConclusionsTreatment in ACs is cost-effective and beneficial in asthma management.
Un informe de la Organización Mundial de la Salud estimó que, en el año 2004, el asma afectaba a 300 millones de personas en el mundo, y que su prevalencia está en aumento1. En España se acepta que se sitúa en torno al 5% de adultos2. A pesar de los avances terapéuticos y de la implementación de guías de práctica clínica3,4, entre el 50 y el 70% de los asmáticos no alcanzan el control deseable5,6. Un estudio español cifró en un 3,9% la proporción de asmáticos mal controlados y con forma grave de la enfermedad7. El estudio AsmaCost8 estimó que el gasto anual promedio por paciente es de 2.635€, y que el 50% del gasto se debe a los asmáticos graves9. El estudio COAX, en el año 2004, cifró el coste medio de una exacerbación moderada en 1.230€, y el de una grave, en 3.543€10.
Considerando estos datos, parece razonable implementar estrategias con el objetivo de mejorar el seguimiento de los asmáticos, su interacción con los especialistas responsables del control de la enfermedad y, finalmente, acercarse a un enfoque clínico más personalizado que permita reconocer necesidades individuales y llevar a cabo intervenciones farmacológicas o conductuales (educación, seguimiento de la adherencia terapéutica)11. Todas estas acciones deberían ser lideradas desde las unidades monográficas de asma (UMA) —consultas hospitalarias atendidas por equipos multidisciplinares y lideradas por un especialista experto en la enfermedad—, que además podrían jugar un papel relevante en la optimización de recursos económicos. Sin embargo, estudios anteriores no han investigado en qué medida una consulta específica de asma puede resultar coste-efectiva tanto para el paciente como para el sistema sanitario.
Material y métodosDiseñoEstudio retrospectivo, observacional, de «casos-cruzados», cuyo objetivo principal fue evaluar el coste-efectividad del manejo de individuos diagnosticados de asma y atendidos por primera vez durante el año 2012 en la UMA del Hospital Universitario Lucus Augusti (HULA), de Lugo.
La UMA del HULA (que comenzó a funcionar en el año 2010) consta de 2 consultas monográficas (una médica y otra de enfermería) atendidas por personal experto en el asma. Además, es una consulta multidisciplinar en la que participa también Alergología. En ella se llevan a cabo pruebas necesarias para el diagnóstico y el seguimiento del asma (espirometría, pletismografía, oscilometría, fracción de óxido nítrico en el aire exhalado, test de metacolina y manitol, recuento celular en esputo…). En un hospital de día neumológico —que funciona en horarios laborales— se atienden las exacerbaciones de los asmáticos y se administran los tratamientos biológicos. Todos los pacientes reciben educación sobre la enfermedad, el tratamiento y un plan de acción por escrito. La UMA está involucrada en proyectos de investigación clínica y ayuda a la formación de médicos residentes y de neumólogos de otras partes del territorio español. Los asmáticos llegan a esta unidad procedentes de atención primaria o de cualquier otra consulta especializada del área sanitaria a criterio del médico responsable, y no necesariamente por estar mal controlados. Según la opinión del responsable de la UMA, se debe atender también pacientes con asma bien controlada (si la demanda asistencial lo permite) por 2 motivos principales: asegurar el diagnóstico de la enfermedad y reducir el tratamiento cuando se ha logrado el control. Por falta de formación o métodos diagnósticos, estos 2 aspectos rara vez se garantizan fuera de una UMA.
Se utilizaron datos obtenidos del IANUS —la historia clínica electrónica del Servicio gallego de Salud (SERGAS)—, en el que se registran datos como visitas médicas, pruebas realizadas o los cambios terapéuticos habidos. Se definió como «periodo-caso» los 365días posteriores a la primera consulta en la UMA, y como «periodo-control» los 365días anteriores. Se comparó la situación clínica y el gasto originado por el paciente durante el año previo y el año posterior a su valoración en la UMA.
El estudio fue aprobado por el Comité Ético de Investigación Clínica (CEIC) de Galicia (código 2014/180).
PacientesSe analizaron todas las historias clínicas de pacientes ≥18años previamente diagnosticados de asma, mayoritariamente no controlados, y que fueron atendidos desde el 1 de enero de 2012 hasta el 1 de enero de 2013. Un caso especial fue el de los pacientes que llegaron a la UMA con el diagnóstico de asma y en los que posteriormente se descartó la enfermedad (en estos casos no se llevó a cabo seguimiento de un año).
Desarrollo del estudioDel IANUS se extrajeron los datos clínicos, funcionales y analíticos, así como los datos de utilización de recursos sanitarios (visitas al médico de atención primaria y especializada debidas a exacerbaciones, días de hospitalización, urgencias, medicación antiasmática y pruebas diagnósticas), de pérdida de productividad laboral por los días de consulta, de hospitalización y de visitas a urgencias, y los costes atribuibles al traslado de todos los pacientes que cumplieron los criterios de inclusión. Estos datos fueron alojados en un cuaderno de recogida de datos (CRD) electrónico para su posterior análisis en un programa estadístico.
VariablesTodas las variables tenidas en cuenta para este estudio y sus definiciones (diagnóstico de asma, definición de control, exacerbación, costes y años de vida ajustados por calidad [AVAC]) se recogen en la tabla 1. Las variables de costes incluyeron los costes directos sanitarios sufragados por el SERGAS relativos al uso de recursos (medicación antiasmática, visitas al médico, pruebas diagnósticas y hospitalizaciones), el coste que supuso el transporte de los pacientes al HULA (coste directo no sanitario) y el coste que las pérdidas de productividad supusieron para la sociedad (costes indirectos) tanto en el año anterior como en el posterior al ingreso en la UMA. El año de referencia de los costes es el 2012, y al tratarse de un estudio con un año de seguimiento no se aplicó ninguna tasa de descuento. La tabla 2 muestra los costes unitarios de los recursos y sus fuentes.
Relación y definición de las variables del estudio
| Variable | Definición |
|---|---|
| Diagnóstico previo de asma | Paciente diagnosticado y tratado de esta enfermedad antes de haber llegado a la UMA del HULA. Este diagnóstico podía ser revocado en la consulta especializada mediante un test de metacolina |
| Asma | Diagnóstico clínico de asma y alguna prueba diagnóstica objetiva según la GEMA (test broncodilatador positivo, test de broncoprovocación positivo, FENO>30ppb)4 |
| Asma controlada | Paciente paucisintomático o asintomático (ACT≥20), con función pulmonar normal o casi normal (FEV1>70% sobre el teórico), y sin exacerbaciones |
| Exacerbación asmática12 | |
| Grave | Eventos que requieren la utilización de esteroides sistémicos, o el aumento de la dosis si ya se recibían, durante un mínimo de 3 días (si los cursos de corticoides están separados en el tiempo por una semana o más, se consideran exacerbaciones diferentes). Visitas a urgencias y hospitalizaciones que empleen esteroides |
| Moderada | Eventos que comprometen la situación del paciente más allá de las variaciones diarias que caracterizan a la enfermedad y que le obligan a cambiar el tratamiento habitual, pero que no alcanzan la categoría de graves. Las visitas a urgencias resueltas sin empleo de esteroides |
| Costes | |
| Costes directos sanitarios | Son aquellos financiados directamente por el sistema sanitario |
| Medicación | Diferencia entre el coste total de la medicación antiasmática durante el mes previo a la valoración en la consulta especializada de asma (según el importe que figura en la receta electrónica) y el coste total de la medicación durante el último mes del año siguiente a la valoración en la UMA. La diferencia se extrapoló a 12 meses para computar el cambio en costes de medicación atribuible a un año |
| Visitas médicas | Se recogió el importe por cada visita (al médico de atención primaria, hospital de día, médico especialista o urgencias) que figura en el DOGA, año 201213 |
| Ingresos hospitalarios | Se estableció un importe por cada día de ingreso en el hospital de acuerdo con lo estipulado en el DOGA Se recogió el importe por prueba funcional (espirometría con o sin test broncodilatador, FENO, test de metacolina), analíticas (hemograma, IgE, gasometría), pruebas cutáneas de alergia y radiológicas que figuran en el DOGA |
| Pruebas diagnósticas | |
| Costes directos no sanitarios | Los costes directos no sanitarios son los directamente solventados por los pacientes o sus familiares en relación con la enfermedad o la obtención de servicios sanitarios (p.ej., transporte por cuenta del paciente, servicios de cuidadores profesionales, terapias alternativas). Este estudio solamente contempla el coste asociado al transporte de los pacientes |
| Coste del traslado | Coste promedio que supuso para el paciente el desplazamiento de su domicilio al HULA o Centro de Salud, motivado por el asma (urgencias o consultas ordinarias). Se asignó un coste de 0,19€/km de acuerdo con el importe de la indemnización por uso de vehículo particular establecido por el Ministerio de Economía y Hacienda14 a la distancia recorrida que figura en el IANUS |
| Costes indirectos | Valoración económica de la pérdida de riqueza que la enfermedad supone para la sociedad. Generalmente incluyen pérdidas de productividad laboral de los pacientes o sus familiares, en caso de que estos presten cuidados a las personas enfermas. En este estudio solo se incluye una aproximación a las primeras |
| Pérdidas de productividad laboral | Coste medio que representaron los días de absentismo laboral debidos a las visitas médicas y días de hospitalización en personas en situación activa. Se imputó un coste a dichos días desde un enfoque de capital humano, según el cual la pérdida de productividad diaria puede medirse en términos monetarios mediante la imputación del salario medio que percibe la persona en un día15. A partir de la Encuesta de Estructura Salarial del Instituto Nacional de Estadística16, se asignaron salarios brutos promedio según tramos de edad y sexo para la comunidad autónoma de Galicia |
| Costes totales | Suma de los costes directos sanitarios, costes directos no sanitarios y costes indirectos |
| Años de vida ajustados por calidad (AVAC) | Los AVAC miden la CVRS en una escala de 0 a 1, donde 1 corresponde a un año con la mejor salud imaginable posible. Se calculan a partir de la autopercepción que tienen los pacientes de su estado de salud. Extrapolamos los AVAC antes y después de la atención en la UMA obtenidos por Doz et al.6, que estiman 0,89 y 0,69 AVAC por año para pacientes controlados y no controlados, respectivamente. En un segundo paso ajustamos estos AVAC por disminuciones en la CVRS debidas a cada día que el paciente sufrió una exacerbación a lo largo del año, utilizando datos de la evaluación económica de NICE, según la cual cada día de exacerbación que no precisa de hospitalización representa una pérdida media de 0,002 AVAC, y cada día de exacerbación que sí precisa de hospitalización resta al paciente 0,001 AVAC17,18 |
ACT: test de control del asma; AVAC: año de vida ajustado por calidad; CVRS: calidad de vida relacionada con la salud; DOGA: Diario Oficial de Galicia; FENO: óxido nítrico en el aire exhalado; FEV1: volumen respiratorio forzado en el primer segundo; GEMA: Guía Española para el Manejo del Asma; HULA: Hospital Universitario Lucus Augusti, Lugo; IANUS: historia clínica electrónica en el SERGAS; IgE: inmunoglobulina E; SERGAS: Servicio Gallego de Salud; UMA: unidades monográficas de asma.
Costes unitarios y fuentes
| Coste (€) | Fuente | |
|---|---|---|
| Pruebas diagnósticas (coste por prueba) | ||
| Espirometría | 40 | a |
| Espirometría con test bd | 80 | a |
| FENO | 50 | a |
| Metacolina | 200 | a |
| Radiografía de tórax | 18 | b |
| TAC | 120 | b |
| Hemograma | 3 | b |
| IgE | 6 | b |
| Prick-test | 15 | b |
| Medicamentos (coste mensual del tratamiento) | ||
| Salmeterol | Fluticasona | c |
| «200/100»/«500/100»/«1.000/100» | 45/61/83 | |
| Budesonida | Formoterol | c |
| «160/4,5»/«160/9»/«320/9»/«620/18»/«640/18»/«160/4,5» | 16/51/32/128/64/16 | |
| Beclometasona | Formoterol | c |
| «100/6»/«200/10»/«400/24» | 12,5/25/51 | |
| Fluticasona «200»/«1.000»/«2.000» | 16/52/104 | c |
| Budesonida «200»/«400»/«800» | 5/8/19 | c |
| Indacaterol 150 | 50 | c |
| Tiotropio 18 | 49 | c |
| Glicopirronio | 47 | c |
| Montelukast 10 | 21 | c |
| Mometasona «200»/«400» | 15/26 | c |
| Mometasona nasal 200 | 16 | c |
| Fluticasona nasal «55»/«110»/«200» | 3,25/6,5/13 | c |
| Dezacort «6»/«30» | 9/45 | c |
| Omalizumab «150»/«300»/«450»/«900»/«1200» | 355/710/1.065/1.420/2.84 | c |
| 0 | ||
| Servicios médicos (coste por servicio) | ||
| Visita a atención primaria (consulta sucesiva) | 34,45 | d |
| Urgencia hospitalaria | 359,79 | d |
| Día de ingreso hospitalario | 526,32 | d |
| Transporte del paciente (coste por km recorrido) | 0,19 | e |
| Pérdidas de productividad laboral (salario medio por día) | ||
| Menos de 25 años (mujeres/varones) | 25,54/30,47 | f |
| De 25 a 34 años (mujeres/varones) | 40,41/50,05 | f |
| De 35 a 44 años (mujeres/varones) | 51,24/66,80 | f |
| De 45 a 54 años (mujeres/varones) | 46,73/61,29 | f |
| 55 y más años (mujeres/varones) | 51,61/67,33 | f |
Puente Maestú L, García de Pedro J. Las pruebas funcionales respiratorias en las decisiones clínicas. Arch Bronconeumol. Mayo de 2012;48(5):161-9.
Decreto 221/2012 (31 de octubre), por el que se establecen las tarifas de los servicios sanitarios prestados en los centros dependientes del Servicio Gallego de Salud y en las fundaciones públicas sanitarias. Disponible en: http://www.xunta.es/dog/Publicados/2012/20121121/AnuncioC3K1-091112-0002_es.html
Orden EHA/3770/2005 (1 de diciembre), por la que se revisa el importe de la indemnización por uso de vehículo particular establecida en el Real Decreto 462/2002 (24 de mayo), sobre indemnizaciones por razón del servicio. Disponible en: http://www.boe.es/boe/dias/2005/12/03/pdfs/A39852-39852.pdf
La efectividad se midió tanto en términos del número de pacientes para los que se logró el control como en AVAC ganados un año después del ingreso a la UMA. Se consideró controlado al paciente paucisintomático o asintomático (test de control del asma [ACT]≥20), con función pulmonar normal o casi normal (FEV1>70% sobre el teórico) y sin exacerbaciones. En este estudio no contamos con respuestas a cuestionarios de calidad de vida que permitiesen medir los AVAC de los pacientes directamente. Por lo mismo, para estimar los AVAC totales de la muestra antes y después de la atención en la UMA se extrapolaron resultados de AVAC obtenidos en estudios previos6,17,18, siguiendo la metodología de extrapolación que se describe en la tabla 1.
Análisis estadístico y análisis de coste-efectividadAnálisis estadísticoSe comparó el número de pacientes controlados de su asma en el momento de la visita a la UMA y después de un año de seguimiento en la consulta especializada. Además, se analizó cada parámetro de evolución clínica por separado (síntomas medidos por el cuestionario ACT y función pulmonar —FEV1 en valor total y porcentaje sobre el teórico— en el momento de la primera visita a la consulta y al cabo de un año, y el número total de exacerbaciones durante el año previo y el año siguiente a la primera consulta en la UMA). Se utilizó principalmente la prueba t para muestras relacionadas, con el objetivo de analizar una misma muestra de individuos en 2 momentos distintos: momento1 (el año previo al manejo en la UMA) y momento2 (un año después del manejo en la UMA). Con este análisis se investigó si el manejo del asma en la unidad de asma proporciona diferencias estadísticamente significativas entre el momento1 de los individuos (estado pasado) y el momento2 (estado actual). Se utilizaron técnicas no paramétricas (p.ej., prueba de Wilcoxon) en caso de que la muestra no hubiera seguido una distribución normal en determinadas variables. El límite de la significación estadística se situó en un valor de p<0,05. Los datos se analizaron con el programa estadístico SPSS (IBM SPSS Statistics for Windows, Versión 19.0).
Análisis de coste-efectividadLa relación coste-efectividad incremental (RCEI), que representa el coste adicional anual de obtener una unidad de efectividad adicional si el paciente es tratado en la UMA en vez de ser tratado en consultas habituales, se calcula como RCEI=(C2-C1)/(E2-E1), donde Ci y Ei representan los costes totales y la efectividad total en el momento i (i=1: año previo al manejo en UMA; i=2: año posterior). Calculamos la RCEI por paciente para el que se logró el control y la RCEI por AVAC ganado, tanto desde la perspectiva del SERGAS como desde la perspectiva social. La primera toma solamente en cuenta los costes cubiertos por el sistema público (costes directos sanitarios), mientras que la segunda incluye también los costes cubiertos por el paciente y la sociedad (en este caso costes del transporte y pérdidas de productividad laboral, respectivamente).
ResultadosDescripción demográfica, clínica y funcional de la muestraSe incluyeron 83 individuos (edad media 48,9±15,2años, 60,2% mujeres). De ellos, 9 pacientes (10,8%) no tenían asma, como se demostró mediante un test de metacolina negativo después de haberse suspendido toda medicación de uso regular. Las características clínicas y demográficas de los pacientes se detallan en la tabla 3. Teniendo en cuenta que el 80% de los pacientes recibían una combinación de corticoide inhalado (CI) y broncodilatador de larga duración (LABA) —la mayoría de ellos sin conseguir el control del asma—, parece razonable asumir que el perfil corresponde a asmáticos con formas moderadas o graves de la enfermedad.
Características clínicas y demográficas de la muestra (n=83)
| Edad (media±DE) | 48,9±15,2 |
| Sexo: mujeresa | 50 (60,2) |
| Confirmación del diagnóstico de asmaa | 74 (89,2) |
| Comienzo del asma: temprano (< 12 años)/tardíoa | 23 (27,7)/60 (72,3) |
| Prick test positivoa | 33 (41,8) |
| IgE: UI/ml (media±DE) | 326±907 |
| Eosinófilos: número/mm3 (media±DE) | 463±402 |
| Rinitisa | 55 (66,3) |
| Sinusitisa | 21 (25,3) |
| Poliposisa | 11 (13,3) |
| Intolerancia al AASa | 7 (8,4) |
| ABPAa | 2 (2,4) |
| RGEa | 17(20,5) |
| Obesidada | 33 (39,8) |
| SAHSa | 4 (4,8) |
| Disfunción de cuerdas vocalesa | 1 (1,2) |
| Tabaquismoa | 10 (12,0) |
| Ansiedada | 17 (20,5) |
| Depresióna | 12 (14,5) |
| Test broncodilatador positivoa | 35 (44,3) |
| Test de metacolina positivo: sí/no/no se realizóa | 8 (9,6)/12 (14,5)/63 (75,9) |
| Feno>30 ppda | 52 (62,7) |
AAS: ácido acetil salicílico; ABPA: aspergilosis broncopulmonar alérgica; DE: desviación estándar; IgE: inmunoglobulina E; RGE: reflujo gastroesofágico; SAHS: síndrome de apnea hipopnea durante el sueño.
La tabla 4 muestra la evolución clínica y funcional de los pacientes. Descendió significativamente el porcentaje de pacientes no controlados (59% vs 14,5%), a la par que mejoraron los parámetros clínicos analizados. Por otra parte, disminuyeron las visitas médicas totales (que incluyen las programadas y las no programadas), las visitas a urgencias, los días laborables perdidos y los días de hospitalización (aunque en este último aspecto el cambio no fue estadísticamente significativo). Las escasas hospitalizaciones consignadas fueron en la planta de neumología, ninguna en cuidados críticos.
Evolución clínica y funcional de los pacientes (media±DE)
| Variables | Año previo | Año posterior | p |
|---|---|---|---|
| FEV1 (l) | 2,5±0,9 | 2,6±0,8 | < 0,05 |
| FEV1 (%) | 81,4±17,5 | 84,4%±16,6 | < 0,05 |
| ACT | 18,7±4,6 | 22,6±2,3 | < 0,001 |
| Exacerbaciones/paciente | 0,8±1,6 | 0,2±0,9 | < 0,001 |
| Control: sí/no (%) | 41,0/59,0 85,5/14,5 | < 0,001 | |
| Visitas al médico | 1,9±2,7 | 0,2±1,1 | < 0,001 |
| Visitas a urgencias | 0,4±1,0 | 0,1±0,8 | < 0,05 |
| Días de hospitalización | 0,11±0,6 | 0,02±0,2 | 0,102 |
| Días laborales perdidos | 2,9±6,3 | 1,3±1,3 | < 0,05 |
DE: desviación estándar. FEV1: volumen espiratorio forzado en el primer segundo; ACT: test de control del asma.
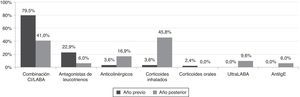
Se redujo la prescripción de combinaciones CI/LABA (del 79,5 al 41,0%) y de antileucotrienos (del 22,9 al 6%), mientras aumentaron los CI en monoterapia, omalizumab, anticolinérgicos y LABA de 24h de duración. En todos los pacientes se pudo retirar el tratamiento con corticoides sistémicos (fig. 1).
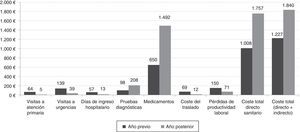
Cambios en costesEl manejo en la UMA supuso un incremento significativo en los costes de los medicamentos y las pruebas diagnósticas, parcialmente compensado por una disminución en los costes de visitas no programadas, hospitalizaciones, el coste del traslado del paciente, y en los costes indirectos asociados a las pérdidas de productividad. Ello supuso un incremento en el coste total por paciente del 51,3% (tabla 5 y fig. 2).
Evolución de los costes anuales por paciente (€)
| Año previo, media±DE | Año posterior, media±DE | Variación (%) | p | |
|---|---|---|---|---|
| A. Costes directos sanitarios | 1.008±959 | 1.757±4.662 | +74,2% | 0,634 |
| a) Visitas médicas, hospitalizaciones y urgencias | 260±669 | 57±432 | −78,1% | < 0,001 |
| b) Pruebas diagnósticas | 98±94 | 208±72 | +112,8% | < 0,001 |
| c) Medicamentos | ||||
| Combinación CI/LABA | 46,24±36,29 | 22,19±31,15 | −52% | < 0,001 |
| Anticolinérgicos | 1,77±9,20 | 8,19±18,30 | +462,6% | < 0,05 |
| Corticoides inhalados | 0,72±4,09 | 10,86±17,36 | +1501,7% | < 0,001 |
| Ultra LABA | 0,00±0,00 | 4,82±14,85 | − | < 0,05 |
| Antagonistas de leucotrienos | 4,81±8,88 | 1,27±5,03 | −73,7% | < 0,001 |
| Corticoides orales | 0,65±5,03 | 0,00±0,00 | −100% | 0,180 |
| Anti-IgE (omalizumab) | 0,00±0,00 | 77±372,11 | − | < 0,05 |
| Total medicamentos | 650±518 | 1.492±4.630 | +129,4% | 0,592 |
| B. Coste directo no sanitario: coste del traslado | 69±191 | 12±81 | −82,6% | < 0,001 |
| C. Costes indirectos: pérdidas de productividad laboral | 149,5±289,3 | 71,3±76,1 | −52,3% | < 0,05 |
| Coste total por paciente (A+B+C) | 1.216,5 | 1.840,3 | +51,3% | 0,296 |
AntiIgE: anti-inmunoglobulina E; CI/LABA: corticoide inhalado con broncodilatador de larga duración; DE: desviación estándar; Ultra LABA: beta-agonista de 24h de duración.
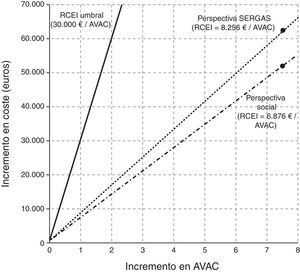
Tras el manejo en la UMA, 37 asmáticos que previamente no estaban controlados lograron el control. El total de AVAC ganados por todos los pacientes de la muestra fue de 7,53AVAC (una media de 0,09 por paciente). Desde la perspectiva del SERGAS, las RCEI, que representan el coste adicional de cada unidad de efectividad ganada, fueron de 1.680€ por paciente controlado al año y de 8.265€ por AVAC ganado. Desde el punto de vista social, estas cifras fueron de 1.399 y 6.876€, respectivamente. Estos resultados representan lo que costaría, desde cada una de las perspectivas de análisis, conseguir el control en un paciente y conseguir un AVAC adicional, respectivamente (tabla 6).
Resultados de coste-efectividad
| Año previo | Año posterior | Incremento | |
|---|---|---|---|
| Costes directos sanitarios totales (€) | 83.664 | 145.831 | 62.167 |
| Costes sociales totales (directos sanitarios, traslado y pérdidas de productividad) (€) | 100.970 | 152.745 | 51.775 |
| Pacientes controlados | 34 | 71 | 37 |
| AVAC en el grupo de pacientes controlados | 30,25 (n=34) | 63,18 (n=71) | 32,93 |
| AVAC en el grupo de pacientes no controlados | 33,65 (n=49) | 8,25 8 (n=12) | −25,4 |
| AVAC totales (n = 83) | 63,89 | 71,42 | 7,53 (p < 0,001) |
| RCEI desde la perspectiva del SERGASa | |||
| RCEI por paciente controlado | 1.680 | ||
| RCEI por AVAC ganado | 8.256 | ||
| RCEI desde la perspectiva socialb | |||
| RCEI por paciente controlado | 1.399 | ||
| RCEI por AVAC ganado | 6.876 | ||
AVAC: años de vida ajustados por calidad, totales para cada grupo de pacientes; RCEI: relación de coste-efectividad incremental; SERGAS: Servicio Gallego de Salud.
Este estudio demuestra que una UMA es capaz de lograr una significativa mejoría en la situación clínica de los pacientes: el porcentaje de pacientes controlados se incrementó desde el 41 al 86%, y el resultado del ACT aumentó desde una media de 18,7 hasta 22,6. Esto es importante, por cuanto se ha relacionado esta herramienta, que mide el control del asma, con la calidad de vida de los asmáticos19,20. Por otra parte, las exacerbaciones disminuyeron un 75%.
Con excepción del gasto en medicamentos y en pruebas diagnósticas, el resto de las partidas de costes disminuyeron, permitiendo un ahorro de 338€ anuales por paciente. La RCEI por paciente controlado fue de 1.680€ desde el punto de vista del SERGAS y de 1.399€ desde una perspectiva social. Cada AVAC adicional ganado por tratar un paciente en la UMA en lugar de una consulta habitual representaría un coste anual adicional de 8.256€ para el SERGAS y de 6.876€ para la sociedad. Aunque en España no existe un valor umbral oficial para recomendar o no la adopción de una intervención sanitaria en función de su coste-efectividad, la literatura indica que un valor razonable estaría en el rango de 30.000 a 45.000€/AVAC21, el cual está en línea también con las recomendaciones del National Institute for Health Care Excellence (NICE), cuya RCEI umbral es de entre 20.000 y 30.000 libras esterlinas22. La figura 3 muestra el plano de coste-efectividad de la atención en la UMA comparada con la atención tradicional.
Los estudios que evalúan el coste-efectividad de una UMA son escasos en nuestro país. En España, un estudio de Domingo Ribas23 llevado a cabo el año 2001 demostró un significativo ahorro de costes por descenso de visitas a urgencias e ingresos, pero este estudio solo incluyó 20 asmáticos, todos ellos corticodependientes.
Es importante resaltar que en un 10% de nuestros pacientes se descartó el diagnóstico de asma después de la evaluación diagnóstica en la UMA. Esta cifra es menor que el 30% de sobrediagnóstico que se ha publicado previamente24,25, posiblemente porque muchos asmáticos ya habían sido atendidos previamente por un especialista. También es interesante observar que la utilización de combinaciones CI/LABA disminuyó significativamente al seguirse las recomendaciones de las guías para la reducción del tratamiento, mientras que se incrementó el uso de otros fármacos: anticolinérgicos, corticoides inhalados en monoterapia y omalizumab, también de acuerdo con las guías. Si, como se hace en otros estudios25, se calculase el ahorro en medicación estimado para toda la vida del paciente (de acuerdo con su esperanza de vida), el desenlace sería más favorable desde un punto de vista económico.
El incremento en costes derivado de la atención a los asmáticos en la UMA se debe fundamentalmente al gasto en medicación, especialmente al uso de omalizumab —utilizado por el 6% de los pacientes en la UMA—, que representa un notorio 60% del incremento. Sin embargo, este fármaco se utiliza solo en pacientes con asma grave, cuando no han respondido al tratamiento inhalado recomendado y en línea con las recomendaciones de las guías, y su coste-efectividad ha sido puesto de manifiesto en estudios previos, diferentes países y con distintos sistemas sanitarios17,26-29. En España se halló un coste incremental de 462€ por exacerbación evitada y de 26.864€ por AVAC ganado en pacientes tratados con omalizumab30.
El estudio tiene limitaciones obvias. Es de carácter retrospectivo, pero se ha escogido un periodo de plena implantación de la historia clínica electrónica en Galicia, lo que permite que los datos referentes a cambios de medicación, visitas a atención primaria, urgencias, consultas especializadas y bajas laborales estén plenamente disponibles. Además, la variabilidad clínica ha sido escasa, ya que la atención clínica de los pacientes ha sido dirigida por un único especialista. El hecho de que este estudio solo se haya llevado a cabo en un hospital tiene su importancia, porque la interpretación del tratamiento en pacientes que están más allá de las guías de práctica clínica podría variar de una UMA a otra (a la hora, por ejemplo, de decidir en qué pacientes reducir el tratamiento o a quiénes tratar con un anticuerpo monoclonal o un LAMA) y tener repercusiones en cuanto a su eficacia y a sus costes. El número de pacientes incluidos no ha sido elevado, pero, por el contrario, cada uno de ellos ha sido rigurosamente seguido en la UMA. Además, aunque el diseño de «casos cruzados» garantiza un adecuado emparejamiento (cada individuo se empareja consigo mismo), tiene la limitación de que no se pueden obviar por completo posibles factores confusores en el periodo control (antes de la atención en la UMA), ya que aspectos como el cumplimiento farmacológico, posibles consultas con especialistas en la medicina privada, etc., no habrían podido ser tenidos en cuenta. En todo caso, pensamos que el haber escogido un periodo de seguimiento de 12meses evita el posible impacto de los factores confusores estacionales (exposición a alérgenos, virus, etc.) y que la revisión exhaustiva de la historia clínica garantiza que los periodos control y caso hayan sido comparables.
La estimación de los costes indirectos puede resultar imprecisa debido a que el cálculo de la pérdida de productividad laboral atribuible al asma se basa en la duración de una exacerbación y en los días de hospitalización, pero no considera los días trabajados con sintomatología asmática que pudieran afectar el rendimiento laboral. Asimismo, desconocemos los días reales que el paciente estuvo de baja laboral. El estudio de Ojeda y Sanz de Burgoa31 estimó que las pérdidas de productividad laboral asociadas al asma en España, incluyendo días trabajados con sintomatología asmática, ascienden a 258,81€ mensuales por paciente, cifra significativamente más alta que nuestros resultados para la consulta habitual (149,5€ anuales). Esto implicaría que nuestro estudio subestima la verdadera magnitud del ahorro potencial en los costes atribuibles a las pérdidas de productividad, lo que a su vez mejoraría significativamente el valor de las RCEI sociales.
En conclusión, la implementación de una UMA en un área de salud consigue importantes beneficios clínicos para el paciente (aumenta considerablemente el porcentaje de asmáticos bien controlados y disminuye sensiblemente las exacerbaciones), con un balance de coste-efectividad muy favorable. Las autoridades sanitarias podrían considerar estos resultados a la hora de decidir qué medidas se deben implementar para mejorar el abordaje clínico del asma. En este sentido, la creación de consultas especializadas en asma aparece como una opción muy razonable y beneficiosa tanto desde la perspectiva de eficiencia para el sistema como desde la perspectiva de mejora de resultados en salud para el paciente.
FinanciaciónEste estudio fue financiado por Novartis.
AutoríaTodos los autores participaron en igual medida en la redacción del manuscrito y en la revisión del contenido intelectual, y todos han dado su aprobación a la versión final. LPLL, RV y MM tuvieron pleno acceso a los datos y son responsables de la integridad de los mismos y de la precisión del análisis estadístico.
Concepción del estudio y diseño: LPLL, AH, RV.
Obtención de los datos: LPLL, MCGN, CM.
Análisis e interpretación de los datos: MM, LPLL, RV, AH.
Conflicto de interesesEl Dr Pérez de Llano declara haber recibido pagos en los últimos 3 años por haber realizado asesorías, presentaciones en congresos o simposios de los laboratorios: Novartis, GSK, Astra, Boehringer, Ferrer, TEVA, Mundipharma, Pfizer, Boehringer, Chiesi, Rovi. El resto de autores declara no tener ningún conflicto de intereses.