En los últimos años se han producido grandes avances en el conocimiento de la fisiopatología del Síndrome de Apneas-Hipopneas durante el Sueño (SAHS). Además de las relaciones clásicas con el riesgo cardiovascular o los accidentes de tráfico, se ha relacionado con trastornos metabólicos (aterogénesis o alteraciones del metabolismo hidrocarbonato), entidades neurológicas (ECVo hipertensión intracraneal) o incluso alteraciones oculares (síndrome del párpado caído o glaucoma)1,2.
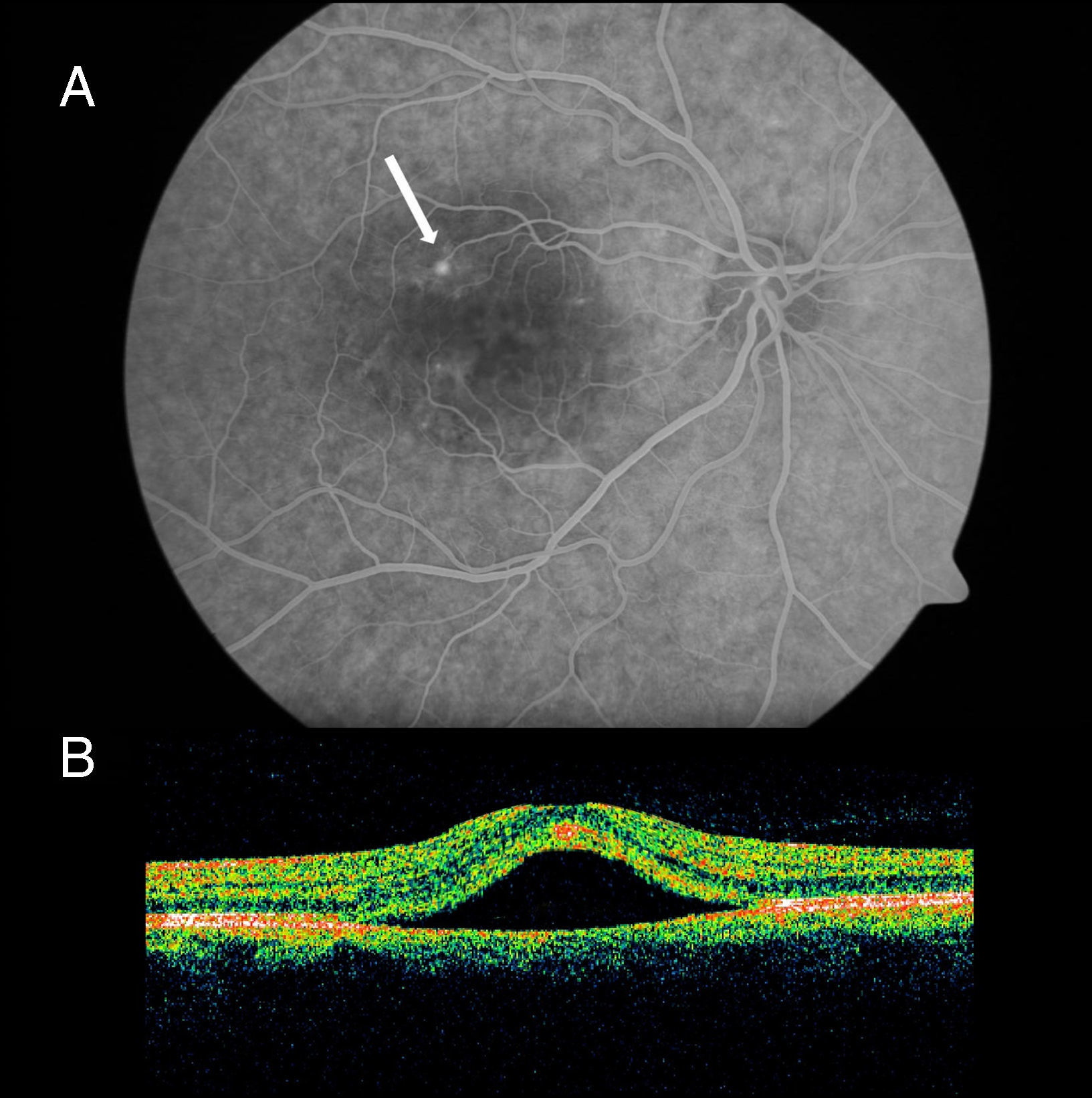
Presentamos un caso de coriorretinopatía central serosa (CCS) en un paciente joven que fue la forma de debut del SAHS, en nuestro conocimiento el primer caso descrito en la literatura española. Varón de 37 años, exfumador, con antecedentes de diverticulitis intervenida quirúrgicamente y migrañas sin aura habituales. Acudió a urgencias por presentar cuadro de pérdida de visión en ojo derecho de 48h de evolución, motivo por el cual fue valorado por oftalmología. La exploración del fondo de ojo derecho reveló un acúmulo de fluido en la zona macular con desprendimiento del neuroepitelio. Se realizó una angiografía fluoresceínica apreciándose una zona hipofluorescente en el área del despegamiento y un punto de fuga hiperfluorescente en la fase tardía (fig. 1A). También se practicó una tomografía de coherencia óptica que mostró el desprendimiento del neuroepitelio con fluido subretiniano (fig. 1B), hallazgos compatibles con el diagnóstico de CCS. Ante historia previa de roncopatía, fue remitido a nuestra unidad de sueño para valoración. En la anamnesis dirigida presentaba cuadro de 3–4 meses de evolución consistente en roncopatía, pausas de apnea referidas, rinorrea acuosa, sequedad bucal matutina y excesiva somnolencia diurna (test de Epworth de 13 puntos). No presentaba alteraciones a la exploración del macizo craneofacial ni hipertrofia amigdalar, con un Mallampati II, un IMC de 28.5kg/m2 y una tensión arterial de 130/85mmHg. El Radio Allergo Sorbent Assay (RAST) fue positivo débilmente a D. pteronyssinus y D. farinae. En la polisomnografía (PSG) existía una alteración arquitectural del sueño, con aumento de sueño superficial, a expensas de eventos respiratorios, en su mayoría obstructivos, con un índice de alteraciones respiratorias (RDI) de 64,2h−1, una saturación de oxígeno (SaO2) media de 94% y un tiempo por debajo de 90% de SaO2 (TC90) de 5,5%. Se inició tratamiento con presión positiva continua en la vía aérea (CPAP) a 7cmH2O y antagonistas de los receptores de leucotrienos, con mejoría de la sintomatología respiratoria y disminución de la somnolencia diurna (Epworth 6 puntos). La evolución oftalmológica fue favorable, recuperando la agudeza visual en 4 semanas y desapareciendo las alteraciones del fondo de ojo.
A) Angiografía fluoresceínica donde se aprecia una zona hipofluorescente coincidente con la zona del despegamiento y un punto de fuga hiperfluorescente (flecha blanca) en la fase tardía de llenado arteriovenoso. B) Tomografía de coherencia óptica que demuestra un desprendimiento de la retina neurosensorial con fluido subretiniano.
Dentro de las alteraciones oftalmológicas del SAHS, se ha descrito excepcionalmente la CCS3–5. En esta entidad, se produce una alteración corioretiniana consistente en un desprendimiento seroso de la retina neurosensorial en la región macular, permitiendo el paso de líquido desde la coroides y su depósito en el espacio subretiniano. Suele ocurrir en varones jóvenes y de mediana edad, presentándose clínicamente con alteraciones en la agudeza visual y metamorfopsias3–5. En su etiopatogenia existen 2 teorías: la reversión de la polaridad del epitelio pigmentario de la retina y el aumento de la permeabilidad vascular de la circulación coroidal5. Los factores de riesgo para su aparición incluyen: personalidad tipo A, embarazo, síndrome de Cushing, tratamiento con corticoesteroides o simpaticomiméticos4. Esta entidad se relaciona con un aumento en los niveles de catecolaminas3, habiéndose señalado dicho hallazgo como el posible nexo de unión con el SAHS.
En los pacientes con SAHS la tensión arterial durante la noche suele seguir un patrón Non-Dipper, debido a que los episodios repetidos de obstrucción de la vía aérea superior provocan una liberación de catecolaminas, cuyos niveles son detectables tanto en suero como en orina, incrementando la actividad simpática, con una clara relación dosis respuesta1,6.
Teniendo en cuenta todo lo expuesto anteriormente, parece lógico pensar que el aumento de los niveles de catecolaminas que se producen en los pacientes afectos de SAHS favorecería, en los sujetos predispuestos, a la aparición de CCS. Este sería el caso de nuestro paciente, en el que no concurrían factores de riesgo ni toma de medicación potencialmente responsable de la CCS. Además, la tensión arterial límite que presentaba sería un marcador de la activación simpática, cuyo efecto estaría implicado en la génesis de la CCS.
En trabajos previos, Leveque et al3 encontraron un mayor riesgo de padecer SAHS entre los pacientes afectos de CCS, (OR de 3.67). Kloos et al4 hallaron una prevalencia de SAHS del 22% entre 36 pacientes con CCS. Además, recientemente se ha descrito un caso en el que el tratamiento mediante CPAP resolvió la CCS, y no la terapia oftalmológica, apoyando la teoría que relaciona ambas entidades5.
Las alteraciones oculares en el SAHS se han revisado recientemente2, aunque es difícil separar los hallazgos asociados a trastornos como la diabetes o la HTA de la contribución propia del SAHS, por lo que este campo se encuentra en plena investigación.
Ante estos hallazgos, podríamos concluir que la activación simpática que se produce en los pacientes con SAHS puede actuar, en sujetos con predisposición, como un factor desencadenante de CCS. Es por ello que, los pacientes con CCS tendrían mayor riesgo de SAHS que la población general y, por tanto, debería valorarse su remisión desde las consultas de oftalmología a las unidades de sueño para su cribado.