La enfermedad pulmonar obstructiva crónica (EPOC) y el cáncer de pulmón (CP) son enfermedades prevalentes y representan causas principales de morbimortalidad a nivel global. Existe firme evidencia que demuestra que la EPOC es un factor de riesgo independiente de CP. La inflamación crónica juega un rol patogénico significativo en el desarrollo de las comorbilidades en la EPOC, y en particular en el CP. Diferentes mediadores inflamatorios celulares y moleculares promueven la tumorigénesis e inhiben la capacidad del sistema inmunitario de reconocer y eliminar células premalignas y malignas, proceso conocido como inmunovigilancia tumoral. Esta alteración de la inmunidad antitumoral se debe en parte a la expansión de las células mieloides supresoras (myeloid derived suppressor cells [MDSC]), que se caracterizan por suprimir la función efectora antitumoral de linfocitosT mediante la reducción de la expresión del T-cell receptor ζ (TCRζ) a través del catabolismo de la L-arginina. Los pacientes con EPOC y CP comparten un patrón similar de aumento y activación de las MDSC circulantes asociado a la reducción de la expresión del TCRζ y a la alteración de la función de los linfocitosT periféricos. Los objetivos de este artículo son revisar la evidencia sobre la asociación entre EPOC y CP, y analizar cómo la acumulación de MDSC podría alterar la inmunovigilancia tumoral en la EPOC y favorecer el desarrollo de CP.
Chronic obstructive pulmonary disease (COPD) and lung cancer (LC) are prevalent diseases and are a leading cause of morbidity and mortality worldwide. There is strong evidence to show that COPD is an independent risk factor for LC. Chronic inflammation plays a significant pathogenic role in COPD comorbidities, particularly in LC. On the one hand, cellular and molecular inflammatory mediators promote carcinogenesis and, on the other, chronic inflammation impairs the capacity of the immune system to identify and destroy pre-malignant and malignant cells, a process known as tumor immune surveillance. This altered antitumor immunity is due in part to the expansion of myeloid-derived suppressor cells (MDSC), which are characterized by an ability to suppress the antitumor activity of T-cells by down-regulation of the T-cell receptor ζ chain (TCRζ) through the catabolism of L-arginine. COPD and LC patients share a common pattern of expansion and activation of circulating MDSC associated with TCRζ downregulation and impaired peripheral T-cell function. The objectives of this study were to review the evidence on the association between COPD and LC and to analyze how MDSC accumulation may alter tumor immune surveillance in COPD, and therefore, promote LC development.
La enfermedad pulmonar obstructiva crónica (EPOC) y el cáncer de pulmón (CP) son enfermedades prevalentes y representan causas principales de morbimortalidad a nivel global1. La EPOC afecta aproximadamente a un 10% de la población mundial adulta2, con similar prevalencia en España3, y se prevé que se constituirá en la tercera causa de muerte y discapacidad en 20204. El CP es la primera causa de mortalidad por cáncer tanto en mujeres como en hombres5,6. La supervivencia a los 5años es pobre y varía entre un 6-14% en hombres y un 7-18% en mujeres7.
La EPOC se caracteriza por una obstrucción al flujo aéreo asociada a una respuesta inflamatoria crónica de las vías aéreas y del parénquima pulmonar secundaria a la inhalación de gases y partículas nocivas, principalmente el humo del tabaco. Las comorbilidades y las exacerbaciones contribuyen a la gravedad de la enfermedad8,9.
Las manifestaciones sistémicas y las comorbilidades influyen críticamente en la presentación clínica, en la evolución y en el pronóstico de la enfermedad, independientemente del grado de obstrucción al flujo aéreo10,11.
En los últimos años se ha evidenciado el rol patogénico de la inflamación crónica en el desarrollo de las comorbilidades en la EPOC, y en particular en el desarrollo del CP, una de las patologías más relevantes que puede desarrollarse y causa de muerte frecuente en estos pacientes12-14. La inflamación crónica juega un papel prominente en el proceso de desarrollo tumoral mediante una amplia variedad de mecanismos que, por un lado, promueven la tumorigénesis y, por otro, inhiben la capacidad del sistema inmunitario de reconocer y eliminar células premalignas y malignas, proceso conocido como inmunovigilancia tumoral15-17. La profunda alteración de la mielopoiesis, la expansión de células mieloides supresoras, llamadas «myeloid derived suppressor cells» (MDSC, por sus siglas en inglés), y su efecto supresor sobre los principales efectores antitumorales, los linfocitosT y natural killer cells (NK), son fenómenos asociados a cáncer como mecanismo de evasión de la inmunidad antitumoral, y también a procesos inflamatorios crónicos de naturaleza no neoplásica, como enfermedades infecciosas, inflamatorias y patología por desregulación inmune16,18,19. Nuestro grupo y otros han demostrado que los pacientes con EPOC presentan también expansión y activación de las MDSC circulantes asociado a disfunción de linfocitosT20,21. Partiendo de estas observaciones, la pregunta que surge es: ¿existe una alteración de la inmunovigilancia tumoral en los pacientes con EPOC como consecuencia de la expansión de las MDSC que explique, en parte, la alta incidencia de CP? Los objetivos de este artículo son revisar los estudios que verifican la asociación entre EPOC y CP, y analizar cómo el aumento de MDSC podría alterar la inmunovigilancia tumoral en la EPOC.
La enfermedad pulmonar obstructiva crónica como factor de riesgo de cáncer de pulmónSi bien el humo de tabaco es el principal factor de riesgo para el CP y EPOC, no todos los fumadores desarrollan estas enfermedades y, significativamente, los pacientes que desarrollan EPOC muestran mayor riesgo de presentar CP, independientemente de la intensidad de la exposición al humo de tabaco, de la edad y del sexo22. Estudios de distinta metodología han confirmado la asociación entre EPOC y CP (tabla 1). En estudios transversales se ha reportado una prevalencia de EPOC en los casos diagnosticados de CP de aproximadamente entre el 40 al 70%23-25. El estudio de Young et al.25 ha evidenciado que alrededor de un 50% de los pacientes con CP tienen EPOC como enfermedad coexistente en comparación con la prevalencia de EPOC del 8% en los controles fumadores, lo cual sugiere que un desproporcionado número de casos de CP ocurre en fumadores con EPOC preexistente. Estudios prospectivos longitudinales confirmaron también la alta incidencia de CP en pacientes con EPOC. En el metaanálisis de Wasswa-Kintu et al.26 se incluyeron estudios poblacionales, prospectivos, de gran número de participantes (>5.000) y ajustados por factores de confusión (edad, raza, intensidad de exposición al humo de cigarrillo)27-30. En total, el análisis incluyó 204.990 participantes, de los cuales 6.185 desarrollaron o murieron por CP en un período de seguimiento de entre 9 a 18años. Los participantes con mayor deterioro de la función pulmonar tuvieron mayor riesgo de desarrollar CP, aunque también aquellos con función pulmonar más preservada (FEV1 pred. del 80-100%) presentaron alto riesgo de presentar CP. Esta relación fue más notable incluso en mujeres que en hombres26. En un estudio más pequeño, no poblacional, de De Torres et al.31 reportaron que la incidencia de CP fue mayor en pacientes con obstrucción leve-moderada de la función pulmonar basal. En el estudio de Skillrud et al.32 la tasa acumulada en 10años de desarrollo de CP fue del 8% en los casos (sujetos con FEV1≤70%) versus el 2% en los controles. La asociación entre bronquitis crónica y enfisema y mortalidad por CP fue también confirmada en una gran cohorte poblacional de sujetos no fumadores33.
Características de los principales estudios sobre asociación entre enfermedad pulmonar obstructiva crónica (EPOC) y cáncer de pulmón (CP)
| Autor | Año | Tamaño muestral | Diseño | Tiempo de seguimiento (años) | Outcome |
|---|---|---|---|---|---|
| Congleton y Muers23 | 1995 | 57 pacientes con CP | Transversal | – | Prevalencia de EPOC: 49% |
| Loganathan et al.24 | 2006 | 294 pacientes con CP | Transversal | – | Prevalencia de EPOC:Hombres: 72,8%Mujeres: 52,5%OR: 0,41 (IC95%, 0,25-0,67; p=0,0003) |
| Young et al.25 | 2009 | 301 pacientes con CP301 controles apareados | Transversal | – | Prevalencia de EPOC en pacientes con CP: 50%Prevalencia de EPOC en controles apareados sin CP: 8%p≤0,001 |
| Skillrud et al.32 | 1986 | 226 | Longitudinal | 10 | Incidencia acumulada a 10 años: 8,8% (casos) vs 2% (controles) |
| Van den Eeden y Friedman28 | 1992 | 171.311 | Longitudinal | 9 | Incidencia quintil 1: FEV1 pred≤66%RR Hombres: 1,86 (IC95%, 1,73-2,64)RR Mujeres: 1,95 (IC95%, 0,32-11,70) |
| Hole et al.29 | 1996 | 15.411 | Longitudinal | 15 | Mortalidad quintil 1: FEV1 pred≤73%RR Hombres: 2,53 (IC95%, 1,68-3,82)RR Mujeres: 4,39 (IC95%, 1,86-10,38) |
| Mannino et al.30 | 2003 | 5.402 | Longitudinal | 18 | Incidencia-mortalidad: RR: 2,8 (IC95%, 1,8-4,4) |
| Turner et al.33 | 2007 | 448.600 no fumadores | Longitudinal | 20 | Mortalidad: HR: 2,44 (IC95%, 1,22-4,90) |
| De Torres et al.34 | 2007 | 1.166 | Longitudinal | 5 | Incidencia: RR pacientes con enfisema: 3,33 (IC95%,1,41-7,85)RR pacientes con enfisema sin obstrucción vía aérea: 4,33 (IC95%, 1,04-18,16) |
| Wilson et al.35 | 2008 | 3.638 | Longitudinal | 3,7 | Incidencia: RR pacientes con enfisema: 3,56 (IC95%, 2,21-5,73)RR pacientes con enfisema sin obstrucción vía aérea: 3,14 (IC95%, 1,91-5,15) |
Otros investigadores exploraron en 2 estudios longitudinales la relación entre ambos componentes de la EPOC —obstrucción de la vía aérea y enfisema pulmonar— de forma independiente con el riesgo de CP. Sus resultados demuestran que incluso en ausencia de obstrucción al flujo aéreo, la presencia de enfisema incrementa sustancialmente el riesgo de CP, confirmando una relación independiente entre ambos34,35. Zurawska et al.36 revisaron estos estudios y otros 4 de distinto diseño (casos y controles). El riesgo relativo (RR) para CP de acuerdo con la presencia de «cualquier grado de enfisema» reportado por radiólogos (análisis semicuantitativo) fue del 1,9 al 4,9, con un RR total de 2,34 (IC95%, 1,46-3,76). Con el objetivo de explorar la relación entre marcadores de inflamación sistémica y las comorbilidades de la EPOC, el estudio de una cohorte prospectiva de base poblacional demostró que la elevación simultánea de la proteína C-reactiva (PCR), fibrinógeno y leucocitos se asoció a un riesgo aumentado de comorbilidades, incluyendo CP, de entre 2 a 4 veces37. Toda esta evidencia sugiere que la inflamación crónica desempeña un rol relevante como vínculo patogénico entre la EPOC y el CP12,13.
Inmunoedición e inmunovigilancia tumoralLa idea de que el sistema inmunitario tiene la capacidad de eliminar células tumorales fue propuesta hace más de 100 años por Paul Erlich38. Posteriormente, debido al mayor conocimiento del sistema inmunitario y a la demostración de la existencia de antígenos tumorales39, resurgió el concepto del control inmunitario del cáncer. Burnet y Thomas introdujeron la hipótesis de la inmunovigilancia tumoral, concepto que sostiene que la inmunidad previene el desarrollo de cáncer en un huésped inmunocompetente, actuando como un supresor extrínseco del tumor15,17,40-43. Las células premalignas y malignas expresan antígenos específicos (moléculas antigénicas específicas del tumor) o antígenos asociados al tumor (moléculas expresadas de forma diferente por células tumorales y células normales). Estos antígenos tumorales pueden ser reconocidos y procesados por células presentadoras de antígenos (CPA) y presentados a linfocitosT que eliminan estas células malignas44,45.
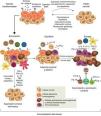
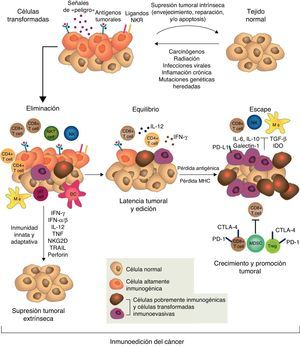
Sin embargo, a pesar de la inmunovigilancia tumoral, algunas células tumorales pueden escapar a la respuesta inmunitaria y desarrollar tumores que coexisten con un sistema inmunitario activo que incluso, y paradójicamente, puede favorecer su crecimiento y modular su inmunogenicidad («editar el tumor»)43,46,47. La noción de que el sistema inmunitario puede por un lado proteger al huésped del desarrollo de cáncer, pero por otro también determinar su inmunogenicidad y hasta promover su crecimiento, es la base de una hipótesis más compleja e integradora de la intrincada relación entre cáncer e inmunidad: la inmunoedición del cáncer. Este nuevo concepto incluye 3 fases secuenciales: eliminación, equilibrio y escape43,47 (fig. 1).
El concepto de inmunoedición del cáncer engloba la relación entre el sistema inmunitario y las células transformadas y malignas incluyendo 3 fases: eliminación o inmunovigilancia tumoral, equilibrio y escape. Para mayor explicación, ver texto.
Figura reproducida de: Schreiber et al.43, con la autorización de AAAS.
En la fase de eliminación, previamente descrita como inmunovigilancia tumoral, el sistema inmunitario innato y el adaptativo detectan y destruyen células transformadas mucho antes de que el tumor sea clínicamente evidente. Mediadores que actúan como «señales de peligro», como interferón tipo1 (TypeIINFs) son inducidos precozmente por las células tumorales. Estas citoquinas activan las CPA y promueven la acción de linfocitos T CD4+ helper y CD8+ citotóxicos, que son los principales efectores de la inmunidad adaptativa antitumoral43. Las moléculas de stress celular expresadas en la superficie de las células tumorales enlazan receptores de activación de células de la inmunidad innata, como macrófagos y células NK, que liberan moléculas citolíticas43.
Si la eliminación de las células transformadas es completa, el huésped permanece libre de tumor, pero si es incompleta, las células tumorales no destruidas inician una fase de equilibrio, en la cual el sistema inmunitario adaptativo previene el crecimiento tumoral manteniendo a las células tumorales residuales en estado de latencia, pudiendo residir en el huésped por décadas sin causar enfermedad. En esta etapa, como consecuencia de la presión selectiva constante de la inmunidad adaptativa sobre células genéticamente inestables, emergen variantes celulares «editadas» que son: a)menos inmunogénicas y, por lo tanto, menos sensibles a los detectores y efectores inmunes, y b)inducen un estado local y sistémico de inmunosupresión antitumoral a través de una gran variedad de mecanismos asociados al proceso inflamatorio crónico causado por el mismo cáncer y conocidos como mecanismos de escape tumoral. En la fase de escape, la proliferación, la progresión y la diseminación del tumor no pueden ser bloqueadas por el sistema inmunitario y el cáncer se transforma en enfermedad clínicamente evidente15,43,47. Las estrategias que emplean los tumores para establecer un ambiente de inmunoprivilegio local y sistémico son variadas y complejas. Entre otras se incluyen la alteración de los mecanismos de presentación de antígenos tumorales, la elaboración de factores inmunosupresores como el transforming growth factorβ (TGF-β) y el ligando FAS soluble, expansión de linfocitosT reguladores (Treg), defectos de la señalización proximal del receptor del linfocito T (TCR) por disminución de la expresión de la subunidad zeta (TCRζ) y una profunda alteración de la mielopoyesis que se traduce en defectos de las células presentadoras de antígenos (CPA), principalmente las células dendríticas, y acumulación de las MDSC18,48,49.
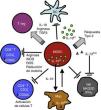
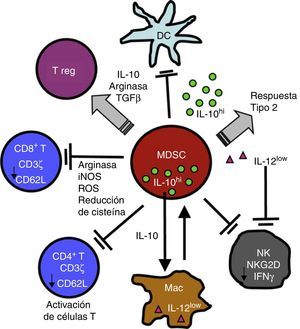
Inflamación crónica e inmunosupresión: rol de las myeloid derived suppressor cellsDiversos procesos de etiología no tumoral, como enfermedades infecciosas, inflamatorias y autoinmunitarias, presentan, de forma similar al cáncer, un patrón de inflamación crónica asociada a inmunosupresión, fenómeno mediado en parte por las MDSC18,50. La participación de las MDSC en enfermedades respiratorias como asma, neumonía y fibrosis quística ha sido reportada recientemente51-54. Las MDSC constituyen una población morfológicamente heterogénea de células producidas en la médula ósea en diferentes estadios de diferenciación y maduración, caracterizadas por la capacidad de suprimir la función de diferentes componentes del sistema inmunitario innato y adaptativo como células NK, linfocitosT CD4+, CD8+, células dendríticas y macrófagos18, inicialmente descritas 40años atrás como «supresores naturales» en modelos animales de tumores en los que se asociaba a la disfunción de linfocitos citotóxicos55. Citoquinas y factores solubles como GM-CSF, G-CSF, M-CSF, SCF, INF-γ, IL-1β, VEGF e IL-3 se liberan en la patología inflamatoria y tumoral mencionada previamente y condicionan la mielopoyesis aumentando la proliferación de precursores mieloides y bloqueando parcialmente su diferenciación. Este fenómeno resulta en la acumulación de MDSC, que luego migran a órganos linfoides secundarios y tejidos, donde ejercen su función supresora. Las MDSC utilizan una variedad de mecanismos para modular la respuesta inmunitaria, entre ellos, mediante la reducción de un nutriente crítico para la función de los linfocitosT, el aminoácido L-arginina. Las MDSC liberan al microambiente tisular y a la circulación la enzima arginasai (ARGI), que degrada la L-arginina. La disminución de este aminoácido causa reducción de la expresión de TCRζ, inhibiendo la proliferación y la producción de citoquinas efectoras56-58 (fig. 2).
Las MDSC suprimen la función de células de la inmunidad innata y adaptativa mediante una variedad de mecanismos, entre ellos la liberación de ARGI y la reducción del TCRζ en linfocitos T CD4, CD8 y NK. Para mayor explicación, ver texto.
Figura reproducida de: Ostrand-Rosenberg et al.16, Copyright 2009. The American Association of Immunologists, Inc.
El TCR es una compleja molécula de membrana del linfocitoT que juega un rol clave en el proceso de reconocimiento antigénico, transducción de la señal intracelular, transcripción y expresión de moléculas efectoras en el contexto de la presentación antigénica por una CPA59. La disminución de su expresión condiciona la normal función del linfocitoT al bloquear la transducción de la señal desde el TCR a los factores de transcripción y expresión génica, que se expresa en menor proliferación linfocitaria y disminución de la producción de moléculas efectoras. Diferentes condiciones inflamatorias crónicas, como cáncer, enfermedades infecciosas crónicas como VIH, tuberculosis activa, lepra, y autoinmunes como lupus eritematoso sistémico y artritis reumatoide, se caracterizan por una reducción de la expresión específica del TCRζ asociada a una función defectuosa de las célulasT50. Recientemente se ha reportado el mismo fenómeno en linfocitosT CD8+ pulmonares en sujetos con EPOC60. Tanto estudios in vitro como in vivo en modelos animales de inflamación crónica han demostrado que las MDSC modulan la función de los linfocitosT reduciendo la expresión del TCRζ y resultando en inmunosupresión60-64. La expansión y activación de las MDSC, al igual que la reducción de la expresión del TCRζ, caracterizan patologías de diferente etiología no tumoral cuyo común denominador es la estimulación crónica del sistema inmunitario. Esta observación ha llevado a la interpretación de que ambos son mecanismos de protección del huésped para atenuar los potenciales daños tisulares resultantes de un sistema inmunitario persistentemente estimulado18,50. Este mecanismo de protección del huésped es manipulado y «secuestrado» por las células tumorales para escapar y evadir la inmunidad47,48,50,55.
Expansión de las myeloid derived suppressor cells en la enfermedad pulmonar obstructiva crónica: potencial alteración de la inmunovigilancia tumoralLa inflamación sistémica asociada a la EPOC se define por la presencia de niveles sanguíneos elevados de diferentes biomarcadores, como leucocitos, PCR, fibrinógeno, interleucina-6 (IL-6), interleucina-8 (IL-8) y factor de necrosis tumoral alfa (TNFα)8,65.
Considerando que las MDSC constituyen un subtipo de células reguladoras en una amplia variedad de enfermedades inflamatorias crónicas no tumorales, nuestro grupo y otros demostraron que las MDSC participan en la patogénesis de la EPOC. Nuestro estudio demostró un aumento de las MDSC circulantes en los pacientes con EPOC asociado al incremento de la enzima ARGI sérica, la reducción de la expresión del TCRζ (fig. 3)20. Kalathil et al.21 describieron la acumulación de MDSC periféricas acompañado del incremento de Treg funcionalmente supresores y disfunción de linfocitosT en pacientes con EPOC. Estas observaciones demuestran un patrón de expansión de las MDSC similar al descrito en otras patologías inflamatorias crónicas de distinta etiología, lo cual apoya el concepto de que las MDSC son células reguladoras naturales de una repuesta inmunitaria persistentemente activada18,50. Estos resultados sugieren que los pacientes con EPOC podrían presentar un medio ambiente de supresión crónica de su inmunidad adaptativa y, como consecuencia, alterar la capacidad del sistema inmunitario de eliminar células premalignas y malignas en fases iniciales del proceso de tumorigéneis, es decir, en la fase de eliminación o inmunovigilancia tumoral16,43,47.
Panel A: box plot de MDSC (expresadas como % de las células mononucleadas). Panel B: media (±SEM) de la expresión del TCRζ en no-fumadores, fumadores con espirometría normal y pacientes con EPOC.
Figura reproducida de: Scrimini et al.20, con la autorización de Elsevier.
Basados en estas observaciones, en un segundo estudio planteamos la hipótesis de que este patrón de expansión de las MDSC asociado a la disminución de la expresión del TCRζ pueda contribuir al aumento de la incidencia de CP reportada en pacientes con EPOC. Para ello comparamos estas mismas variables en los pacientes con EPOC (con y sin CP), pacientes fumadores con función pulmonar normal (con y sin CP), y en no fumadores sin CP. En este estudio confirmamos que el porcentaje de MDSC circulantes y los niveles séricos de ARGI están aumentados y la expresión del TCRζ está reducida en grado similar tanto en pacientes con CP, EPOC, y ambos, CP con EPOC. Estos hallazgos apoyan nuestra hipótesis de trabajo y sugieren que estos mecanismos orquestados por el cáncer para evadir el sistema inmunitario (en fase de escape tumoral) ya están presentes en pacientes con EPOC y podrían alterar la inmunovigilancia tumoral y así contribuir al aumento de la incidencia del CP descrito en estos pacientes66.
ConclusionesLa expansión de las MDSC, asociada a la inflamación crónica en la EPOC, podría jugar un rol patogénico en el proceso tumorigénico mediante la disfunción de linfocitosT y la inhibición de la inmunovigilancia tumoral, contribuyendo al aumento del riesgo de desarrollar CP reportado en estos pacientes.
FinanciaciónDirección General de Investigación y Desarrollo Tecnológico e Innovación de la Consejería de Innovación, Interior y Justicia de la Comunitat Autònoma de les Illes Balears y Fondos FEDER. Grupos competitivos (PRE-R-22528-2011).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.