La información sobre la asociación del cáncer de pulmón (CP) y combinación de fibrosis pulmonar y enfisema (CFPE) es limitada y procedente casi exclusivamente de series asiáticas. El objetivo principal del estudio fue valorar el impacto del CP en la supervivencia en la CFPE y en pacientes diagnosticados de fibrosis pulmonar idiopática (FPI).
MétodosSe realizó un estudio retrospectivo con los datos de pacientes con CFPE y FPI diagnosticados en nuestro centro en un periodo de 5 años.
ResultadosSe incluyó a 66 pacientes, 29 en el grupo de CFPE y 37 pacientes con FPI. Nueve tenían un diagnóstico de CP (6 con CFPE y 3 con FPI); 6 pacientes (67%) recibieron tratamiento paliativo a pesar de que 3 de ellos presentaban estadios i y ii. No hubo diferencias significativas en la mortalidad global de los 2 grupos; sin embargo, en los pacientes con CP la supervivencia fue significativamente menor con respecto a los que no tenían CP (p=0,044). Las causas más frecuentes de muerte fue la insuficiencia respiratoria secundaria a la exacerbación de la fibrosis pulmonar (44%). En el análisis multivariante, la odds ratio de morir en los pacientes con CP respecto a los pacientes sin CP fue de 6,20 (p=0,037, intervalo de confianza [IC] del 95%: 1,11 a 34,48).
ConclusiónEl CP empeora la supervivencia de estas 2 entidades. El manejo diagnóstico y terapéutico del CP se ve dificultado por el mayor riesgo de complicaciones posteriores al tratamiento elegido, incluso tras el tratamiento paliativo.
Information on the association of lung cancer (LC) and combined pulmonary fibrosis and emphysema (CPFE) is limited and derived almost exclusively from series in Asian populations. The main objective of the study was to assess the impact of LC on survival in CPFE patients and in patients with idiopathic pulmonary fibrosis (IPF).
MethodsA retrospective study was performed with data from patients with CFPE and IPF diagnosed in our hospital over a period of 5 years.
ResultsSixty-six patients were included, 29 with CPFE and 37 with IPF. Nine had a diagnosis of LC (6 with CPFE and 3 with IPF). Six patients (67%) received palliative treatment even though 3 of them were diagnosed atstage i-ii. Overall mortality did not differ significantly between groups; however, in patients with LC, survival was significantly lower compared to those without LC (P=.044). The most frequent cause of death was respiratory failure secondary to pulmonary fibrosis exacerbation (44%). In a multivariate analysis, the odds ratio of death among patients with LC compared to patients without LC was 6.20 (P=.037, 95% confidence interval: 1.11 to 34.48).
ConclusionsLung cancer reduces survival in both entities. The diagnostic and therapeutic management of LC is hampered by the increased risk of complications after any treatment modality, even after palliative treatment.
La combinación de fibrosis pulmonar y enfisema (CFPE) es un síndrome caracterizado por la coexistencia de enfisema en lóbulos superiores y fibrosis pulmonar con predominio en lóbulos inferiores, asociado a un perfil funcional peculiar1,2. Los valores espirométricos se encuentran aparentemente poco alterados y contrastan con una grave disminución de la capacidad de difusión alveolar (DLCO), hipoxemia y desaturación al esfuerzo. Dentro de sus complicaciones más relevantes destacan la hipertensión pulmonar (HP)3,4 y el cáncer de pulmón (CP), descrito hasta en un 47% de los casos5, siendo ambas determinantes en la supervivencia de estos pacientes3-6.
La información acerca de la prevalencia, las características y el pronóstico del CP en la CFPE proceden casi su totalidad de series en poblaciones asiáticas5,7-17. Recientemente, Girard et al.18 han descrito por primera vez las características del CP en la CFPE en un estudio retrospectivo en una cohorte europea realizado en Francia. En dicho estudio, el mal pronóstico fue atribuido principalmente a la limitación terapéutica con la que se maneja a estos pacientes, condicionado por su pobre reserva funcional respiratoria y mayor riesgo de complicaciones tras la cirugía o tratamiento oncológico.
Debido a que no existen estudios en nuestro medio que exploren la relación entre el CP y la CFPE, nuestro objetivo fue analizar la influencia del CP en la supervivencia de una serie de pacientes con CFPE. Los datos clínicos, funcionales y radiológicos se compararon con una serie de pacientes con fibrosis pulmonar idiopática (FPI), puesto que es conocido que esta enfermedad también presenta un mayor riesgo de desarrollar CP comparado con la población general19-21. Como objetivos secundarios, nos planteamos describir la prevalencia y las características del CP en ambos grupos.
MétodosSe trata de un estudio observacional, de cohortes y retrospectivo, que incluyó 2 grupos de pacientes: 1) pacientes con diagnóstico de CFPE, y 2) pacientes diagnosticados de FPI en un período comprendido entre diciembre del 2009 y diciembre del 2014. Los pacientes fueron atendidos en la consulta monográfica de enfermedad pulmonar intersticial difusa (EPID) de un hospital universitario de tercer nivel.
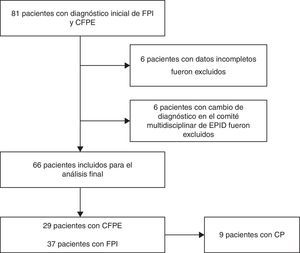
Para incluir a los pacientes con diagnóstico de CFPE se utilizaron los siguientes criterios descritos por Cottin et al.1 y Brillet et al.2: a) presencia en la tomografía axial computarizada de alta resolución (TCAR), de áreas de enfisema, bien delimitadas, definidas por la disminución de la atenuación en comparación con el parénquima pulmonar normal contiguo y delimitada por una pared muy delgada (< 1mm) o ninguna pared, y/o múltiples bullas (> 1cm) con predominio en lóbulos superiores; las lesiones enfisematosas deben ser descritas como porcentaje de pulmón afectado, que tiene que ser más de 10%,y b) presencia de EPID con características significativas de fibrosis pulmonar, que se define como opacidades pulmonares reticulares con predominio periférico y basal, panal de abeja, distorsión de la arquitectura pulmonar y/retracción, bronquiectasias o bronquiolectasias. Las opacidades y/o las áreas de consolidación alveolar en vidrio deslustrado focales podrían estar asociadas a este patrón, pero no deben ser prominentes. El diagnóstico de FPI se realizó sobre la base de la normativa sobre el diagnóstico y tratamiento de la FPI de la SEPAR22, el cual establece que el diagnóstico definitivo de FPI requiere: a) la exclusión de otras entidades clínicas definidas o enfermedades parenquimatosas pulmonares difusas de causa conocida (exposición ambiental u ocupacional, enfermedades del tejido conectivo, toxicidad por fármacos), y b) la presencia de un patrón histológico de neumonía intersticial usual (NIU) en el examen del tejido pulmonar obtenido mediante biopsia pulmonar quirúrgica, o bien la evidencia radiológica de patrón NIU en la TCAR, o ambas. Los casos que planteaban dudas diagnósticas fueron revisados en el comité multidisciplinar de EPID de nuestro hospital (fig. 1).
En los pacientes con sospecha clínica o radiológica de HP, se recogieron los datos de la ecocardiografía. Para evaluar la posibilidad del diagnóstico de HP se utilizaron los criterios arbitrarios propuestos por Galiè et al.23. En los pacientes con diagnóstico de CP se recogieron los síntomas iniciales, los hallazgos de la fibrobroncoscopia (FBC), el estadio, la histología, el tratamiento y la supervivencia en meses desde el diagnóstico. En todos los pacientes se realizó la estadificación inicial según la séptima clasificación TNM24 y la anatomopatológica de acuerdo con la clasificación de la World Health Organization25.
La exacerbación aguda de la fibrosis pulmonar se definió por un deterioro respiratorio sin causa identificable, siguiendo los criterios propuestos por Collard et al.26.
Para el análisis de la mortalidad se registraron: a) fecha de diagnóstico de CFPE y de FPI b) fecha de diagnóstico de CP, y c) fecha de fallecimiento. Esta última se confirmó mediante la historia clínica digitalizada y/o del registro de mortalidad del hospital. Las pruebas de función pulmonar y la prueba de la marcha de 6 min (PM6M) fueron realizadas de acuerdo con las recomendaciones internacionales27-30. El composite physiologic index (CPI) fue calculado por la siguiente fórmula: 91 – (0,65×porcentaje de DLCO predicho) – (0,53×porcentaje de la capacidad vital forzada [FVC] predicho)+(0,34× porcentaje del volumen espiratorio en el primer segundo [FEV1] predicho)31.
Análisis estadísticoSe utilizó el paquete estadístico Stata, versión 13 (StataCorp LP, College Station, EE. UU.). Todos los datos se tabularon como media y desviación estándar en el caso de variables cuantitativas y como números absolutos y porcentajes en el caso de las variables cualitativas. Las curvas de supervivencia de los grupos se construyeron de acuerdo con el método de Kaplan-Meier y se compararon mediante log-rank test.
ResultadosSe incluyó a un total de 66 pacientes, 29 en el grupo de CFPE y 37 pacientes con FPI. La mediana del tiempo de seguimiento fue de 24,3 meses (rango intecuartílico 11,4-42,5). Todos los pacientes con CFPE eran hombres y tenían un acumulado de paquetes/año significativamente mayor que los pacientes con FPI (p<0,001). Los pacientes con CFPE presentaron un valor significativamente mayor de los siguientes parámetros funcionales (expresado en porcentaje de su valor predicho): FVC, cociente volumen espiratorio forzado en el primer segundo y FVC (FEV1/FVC), capacidad pulmonar total (TLC) y volumen residual. También se observó una menor DLCO y una menor relación del cociente DLCO/volumen alveolar con respecto a los pacientes con FPI (p<0,05). La HP estimada por ecocardiografía fue más frecuente en los pacientes con CFPE (45% vs. 22% en el grupo con FPI). Estos pacientes presentaban una mayor presión arterial sistólica, así como una mayor velocidad de regurgitación tricúspide con respecto a los pacientes con FPI (p=0,047 y 0,023, respectivamente). Estos datos se resumen en la tabla 1.
Características demográficas y funcionales de los pacientes
| CFPE (n=29) | FPI (n=37) | p | |
|---|---|---|---|
| Edad | 71±7 | 72±10 | NS |
| Sexo (H/M) | 29/0 | 26/11 | |
| Fumador activo | 4 | 2 | |
| Exfumador | 25 | 15 | |
| Nunca fumador | 0 | 20 | |
| Paquetes/año | 57±26 | 19±31 | < 0,001 |
| FVC (% pred) | 71±12 | 62±15 | 0,01 |
| FEV1 (%) | 69±14 | 72±19 | NS |
| FEV1/FVC | 73±9 | 83±10 | < 0,001 |
| TLC (%) | 90±24 | 70±15 | < 0,001 |
| RV (%) | 117±49 | 79±31 | 0,002 |
| RV/TLC | 118±34 | 94±38 | 0,052 |
| DLCO (% pred) | 44±11 | 55±11 | 0,012 |
| DLCO/VA(% pred) | 68±18 | 86±19 | 0,002 |
| CPI | 45±12 | 46±11 | NS |
| PM6M (m) | 369±150 | 421±113 | 0,006 |
| SatO2inicial (%) | 95±2 | 96±2 | NS |
| SatO2final (%) | 88±4 | 86±7 | NS |
| HPa (n) | 13 | 8 | NS |
| PAS (mmHg) | 50±19 | 38±17 | 0,047 |
| Velocidad RT (m. s−1) | 3,1±0,77 | 2,4±0,74 | 0,023 |
CFPE: combinación de fibrosis pulmonar y enfisema; CPI: composite physiologic index; DLCO: capacidad de difusión del monóxido de carbono; FEV1: volumen espiratorio forzado en el primer segundo; FEV1/FVC: cociente volumen espiratorio forzado en el primer segundo y capacidad vital forzada expresada como porcentaje absoluto; FPI: fibrosis pulmonar idiopática; FVC: capacidad vital forzada; HP: hipertensión pulmonar; PAS: presión arterial sistólica; PM6M: prueba de 6 min de la marcha; RT: regurgitación tricúspide; RV: volumen residual; RV/TLC: cociente volumen residual y capacidad pulmonar total; SatO2final: saturación arterial de oxígeno al final de la PM6M; SatO2inicial: saturación arterial de oxígeno al inicio de la PM6M; TLC: capacidad pulmonar total; VA: volumen alveolar; % pred: porcentaje del valor predicho.
Los datos se presentan como media±DE.
El diagnóstico de CFPE y de FPI fue previo al de CP en todos los pacientes con una media de 9,8 meses. Nueve pacientes tenían un diagnóstico de CP (13,6%). Seis de ellos (66,6%) tenían CFPE. En este grupo, todos eran hombres y con antecedentes de tabaquismo. La prevalencia de CP en esta serie fue del 20% en los pacientes con CFPE y de 8% en los pacientes con FPI.
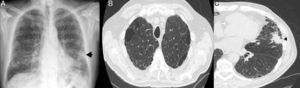
La sospecha inicial de CP en casi todos los pacientes fue radiológica mediante la TCAR de seguimiento (67%). Tres pacientes manifestaron incremento de su tos habitual y presentaron el diagnóstico de infección bronquial aguda (33%). El tumor fue visible en 5 de los 9 pacientes (55%) en la radiografía de tórax. En 2 casos (22%) la lesión tumoral se encontraba adyacente a áreas de fibrosis pulmonar (fig. 2). La mayoría de los tumores se encontraba en los lóbulos superiores y en 5 de ellos estaban en las áreas de enfisema (56%). La estrategia diagnóstica más empleada fue la FBC, seguida de la ultrasonografía endobronquial con punción transbronquial aspirativa en tiempo real (USEB-PTBA) y la biopsia con aguja gruesa guiada por tomografía axial computarizada (BAG-TAC). Sin embargo, en 3 pacientes no se pudo llegar al diagnóstico anatomopatológico (33%). El subtipo histopatológico más frecuente fue el adenocarcinoma; 6 pacientes tenían estadios localizados (i-ii) en el momento del diagnóstico (67%). Solo 2 pacientes recibieron tratamiento quirúrgico, uno de ellos falleció a los 17 días del período postoperatorio (bilobectomía) y en el otro se realizó lobectomía y, posteriormente, quimioterapia adyuvante, con una supervivencia de 39 meses hasta la actualidad. La modalidad de tratamiento más utilizada fue el manejo paliativo. Las complicaciones observadas con mayor frecuencia fueron las agudizaciones de la fibrosis pulmonar en 4 pacientes (44%) (tabla 2).
Paciente con CFPE y CP. A) Radiografía de tórax (proyección postero-anterior): Se observa una opacidad pulmonar focal nodular mal definida (flecha) en la base del pulmón izquierdo, así como una afectación intersticial reticular en ambas bases pulmonares. B) TCAR torácica que muestra la presencia de enfisema en los lóbulos superiores. C) La TCAR torácica confirma la presencia de una masa pulmonar de bordes lobulados y espiculados (cabeza de flecha) en la língula, adyacente a un área de panalización.
CFPE: combinación de fibrosis pulmonar y enfisema; CP: cáncer de pulmón; TCAR: tomografía axial computarizada de alta resolución.
Características, tratamiento y evolución de los pacientes con cáncer de pulmón
| N.° | Diagnóstico | Edad | Género (H/M) | Tabaquismo (sí/no) | Manifestación inicial | Técnica diagnóstica/estadificación | Anatomía patológica | Localización de la neoplasia | Estadio | Tratamiento | Complicaciones | Causa de muerte |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | CFPE | 65 | H | Sí | Hallazgo radiológico | FBC/USEB-PTBA | Adenocarcinoma | LII (adyacente a panal) | IB | RDT | Exacerbación de la fibrosis pulmonar | AVC hemorrágico por MT cerebral |
| 2 | CFPE | 64 | H | Sí | IBA | FBC/USEB-PTBA | Carcinoma escamoso | LID (zona no afectada) | IIB | IQ | Fístula broncoarterial | Hemoptisis |
| 3 | CFPE | 68 | H | Sí | Hallazgo radiológico | Mediastinoscopia | Adenocarcinoma | LSD (adyacente a enfisema) | IIA | IQ+QT | Neumotórax | NA |
| 4 | CFPE | 68 | H | Sí | Hallazgo radiológico | BAG-TAC | No concluyente | LSI (língula) (adyacente a panal) | IA | RDT/paliativo | Exacerbación de la fibrosis pulmonar | Insuficiencia respiratoria |
| 5 | CFPE | 76 | H | Sí | IBA | BAG-TAC | Adenocarcinoma | LSI (adyacente a enfisema) | IV | QT | Exacerbación de la fibrosis pulmonar | Insuficiencia respiratoria |
| 6 | CFPE | 74 | H | Sí | Hallazgo radiológico | FBC/USEB-PTBA PET-TC | No concluyente | Lesión hiliar izquierda que infiltra arteria pulmonar | IIIA | Paliativo | TEP | Sepsis de origen respiratorio |
| 7 | FPI | 73 | M | No | Hallazgo radiológico | FBC | No concluyente | LSD (zona no afectada) | IA | Paliativo | Exacerbación de la fibrosis pulmonar | Insuficiencia respiratoria |
| 8 | FPI | 68 | H | Sí | Hallazgo radiológico | BAG-TAC | Adenocarcinoma | LSI (adyacente a enfisema) | IV | Paliativo | TEP | Insuficiencia respiratoria |
| 9 | FPI | 89 | H | Sí | IBA | FBC | Células atípicas indicativas de malignidad | LSD (adyacente a enfisema) | IA | Paliativo | Neumonía | Fallo multiorgánico |
AVC: accidente cerebrovascular; BAG-TAC: biopsia con aguja gruesa guiada por tomografía axial computarizada; CPFE: combinación de fibrosis pulmonar y enfisema; FBC: fibrobroncoscopia; FPI: fibrosis pulmonar idiopática; H/M: hombre/mujer; IBA: infección bronquial aguda; IQ: tratamiento quirúrgico; LID: lóbulo inferior derecho; LII: lóbulo inferior izquierdo; LSD: lóbulo superior derecho; LSI: lóbulo superior izquierdo; Mt: metástasis; NA: no aplicable; PET-TC: tomografía por emisión de positrones-tomografía computarizada; QT: quimioterapia; RDT: radioterapia; TEP: tromboembolismo pulmonar; USEB-PTBA: ultrasonografía endobronquial con punción transbronquial aspirativa en tiempo real.
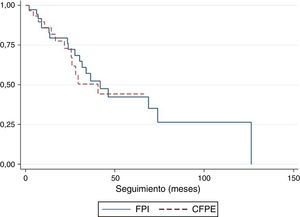
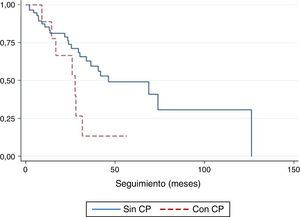
La curva de supervivencia no mostró diferencias entre los pacientes con CFPE respecto a los pacientes con FPI (p=0,10) (fig. 3). Para los pacientes con CP, la supervivencia a los 12 meses fue de 0,78 (intervalo de confianza [IC] del 95%: 0,36 a 0,94). A los 24 meses, fue de 0,67 (IC del 95%: 0,28 a 0,88). A los 36 meses fue de 0,13 (IC del 95% 0,01 a 0,44). Para los pacientes sin CP, el acumulado de supervivencia a los 12, 24, 36 y 48 meses fue de 0,85 (IC del 95%: 0,73 a 0,92), 0,74 (IC del 95%: 0,59 a 0,84), 0,59 (IC del 95%: 0,43 a 0,73) y 0,49 (IC del 95%: 0,32 a 0,64), respectivamente. La diferencia de supervivencia entre los 2 grupos fue estadísticamente significativa (p=0,044) (fig. 4). En el análisis multivariante, la OR de morir en los pacientes con CP respecto a los pacientes sin CP fue de 6,20 (p=0,037, IC del 95%: 1,11 a 34,48).
Nuestros datos muestran que el CP disminuye significativamente la supervivencia de los pacientes con CFPE y FPI. El riesgo de muerte por esta complicación es hasta 6 veces mayor comparado con los pacientes sin CP. La imposibilidad de diagnosticar el tipo histopatológico en un tercio de los mismos y la alta frecuencia de complicaciones tras la modalidad de tratamiento elegida ponen de manifiesto la dificultad en el diagnóstico y el manejo del CP en este grupo de pacientes.
Hasta nuestro conocimiento, este estudio es el primero que describe una serie de pacientes con CFPE en España. La información acerca del pronóstico del CP en la CFPE procede en su mayoría de series asiáticas, siendo necesario replicar los resultados en otros grupos étnicos6. Por el contrario, la influencia del CP en la FPI ha sido ampliamente estudiada en distintas poblaciones y se ha reconocido como un factor independiente de mortalidad en esta entidad19-21,32-34. Girard et al.18 realizaron un estudio sobre 47 pacientes con CFPE, en el cual no se pudo obtener el diagnóstico de CP en 9 de ellos (19%). En 20 pacientes (42%) no hubo la posibilidad de administrar el tratamiento oncológico recomendado por las guías internacionales dadas las características funcionales de los mismos.
En nuestra serie, los pacientes con CFPE cumplían las características descritas previamente, presentando un perfil funcional peculiar y diferente con respecto a los pacientes con FPI1,5,6. En su totalidad eran hombres, con antecedentes de tabaquismo y con un mayor número de paquetes/año comparado con el grupo de FPI. Las cohortes estudiadas en la literatura son en su gran mayoría hombres, siendo la naturaleza de este hallazgo, hasta ahora, incierta6,35. En la espirometría, presentaban un valor mayor de porcentaje predicho de la FVC y de la TLC en contraste con una profunda afectación de la DLCO. La HP representa en la CFPE una complicación cardiovascular asociada a peor pronóstico en estos pacientes3,4. En nuestro estudio, la prevalencia de la HP estimada por ecocardiografía fue más frecuente en el grupo de CFPE, en concordancia con resultados previos1,3,4.
En la práctica clínica diaria, en ocasiones es difícil la diferenciación entre estas 2 entidades. La discusión en un equipo multidisciplinar de EPID es imprescindible para consensuar el diagnóstico diferencial. El CPI ha demostrado tener un valor predictivo superior frente a los parámetros funcionales individuales en el seguimiento en pacientes con FPI6,31; sin embargo, en nuestro estudio esta medida no fue útil para diferenciarlas. Serían oportunos estudios que analicen nuevos índices funcionales o radiológicos que sean capaces de reflejar el grado de afectación funcional y anatomopatológica que caracteriza a los pacientes con CFPE.
En nuestro estudio, la prevalencia del CP fue mayor en el grupo con CPFE (20% vs. 8% en los pacientes con FPI); sin embargo, debido al reducido tamaño de la muestra, este resultado debe interpretarse con cautela. Kwak et al.12 demostraron un riesgo significativamente mayor de CP en pacientes con CFPE que en pacientes con enfisema aislado, pero no encontraron diferencias significativas con los pacientes con FPI. Estudios en la literatura demuestran que 1 de cada 10 pacientes con FPI desarrollan CP, con una prevalencia variable que alcanza hasta el 48% en estudios de necropsia32. Algunos autores consideran que el mayor riesgo de CP en los pacientes con CFPE es debido al «triple efecto» en estos pacientes de la concurrencia de los efectos del tabaquismo, el enfisema y la fibrosis pulmonar6. El humo del cigarrillo es el principal agente causal del CP (90% de los casos)36, mientras que la presencia de enfisema ha demostrado ser un factor de riesgo independiente para su desarrollo36,37. Respaldando esta última observación, en casi 2 tercios de nuestros casos con CP, las lesiones se encontraban en áreas de enfisema, en contraste con lo descrito en otros estudios12,32. En este sentido, la información acerca de la localización del tumor es limitada en las series publicadas12. La mayoría de las neoplasias estaban en los lóbulos superiores, en correspondencia con la cohorte occidental descrita por Girard et al.18.
A pesar de que ambas entidades representan un grupo de riesgo para el desarrollo del CP, actualmente no existen recomendaciones en las guías clínicas acerca de la estrategia de cribado en los mismos22,36. Por otro lado, la falta de diagnóstico en un tercio de los casos refleja la dificultad de aplicar las pruebas invasivas en estos pacientes por el alto riesgo de complicaciones, dado las alteraciones parenquimatosas que presentan18.
En estadios i y ii del CP de célula no pequeña, la cirugía radical ofrece la mejor posibilidad de curación36. Sin embargo, recientemente han sido publicados varios trabajos que indican un peor pronóstico tanto de los pacientes con CFPE como con FPI, tras la resección quirúrgica, tras una mayor tasa de complicaciones posoperatorias (en especial, la exacerbación aguda de la fibrosis pulmonar y recaída precoz del CP)14,21,32,34. En nuestra serie, solo 2 pacientes recibieron tratamiento quirúrgico, por lo cual es difícil extraer conclusiones al respecto. No obstante, el paciente superviviente, y libre de enfermedad hasta la redacción de este artículo, fue sometido a lobectomía, a diferencia del otro caso fallecido en el posoperatorio tardío (en este último, se realizó bilobectomía). Esta observación está en línea con estudios previos que respaldan un tratamiento quirúrgico más conservador en estos pacientes, como la segmentectomía o la lobectomía21,34,38.
A pesar de que el 67% de los pacientes con CP se encontraban en estadios i-ii, la modalidad de tratamiento más empleada fue el tratamiento paliativo. El tratamiento con quimioterapia o radioterapia (2 casos en ambos tratamientos) tampoco representó una opción terapéutica efectiva. La complicación más frecuente en los pacientes con CP fue la exacerbación de la fibrosis pulmonar, la cual es también un acontecimiento comúnmente descrito en las series publicadas13,34,38.
En el presente estudio, el CP redujo de manera significativa la supervivencia de los pacientes y se asoció a un riesgo de mortalidad 6 veces mayor con respecto a los pacientes sin CP. En concordancia con nuestros hallazgos, Tomassetti et al.34 comunicaron una hazard ratio de 7 en una cohorte de 186 pacientes con FPI. En otro estudio reciente, el CP fue un predictor significativo de muerte en el «comorbidoma» de pacientes con FPI33.
La CFPE per se ha sido identificada por algunos autores como factor pronóstico independiente de recaída de CP y de supervivencia14. Girard et al.18 confirmaron el pronóstico desfavorable del CP en estos pacientes, en línea con nuestros resultados y con los de los estudios en las cohortes asiáticas.
En cuanto a la mortalidad global, no encontramos diferencias significativas entre los pacientes con CFPE y FPI, hallazgo que está en consonancia con lo observado por Jankowich y Rounds39 en un estudio con una muestra y un seguimiento similares a la nuestra. Al respecto, la mayoría de los estudios disponibles hasta el momento reconocen que la ya comprometida supervivencia de ambas entidades es sustancialmente afectada por las comorbilidades extrapulmonares (enfermedad cardiovascular, incluyendo la HP, el reflujo gastroesofágico y el CP3,4,6,9-21,32-34). Los nuevos fármacos aprobados para el tratamiento de la FPI (pirfenidona y nintedanib) abren un nuevo escenario en este sentido, pudiendo modificar la historia natural de la enfermedad40. Serán necesarios estudios futuros que comparen cohortes históricas que analicen la influencia de estos tratamientos en la supervivencia y sobre la incidencia de comorbilidades.
Reconocemos que nuestro estudio presenta algunas limitaciones que condicionan la generalización de los resultados. En primer lugar, el haber sido realizado en un solo centro y su diseño retrospectivo pueden introducir limitaciones en el análisis de los datos. Debido a que el objetivo principal era analizar la influencia del CP en la mortalidad de los pacientes con CFPE y FPI por primera vez en una serie española, los hallazgos presentados responden a la pregunta de la investigación. Segundo, no podemos establecer la influencia de los nuevos tratamientos antifibróticos aprobados recientemente sobre la incidencia del CP ni en la supervivencia global de la serie. Creemos que este hecho no afecta a los resultados presentados debido al escaso número de pacientes tratados incluidos en la muestra en el momento del reclutamiento. Por último, se estudian 2 grupos relativamente reducidos de pacientes, con las consiguientes limitaciones de las comparaciones efectuadas y de la extrapolación de los resultados. Sin embargo, pensamos que se adecua a los pacientes manejados en la vida real en los hospitales de tercer nivel de nuestro medio. La colaboración investigativa y los registros multicéntricos nacionales son necesarios para aportar más información al respecto.
En conclusión, nuestros resultados muestran que en pacientes con CFPE y FPI el CP es una complicación que aumenta de forma ostensible la mortalidad de los mismos. Estos pacientes presentan una mayor vulnerabilidad a producir complicaciones relacionadas con el tratamiento oncoespecífico elegido, incluso tras el manejo paliativo. Es necesario que en las guías clínicas tomen en cuenta estas consideraciones, para una mejor estandarización del abordaje diagnóstico y terapéutico del CP en estos pacientes.
FinanciaciónKarina Portillo Carroz es beneficiaria de una beca ayuda para la investigación de la Sociedad Española de Neumología y Cirugía Torácica (2013) y de una beca EPID-futuro patrocinada por Roche (2013).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.