Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es un problema sanitario de primer orden debido a su importante morbimortalidad en quienes la presentan y el enorme gasto sanitario que implica1. La GOLD (Global Initiative for the Diagnosis, Management and Prevention of Obstructive Lung Diseases) la ha definido como una enfermedad caracterizada por la obstrucción crónica al flujo respiratorio, que habitualmente es progresiva y se asocia con una respuesta inflamatoria anormal a la inhalación de partículas o gases tóxicos2. Existen pocas dudas actualmente de que el humo del tabaco es el principal factor desencadenante de esta reacción inflamatoria en el pulmón de los fumadores. Sin embargo, los mecanismos por los cuales el tabaco desencadena la enfermedad y los responsables de la perpetuación de la respuesta inflamatoria al dejar de fumar están todavía lejos de ser totalmente comprendidos, y por tanto el tratamiento de la enfermedad es esencialmente sintomático. En este artículo se caracteriza esta respuesta inflamatoria y se revisa el posible papel de las células T y la autoinmunidad en la patogenia de la EPOC.
Caracterización de la inflamación en la EPOC
Durante muchos años el estudio de la respuesta inflamatoria de la EPOC se centraba en los neutrófilos y sus elastasas, los macrófagos y sus metaloproteinasas: la hipótesis del desequilibrio entre proteasas y antiproteasas. Este mecanismo es, probablemente, un paso importante en la compleja cascada de acontecimientos en la patogenia de la EPOC, pero no el último. Muchos estudios han tratado de caracterizar la respuesta inflamatoria de la EPOC. Sin embargo, los resultados obtenidos eran difícil de integrar, ya que estos estudios variaban en función de la intensidad de la enfermedad (leve, moderada o grave), el tipo de control estudiado (fumadores, ex fumadores o no fumadores, pacientes estables frente a agudizados), el compartimiento del pulmón estudiado (vía respiratoria central o periférica, espacio alveolar), o bien estaban sesgados hacia la función del tipo de célula estudiada. No obstante, una revisión crítica de la bibliografía3 permitía llegar a las siguientes conclusiones: a) todos los fumadores desarrollan inflamación de las vías respiratorias; b) esta inflamación está amplificada en los pacientes con EPOC, particularmente durante las exacerbaciones de la enfermedad; c) existe una relación directa entre la gravedad de la enfermedad y la intensidad de la respuesta inflamatoria; d) la inflamación persiste después de dejar de fumar; e) todos los tipos de células inflamatorias (macrófagos, linfocitos, neutrófilos, eosinófilos y células natural killer (NK) están implicados; f) muchos mediadores inflamatorios liberados por dichas células pueden dañar las estructuras del pulmón, y g) el estrés oxidativo producido por el humo del tabaco es importante en la patogenia de la enfermedad.
Recientemente Hogg et al4 han aportado más luz en este complejo proceso al estudiar tejido pulmonar de pacientes con diferentes grados de severidad clasificados por la GOLD. Sus resultados confirman que la progresión de la EPOC se asocia con una respuesta inflamatoria más intensa en las paredes y luces de las pequeñas vías respiratorias que compromete células de la respuesta inmunitaria innata y adaptativa, que llegan a formar folículos linfoides. Así, el porcentaje de vías respiratorias que contenían neutrófilos, macrófagos, células CD4+, células CD8+, células B y folículos linfoides aumentaba según progresa la gravedad de la EPOC.
Papel de las células T
Finkelstein et al5 fueron los primeros en describir la importancia de las células T, predominantemente CD8+, en las vías respiratorias y parénquima pulmonar de fumadores que desarrollan EPOC, comparados con fumadores "sanos". Posteriormente estos hallazgos se confirmaron en distintos trabajos de Saetta et al6 en piezas quirúrgicas y O'Shaughnessy et al7 en biopsias bronquiales, y más recientemente en el trabajo de Hogg et al4 antes mencionado. La presencia de estas células en el proceso inflamatorio de la EPOC es coherente con la hipótesis de una respuesta inmunológica como factor determinante de la lesión tisular en el pulmón8. Así, sobre la base del comportamiento fisiológico conocido de estas células, cabe recordar que las células T no activadas no pueden entrar en el pulmón ni en ningún otro órgano en cuestión, ya que sus receptores naturales hacen que su tráfico natural sea a través del tejido linfático9. Por tanto, estas células tienen que ser estimuladas mediante el reconocimiento de un antígeno y, para poder permanecer en el pulmón, este antígeno tiene que provenir de dicho órgano. Una vez activadas en el pulmón, las células T pueden realizar su función efectora. Las células CD4+ y CD8+ lo harán a través de la liberación de citocinas con patrón T helper (Th) 1 --interleucina (IL) 2 e interferón gamma (IFN-γ)--, o bien Th2 --IL-4, IL-5 e IL-10--10. La presencia de un número importante de macrófagos en el pulmón y la significativa correlación con células T CD3+ (marcador de linfocitos) en pulmones de fumadores indicaría que una población Th1 de CD4+ y CD8+ participa en este proceso inflamatorio. Las células CD4+ Th1 producen IFN-γ, que es la citocina activadora de macrófagos más potente que se conoce. Otras citocinas producidas por células CD8+ pueden iniciar la misma reacción. Una vez activados, los macrófagos realizan sus funciones, como la generación de partículas reactivas de oxígeno (como el óxido nítrico) y la producción de una reacción inflamatoria aguda, mediante la liberación de mediadores inflamatorios de vida corta como los eicosanoides10. Además, los macrófagos se hacen más eficientes como células presentadoras de antígeno una vez que son activadas. El IFN-γ derivado de células CD4+ y CD8+ estimula la liberación de citocinas por los macrófagos alveolares, incluida la IL-12, que retroalimenta la diferenciación Th1 en las células T; por tanto, promueve las citocinas Th1 de las células CD4+ y CD8+ y la diferenciación a linfocitos T citotóxicos. Otra función efectora importante de los linfocitos T es la alteración de la homeostasis vascular que contribuye a intensificar la inflamación11. La vasodilatación producida bajo la influencia de citocinas, procedentes de células T activadas que actúan sobre las células endoteliales, aumenta el flujo de sangre y la llegada de leucocitos al sitio de inflamación, vía prostaciclinas y óxido nítrico. Mediante la expresión de proteínas de superficie estas células endoteliales se hacen adhesivas a los leucocitos y, además, liberan quimiocinas como la IL-8 y la proteína quimiotáctica de monocitos 1 que promueven su extravasación10. Una vez en el pulmón, otra de las consecuencias importantes de las funciones efectoras de las células T CD8+ citotóxicas es la apoptosis de las células diana, lo cual iría a favor del papel de la apoptosis en la destrucción del parénquima pulmonar en los pacientes con enfisema propuesto por otros autores. Majo et al12 han descrito una relación directa entre el grado de apoptosis y el número de células T CD8+ en las paredes alveolares de fumadores con enfisema.
Relación con la autoinmunidad
Las enfermedades autoinmunitarias se han definido como un síndrome clínico causado por la activación de células T o B, en ausencia de infección subyacente u otra causa atribuible13.
La respuesta inmunológica normal incluye la respuesta innata (natural) y la adquirida (adaptativa)14. La primera se compone por células fagocíticas (neutrófilos y macrófagos), células que liberan mediadores inflamatorios (mastocitos, eosinófilos) y células citolíticas (natural killer). La respuesta adquirida requiere la proliferación de células B y T tras la presentación de antígenos por células especializadas (macrófagos y células dendríticas)14.
Las enfermedades autoinmunitarias se caracterizan por la pérdida de tolerancia a autoantígenos, o bien por el desarrollo de una respuesta inmunológica adquirida hacia epítopos extraños que producen una reacción cruzada con autoantígenos.
Es interesante destacar que la EPOC compartiría muchas características clínicas y fisiopatológicas con varias enfermedades autoinmunitarias como, por ejemplo, la artritis reumatoide (AR)8. En primer lugar, fumar es un factor de riesgo tanto para desarrollar EPOC como para la AR15. En segundo lugar, una vez iniciada, la respuesta inflamatoria en la AR se autoperpetúa16 y, de alguna manera, esto puede ser similar a lo que ocurre en la EPOC, donde la inflamación de las vías respiratorias progresa incluso una vez que el paciente ha dejado de fumar. En tercer lugar, tanto la AR como la EPOC se caracterizan por exacerbaciones de la enfermedad, si bien en la segunda éstas se "explican" por factores externos, como la infección o la polución. Sin embargo, en la AR se consideran parte integral de la enfermedad, caracterizada por células T sensibilizadas hacia epítopos de los cartílagos, o bien hacia productos de degradación de bacterias intestinales que los emulan y que las dirigen hacia las sinoviales, lo cual contribuye al mantenimiento (o amplificación) del proceso inflamatorio17. Por último, son muy destacables las similitudes entre las células inflamatorias (neutrófilos, macrófagos y linfocitos T) y los mediadores inflamatorios (factor de necrosis tumoral alfa, IL-6 e IL-8) implicados en la patogenia de la AR y la EPOC.
La respuesta inmunitaria en la EPOC
Varios elementos tanto de la respuesta inmunitaria innata como de la adquirida son anormales en la EPOC. Durante mucho tiempo se ha considerado de forma implícita que la respuesta inmunitaria innata era la dominante en la patogenia de la EPOC. La teoría tradicional del desequilibrio entre proteasas y antiproteasas requiere la participación de neutrófilos y macrófagos, que son elementos destacados de dicha respuesta18. Sin embargo, el papel de la respuesta inmunitaria adquirida en este proceso no se ha estudiado hasta muy recientemente. Como ya se ha comentado, en la caracterización de la inflamación de la EPOC existe evidencia suficiente para pensar que hay una respuesta inmunológica adquirida implicada en este proceso inflamatorio: a) ambos tipos de células T, los linfocitos Th (CD4+) y los citotóxicos (CD8+), se acumulan en el parénquima pulmonar de pacientes con EPOC3,10; b) los linfocitos B forman el núcleo del llamado tejido linfoide asociado al bronquio, que, como se ha reseñado antes, está significativamente aumentado en fumadores y pacientes con EPOC4; c) fumar se asocia con una expansión de las células presentadoras de antígeno en el epitelio del tracto respiratorio bajo19, y d) datos preliminares de nuestro laboratorio indican una mayor prevalencia de títulos elevados de anticuerpos antinucleares en pacientes con EPOC comparados con fumadores con función pulmonar normal (datos no publicados).
Existen varias incógnitas en la patogenia de la enfermedad que podrían aclararse mediante la implicación de una respuesta inmunológica aberrante como, por ejemplo: a) ¿por qué no todos los fumadores desarrollan la enfermedad?; b) ¿por qué la inflamación persiste después de dejar de fumar?, o c) ¿cuáles son los mecanismos que subyacen a las exacerbaciones de la enfermedad?
Hipótesis patogénica
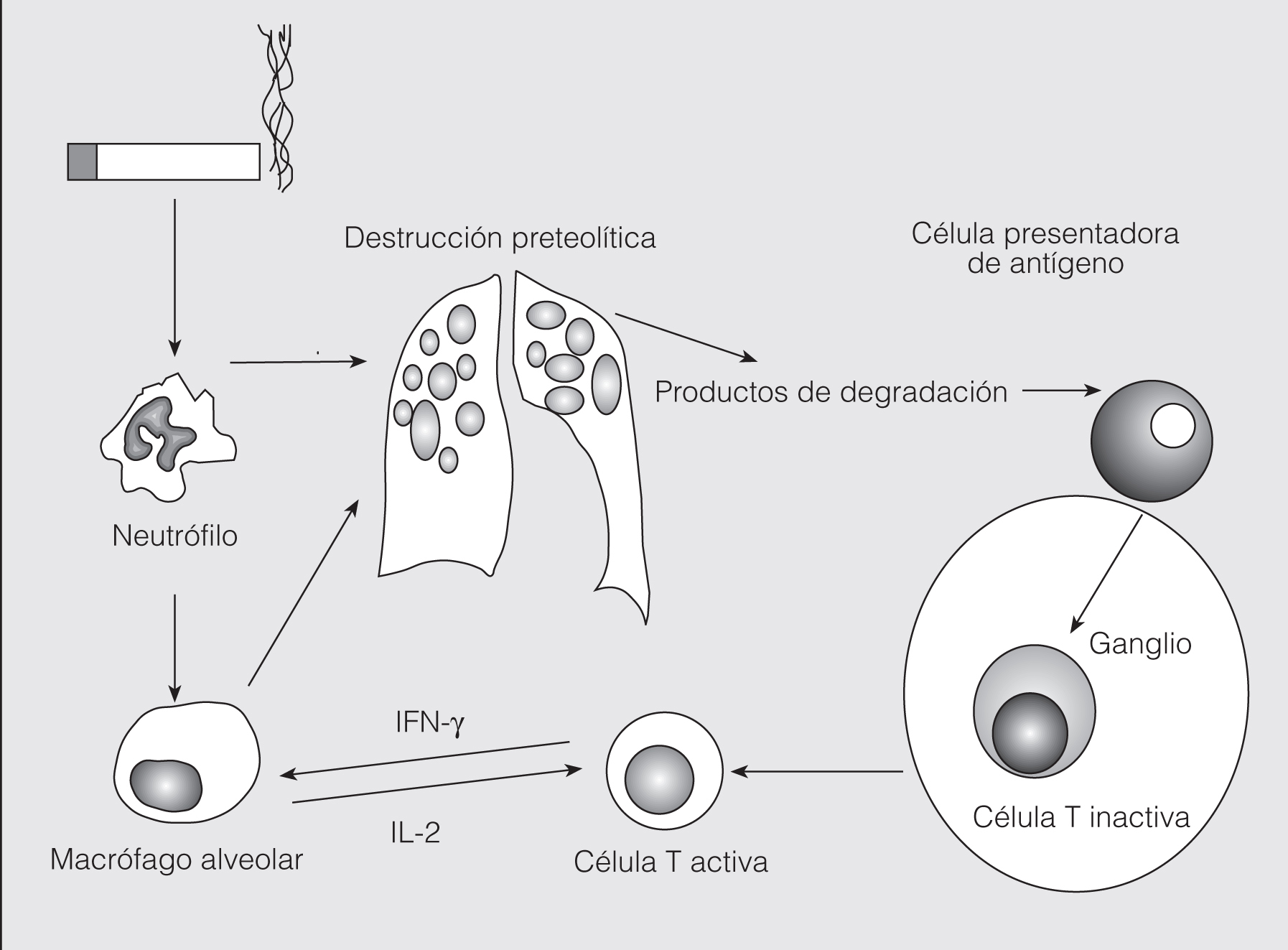
En un intento de integrar estos hallazgos y responder a estas incógnitas, Agustí et al8 propusieron recientemente la hipótesis de que una respuesta inmunitaria adquirida contra nuevos epítopos o bien epítopos alterados es un componente esencial en la patogenia de la EPOC. Esta hipótesis implica la pérdida de tolerancia inmunológica contra autoantígenos y, por tanto, de acuerdo con ella la EPOC se consideraría una enfermedad autoinmunitaria inducida por el humo del tabaco (fig. 1).
Fig. 1. Hipótesis de la autoinmunidad en la patogenia de la EPOC. IL: interleucina; IFN: interferón.
Mecanismos potenciales
Una respuesta inmunológica aberrante puede ser el resultado de un defecto en la selección, regulación o muerte de células inmunitarias (linfocitos B y T), o bien de la generación de nuevos antígenos (propios o extraños)13. Ambas posibilidades podrían ser operativas en la EPOC a través de mecanismos diferentes. El humo del tabaco (el factor de riesgo principal para el desarrollo de la enfermedad) modula la proliferación y las vías de eliminación de los linfocitos20, y puede generar nuevos epítopos, bien mediante la oxidación de proteínas existentes21, bien interfiriendo con la aclaración de células apoptóticas y, por tanto, exponiendo antígenos secuestrados intracelularmente y amplificando la población de células presentadoras de antígeno en el pulmón22. Además, varios factores frecuentemente asociados a la EPOC pueden contribuir al mantenimiento del proceso inflamatorio. Por ejemplo, los pacientes con EPOC a menudo presentan colonización bacteriana crónica del tracto respiratorio23. En la AR se ha demostrado que las bacterias intestinales son una fuente de nuevos antígenos que contribuyen al mantenimiento del proceso inflamatorio16. Por tanto, es posible que la colonización crónica de las vías respiratorias por bacterias pueda ejercer efectos similares en la EPOC. Las infecciones virales y el estrés oxidativo creado por partículas ambientales y el humo del tabaco podrían contribuir de la misma manera a la creación de epítopos nuevos o alterados. En definitiva, existen diferentes mecanismos potenciales que teóricamente pueden potenciar una respuesta inmunitaria adquirida en la EPOC.
No obstante, la implicación potencial de la inmunidad adquirida en este proceso patogénico no resta importancia al papel de los neutrófilos y macrófagos (inmunidad innata) en la patogenia de esta enfermedad. Es posible que el humo del tabaco desencadene una respuesta inicial en la que neutrófilos y macrófagos sean las células dominantes en el proceso inflamatorio incipiente que, a través de diversos mecanismos como proteasas u oxidación, lesione las células del pulmón y degrade el intersticio (liberando elastina, colágeno y proteoglicanos). Esta lesión tisular produciría alteraciones estructurales diversas en proteínas que podrían actuar como autoantígenos y que serían reconocidas por las células T autorreactivas, lo cual induciría su activación y proliferación.
Evidencia científica
Recientemente el grupo de Voelkel en Denver24 ha descrito un modelo animal de enfisema autoinmunitario. En este interesante trabajo se propone que el factor de crecimiento del endotelio vascular --un factor de supervivencia de las células endoteliales expresado de forma muy importante en el tejido pulmonar-- es esencial para el mantenimiento de la estructura del parénquima pulmonar, y que el bloqueo de su receptor produce enfisema en ratas. Para demostrar la participación de la inmunidad adquirida en este modelo, inyectaron células endoteliales xenogénicas en el peritoneo de ratas y observaron que éstas producían anticuerpos anticélulas endoteliales, lo cual se asoció al desarrollo de enfisema centrolobulillar en estos animales. La inmunización de ratas inmunocompetentes con anticuerpos anticélula endotelial también indujo el desarrollo de enfisema, así como apoptosis de las células alveolares y activación de las metaloproteinasas de matriz 2 y 9, además de acumulación de células T CD4+ en el pulmón. Sin embargo, la inyección de anticuerpos anticélula endotelial en ratas atímicas (sin células T) no produjo enfisema en estos animales, lo cual reafirma el importante papel de estas células de la respuesta inmunitaria adquirida en la patogenia de la EPOC y el desarrollo de enfisema.
En otro reciente trabajo publicado por Grumelli et al25 se estudian las subclases de linfocitos y sus receptores de superficie en pulmones de pacientes con EPOC comparándolos con controles ex fumadores sin la enfermedad. La gravedad de la EPOC se asoció con una mayor proporción de linfocitos CD4+ y CD8+ que expresaban receptores de quimiocinas CCR-5 y CXCR-3 (marcadores de células T con patrón Th1). Además, estos linfocitos liberaban más IFN-* y proteína 10 inducible por IFN, que son ligandos para el receptor CXCR-3 que participan en el reclutamiento de más linfocitos Th1 y en la liberación de la metaloproteinasa de matriz 12 por los macrófagos alveolares, una potente enzima degradante de elastina que causa destrucción tisular y que está asociada al desarrollo de enfisema.
Otro interesante trabajo publicado por Di Stefano et al26 proporciona más evidencia sobre la implicación de una respuesta inmunitaria adquirida con patrón Th1. Dichos autores estudian la activación de un factor de transcripción (STAT-4, transductor de señal y activador de la transcripción), esencial para la diferenciación de los linfocitos T en patrón Th1 y la producción de IFN-γ, en biopsias bronquiales y lavado bronquioalveolar de pacientes con EPOC, fumadores sin la enfermedad y no fumadores. Sus hallazgos demuestran de nuevo una asociación entre la EPOC y un proceso inflamatorio caracterizado por la presencia de linfocitos T activados (Th1/ linfocitos citotóxicos tipo I) con activación de STAT-4 y producción de IFN-γ.
Todos estos trabajos respaldan la participación de las células T en el proceso inflamatorio de la EPOC. Una vez aceptado este hecho, no cabe sino aceptar que la razón por la que las células T están en el pulmón es que responden a un estímulo antigénico originado en dicho órgano. En este caso, no es posible sino concluir que la EPOC es una enfermedad caracterizada, al menos en parte, por antígenos (propios o extraños) originados en el pulmón (autoinmunitarios) en respuesta al humo del tabaco.
Implicaciones
La visión actual del problema es que la inflamación crónica del pulmón es un factor patogénico primordial en la EPOC, ya que contribuye a la pérdida acelerada de función pulmonar que caracteriza a la enfermedad. Sin embargo, el tratamiento antiinflamatorio actualmente disponible (corticoides inhalados) no tiene un efecto consistente sobre la citada inflamación27, por lo que se requieren nuevas medidas terapéuticas con urgencia. Esto es particularmente importante si el proceso inflamatorio en los espacios respiratorios persiste después de abandonar el hábito tabáquico.
Si la hipótesis de la EPOC como enfermedad autoinmunitaria se confirma, esto facilitaría el desarrollo de nuevas estrategias terapéuticas, principalmente encaminadas a la inmunomodulación. Esto podría detener la progresión de la enfermedad y prevenir los episodios de exacerbaciones, lo cual produciría una mejora importante en la calidad de vida de estos pacientes y quizá en su pronóstico, así como una significativa reducción del gasto sanitario.
Conclusiones
La revisión presentada en este manuscrito sostiene la hipótesis de que la respuesta autoinmunitaria puede ser un mecanismo potencialmente relevante en la patogenia de la EPOC. A pesar de que la evidencia científica disponible es todavía incipiente, apoyada por un elegante trabajo sobre un modelo animal24, son necesarios nuevos estudios en humanos para explorar esta hipótesis de forma minuciosa. Es preciso aclarar, por ejemplo, si algunas de las alteraciones inflamatorias descritas (como la expansión del tejido linfoide asociado al bronquio y de las células presentadoras de antígeno) se deben a una respuesta fisiológica frente al tabaco más que patológica. Estos estudios deberían ir encaminados a detectar la presencia de autoantígenos, identificar epítopos potenciales y determinar la relación potencial entre la EPOC y el tipo de antígneo del complejo principal de histocompatibilidad, entre otros, información que podría ser de utilidad para el beneficio de los pacientes con EPOC.
Correspondencia: Dr. A. Agustí.
Andrea Doria, 55. 07014 Palma de Mallorca. Islas Baleares. España.
Correo electrónico: aagusti@hsd.es