A lo largo de las últimas décadas, el número de trasplantes pulmonares realizados como terapia final de muchas enfermedades respiratorias ha ido creciendo considerablemente, tanto en la población adulta como a nivel pediátrico. Sin embargo, se hace muy necesario estudiar las causas por las que su supervivencia es relativamente baja en comparación con otros trasplantes de órganos.
Por ello, desde mediados del siglo pasado comenzaron a realizarse trasplantes pulmonares experimentales, cuya técnica ha ido mejorando, y se ha ampliado a distintas especies animales hasta llegar a los roedores. La ventaja que presentan estas especies pequeñas ha facilitado que el modelo quirúrgico se haya extendido y estandarizado, permitiendo estudiar diferentes aspectos relacionados con las enfermedades respiratorias.
En esta revisión se analizan las distintas modalidades técnicas disponibles de trasplante experimental en rata y ratón, destacando tanto la técnica quirúrgica como la anestésica o la monitorización, así como las principales aportaciones generadas por el trasplante pulmonar murino.
In recent years, the number of lung transplantations performed as the last option for many respiratory diseases has grown considerably, both in adults and children. However, the causes for the relatively short survival of lungs compared to other organ transplants still need to be studied.
Techniques have improved since the 1950s when experimental lung transplantation began, and the different animal species used now include rodents. The advantage of using these small species is that the surgical model has been expanded and standardized, and different respiratory problems can be studied.
In this review we examine the different technical strategies used in experimental transplantation in rats and mice, focusing on surgical techniques and anesthesia and monitoring methods, and highlighting the major contributions of mouse lung transplantation to the field.
El trasplante pulmonar es, en ocasiones, la única opción terapéutica disponible para las fases finales de determinadas enfermedades respiratorias, como enfermedad pulmonar obstructiva crónica, enfermedad pulmonar intersticial difusa, bronquiectasias asociadas a fibrosis quística, bronquiolitis obliterante, sarcoidosis o hipertensión pulmonar arterial1-3.
Desde la realización del primer trasplante en animales en 19404,5, estos modelos experimentales han favorecido el desarrollo del procedimiento quirúrgico y la prevención de las complicaciones asociadas al mismo, como el rechazo o la lesión por isquemia-reperfusión. Aunque el primer trasplante murino se efectuó en 19716, durante el siglo pasado se realizaron fundamentalmente en el perro4,5, así como en cerdo, oveja7 o mono8-10, ya que los animales de mayor tamaño presentan ventajas a la hora de desarrollar la técnica quirúrgica y de trasladar los resultados a la clínica humana. Actualmente, estas especies se siguen empleando, sobre todo para el entrenamiento quirúrgico, mientras que han adquirido un mayor protagonismo especies de menor tamaño como el conejo11, la rata o el ratón, que proporcionan ventajas económicas, logísticas y de manejo, así como menos limitaciones éticas.
En la rata, se desarrolló inicialmente el trasplante ortotópico de pulmón izquierdo6, mientras que el de todo el bloque cardiopulmonar tiene un uso más limitado por su elevada mortalidad12. Las mejoras en el procedimiento quirúrgico, en la técnica anestésica, en la ventilación mecánica y en las condiciones de preservación y reperfusión han permitido no solo el éxito del modelo sino también su reproducibilidad. Además, se han desarrollado modelos de trasplantes heterotópicos, aunque estos carecen de ventilación y buena perfusión del injerto13,14. Por último, la disponibilidad de una gran diversidad de cepas, que permiten estudiar factores genéticos que afectan al trasplante, ha potenciado el modelo en ratón15,16.
En esta revisión pretendemos describir los distintos procedimientos disponibles para el trasplante pulmonar murino, incidiendo en la técnica quirúrgica y en aspectos perioperatorios relevantes, como anestesia-analgesia, ventilación mecánica, manejo del postoperatorio y prevención de complicaciones. Además, revisaremos las principales aportaciones generadas por el trasplante pulmonar en roedores.
Anestesia y cuidados perioperatoriosLos protocolos anestésicos deben proporcionar un adecuado efecto anestésico y analgésico, manteniendo la estabilidad fisiológica del animal y ser fácilmente reversibles al finalizar la técnica quirúrgica. Aunque permite una rápida inducción y recuperación del animal, el uso de anestesia inhalatoria16 (isoflurano al 1,5-2% o sevoflurano al 2,5-3%, cuyo efecto protector sobre el pulmón es conocido17) puede generar dificultades si no se dispone de los medios adecuados. En concreto, se requieren recursos económicos, debido al elevado coste y gasto de los anestésicos inhalatorios, así como la disponibilidad de un equipo de ventilación mecánica que permita la introducción de gases anestésicos. Por ello, cuando no es posible realizar una anestesia inhalatoria se puede recurrir a métodos parenterales (tabla 1).
Combinaciones anestésicas empleadas en la rata y el ratón para la realización de procedimientos quirúrgicos, incluido el trasplante pulmonar
| Protocolo | Dosis (mg/kg) | Duración (min) | |
|---|---|---|---|
| Rata | Ratón | ||
| Ketamina+medetomidina | 75-100+0,25-0,5 | 75-150+0,5-1 | 40-50 |
| Ketamina+xilacina | 75-100+12 | 75-150+12-20 | 40-50 |
| Ketamina+diacepam | 80+20 | 75-100+5 | 30-40 |
| Medetomidina+fentanilo | 0,3+0,3 | – | 50-60 |
| Atipamezola (antagonista α2-adrenérgico) | 0,5-1 | 0,5-1 | – |
La ketamina es uno de los fármacos más empleados y proporciona un efecto analgésico, potenciado cuando se administra conjuntamente con un agonista de los receptores α2-adrenérgicos, como la xilacina o la medetomidina, a la vez que reduce la rigidez muscular. Esta combinación anestésica se puede revertir fácilmente con la administración de un antagonista de los receptores α2-adrenérgicos como el atipamezol. Otras combinaciones emplean ketamina y la benzodiacepina diacepam, o el opioide fentanilo asociado a la medetomidina.
Es necesario compensar la diuresis causada por los agonistas de los receptores α2-adrenérgicos mediante fluidoterapia subcutánea. Además, resulta importante la aplicación de pomadas oftálmicas para evitar la sequedad corneal.
La toracotomía es un potente estímulo nociceptivo, por lo que una analgesia apropiada resulta esencial. Normalmente, se basa en la administración preoperatoria subcutánea de opioides (como buprenorfina, a 10-50μg/kg/8h en rata o 50-100μg/kg/8h en ratón) asociados a antiinflamatorios no esteroideos (2mg/kg/día de meloxicam). Finalmente, se recomienda realizar profilaxis antibiótica con cefazolina (30mg/kg) o ceftriaxona (70mg/kg).
VentilaciónUna vez anestesiados, los animales deben ser intubados con catéteres de 14G (ratas >300g), 16 G (rata de 200-300g) o 22 G (ratones de unos 25g) y ventilados mecánicamente. En el caso del receptor, suele recomendarse el modo de ciclado por presión, dado que su pulmón izquierdo no será funcional durante gran parte de la cirugía.
Para la programación del ventilador, se recomienda establecer un volumen corriente de 7-10ml/kg (si está ciclado por volumen), una presión máxima de 10-12cmH2O (si está ciclado por presión) y una frecuencia respiratoria de 60-100 respiraciones/min. Además, es muy recomendable aplicar una presión positiva al final de la espiración de 2-5cmH2O para evitar la formación de atelectasias durante la espiración.
Monitorización intraoperatoriaExisten equipamientos específicos para roedores que permiten el registro de pulsioximetría, capnografía, presiones arteriales no invasivas o electrocardiograma. En general, los equipos diseñados para humanos o para animales de mayor tamaño no son adecuados para roedores.
Además, es relevante monitorizar la temperatura corporal mediante un termómetro o sonda rectal para mantenerla entre 37,5-38,5°C. La hipotermia es una complicación muy frecuente en roedores y produce muchos efectos adversos si se alcanzan temperaturas inferiores a 32°C, incluyendo un retraso en la recuperación de la anestesia. Para mantener la temperatura corporal, se emplea una manta eléctrica o de agua caliente, aunque vigilando la posible hipertermia que pueda provocar. La saturación de oxihemoglobina suele mantenerse en niveles superiores al 99% cuando la fracción inspirada de oxígeno se incrementa entre un 30 o 60% con respecto al 21% del aire ambiental.
Aspectos quirúrgicos del trasplante pulmonar ortotópico en rata y ratónEl modelo de trasplante ortotópico del pulmón izquierdo es el más utilizado por su viabilidad y mayor sencillez, ya que el pulmón izquierdo está formado por un único lóbulo, mientras que el derecho se divide en 4. No obstante, en el ratón también se ha utilizado el trasplante ortotópico del pulmón derecho18.
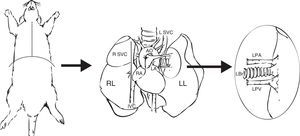
Preparación del donanteSuele recomendarse la extracción de todo el bloque cardiopulmonar. Bajo anestesia y con el animal en decúbito supino, se prepara el campo operatorio rasurando la piel del tórax y aplicando povidona iodada o clorhexidina de forma centrípeta desde el centro del tórax. Posteriormente, se realiza una esternotomía media con heparinización (100UI/100g) en vena cava inferior, subcutánea o intracardíaca, para evitar la formación de coágulos en el pulmón a trasplantar. Con un microscopio óptico, se procede a la disección del hilio pulmonar para localizar el cayado aórtico y pinzarlo. Simultáneamente, se realizan cortes a nivel de las aurículas y vena cava inferior.
En la mayoría de los modelos se lleva a cabo una perfusión anterógrada, a través del ventrículo derecho19,20 o del tronco pulmonar15,21–23, aunque es conveniente combinarla con la perfusión retrógrada desde la aurícula izquierda22 para simular las condiciones fisiológicas. Los pulmones deben ser perfundidos a una presión mantenida (10-15cmH2O), de forma homogénea, con una solución de preservación fría (4°C) de glucosa dextrano bajo en potasio (LDPG).
A continuación, se liga y secciona la tráquea para extraer todo el bloque cardiopulmonar con el pulmón insuflado, para evitar la formación de atelectasias y mejorar la oxigenación y la presencia de surfactante, lo que reduce el daño isquemia-reperfusión24,25. Las recomendaciones de inflado varían entre un 50% de la capacidad pulmonar total22,25 y un 75-100%26 sin llegar a provocar barotrauma. Además, el insuflado previo a la preservación reduce la expresión de marcadores proinflamatorios tras la reperfusión26.
Con respecto a la preservación del órgano trasplantado, el pulmón donante se suele mantener a 4°C para minimizar el daño isquémico del injerto pulmonar27. La solución de preservación más utilizada es el dextrano bajo en potasio (Perfadex)16,28-30, aunque también se emplean otras soluciones, como Celsior31, Euro-Collins o Wisconsin24.
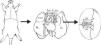
Preparación del injertoUna vez extraído el bloque pulmonar, se debe individualizar el pulmón izquierdo pinzando el bronquio para mantenerlo insuflado. Junto con la arteria y vena pulmonares, se secciona el bronquio lo más distal posible al pulmón para facilitar las anastomosis (fig. 1).
Extracción y preparación del pulmón donante. Realización de una estereotomía media y disección y extracción del bloque cardiopulmonar. Disección de la arteria pulmonar izquierda (LPA), vena pulmonares izquierdas (LPV) y del bronquio izquierdo (LBr).AO: aorta torácica; IVC: vena cava inferior; LA: aurícula derecha; L SVC: vena cava superior izquierda; LL: pulmón izquierdo; RA: aurícula izquierda; RL: pulmón derecho; R SVC: vena cava superior derecha.
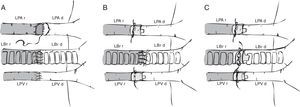
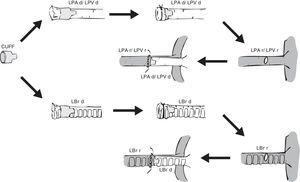
La preparación del pulmón izquierdo variará en función de la forma de realizar las anastomosis: anastomosis vascular y bronquial con puntos de sutura6,19,21,32, anastomosis bronquial con puntos de sutura y empleo de manguitos vasculares o cuffs30,33-36, y anastomosis vascular y bronquial mediante manguitos20,22,23,35-39 (fig. 2). En el primer caso, se procede a la disección del hilio pulmonar individualizando cada estructura a anastomosar y manteniendo el pulmón en el medio de conservación a baja temperatura. En los 2 últimos casos, las uniones vasculares y bronquiales se simplifican al no emplear suturas sino unos manguitos, usados tanto en el trasplante pulmonar33 como de otros órganos40-42. Se trata de estructuras anulares constituidas por policloruro de vinilo o teflón, fabricadas a partir de cánulas o catéteres, cuyo tamaño en la rata oscila de 18 a 14G, siendo los de mayor diámetro los empleados en el bronquio, y los más pequeños, en la arteria pulmonar22. Los manguitos tradicionales están constituidos por un cuerpo, que es donde se fijan los vasos o el bronquio, y una lengüeta para permitir una fácil manipulación de los mismos (fig. 3). Su longitud es de 2-3mm (cuerpo de 1, 1,5 o 2mm y lengüeta de 1 o 1,5mm). Existe un modelo modificado de manguitos en el que se ha eliminado la lengüeta32,36,43, pero ello complica su manipulación. Por este motivo, algunos grupos utilizan el manguito convencional y, tras realizar la anastomosis, eliminan la lengüeta33.
Técnicas quirúrgicas descritas de trasplante pulmonar en modelos murinos. A) Anastomosis vascular y bronquial con puntos de sutura. B) Anastomosis bronquial con puntos de sutura y empleo de manguitos vasculares o cuffs en vena y arteria pulmonares. C) Anastomosis vascular y bronquial mediante manguitos o cuffs.LBr d: bronquio izquierdo de animal donante; LBr r: bronquio izquierdo de animal receptor; LPA d: arteria pulmonar izquierda de animal donante; LPA r: arteria pulmonar izquierda de animal receptor; LPV d: vena pulmonar izquierda de animal donante; LPV r: vena pulmonar izquierda de animal receptor.
Esquema de colocación de un manguito o cuff en el pulmón donante y su anastomosis en el pulmón receptor.LBr d: bronquio izquierdo de animal donante; LBr r: bronquio izquierdo de animal receptor; LPA d: arteria pulmonar izquierda de animal donante; LPA r: arteria pulmonar izquierda de animal receptor; LPV d: vena pulmonar izquierda de animal donante; LPV r: vena pulmonar izquierda de animal receptor.
Independientemente del tipo de manguito utilizado, la colocación se realiza introduciendo la vena, arteria o bronquio del pulmón donante a través del orificio del cuerpo del manguito, para posteriormente evertirlos fijando los tejidos con sutura de polipropileno de 7/0 o 8/0 en la rata22,23 y de 10/0 en el ratón18. En ocasiones, el bronquio es preparado justo antes del momento del implante para evitar la entrada de líquido de preservación18,20.
Preparación del receptorBajo anestesia y una adecuada analgesia, se coloca al animal en decúbito lateral derecho. Se prepara el campo quirúrgico como en el animal donante y se realiza una toracotomía lateral a través del cuarto espacio intercostal. Se extrae el pulmón izquierdo y se aíslan las principales estructuras pinzando la arteria, vena y bronquio pulmonares izquierdos, siempre lo más distal posible al pulmón. La sección de dichas estructuras se realiza lo más próximo posible al parénquima pulmonar. Para evitar la formación de coágulos, se aplica suero heparinizado (0,5-1UI/ml) a la arteria y vena. La manipulación de todas las estructuras debe ser cuidadosa para evitar desgarros vasculares.
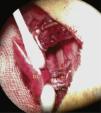
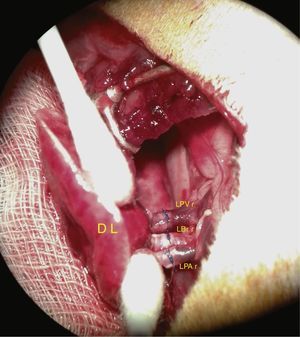
A continuación, se procede a realizar las anastomosis de las estructuras vasculares y del bronquio. En la figura 4 aparecen reflejadas, en una imagen real, las anastomosis realizadas con manguitos.
Una vez anastomosado el bronquio, se debe ventilar el pulmón donante para evitar la formación de atelectasias y favorecer el reclutamiento alveolar. Una rápida reperfusión del pulmón indica que la permeabilidad vascular de las anastomosis es adecuada. Por último, se extrae el pulmón nativo del animal receptor, dejando únicamente el pulmón donante.
La colocación de un drenaje es fundamental para eliminar los restos de sangre, líquido o aire alrededor de los pulmones y que estos se puedan expandir con normalidad. El cierre de la cavidad torácica se realiza por planos, retirando el drenaje cuando el animal se recupera de la anestesia y comienza su ventilación espontánea.
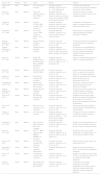
En función del grupo de trabajo y de la técnica empleada, el tiempo necesario para completar la cirugía varía. Por lo general, se observan tiempos más bajos cuando se emplea la técnica de cuff que cuando se emplean suturas convencionales, especialmente, cuando esto último se realiza en vasos y bronquio. De igual manera, el índice de supervivencia es mejor cuando en las anastomosis se utilizan manguitos frente a puntos de sutura (tabla 2).
Comparación de distintos protocolos de trasplante pulmonar en modelo murino
| Técnica | Tiempo de cirugía (min) | Tipo de anastomosis | Orden anastomosis | Longitud cuff (mm) | Diámetro cuff (mm) | Supervivencia (%) |
|---|---|---|---|---|---|---|
| Sutura | ||||||
| Asimacopoulos6, 1971 | No descrito | Sutura | B-A-V | – | – | 50 |
| Marck32, 1982 | 240 | Sutura | V-A-B | – | – | 80a 50b |
| Prop19, 1984 | 210±31y 238±19 | Sutura | V-A-B | – | – | 89 y 75 |
| Zhang21, 2008 | 78,4±5,2 | Sutura | B-A-V | – | – | 89a 50b |
| Manguitos vasculares y sutura bronquial | ||||||
| Mizuta33, 1989 | 101±4,8 | Manguito convencional | V-A-B | 2 (cuerpo: 1; lengüeta: 1) | 2 y 1,65 | 88,8 |
| Kubisa34, 2003 | 120 | Manguito convencional | V-A-B | No descrito | 0,8 | 96,57 |
| Mizobuchi35, 2004 | 116±1,6 | Manguito convencional | V-A-B | 4 (cuerpo: 2,5; lengüeta: 1,5) | 1,65 | 95,6 |
| Zhai36, 2008 | No descrito | Manguito modificado | A-B-V | 2,5 (cuerpo: 1; lengüeta: 1,5) | 1,65 | No descrito |
| Habertheuer30, 2013 | 130±9 | Manguito convencional | B-A-V | No descrito | No descrito | 100 (70-90-100) |
| Manguitos vasculares y bronquiales | ||||||
| Mizuta37, 1991 | 64,1±3,6 | No descrito | No descrito | No descrito | No descrito | 90b |
| Reis38, 1995 | 108,6±4,2 | Manguito convencional | A-V-B | 3 (cuerpo: 2; lengüeta: 1) | 1,65 | No descrito |
| Santana Rodríguez23, 2004 | 110±12,7 | Manguito convencional | V-B-A | 3 (cuerpo: 1,5; lengüeta: 1,5) | 2,2 y 1,65 | No descrito |
| Mizobuchi35, 2004 | 84,8±0,6 | Manguito convencional | V-B-A | 4 (cuerpo: 2,5; lengüeta: 1,5) | 2,1 y 1,65 | 91,8 |
| Zhai36, 2008 | No descrito | Manguito modificado | A-B-V | 2,5 (cuerpo: 1; lengüeta: 1,5) | 1,65 | No descrito |
| Sugimoto39, 2009 | 110 aprox. | No descrito | A-B-V | No descrito | No descrito | 93,6 |
| Jungraithmayr16, 2009 | 95,6±8,5 | Manguito convencional | A-B-V | Diferentes tamaños | 0,64-0,51-0,4 | 80 |
| Santana Rodríguez22, 2011 | 107,7±6,2 | Manguito convencional | A-B-V | 3 (cuerpo: 1,5; lengüeta: 1,5) | 1,65 | 87,6 |
| Zheng43, 2013 | 96,8±6,2 | Manguito convencional | A-V-B | Diferentes tamaños | 0,81-0,64-0,51 | 96,7 |
| Zheng43, 2013 | 85,3±6,9 | Manguito modificado | A-V-B | No descrito | 0,81-0,64-0,51 | 80 |
Orden de anastomosis: A: arteria; B: bronquio; V:vena.
Tras la cirugía, se debe mantener el tratamiento analgésico y antibiótico durante al menos 5-6 días, incrementándose la analgesia si se detecta dolor. La herida quirúrgica se debe limpiar y desinfectar para favorecer la cicatrización. También es necesario establecer protocolos de supervisión e incluir criterios de punto final, valorar aspectos como la pérdida de peso, el aspecto físico, el patrón ventilatorio, la presencia de cianosis o el comportamiento del animal. Cuando se produzcan alteraciones de los mismos, será necesario llevar a cabo actividades correctoras inmediatas.
Complicaciones perioperatorias y su manejoLas más importantes son derivadas del procedimiento quirúrgico, tanto en la preparación del donante como del receptor44. Para lograr habilidad en el manejo del material microquirúrgico y, por tanto, alcanzar éxito en la técnica quirúrgica, se requiere una curva de aprendizaje relativamente larga, con una alta mortalidad durante la puesta a punto de la cirugía15. Algunos autores establecen en 50 trasplantes el umbral para dominar la técnica20. Además, la duración del procedimiento quirúrgico y el tiempo empleado en la realización de las anastomosis influyen en la aparición de complicaciones y en la supervivencia de los animales6,16,30,32,44.
En general, el uso de manguitos requiere menor habilidad y experiencia, resultando un procedimiento más rápido que la sutura con puntos simples38,45. Los manguitos vasculares reducen el riesgo de sangrado y, por ello, se produce menos tejido de granulación, disminuyendo la posibilidad de trombosis o estenosis a largo plazo de las zonas de anastomosis38. En el bronquio, se detecta una menor presencia de fugas, factor causante de neumotórax, lo que condiciona la funcionalidad del injerto35. No obstante, el uso de manguitos puede originar una disminución de la luz si la elección de su diámetro no es adecuada, y puede provocar una reacción de cuerpo extraño35,38,45. Los manguitos modificados, sin extensiones o lengüetas, reducen el riesgo de torsión de los vasos o bronquios tras realizar la anastomosis y el daño producido por dicha extensión. Además, al ser más pequeños producen menos reacción de cuerpo extraño36. Otras complicaciones perioperatorias referidas incluyen la rotura de la vena cava, el empiema pleural34, la parada respiratoria38 o la trombosis venosa43.
En cuanto a complicaciones postoperatorias, son importantes la insuficiencia respiratoria, la hemoptisis, la trombosis de una vena o arteria bronquial, el neumotórax, las infecciones respiratorias, los derrames pleurales, el edema pulmonar y el rechazo del injerto19,46.
Principales aportaciones científicasPese a la complejidad quirúrgica, los modelos de trasplante pulmonar en roedores están suficientemente estandarizados y son reproducibles, lo que permite evaluar diferentes aspectos técnicos y los mecanismos de las principales complicaciones del trasplante en humanos. Hasta el momento, el trasplante pulmonar murino ha facilitado la generación de conocimiento sobre las características de los donantes22,47, modelos de conservación y preservación pulmonar26,48,49, lesión por isquemia-reperfusión48,50-52 y, sobre todo, rechazo agudo y crónico (tabla 3)48,53-66.
Resumen de los principales aspectos evaluados mediante modelos murinos de trasplante pulmonar
| Autor y año | Especie | Sexo | Cepas | Modelo | Objetivo |
|---|---|---|---|---|---|
| Aeba et al.49, 1992 | Rata | Machos | Lewis (donante y receptor) | Trasplante pulmonar ortotópico izquierdo tras 6 o 12h de isquemia fría | Comparación de diferentes soluciones de preservación pulmonar (Wisconsin y Euro-Collins) |
| Zweers et al.47, 2004 | Rata | Machos | Fisher 344 (donante); Wistar Kyoto WKY (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de sutura convencional e inducción de muerte cerebral en el donante durante 6h | Estudio del efecto de la muerte cerebral en el rechazo crónico tras el trasplante pulmonar |
| Okazaki et al.58, 2007 | Ratón | Machos | BALB/c, C57BL/6 (B6)a (donante); B6 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff y trasplante heterotópico de tráquea | Comparativa del trasplante de tráquea y trasplante pulmonar en el estudio del rechazo agudo |
| Greschus et al.53, 2009 | Rata | Machos | F344, Dark Agouti, WKY (donantes); WKY, Lewis, F344 | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff vascular y sutura bronquial | Monitorización y evaluación del pulmón trasplantado mediante tomografía volumétrica |
| Santana-Rodríguez et al.52, 2011 | Rata | Machos | Sprague-Dawley (donante y receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Evaluación del efecto del estradiol en la lesión pulmonar por isquemia-reperfusión |
| Santana Rodríguez et al.22, 2011 | Rata | Machos | Sprague-Dawley (donante y receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff e inducción de muerte cerebral en el donante | Evaluación de la permeabilidad de las anastomosis y de los signos de lesión por isquemia-reperfusión similares al rechazo agudo en 2 modelos técnicos |
| Kreisel et al.50, 2011 | Ratón | Machos | Balb/c, B6, B10.BR CD11c-EYFP (donante); B6 LysM-GFP, B6 TNF-α−/− (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff tras 1 y 18h de isquemia fría | Estudio de la disfunción primaria del injerto por isquemia-reperfusión |
| Kreisel et al.51, 2011 | Ratón | Machos | B6 (donante)-B6 (B6), B6 (Bcl3) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Estudio del factor transcripcional Bcl3 y su relación con el rechazo agudo tras el trasplante pulmonar |
| Dodd-o et al.59, 2011 | Ratón | Machos | B6, BALB/c (donante); B6 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Estudio de la atenuación del rechazo agudo mediante el uso de anticuerpos anti-CD-154 |
| Jungraithmayr et al.55, 2012 | Ratón | Machos | BALB/c (H-2Kd) (donante); B6 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Evaluación y estudio del rechazo agudo mediante microscopia electrónica de barrido |
| Santana-Rodríguez et al.66, 2012 | Rata | Machos | Sprague-Dawley (donante y receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Evaluación del rechazo agudo en el trasplante pulmonar mediante el estudio de microarrays de ADN |
| Chen et al.57, 2013 | Ratón | Machos | B6, BALB/c (donante); B6 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Identificación del rechazo agudo mediante el estudio del metabolismo de las células T con técnicas de imagen (microtomografía de emisión de positrones) |
| Erne et al.62, 2013 | Rata | Machos | Brown-Norway (donante); Lewis (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Atenuación del rechazo pulmonar agudo mediante la administración de N-acetilcisteína |
| Tanaka et al.26, 2014 | Rata | Machos | Lewis (donante y receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff tras 6h de preservación a distintos porcentajes de inflado | Evaluación del efecto de inflado de los pulmones donantes durante la preservación pulmonar |
| Takahashi et al.56, 2014 | Rata | Machos | Brown-Norway (BN) (donante); BN, Lewis (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Estudio de la función pulmonar en el rechazo agudo mediante técnicas no invasivas como la oscilación forzada |
| Kreisel et al.61, 2010 | Ratón | Machos | B6CD45.1, B6II− (donante); B6, B6Rag-/-, B6/B6II− F1 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff, así como de médula ósea | Estudio del efecto de las células pulmonares no hematopoyéticas y su acción sobre las células T CD4+ |
| Zhou et al.60, 2015 | Ratón | Machos | B6, BALB/c (donante); B6 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Relación entre el rechazo agudo y la producción de IL-17 |
| Raissadati et al.63, 2015 | Ratón | Machos | BALB/c (donante); B6(receptor) | Trasplante heterotópico de tráquea | Estudio del efecto de la proteína CCN1 en un modelo de bronquiolitis obliterante |
| Wu et al.64, 2015 | Ratón | Machos | C57Bl/10, B6 (donante); B6 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Estudio de la influencia de las células T CD4+ y la producción de IL-17 en un modelo de bronquiolitis obliterante |
| Chuck et al.54, 2016 | Ratón | Machos | B6, BALB/c (H-2Kd) (donante); B6 (receptor) | Trasplante pulmonar ortotópico izquierdo con la técnica de cuff | Evaluación de los cambios producidos en el pulmón trasplantado por el rechazo agudo y lesión por isquemia-reperfusión mediante resonancia magnética ultracorta |
Aparece en las primeras 72h y se gradúa en función de la relación PaO2/FiO2 y la presencia de infiltrados radiológicos, siendo una causa muy importante de morbimortalidad durante el postoperatorio inmediato.
Su análisis en modelos murinos ha permitido una mejor caracterización de los mecanismos desencadenantes, en los que la lesión primaria de los neutrófilos originada por la isquemia-reperfusión parece desempeñar un papel nuclear. Así, se ha demostrado que neutrófilos aislados de las vías aéreas de receptores de trasplante estimulan las células dendríticas del donante, por un mecanismo dependiente de contacto, para inducir la producción de IL-12 y expandir linfocitos T específicos del aloantígeno50. A su vez, se ha demostrado que este fenómeno es regulado por la degranulación inducida por el TNF-α asociado a la membrana plasmática de los neutrófilos50. También ha sido posible identificar algunos factores moduladores de esta respuesta celular, que podrían resultar de potencial interés en la identificación de futuras vías terapéuticas. Se ha mostrado que el factor transcripcional Bcl3 limita la granulopoyesis por una vía NF-kB dependiente51.
Rechazo celular agudoLos modelos murinos proporcionan un medio ideal para el estudio del rechazo celular agudo, al poder evaluar en cepas puras el grado de concordancia o discordancia del antígeno mayor de histocompatibilidad. Esto resulta particularmente favorecido por el desarrollo de sistemas de monitorización específicos para este modelo de trasplante. Además de los lavados broncoalveolares para el estudio de la celularidad de las vías aéreas y de medir la capacidad de oxigenación a través de los gases en sangre arterial, se han generado técnicas de imagen propias, como la tomografía volumétrica53 o la resonancia magnética ultracorta54, que junto con la evaluación histológica de los cambios ultraestructurales del rechazo agudo mediante microscopia de barrido55 facilitan una mejor monitorización del pulmón trasplantado.
También se han desarrollado procedimientos complementarios para la evaluación de la función pulmonar. Así, la oscilación forzada resulta muy útil en los modelos murinos, ya que tanto la elastancia dinámica como la dependencia de frecuencia de las resistencias parecen tener capacidad predictiva del grado de rechazo agudo56, constituyéndose como índices no invasivos para la detección y monitorización de su progresión. En un ámbito de imagen-función, la microtomografía de emisión de positrones permite identificar un mayor consumo de 18fluorodesoxiglucosa por neutrófilos y linfocitos CD857, pudiendo identificar más precisamente el rechazo agudo a través de la valoración del metabolismo de las células T.
La evaluación de los mecanismos patogénicos del rechazo agudo en modelos murinos ha facilitado el desarrollo de intervenciones para prolongar la supervivencia del injerto, por ejemplo, mediante el bloqueo de los coestimuladores anti-CD28-B7 y del ligando CD40-CD4058. Otros autores han demostrado en un modelo de trasplante pulmonar ortotópico murino MHC-discordante que la monoterapia con anticuerpos anti-CD154 podría ser suficiente para atenuar el rechazo agudo59, debido a un bloqueo de la coestimulación CD154/CD40, que favorece un desplazamiento del entorno del injerto hacia un predominio de células T reguladoras CD4(+) CD25(+) Foxp3(+)60. También se ha referido que algunas células pulmonares no hematopoyéticas pueden desempeñar un importante papel en la supresión in vivo de las respuestas inmunes mediadas por células T CD4(+)61.
Aunque todavía muy incipiente, estos hallazgos podrían tener una potencial traslación clínica mediante el tratamiento con N-acetilcisteína. En modelos murinos, se ha demostrado que su administración tiene capacidad para atenuar el rechazo pulmonar agudo por reducción del infiltrado de macrófagos y células T, que está íntimamente relacionada con la disminución de la vía de señalización inflamatoria mediada por NF-kB62.
Rechazo crónicoSuele manifestarse mediante el desarrollo de bronquiolitis obliterante, debida a una infiltración celular de linfocitos y neutrófilos atribuida a un conjunto de factores, como una activación excesiva de la respuesta del sistema inmune innato, una angiogénesis anormal o una inadecuada regeneración epitelial y remodelado del tejido linfoproliferativo48.
Aunque cada modelo animal tiene ventajas y limitaciones para el estudio de la bronquiolitis obliterante, el modelo de bronquiolitis obliterante secundario al trasplante pulmonar murino resulta más próximo al rechazo crónico humano que otros modelos de bronquiolitis obliterante inducida por agentes químicos. Además, permite valorar de forma seriada tanto la función pulmonar como múltiples alteraciones morfológicas o en la función celular, y probar la eficacia de diversos fármacos. Otra ventaja sustancial viene dada por la disponibilidad de cepas knock-out y transgénicas de modelos de múltiples enfermedades humanas, lo que permite reproducir situaciones de rechazo crónico relativamente similares a las desarrolladas en distintas enfermedades respiratorias terminales, así como evaluar la contribución de potenciales vías de señalización.
Sin embargo, algunos factores de la anatomía y fisiología del pulmón murino ocasionan dificultades de traslación. En relación con los pulmones humanos, los bronquiolos murinos tienen una disminución de las glándulas submucosas y un mayor número de células Clara, lo que genera un entorno protector frente a la lesión del epitelio bronquiolar, principalmente mediante la secreción de proteína secretada por las células Clara y una solución similar al surfactante pulmonar, lo que determina una mayor lesión vascular que epitelial en estos modelos de rechazo58. No obstante, en los últimos años se han realizado importantes avances en el desarrollo de diversos modelos de bronquiolitis obliterante en el ratón63-65, así como estudios con microarrays de ADN para evaluar el rechazo crónico tras el trasplante66.
En conclusión, se han producido importantes desarrollos técnicos en el trasplante pulmonar murino, permitiendo la elección de diversas alternativas quirúrgicas con una notable viabilidad de los animales trasplantados. Esto determina una mayor accesibilidad a estos modelos experimentales quirúrgicos, que han demostrado su capacidad para generar conocimiento sobre los mecanismos patogénicos de la lesión por isquemia-reperfusión y del rechazo, con una potencial traslación al ser humano a medio plazo.
FinanciaciónEste trabajo ha sido subvencionado por la ayuda FPU2013-01638 a Daniel Ruiz-Pérez otorgada por el Ministerio de Educación, Cultura y Deporte, España. El financiador no tiene ningún papel en el diseño del estudio, recogida y análisis de los datos, ni en la preparación del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.