El ancho de distribución eritrocitaria (ADE) describe el grado de heterogeneidad en el tamaño de los hematíes. Un incremento de ADE se ha asociado con exceso de mortalidad en insuficiencia cardiaca y otras enfermedades crónicas. Dado que existe mayor riesgo de morbimortalidad cardiovascular en apnea obstructiva del sueño (AOS), es posible que estos pacientes presenten un ADE elevado.
MétodoSe reclutaron sujetos de 18 a 60 años remitidos a la Unidad de Trastornos Respiratorios del Sueño (UTRS) por sospecha de AOS. Se excluyeron sujetos con cualquier comorbilidad. En la poligrafía respiratoria se determinó el índice de apnea-hipopnea (IAH). El ADE se obtuvo a partir del hemograma. Al año de seguimiento se determinaron los cambios de ADE tras tratamiento con presión positiva continua en la vía respiratoria (CPAP).
ResultadosSe incluyeron 34 sujetos sin AOS y 138 con AOS con una edad de 40,5±9,8 y 45,6±9,2 (p=0,004) respectivamente. El ADE fue mayor en sujetos con AOS que en sujetos sanos: 13,40 (12,40-14,40) vs. 13,15 (12,07-14,23) (p=0,036). El IAH mostró una relación positiva e independiente con ADE tanto en el conjunto de la población (r=0,223; p=0,002) como en el grupo con AOS (r=0,231; p=0,005). No se observaron cambios significativos de ADE tras un año de tratamiento con CPAP.
ConclusionesEl ADE está aumentado en AOS en relación directa con su gravedad, sin embargo, sus niveles no se ven modificados por el tratamiento efectivo de la AOS con CPAP.
Red cell distribution width (RDW) describes heterogeneity in the size of red blood cells. An increase in RDW has been associated with excess mortality in heart failure and other chronic diseases. Since there is an increased risk of cardiovascular morbidity and mortality in obstructive sleep apnea (OSA), it is possible that these patients have a high RDW.
MethodWe recruited subjects aged 18 to 60 years referred to the sleep-disordered breathing unit for suspected OSA. Subjects with any comorbidity were excluded. Apnea-hypopnea index (AHI) was calculated from the respiratory polygraphy. The RDW was obtained from the complete blood count. Changes in RDW after one year of treatment with continuous positive airway pressure (CPAP) were determined.
ResultsWe included 34 healthy subjects and 138 with OSA, aged 40.5±9.8 and 45.6±9.2 (P=.004) years, respectively. The RDW was higher in subjects with OSA compared to healthy subjects: 13.40 (12.40 to 14.40) vs. 13.15 (12.07 to 14.23) (P=.036). AHI showed a positive independent relationship with RDW in both the whole population (r=0.223; P=.002) and the OSA group (r=0.231; P=.005). No significant changes were found in RDW after one year of CPAP therapy.
ConclusionsRDW increase in patients with OSA is directly associated with severity, although levels are not modified by the effective treatment of OSA with CPAP.
La apnea obstructiva del sueño (AOS) es una entidad muy prevalente en la población general asociada a deterioro de la calidad de vida, hipertensión arterial, enfermedades cardiovasculares, cerebrovasculares, accidentes de tráfico y un exceso de mortalidad1,2. En España, entre el 3 y el 6% de la población padece un síndrome de apnea e hipopnea del sueño (SAHS) sintomático y entre el 24 y el 26% sufre AOS, entendida como la presencia de apneas-hipopneas nocturnas en número superior a 5 eventos por hora de sueño (IAH>5)3. La AOS se asocia con grados variables de hipoxemia, hipercapnia, reducción de la presión intratorácica y activación simpática y cortical. Estos mecanismos intermedios potencialmente favorecen el desarrollo de enfermedades cardiovasculares, metabólicas y muerte prematura. En el momento actual, el diagnóstico de AOS debe establecerse mediante estudios de sueño a partir de la sospecha clínica. No disponemos de variables de utilidad clínica predictoras de riesgo cardiovascular propiamente asociadas a AOS, y sería deseable disponer de biomarcadores de riesgo cardiovascular que ayuden en la toma de decisiones al clínico, como por ejemplo, en qué casos se debe realizar estudio de sueño o en quién iniciar tratamiento vs. observación. La normativa española de manejo de la AOS recomienda la solicitud de un perfil analítico metabólico que incluya hemograma, bioquímica básica y perfil lipídico en todos los pacientes en los que se realiza un estudio de sueño1.
Entre las variables que se analizan de forma rutinaria en un hemograma se incluye el valor del ancho de distribución eritrocitaria (ADE). El ADE es una medida cuantitativa de la variabilidad del tamaño de los eritrocitos. Su valor se obtiene mediante un cálculo matemático (fig. 1), por lo que no supone coste económico. En la actualidad, se utiliza principalmente en el diagnóstico diferencial de la anemia4. Su variabilidad es independiente del estado nutricional, sexo y edad5. Recientes estudios demuestran que el aumento de ADE, incluso dentro del rango de referencia normal, está fuertemente asociado con un mayor riesgo de muerte y de episodios de enfermedad cardiovascular en los adultos de mediana edad y de edad avanzada6-15. El ADE podría actuar como un biomarcador de riesgo cardiovascular sensible a los cambios inflamatorios sistémicos y a la movilización de los depósitos de hierro durante el estrés oxidativo11. Se ha descrito relación de ADE con la gravedad de AOS en pacientes sin y con enfermedad cardiovascular asociada16–18 y su reducción tras tratamiento con presión positiva continua en la vía respiratoria (CPAP)19. Sin embargo, estos estudios incluyen un limitado número de pacientes, el seguimiento ha sido escaso y mayoritariamente incluyen pacientes con otras comorbilidades diferentes a AOS.
Hipotetizamos que el ADE es un biomarcador que identifica la presencia y gravedad de AOS en sujetos con sospecha de trastornos respiratorios de sueño.
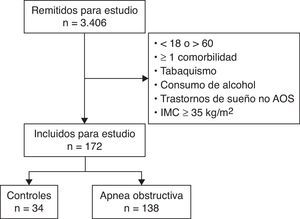
MétodosSujetos de estudioSe han utilizado los datos de un estudio prospectivo sobre anomalías epigenéticas en AOS actualmente en fase de análisis de resultados (EPIOSA, ClinicalTrials.gov: NCT02131610). El estudio incluyó sujetos de 18 a 60 años remitidos a la Unidad de Trastornos Respiratorios del Sueño (UTRS) del Hospital Universitario Miguel Servet de Zaragoza por sospecha de AOS entre febrero de 2013 y julio de 2014. La metodología general y los criterios de inclusión/exclusión se han descrito ampliamente20. En resumen, se han excluido fumadores activos o con una historia de tabaquismo de >5 paquetes/año, consumo regular de alcohol (media de ≥20gr/día), trastornos de sueño diferentes a AOS, o con cualquier comorbilidad para la cual fuese necesario la toma de algún fármaco de forma habitual. También se han excluido aquellos que presentaron cifras de presión arterial ≥140/90mmHg, hiperglucemia (>126mg/ml) o un IMC ≥35kg/m2 en la visita inicial. El protocolo del estudio fue aprobado por el Comité de Ética e Investigación Clínica de Aragón (03/2013).
ProcedimientosA todos los sujetos se les aplicó en la primera visita un protocolo estandarizado de pruebas complementarias que incluían: 1) cuestionarios clínicos (de salud general, de nutrición, de calidad de vida, de somnolencia diurna, de comorbilidades y de higiene de sueño); 2) antropometría y exploración general (presión arterial, peso, talla, y diámetros de cuello, cintura y cadera); 3) poligrafía cardiorrespiratoria a domicilio; 4) espirometría; 5) ecografía de arterias carótida interna, bulbo carotideo y arteria carótida común, y 6) analítica de sangre completa. La determinación de ADE se realizó usando un contador de células sanguíneas (Coulter® LH 780). Las pruebas complementarias, incluido el hemograma, se repitieron tras un año de evolución a todos los pacientes, independientemente del diagnóstico o no de AOS, de la gravedad del mismo, o del tratamiento recibido. La poligrafía se realizó y analizó siguiendo las recomendaciones de la SEPAR y de la iniciativa nacional del SAOS1.
El diagnóstico de AOS y su gravedad se estableció según el número de apneas e hipopneas por hora de registro (índice de apnea/hipopnea[IAH]). Se consideraron sanos aquellos con IAH <5. Tras el diagnóstico de AOS, a los sujetos se les prescribió CPAP según recomendaciones habituales1. Consideramos paciente eficientemente tratado aquel que usó CPAP un promedio de más de 4h al día a lo largo del periodo de seguimiento. El uso de CPAP fue evaluado en cada visita registrando las lecturas del contador de uso de la unidad de CPAP.
Análisis estadísticoLas variables categóricas se expresan como número de casos y porcentajes. Se aplicó el test de Kolmogorov-Smirnov para evaluar el tipo de distribución de las variables cuantitativas. Las variables con distribución normal son expresadas como media±desviación estándar y aquellas con distribución no normal, como mediana y rango intercuartílico. La comparación entre grupos se realizó mediante t de Student y ANOVA y mediante la prueba de U de Mann-Whitney o Kruskal-Wallis según correspondiera a cada variable por su tipo de distribución. Las diferencias entre variables con datos categóricos fueron establecidas mediante la prueba de Chi-cuadrado. La relación entre el valor individual del ADE y otras variables de interés clínico fue evaluada mediante modelos de regresión lineal ajustados. Los análisis estadísticos fueron realizados mediante la versión 20 del paquete estadístico SPSS (IBM Corporation, Somers NY, EE.UU).
ResultadosCaracterísticas de la poblaciónLa figura 2 refleja el diagrama de flujo de los participantes. En el análisis final se incluyeron 172 sujetos que cumplieron los criterios de inclusión/exclusión. La tabla 1 describe las características de la población, distribuida según presencia o no de AOS.
Características basales de los sujetos en estudio
| No AOS (n=34) | AOS (n=138) | p | |
|---|---|---|---|
| Edad, años | 40,5±9,8 | 45,6±9,2 | 0,004 |
| Hombres, n (%) | 19 (52,8%) | 110 (80,9%) | 0,001 |
| IMC, kg/m2 | 25,9±3,3 | 31,1±4,1 | 0,000 |
| Epworth | 10,3±5,0 | 10,3±4,8 | 0,973 |
| PAS, mmHg | 118,5±15,3 | 129,3±14,9 | 0,000 |
| PAD, mmHg | 74,0±11,8 | 80,1±11,4 | 0,005 |
| FVC, l | 4,48±0,91 | 4,38±1,06 | 0,611 |
| FEV1, l | 3,59±0,82 | 3,46±0,8 | 0,369 |
| Colesterol total, mg/dl | 200±36,3 | 214,2±39,1 | 0,05 |
| Colesterol LDL, mg/dl | 120 (72-162) | 132 (89-175) | 0,09 |
| Colesterol HDL, mg/dl | 54,2±9,3 | 48,5±10,5 | 0,004 |
| Triglicéridos, mg/dl | 93,5 (50,5-136,5) | 128,5 (42,5-214,5) | 0,000 |
| Glucemia, mg/dl | 86,5 (76,5-96,5) | 92 (73-111) | 0,017 |
| Creatinina, mg/dl | 0,82±0,15 | 0,87±0,14 | 0,106 |
| Hb, g/dl | 14,6 (12,7-16,5) | 14,9 (13,6-16,2) | 0,058 |
| PCR, mg/dl | 0,08 (0-0,24) | 0,23 (0-0,58) | 0,000 |
| ADE, % | 13,15 (12,07-14,23) | 13,40 (12,40-14,40) | 0,036 |
Se expresan como media±desviación estándar aquellas variables con distribución homogénea y como mediana (rango intercuartílico) aquellas con distribución no homogénea.
ADE: ancho de distribución eritrocitaria; AOS: apnea obstructiva del sueño; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; Hb: hemoglobina; HDL: high density lipoprotein; IMC: índice de masa corporal; IPA: índice paquetes/año; LDL: low density lipoprotein; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva.
El 92% de los sujetos eran de origen étnico caucásico. Respecto a los controles, los pacientes con AOS tenían, como valores medios, una edad mayor (40,5 vs. 45,6 p=0,004), un IMC más elevado (26 vs. 31, p<0,001) y niveles significativamente más elevados de presión arterial, colesterol, triglicéridos, glucemia y proteína C reactiva (PCR) (todas las diferencias con p<0,05).
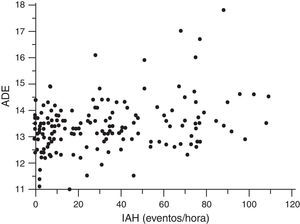
Ancho de distribución eritrocitariaLa mediana y el rango intercuartílico del ADE en toda la población al inicio del estudio fueron de 13,3 (12,3-14,3): en sujetos sanos fueron de 13,15 (12,07-14,23) y en pacientes con AOS, de 13,40 (12,40-14,40) (p=0,036). En la tabla 2 se refleja la relación de ADE con las características clínicas basales de los sujetos en estudio. El ADE mostró una relación significativa con el IMC (r=0,190; p=0,014), con la PCR (r=0,197; p=0,011), con el tiempo de registro con una SaO2 inferior a 90% (CT90) (r=0,215; p=0,007), y con el IAH (r=0,212; p=0,006) (fig. 3). En la misma tabla 2 se refleja un modelo ajustado de regresión múltiple en el que se fuerza la presencia de edad, Hb e IMC. Se aprecia como ADE sigue manteniendo una relación independiente positiva con IAH (r=0,223; p=0,002) y con el CT90 (r=0,232; p=0,002). En estos modelos también persisten como variables independientes relacionadas con ADE, el IMC y el nivel de PCR. Se realizó un análisis secundario para establecer, solo entre los pacientes con AOS, las relaciones entre ADE y gravedad de la AOS. Tras el ajuste en modelo de regresión múltiple, el ADE se sigue relacionando de forma significativa con el CT90 (r=0,255; p=0,002) y el IAH (r=0,231; p=0,005). En este análisis restringido para pacientes con AOS, el IMC y la PCR no muestran relación independiente con ADE.
Relación de ADE con las variables basales en la población total (n=172)
| Regresión simple | Regresión múltiple (modelo con IAH) | Regresión múltiple (modelo con CT90) | ||||
|---|---|---|---|---|---|---|
| r | p | r | p | r | p | |
| Edad, años | 0,082 | 0,291 | ||||
| IMC, kg/m2 | 0,190 | 0,014 | 0,181 | 0,01 | 0,151 | 0,03 |
| Epworth | 0,151 | 0,054 | ||||
| IPA | 0,071 | 0,366 | ||||
| PAS, mmHg | 0,022 | 0,783 | ||||
| PAD, mmHg | 0,085 | 0,280 | ||||
| Colesterol total, mg/dl | –0,014 | 0,857 | ||||
| Colesterol LDL, mg/dl | 0,095 | 0,232 | ||||
| Colesterol HDL, mg/dl | –0,150 | 0,053 | ||||
| Triglicéridos, mg/dl | –0,005 | 0,949 | ||||
| Glucemia, mg/dl | 0,109 | 0,163 | ||||
| Creatinina, mg/dl | –0,038 | 0,627 | ||||
| Hb, g/dl | –0,074 | 0,343 | ||||
| PCR, mg/dl | 0,197 | 0,011 | 0,236 | 0,001 | 0,146 | 0,035 |
| CT90 | 0,215 | 0,007 | – | – | 0,232 | 0,002 |
| IAH | 0,212 | 0,006 | 0,223 | 0,002 | – | – |
ADE: ancho de distribución eritrocitaria; CT90: tiempo de registro con una SaO2 inferior a 90%; Hb: hemoglobina; HDL: high density lipoprotein; IAH: índice de apnea-hipopnea; IMC: índice de masa corporal; IPA: índice paquetes/año; LDL: low density lipoprotein; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva.
En la tabla 3 se reflejan las características de los participantes en la visita inicial y tras un año de seguimiento. De los 34 sujetos sanos, 32 acudieron para reevaluación.
Características basales y tras un año de seguimiento en sujetos sanos y pacientes tratados o no tratados con CPAP
| No AOS (n=32) | AOS sin tratamiento con CPAP (n=44) | AOS en tratamiento con CPAP (n=71) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Basal | 1 año | p | Basal | 1 año | p | Basal | 1 añoa | p | |
| IAH | 2,1±1,3 | 2,3±2,1 | 0,648 | 28±45 | 29±43 | 0,144 | 44±39 | 4.7±3.9 | <0,001 |
| Epworth | 10±5,5 | 8,3±4,6 | 0,029 | 9,1±4,3 | 7,1±4,1 | 0,003 | 11,5±4,8 | 6,9±5,1 | 0,000 |
| IMC, kg/m2 | 25,5±3,1 | 25,6±3,3 | 0,749 | 28,4±4,4 | 28,5±4,5 | 0,687 | 33,1±5,1 | 32,7±4,8 | 0,025 |
| PAS, mmHg | 117,9±16,5 | 112,4±13,9 | 0,055 | 122,7±14,1 | 121,9±11,8 | 0,701 | 132,7±13,7 | 131,4±14,1 | 0,468 |
| PAD, mmHg | 73,7±11,7 | 68,5±9 | 0,007 | 74,1±10,3 | 73,7±8,7 | 0,815 | 83,4±11,03 | 78,1±9,9 | 0,001 |
| Colesterol total, mg/dl | 201,5±39 | 201,3±39,1 | 0,977 | 211,6±37,9 | 210±32,4 | 0,648 | 216,7±39,8 | 211,9±36,1 | 0,248 |
| Colesterol LDL, mg/dl | 119 (102-141) | 124 (98-141) | 0,864 | 129 (109-156) | 128 (113-146) | 0,971 | 137 (117-161,5) | 129 (110-152) | 0,205 |
| Colesterol HDL, mg/dl | 54,3±9,1 | 52,9±10,5 | 0,303 | 51,1±9,6 | 50,8±10,9 | 0,790 | 46,8±11,2 | 46,9±10,4 | 0,830 |
| Triglicéridos mg/dl | 94 (76-122) | 92 (71-125) | 0,546 | 114 (88-167) | 125 (81-168) | 0,683 | 137 (102-192) | 140 (98-194) | 0,425 |
| Glucemia mg/dl | 88 (82-97) | 84 (76-93) | 0,039 | 89 (82-101) | 90 (85-98) | 0,054 | 95 (85-102) | 95 (90-102) | 0,529 |
| Creatinina mg/dl | 0,83±0,12 | 0,83±0,13 | 0,823 | 0,86±0,14 | 0,83±0,12 | 0,098 | 0,8±0,14 | 0,8±0,14 | 0,979 |
| Hb g/dl | 16,6 (13,4-15,2) | 14,3 (13,5-15,1) | 0,534 | 15 (14,3-15,6) | 15,2 (14,3-15,5) | 0,447 | 14,9 (14,3-15,7) | 14,7 (13,8-15,4) | 0,042 |
| PCR mg/dl | 0,09 (0,04-0,23) | 0,11 (0,05-0,27) | 0,673 | 0,16 (0,1-0,35) | 0,18 (0,09-0,52) | 0,006 | 0,28 (0,14-0,49) | 0,38 (0,15-0,57) | 0,540 |
| ADE % | 13,1 (12,4-13,6) | 13,2 (12,6-13,5) | 0,942 | 13,3 (12,8-13,7) | 13,3 (12,9-13,7) | 0,571 | 13,4 (13,05-14,1) | 13,6 (13,1-14,05) | 0,234 |
Se expresan como media±desviación estándar aquellas variables con distribución homogénea y como mediana (rango intercuartílico) aquellas con distribución no homogénea.
ADE: ancho de distribución eritrocitaria; AOS: apnea obstructiva del sueño; CPAP: presión positiva continua en la vía respiratoria; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; Hb: hemoglobina; HDL: high density lipoprotein; IAH: índice de apnea-hipopnea; IMC: índice de masa corporal; IPA: índice paquetes/año; LDL: low density lipoprotein; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PCR: proteína C reactiva.
Entre los pacientes con AOS no hubo pérdidas de seguimiento. De ellos, 85 iniciaron tratamiento con CPAP y 71 lo cumplimentaron de forma adecuada y fueron agrupados en el grupo «AOS en tratamiento con CPAP».
En los otros 14 casos en los que se inició CPAP, este tratamiento fue rechazado posteriormente por 4 pacientes y fue retirado por falta de adherencia en 10. Los 14 casos formaron parte del grupo de pacientes con «AOS sin tratamiento CPAP». El resto de pacientes de este grupo no recibieron tratamiento con CPAP por no cumplir criterios médicos (n=21) y por negativa del paciente al uso del sistema (n=9).
En esta tabla no se incluyen los datos de 23 pacientes con AOS que recibieron tratamiento alternativo a CPAP (18 con diversas formas de cirugía de la vía aérea superior y 2 con dispositivos de avance mandibular) o rechazaron la realización de nueva PCR (n=3). En sujetos sanos y en pacientes con AOS que no recibieron tratamiento con CPAP, no existieron cambios tras un año de evolución en las variables estudiadas, incluyendo el nivel de ADE. En pacientes con AOS tratados con CPAP, el nivel de somnolencia diurna medido por el cuestionario de Epworth y la presión diastólica se redujeron significativamente durante este periodo, sin embargo, tampoco los niveles de ADE cambiaron de forma significativa. Un subanálisis agrupando a los pacientes según la gravedad de AOS basada en el IAH (p.e. 5 a 15, 15 a 30 o >30), no mostró cambios de ADE, independientemente de si se había recibido tratamiento o no con CPAP.
DiscusiónEl principal resultado de este estudio indica que el ADE es mayor en pacientes con AOS que en sujetos sanos, y que está asociado de forma independiente con el nivel de gravedad de la AOS medido por IAH o por tiempo de registro en hipoxemia. Sin embargo, deberían realizarse nuevos estudios para evaluar la potencial utilidad de ADE como biomarcador con potencial valor discriminativo entre sujetos sanos y con AOS. El otro resultado relevante es que los niveles de ADE no se modifican con el tratamiento efectivo de CPAP. Recientemente, el ADE ha sido evaluado como posible biomarcador en diversas cardiopatías por su relación positiva con la mortalidad cardiovascular7-14. Los pocos estudios que han evaluado la relación de ADE con AOS indican que sus niveles están elevados en relación con la gravedad de la enfermedad16-19. La hipótesis que se viene justificando, para explicar el nivel elevado de ADE en AOS, sería la presencia de inflamación sistémica que movilizaría los depósitos de hierro y, consecuentemente, produciría un aumento de los valores de ADE. La asociación entre AOS e inflamación sistémica sigue siendo tema de debate. Investigaciones principalmente realizadas con animales de laboratorio indican que la hipoxia intermitente juega un papel en el desarrollo de ateroesclerosis acelerada, que tendría a la inflamación sistémica como uno de los principales mecanismos intermediarios21. Mediante ecografía carotidea, se ha demostrado como la CPAP reduce el espesor de la capa íntima-media arterial como expresiones de la mejoría de la ateroesclerosis subclínica22. Sin embargo, estudios controlados no han demostrado una reducción del nivel de inflamación sistémica evaluada mediante diversas citoquinas proinflamatorias tras meses de tratamiento mediante CPAP23 Así pues, es cuestionable en el momento actual el papel de la inflamación como factor explicativo de la consistente elevación de la morbimortalidad cardiovascular en AOS2. Los datos de nuestro estudio indican que el nivel de PCR está elevado en pacientes con AOS respecto a sujetos sanos. Sin embargo, el tratamiento efectivo mediante CPAP no redujo los niveles de PCR ni de ADE, apoyando los resultados del ensayo aleatorizado de Stradling et al.23, en el sentido de la ineficacia de CPAP para reducir el estado inflamatorio sistémico asociado a la AOS.
El hallazgo de una correlación positiva entre ADE y PCR en el conjunto de la población y entre los pacientes con AOS refuerza la idea de que el ADE podría ser un biomarcador de inflamación sistémica (tabla 2). Sin embargo, en pacientes con AOS no existió relación independiente entre ADE y PCR. Ello sugiere que estos 2 biomarcadores, al menos en AOS, reflejan procesos fisiopatológicos diferentes. Tras un año de tratamiento con CPAP, el ADE no se modifica en pacientes con AOS y, por tanto, nuestros resultados no confirman resultados previos en los que sí se modificaba el ADE con tratamiento con CPAP19. En este trabajo, el seguimiento era de solo 6 meses, la población era más reducida (n=58), solo se incluyeron pacientes con un IAH>30 y la mayoría padecían otras comorbilidades que complicaban la interpretación de los resultados que ADE, al igual que otros biomarcadores circulantes como PCR, no cambian con CPAP. Nuestros resultados no confirman el efecto de la CPAP sobre el nivel de ADE. No obstante, las poblaciones estudiadas son diferentes, ya que nuestros pacientes fueron seleccionados con la idea de evitar potenciales causas de inflamación sistémica diferente a la AOS y evitar sesgos de interpretación. La ausencia de efecto de la CPAP sobre ADE no indicó falta de eficacia del tratamiento. Por el contrario, en pacientes con AOS que han recibido terapia con CPAP observamos un descenso estadísticamente significativo, tras un año de terapia, de los valores del índice Epworth y de las cifras de PAD, hallazgos similares a los descritos repetidamente como efecto de la CPAP24.
Los resultados de este estudio deben interpretarse teniendo en cuenta algunas limitaciones del mismo. La principal limitación del estudio es su carácter observacional y la ausencia de aleatorización para evaluar el efecto de la CPAP. Sin embargo, se ha incluido un número de sujetos suficientes que, de acuerdo a la literatura, permite determinar cambios debidos a la intervención con CPAP. Por otra parte, los grupos de sujetos sanos con AOS no son comparables completamente, dado que los primeros son algo más jóvenes, incluyen un porcentaje mayor de mujeres, muestran un IMC menor y niveles menos elevados de presión arterial y de lípidos en sangre.
En segundo lugar, los criterios de inclusión y exclusión de nuestra serie son muy restrictivos y se circunscriben a sujetos de 18 a 60 años. Ello impide una generalización de los resultados hacia el conjunto de la población con AOS.
Sin embargo, al ser restrictivos en la selección de los participantes, se evitaron sesgos de selección (p.e. la inclusión de sujetos con enfermedades crónicas que están asociadas a un incremento de ADE) que permiten establecer relaciones asociativas robustas entre ADE y AOS.
ConclusionesEn una población de pacientes con AOS sin comorbilidad asociada, el ADE se encuentra elevado respecto a sujetos sanos sin AOS. El nivel de ADE se relaciona de forma independiente con la gravedad de la AOS sin comorbilidad asociada.
Sin embargo, el ADE no cambia con el tratamiento efectivo de la AOS con CPAP y se cuestiona en este estudio la utilidad clínica de ADE en el manejo de pacientes con AOS.
FinanciaciónEPIOSA es un Proyecto de investigación financiado por el Instituto de Salud Carlos III (PI12/01275), la Sociedad Española de Neumología y Cirugía Torácica (SEPAR 71/2012) y la Sociedad Aragonesa de Aparato Respiratorio (SADAR 02/2013).
AutoríaLeón E. ha tenido acceso a los datos y los ha completado e integrado en una base de datos para posteriormente llevar a cabo el análisis estadístico. León E. ha sido el autor principal. Marin JM ha supervisado y ha ayudado a completar el estudio. Gómara S. ha contribuido al análisis e interpretación de resultados. Todos los autores han contribuido a la redacción del manuscrito.
Conflicto de interesesLos autores declaran no tener conflicto de intereses en relación con el tema objeto de este estudio.
Agradecemos la participación del equipo al completo de la Unidad de Trastornos Respiratorios del Sueño, así como a los trabajadores de la Unidad de Investigación Traslacional del Hospital Miguel Servet de Zaragoza por su gran labor con la organización y recogida de datos.