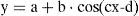La saturación periférica de oxígeno (SpO2) medida por oximetría de pulso es ampliamente usada en la práctica clínica, pero sus fluctuaciones durante las 24h del día han sido poco exploradas. Recientemente describimos que niños hospitalizados por causas no cardiopulmonares tenían una variación circadiana de la SpO2. Este hallazgo necesitaba ser corroborado en niños sanos, lo que constituyó la finalidad del presente estudio.
Población y métodoNiños sanos residentes en una casa cuna gubernamental se estudiaron mediante oximetría de pulso cada 2h a lo largo de 24h.
ResultadosSe incluyeron 82 niños de un mes a 6,5 años de edad (media±error estándar: 3,06±0,16 años), con peso para la talla en el percentil 65,5±2,9. En 65 (79,3%) niños los valores de SpO2 siguieron una curva sinusoidal sugestiva de un ritmo circadiano. El conjunto de curvas sinusoidales en esta población tuvo un mesor de 95,10±0,08%SpO2 y un período de 21,05±0,54h (en el 53,8% de estos niños el período estuvo entre 20 y 28h). El valor máximo de SpO2 se alcanzó a las 3:14PM±16min, y el más bajo a las 5:16AM±48min. Al dividir las 24h en 4 períodos se demostró que los valores más altos de SpO2 se alcanzaban entre las 2PM y las 8PM.
ConclusionesEn esta población de niños clínicamente sanos existió una variación circadiana en la oximetría de pulso, con valores máximos a media tarde y mínimos en la madrugada.
Peripheral oxygen saturation (SpO2) measured by pulse oximetry is widely used in clinical practice, but its fluctuations over the course of the 24h of a day have not been explored at length. Recently, we reported that children hospitalized due to non-cardiopulmonary causes had a circadian variation in SpO2. This finding needed to be corroborated in healthy children, which is the objective of the present study.
Patients and methodsHealthy children residing in a state foster home were studied with pulse oximetry every 2h for 24h.
ResultsEighty two children were included in the study, ranging in age from one month to 6.5 years (average±standard error of 3.06±0.16 years), with a weight-for-length/height percentile of 65.5±2.9. In 65 (79.3%) children, the SpO2 levels followed a sinusoidal curve suggesting circadian rhythm. The total group of sinusoidal curves in this population had a mesor of 95.10±0.08%SpO2, period of 21.05±0.54h (in 53.8% of these children, the period was between 20 and 28h). The maximum SpO2 was reached at 3:14PM±16min, and the minimum at 5:16AM±48min. When the 24h were divided into four periods, it was demonstrated that the highest SpO2 levels were reached between 2PM and 8PM.
ConclusionsIn this population of clinically healthy children, there was a circadian variation in pulse oximetry, with maximum values in the late afternoon and minimal values in the early morning.
La oximetría de pulso es un procedimiento sumamente utilizado en el ámbito clínico y quirúrgico, y es una herramienta indispensable en las unidades de cuidados intensivos1. Esta técnica se realiza habitualmente colocando un sensor en un dedo de cualquier extremidad o en otros sitios como el lóbulo de la oreja. El equipo emite un rayo de luz a 2 diferentes longitudes de onda (∼660 y ∼940nm, alternativamente), que son absorbidos parcialmente por la hemoglobina2. La cantidad de absorción dependerá de si la hemoglobina está unida al oxígeno o no. Mediante el cálculo de la cantidad de luz absorbida a cada una de las longitudes de onda se determina un índice que se compara automáticamente con una tabla o ecuación de valores de referencia, obteniéndose así el porcentaje de saturación de hemoglobina en sangre periférica (SpO2)3.
Diversos estudios han publicado valores de referencia para la SpO2 tanto en niños4-9 como en adultos10,11. Sin embargo, estos estudios suelen realizarse a través de polisomnografía nocturna o con registros de relativamente corta duración, por lo que no hacen un análisis completo de las 24h del día. Los trabajos encaminados a evaluar posibles cambios circadianos en la oxigenación son muy escasos. En 1972 Reinberg y Gervais12 describieron que la PaO2 era menor durante la noche en adultos sanos o en pacientes con obstrucción crónica de la vía aérea. En 1985 Updike et al.13 estudiaron a 6 recién nacidos pretérmino y concluyeron que en la mitad de ellos la presión transcutánea de oxígeno (tcPO2) seguía un ritmo circadiano, alcanzando valores mínimos durante la madrugada. Por el contrario, en 1985 Postma et al.14 no pudieron demostrar un ritmo circadiano de la PaO2 o la SpO2 en 8 adultos sanos, aunque dicho ritmo sí fue evidente en 8 pacientes con obstrucción crónica de la vía aérea. En un estudio reciente nosotros evaluamos los valores de SpO2 en 131 niños de entre 23 días y 16 años de edad internados en el Hospital de Pediatría del Centro Médico Nacional Siglo XXI debido a diversas enfermedades, pero sin alteraciones cardiorrespiratorias agudas o crónicas15. A cada niño se le realizó oximetría de pulso aproximadamente cada 2h durante 24h, y encontramos que en la mayoría de ellos (85%) las mediciones de SpO2 seguían un ritmo sinusoidal circadiano, con valores máximos a media tarde (∼5:00PM) y mínimos en la madrugada (∼3:00AM). Evidentemente, la principal desventaja de este estudio fue que se realizó en niños con alguna enfermedad, por lo que era indispensable explorar si dicho fenómeno de ritmicidad circadiana se presentaba igualmente en niños clínicamente sanos, lo que constituyó el objetivo del presente trabajo.
Material y métodosSe trató de un estudio prospectivo, longitudinal y observacional realizado entre junio y noviembre de 2009 en una institución gubernamental de asistencia social ubicada en la ciudad de México (Centro Nacional Modelo de Atención, Investigación y Capacitación Casa Cuna Tlalpan, Sistema Nacional para el Desarrollo Integral de la Familia [DIF]). Los niños pueden ingresar en la casa cuna a cualquier edad (entre 0 y 6años), y a su ingreso se les abre un expediente y se les realiza un examen clínico completo, así como biometría hemática, química sanguínea y coproparasitoscopia. Se revisa el esquema de vacunación y se aplican las vacunas que faltan. Las instalaciones cuentan con una enfermera y un médico en cada turno que supervisan diariamente la salud de los niños. Además, a partir de su ingreso se lleva a cabo un programa de atención del niño sano que incluye revisiones periódicas (al menos cada 3 meses) en las que se efectúan exámenes dentales, visuales, ortopédicos, etc. Fuera de las actividades programadas de acuerdo a su edad (aseo, alimentación, educación escolar, etc.), los niños están en posibilidades de convivencia libre con los demás.
Se seleccionaron para participar en el estudio a los niños que según su historia clínica y la exploración física se encontraban clínicamente sanos, sin antecedente de ronquidos frecuentes y sin que hubieran tenido infección de vías aéreas en los últimos 30 días. Previa firma del consentimiento informado por parte del representante legal, a los niños que ingresaron al estudio se les midió la SpO2 aproximadamente cada 2h durante un período de 24h, empleando para ello un oxímetro de pulso portátil (modelo 513, Novametrix Medical Systems Inc., Wallingford, CT, EUA) equipado con un sensor pediátrico no desechable de tipo pinza rígida (modelo DB-9). Según las indicaciones del fabricante, la precisión de este oxímetro es de ±2% en valores de SpO2 entre 80 y 100%. El sensor se colocó en un dedo de la mano, seleccionando el que mejor se ajustaba a su concavidad. Después de un período de estabilización de entre 10 a 15s, se procedió a la lectura de la SpO2 durante 1min, seleccionando como valor final el más constante durante ese lapso. Si el niño estaba dormido, la medición de la oximetría se hizo en esas condiciones, sin despertarlo. Si el niño estaba despierto, se aseguró que estuviera en reposo al menos 5min antes de las mediciones. Todas las mediciones las llevaron a cabo 2 de los médicos que participaron en el estudio (IRG y JAG). Estos valores y los de otras variables (pulso, temperatura timpánica, condiciones, etc.) se registraron en la hoja de captura.
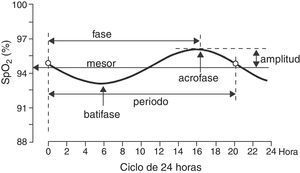
Para cada niño se determinó cuál era la función sinusoidal (método de Levenberg-Marquardt) que mejor ajustaba los 12 puntos (es decir, los 12 valores de SpO2 medidos en el ciclo de 24h), para lo cual se empleó un programa de computación (CurveExpert v1.38, Daniel Hyams, EUA). Este mismo procedimiento se realizó reuniendo todos los valores de SpO2 de todos los niños, para obtener una sola ecuación global. La presencia de una función sinusoidal con ciclo cercano a 24h (entre 20 y 28h) corroboró la existencia de una variabilidad circadiana de la SpO2. Una función sinusoidal, como la ilustrada en la figura 1, tiene por fórmula general:
donde la función y es el valor de SpO2 en la fracción del día seleccionada (x), la constante a corresponde al mesor (midline estimating statistic of rhythm, cuyo valor es muy parecido al promedio de las mediciones de SpO2 en un ciclo completo), b es la amplitud (distancia desde el mesor hasta el punto más bajo o alto de la curva), c es 2π/período (el período es la duración de un ciclo completo, que en este caso se espera sea cercano a 24h) y d es la fase (momento del período en el que se alcanza el valor máximo de SpO2). Por lo tanto, una vez obtenida la fórmula de la función sinusoidal es posible conocer la hora en que ocurren los valores máximo y mínimo de SpO2, así como el grado de variación (máximo-mínimo). El posible ritmo circadiano se evaluó también dividiendo al ciclo de 24h en 4 períodos de 6h cada uno (2-8, 8-14, 14-20 y 20-2h).La mayoría de las variables siguieron una distribución normal según la prueba de Kolmogorov-Smirnov, por lo que se empleó estadística paramétrica para su análisis, incluyendo análisis de regresión y correlación y prueba t de Student. La única variable que no siguió una distribución normal fue la medición de la SpO2 en 4 períodos de 6h cada uno, por lo que en ella se empleó estadística no paramétrica mediante prueba de Kruskal-Wallis seguida por prueba de Dunn para comparaciones múltiples.
El protocolo fue aprobado por la Comisión Nacional de Investigación en Salud del IMSS con el número 2008-785-040, así como por la Dirección General de Rehabilitación y Asistencia Social del DIF mediante oficio 221 000 00/668/09.
ResultadosSe estudiaron 82 niños de entre un mes y 6,5 años de edad (media 3,06±0,16 años [error estándar]), 43 (52,4%) del sexo femenino, peso de 12,9±0,39kg y estatura de 87,8±1,55cm. Según los valores de referencia de la OMS, el indicador de peso para la talla estuvo en el percentil 65,5±2,9; ninguno de los niños estaba por debajo del percentil 5, y solo 9 niños estaban por encima del percentil 95.
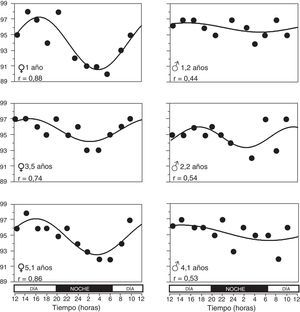
En 65 (79,3%) niños los valores de SpO2 tomados durante las 24h pudieron ajustarse a una curva sinusoidal. La figura 2 muestra algunos ejemplos de estos registros. No hubo diferencias estadísticamente significativas en las características antropométricas de estos niños y los 17 niños en quienes no fue posible obtener un ajuste sinusoidal. Tampoco hubo diferencias en el promedio de su SpO2 o en los valores mínimos y máximos. Al conjuntar todas las curvas sinusoidales el promedio del mesor fue de 95,10±0,08%SpO2 y el correspondiente a la amplitud, de 1,39±0,07%SpO2. El período tuvo una duración promedio de 21,05±0,54h, y en 35 (53,8%) de estos niños este estuvo comprendido entre 20 y 28h. La hora en que se alcanzó el valor más alto de SpO2 (acrofase) fue a las 3:14PM±16min, mientras que el valor más bajo (batifase) se dio a las 5:16AM±48min. A su vez, los valores más altos y más bajos de SpO2 tuvieron promedios de 96,49±0,07 y 93,71±0,14%SpO2, respectivamente, y concordando con esto último las diferencias máximas alcanzaron un promedio de 2,77±0,14%SpO2.
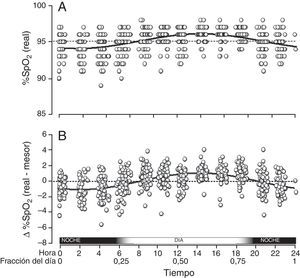
Al conjuntar todas las mediciones de SpO2 de todos los niños que tuvieron cambios circadianos se encontró que se ajustaban a una curva sinusoidal única, con coeficiente de correlación r=0,47 (tabla 1 y fig. 3A). Este coeficiente fue mayor cuando en lugar de usar los valores originales de SpO2 se usaron las diferencias de cada valor con respecto a su respectivo mesor. Así, con este último enfoque la curva sinusoidal resultante tuvo una r=0,51, con fórmula y=0,022+1,032·cos(6,192x–3,671) (tabla 1 y fig. 3B). Según esta ecuación, el período tuvo una duración de 24h 21min, la acrofase se alcanzó por la tarde (2:14PM), mientras que la batifase ocurrió por la madrugada (2:03AM). La diferencia entre el valor más alto y más bajo de SpO2 fue de 2,06 puntos porcentuales.
Características de las curvas de SpO2, Δ SpO2, frecuencia cardiaca y temperatura timpánica, calculadas después de conjuntar los datos de todos los niños y calcular una función sinusoidal única para cada variable
| Característica | Curva usando %SpO2 real | Curva usando Δ %SpO2 (real – mesor) | Curva de frecuencia cardiaca (latidos/min) | Curva de temperatura (°C) |
| Mesor (%SpO2) | 95,11 | 0,02 | 101,13 | 36,24 |
| Máximo (%SpO2) | 96,13 | 1,05 | 111,64 | 36,54 |
| Mínimo (%SpO2) | 94,09 | –1,01 | 90,62 | 35,93 |
| Período (h) | 24,93 | 24,35 | 22,89 | 19,86 |
| Acrofase (h) | 14:19 | 14:14 | 13:28 | 12:30 |
| Batifase (h) | 01:51 | 02:03 | 02:01 | 02:34 |
| Coeficiente de correlación | 0,47 | 0,51 | 0,48 | 0,37 |
Acrofase: hora del día en que se alcanzó el valor máximo; batifase: hora de la noche en que se alcanzó el valor mínimo.
Valores conjuntos de SpO2 obtenidos de los 65 niños que tuvieron un patrón sinusoidal. A) Cada círculo corresponde al valor real de cada medición de SpO2. B) Ya que las curvas individuales de cada niño podían estar situadas a niveles distintos de SpO2 (es decir, más arriba o más abajo con respecto al eje Y), los valores reales de SpO2 de cada niño se ajustaron con respecto al mesor del mismo niño, con lo cual se homogeniza la posición de las curvas y se ilustra mejor la variabilidad circadiana.
Con respecto a la frecuencia cardiaca y la temperatura corporal, al conjuntar todas las mediciones de los niños también se obtuvieron patrones sinusoidales (tabla 1). Para el caso de la frecuencia cardiaca la ecuación de la función sinusoidal fue y=101,13+10,51·cos(6,59x–3,70), por lo que el período fue de 22h 54min y la acrofase y batifase ocurrieron a las 1:28PM y 2:01AM, respectivamente. Para la temperatura corporal la función fue y=36,24+0,30·cos(7,59x–3,95), con un período de 19h 52min, acrofase a las 12:30PM y batifase a las 2:34AM.
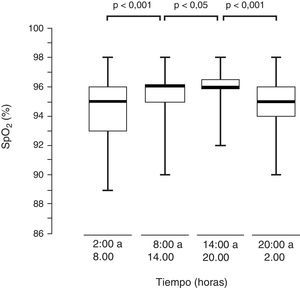
Al dividir las mediciones de SpO2 de los 82 niños en 4 intervalos de 6h cada uno se observó que hubo modificaciones progresivas de sus valores, alcanzando su máximo entre las 2:00PM y las 8:00PM (fig. 4).
DiscusiónCon mucha frecuencia los organismos vivos presentan cambios a nivel bioquímico, celular y/o funcional durante el ciclo de 24h, y la presencia de este reloj biológico es una gran ventaja en la adaptación al ambiente16. El sistema cardiovascular y el aparato respiratorio presentan este tipo de variaciones circadianas17,18. Sin embargo, una de sus posibles consecuencias, la modificación circadiana de la SpO2, ha sido poco explorada. En un estudio previo realizado en niños que estaban hospitalizados por enfermedades no cardiopulmonares se encontró que la SpO2 tenía una variación circadiana15. En el presente estudio hemos evaluado si este fenómeno se presenta también en niños clínicamente sanos. Nuestros resultados corroboran que dicha variación circadiana de la SpO2 está presente, alcanzando valores máximos a media tarde y valores mínimos en la madrugada. El presente estudio arrojó, sin embargo, algunas diferencias con respecto al previo. Así, los niños hospitalizados tuvieron un mesor ligeramente más bajo (mediana, 94,2%SpO2), una mayor amplitud del ritmo circadiano (mediana, 1,6%SpO2) y la acrofase se alcanzó más tarde (mediana, 4:53PM). Si bien parte de estas diferencias pudieran deberse a que el rango de edad era mayor (23 días a 16 años; mediana, 6,9años), queda la posibilidad de que también hubiera influido en ellas su estancia en un ambiente hospitalario.
Aunque en el estudio no investigamos las causas de esta variación diurna-nocturna de la SpO2, es posible que sea debida a cambios en los 2 principales factores que determinan el grado de oxigenación de la sangre: la ventilación (V’) y la circulación pulmonar (Q’), en lo que se denomina la relación V’/Q’. Con respecto a la ventilación, se sabe que el calibre de las vías aéreas alcanza su máxima apertura alrededor de las 4:00 de la tarde y la menor hacia las 4:00 de la madrugada19,20. Algunos de los factores neurohormonales que influyen en la circulación pulmonar también siguen un patrón circadiano. Por ejemplo, se conoce que el tono vagal y la concentración plasmática de histamina, capaces de provocar vasodilatación de la microcirculación pulmonar, son mayores en la madrugada y menores a media tarde21. De forma inversa, el tono simpático y las concentraciones plasmáticas de adrenalina y esteroides suprarrenales, que son factores que promueven vasoconstricción, son menores en la madrugada y mayores a media tarde22,23. Por lo tanto, las fluctuaciones en la ventilación alveolar y la circulación pulmonar durante las 24h del día pueden dar lugar a cambios progresivos en la relación V’/Q’ y, por lo tanto, de la SpO215. El máximo desequilibrio de esta relación (es decir, la menor ventilación con la mayor perfusión), que se traduciría en una disminución de la SpO2, teóricamente se alcanzaría durante la madrugada.
Los resultados encontrados en este estudio podrían tener implicaciones en la práctica clínica. En nuestro estudio la diferencia entre el valor más alto y más bajo de SpO2 fue en promedio de 2,77 puntos porcentuales, lo que parece una diferencia relativamente pequeña. Sin embargo, hubo niños que alcanzaron diferencias de hasta 6%SpO2, y una caída de esa magnitud podría ser clínicamente relevante en pacientes con afecciones cardiopulmonares. Por otro lado, recientemente se ha propuesto que si a todos los recién nacidos se les realiza una oximetría de pulso después de las 24h de vida y antes de salir del hospital, podrían detectarse cardiopatías congénitas potencialmente graves entre los que presentan cifras de SpO2 menores o iguales a 90-95%, lo que ayudaría a prevenir una mayor morbilidad o mortalidad en estos niños24-26. Evidentemente, la cifra que se ponga como límite deberá considerar la variación circadiana de la SpO2.
La altitud sobre el nivel del mar es el determinante principal de la presión absoluta de oxígeno en el aire inspirado y, por tanto, de la cantidad de oxígeno alveolar disponible para su difusión hacia el torrente circulatorio. Debido a ello, se ha comprobado ampliamente que los valores de SpO2 descienden paulatinamente desde ∼97% a nivel del mar hasta ∼87% a una altitud de 4.000m27. El presente estudio se llevó a cabo en la Ciudad de México, situada a 2.240m sobre el nivel del mar, por lo que los valores absolutos de SpO2 podrían ser diferentes a otras altitudes. Sin embargo, consideramos muy probable que la variabilidad circadiana de la SpO2 seguirá presentándose independientemente de la altitud y de la presión atmosférica de oxígeno.
Existen en el mercado oxímetros que pueden almacenar las determinaciones de SpO2 de forma continua durante 24h o más. Sin embargo, su utilidad en el análisis circadiano de la SpO2 es todavía incierta, pues no habría manera de conocer las condición en que se encontraba el niño (jugando, tosiendo, comiendo, durmiendo, llorando, etc.).
En conclusión, en el presente estudio en niños clínicamente sanos encontramos una variación circadiana en los valores de oximetría en los niños sanos, con un período promedio cercano a 21h y valores más altos de SpO2 por la tarde (∼3:14PM) y más bajos en la madrugada (∼5:16AM).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AgradecimientosLos autores agradecen a las autoridades y al personal del Centro Nacional Modelo de Atención, Investigación y Capacitación Casa Cuna Tlalpan, así como a la Dirección General de Rehabilitación y Asistencia Social del Sistema Nacional para el Desarrollo Integral de la Familia, su invaluable apoyo para la realización de este estudio.