La silicosis se asocia con aumento del riesgo de padecer alguna de las enfermedades reumatológicas autoinmunitarias sistémicas (ERAS), aunque no se conocen las implicaciones clínicas de esta asociación. El objetivo del estudio es determinar la prevalencia de ERAS y de marcadores de autoinmunidad en una cohorte de pacientes con exposición a inhalación de polvo de sílice y evaluar su impacto clínico.
MétodoEstudio observacional prospectivo, en pacientes atendidos en una consulta monográfica de silicosis, desde 2009 hasta diciembre 2017. El diagnóstico de ERAS se confirmó por un especialista en Reumatología según criterios de la Sociedad Española de Reumatología. Se analizaron marcadores de autoinmunidad, pruebas de función respiratoria, progresión radiológica e impacto clínico medido por visitas a Atención Primaria, a Servicio de Urgencias, ingresos hospitalarios por causa respiratoria y mortalidad.
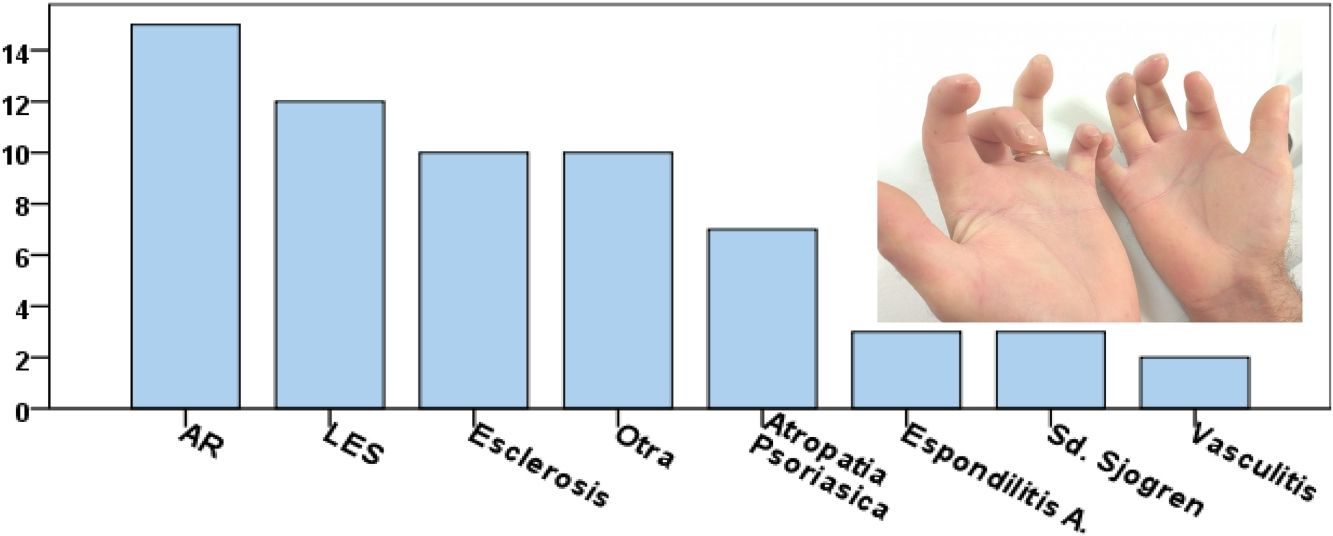
ResultadosSe estudiaron 489 casos de silicosis y 95 de exposición a inhalación de polvo de sílice sin silicosis. De los pacientes con silicosis 54 (11,0%) tenían ERAS: 12 (2,4%) artritis reumatoide, 10 (2,0%) lupus eritematoso sistémico, 10 (2,0%) esclerosis sistémica, seis (1,2%) artritis psoriásica, tres (0,6%) síndrome de Sjögren, dos (0,4%) vasculitis asociada con anticuerpos anticitoplasma de neutrófilos, tres (0,6%) espondiloartritis y ocho (1,6%) enfermedad autoinmunitaria sin características específicas. Los pacientes con ERAS realizaron más visitas a urgencias (63,0 vs. 42,5%; p = 0,004), y experimentaron mayor progresión (22,2 vs. 11,7%; p = 0,030).
ConclusionesLos pacientes con silicosis presentan una prevalencia de ERAS elevada y su presencia se asocia con una mayor progresión radiológica y un mayor impacto clínico.
Silicosis is associated with an increased risk of developing systemic autoimmune rheumatic disease (SARD). The prognostic implications of this association are poorly characterized. The aim of this study was to determine the prevalence of SARD and autoimmune markers in a cohort of patients with exposure to silica and assess their impact on prognosis.
MethodWe performed a prospective observational study of all patients attending the dedicated silicosis clinic of our pulmonology unit between 2009 and December 2017. Diagnosis was confirmed by a rheumatologist according to Spanish Rheumatology Society criteria. Autoimmune markers, pulmonary function tests, radiological progression, visits to the emergency department and primary care center, and hospital admissions for respiratory causes, and mortality were analyzed.
ResultsOverall, 489 cases of silicosis and 95 cases of exposure were studied. In total, 54 (11.0%) patients with silicosis had SARD: 12 (2.4%) rheumatoid arthritis, 10 (2.0%) systemic lupus erythematosus, 10 (2.0%) systemic sclerosis, 3 (0.6%) Sjögren syndrome, 2 (0.4%) vasculitis associated with anti-neutrophil cytoplasmic antibodies (ANCA +), 6 (1.2%) psoriatic arthritis, 3 (0.6%) ankylosing spondylitis, and 8 (1.6%) other autoimmune diseases with no special features. The patients with SARD visited the emergency room more often (63.0 vs. 42.5%; p = 0.004), and progressed more rapidly (22.2 vs. 11.7%; p = 0.030).
ConclusionsThe presence of systemic rheumatic autoimmune diseases involves radiological progression and a higher clinical impact.
La silicosis es una enfermedad pulmonar intersticial crónica irreversible, en la actualidad incurable, causada por la inhalación crónica de polvo con sílice en forma cristalina. Es una de las enfermedades respiratorias de origen ocupacional más frecuentes en nuestro entorno1,2. En las memorias anuales del Instituto Nacional de Silicosis (INS), se observa que a partir de 2008 ha habido un aumento de nuevos diagnósticos procedentes de industrias distintas a la minería del carbón, como son la industria del granito, pizarra y conglomerados artificiales de sílice3,4.
La exposición a inhalación de polvo de sílice, además de afecciones respiratorias como la propia silicosis, obstrucción bronquial, infecciones micobacterianas o cáncer de pulmón, se ha asociado también con algunas enfermedades como las enfermedades reumatológicas autoinmunitarias sistémicas (ERAS)1,5. Sin embargo, se desconocen los mecanismos que permiten explicar la asociación de la exposición al sílice con estas enfermedades autoinmunitarias.
Varias ERAS han sido asociadas con la exposición a inhalación de polvo de sílice, como la esclerosis sistémica (SSc)6,7, la artritis reumatoide (AR)8,9, el lupus eritematoso sistémico (LES), el síndrome de Sjögren (SS) y la vasculitis asociada con anticuerpos anticitoplasma de neutrófilos (v-ANCA)9. Sin embargo, los estudios han sido realizados en poblaciones heterogéneas, con pocos pacientes y con determinaciones parciales de algunos anticuerpos o sistemas de detección diferentes a los actuales10. Si bien la presencia de AR se ha descrito como un factor de riesgo para la progresión a fibrosis masiva progresiva (FMP)11, el impacto clínico en cuanto a situación funcional, sintomatología, progresión radiológica y eventos como asistencias, ingresos y mortalidad en pacientes con silicosis, con o sin ERAS, no se ha analizado de forma exhaustiva en la literatura.
Los objetivos de nuestro estudio fueron determinar la prevalencia de ERAS y de una serie de marcadores de autoinmunidad en una población de pacientes expuestos a inhalación de polvo de sílice, sin silicosis y con silicosis, y analizar su impacto clínico, la progresión radiológica y la mortalidad.
MétodoEstudio observacional, prospectivo, de una cohorte de pacientes atendidos en una consulta de silicosis entre 2009 y 2017. Inicialmente se incluyeron todos los pacientes que consultaron durante el periodo de estudio con exposición a inhalación de polvo de sílice, con o sin diagnóstico de silicosis y que firmaran el consentimiento informado. Se excluyeron los pacientes en los que se planteaban dudas diagnósticas diferenciales con otras enfermedades (10 con sarcoidosis y cuatro con fibrosis pulmonar idiopática). El estudio fue aprobado por la Red de Comités de Ética de la Investigación de Galicia y se llevó a cabo siguiendo los principios de la declaración de Helsinki y posteriores actualizaciones, así como la legislación vigente en investigación biomédica.
En la visita inicial se recogieron variables sociodemográficas, historia de tabaquismo (nunca fumador, exfumador o fumador activo), se estimó el índice acumulado de paquetes-año, comorbilidad por medio del índice de Charlson12, antecedentes de otras enfermedades específicas (tuberculosis pulmonar, enfermedad por micobacterias no tuberculosas, hipertensión pulmonar), historia de exposición a inhalación de polvo de sílice, fecha de diagnóstico de silicosis y su gravedad, función pulmonar, hallazgos en radiografía (Rx) y/o tomografía computarizada (TC) de tórax de alta resolución, análisis de sangre e índice de masa corporal.
El diagnóstico de silicosis se realizó de acuerdo con la normativa SEPAR13. Se consideró silicosis crónica simple la existencia de opacidades con tamaño < 10 mm y silicosis crónica complicada con opacidades > 10 mm. Un especialista en Reumatología evaluó el posible diagnóstico de las ERAS, estableciéndose el diagnóstico de certeza de acuerdo con los criterios de la Sociedad Española de Reumatología14. Como marcadores de autoinmunidad se evaluaron anticuerpos antinucleares (ANA), anticuerpos frente a antígenos extraíbles del núcleo (Anti-ENA), anticuerpo antipéptido cíclico citrulinado (ACPA), anticuerpos anticitoplasma de los neutrófilos (ANCA) y factor reumatoide (FR). Se evaluaron la progresión radiológica de la silicosis, ingresos hospitalarios, consultas al Servicio de Urgencias o al Centro de Atención primaria por causa respiratoria, y el fallecimiento, en las consultas de seguimiento hasta diciembre de 2018. Antes del cierre de la base se realizó una revisión de las historias clínicas para completar posibles datos perdidos.
La Rx y la TC de tórax se interpretaron por radiólogos con amplia experiencia en lectura de silicosis. La evaluación radiológica se efectuó mediante la lectura ILO15. En la TC las opacidades pequeñas se clasificaron de manera similar a la utilizada para clasificar los hallazgos radiológicos de tórax16. Las opacidades grandes se clasificaron como categoría A, ante una o más opacidades de más de 10 mm y menor a ¼ del área (cuadrante) del lado derecho de la TC, al nivel de la carina; categoría B, ante una opacidad mayor que A pero menor que la mitad del área (dos cuadrantes) del lado derecho del TC, al nivel de la carina; y categoría C ante una o más opacidades que sumadas constituían más de la mitad del área del lado derecho de la TC al nivel de carina17.
Se interpretó como progresión, en Rx o TC, cualquier incremento, independiente de la cuantía, en la profusión de nódulos. Se consideró progresión con cambio de categoría cuando se apreció un cambio de silicosis simple a complicada, de silicosis complicada A a silicosis complicada B o C, o de B a C, confirmados con TC.
Las pruebas de función pulmonar, espirometría y determinación de capacidad de difusión para monóxido de carbono (DLCO) se realizaron siguiendo las recomendaciones de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR) y de la European Respiratory Society (ERS)18,19. Los resultados analizados fueron capacidad vital forzada (FVC), volumen espiratorio forzado en 1 segundo (FEV1), cociente FEV1/FVC, capacidad pulmonar total (TLC) y DLCO. Se consideró limitación obstructiva al flujo aéreo un cociente FEV1/FCV < 0,7 y se analizaron los descensos de FVC de >10%, considerando este valor como diferencia mínima clínicamente significativa20. Las exploraciones de la función respiratoria y radiológica en el seguimiento se realizaron según criterio clínico. El intervalo entre pruebas de función pulmonar (primer y último estudio) fue de 53,9 ± 31,1 meses. Los intervalos entre la realización de las radiografías de tórax fueron de 76,1 ± 41,8 meses y entre TC 54,5 ± 30,0 meses.
Se realizó un análisis descriptivo y analítico de los datos. Los resultados de las variables cualitativas se representaron como frecuencia y porcentaje, mientras que las variables cuantitativas como media y desviación estándar. Se llevó a cabo la comparación de las características basales de los pacientes y de las pruebas de función pulmonar entre los pacientes, con y sin ERAS. Se utilizó χ2 en la comparación de las variables cualitativas y el prueba t de Student en las variables cuantitativas. Se emplearon estas mismas pruebas y análisis de supervivencia Kaplan-Meier para analizar la asociación con las variables de pronóstico y progresión. En los contrastes realizados se consideró que existían diferencias estadísticamente significativas cuando p < 0,05.
ResultadosDesde enero de 2009 a diciembre de 2017 fueron evaluados un total de 584 pacientes, todos varones, con edad media 52,8 ± 11,4 años. 489 tenían silicosis y 95 eran expuestos sin silicosis. Del grupo con silicosis, 203 tenían silicosis simple y 286 silicosis complicada (165 A, 72 B y 49 C). En cuanto a los antecedentes laborales 369 (75,5%) procedían de canteras de granito, 44 (9,0%) de taller de elaboración de piedra ornamental, 11 (2,3%) constructores de casas de piedra, 15 (3,1%) de minas de carbón, nueve (1,8%) de exposición a conglomerados artificiales de cuarzo y 41 (8,4%) otras labores, donde se incluyen trabajadores de cerámica, áridos y protésicos dentales. La duración media de la exposición a inhalación de polvo de sílice fue de 23,9 ± 9,9 años y el seguimiento de 65,8 ± 32,7 meses, durante el cual fallecieron 82 (16,8%) pacientes.
De los 489 pacientes con silicosis 54 (11,0%) tenían ERAS: 12 (2,4%) AR, 10 (2,0%) LES, 10 (2,0%) SSc, 3 (0,6%) síndrome de Sjögren, dos (0,4%) vasculitis v-ANCA+, seis (1,2%) AP, tres (0,6%) EA y ocho (1,6%) ERAS sin características específicas.
Las características demográficas, clínicas y funcionales se muestran en la tabla 1. Al comparar los pacientes con ERAS y sin ERAS no se observaron diferencias significativas en las características de los pacientes, excepto una mayor frecuencia de fenómeno de Raynaud en los pacientes con ERAS 29 de 54 (52,8%) frente a sin ERAS 124 de 435 (29,2%) (p < 0,001) y un mayor número de comorbilidades, índice de Charlson de 2,3 ± 1,4 en caso de ERAS frente a 0,9 ± 1,3 en su ausencia (p = 0,001).
Características de los pacientes con silicosis con y sin ERAS
| Pacientes con silicosis (n = 489) | p valor | ||
|---|---|---|---|
| Con ERAS(n = 54) | Sin ERAS(n = 435) | ||
| Edad* | 52,8 (11,5) | 52,9 (11,4) | 0,963 |
| Años de exposición | 23,3 (11,1) | 24,0 (9,8) | 0,619 |
| Forma de silicosis; n (%) | |||
| Simple | 22 (40,7%) | 181 (41,6%) | 0,903 |
| Complicada | 32 (59,3%) | 254 (58,4%) | |
| Categoría de la forma complicada; n (%) | |||
| A | 15 (46,9%) | 150 (59,1%) | 0,228 |
| B | 12 (37,5%) | 60 (23,6%) | |
| C | 5 (15,6%) | 44 (17,3%) | |
| Tabaquismo (IA)* | 26,3 (16,1) | 27,2 (18,6) | 0,788 |
| IMC* | 27,9 (3,4) | 27,5 (4,0) | 0,787 |
| FR; n (%) | |||
| No | 25 (47,2%) | 300 (70,8%) | < 0,001 (*) |
| Sí | 29 (52,8%) | 124 (29,2%) | |
| mMRC; n (%) | |||
| 0 | 13 (24,1%) | 140 (32,9%) | 0,637 |
| 1 | 27 (50,0%) | 181 (42,5%) | |
| 2 | 10 (18,5%) | 67 (15,7%) | |
| 3 | 4 (7,4%) | 34 (8%) | |
| 4 | 0 (0%) | 4 (0,9%) | |
| Índice Charlson* | 2,29 (1,4) | 0,87 (1,3) | 0,001 (*) |
| AP de TBP | 10 (18,5%) | 85 (19,5%) | 0,513 |
| AP de MNT | 2 (4,1%) | 19 (4,8%) | 0,591 |
| HTAP | 5 (9,4%) | 22 (5,2%) | 0,172 |
| FVC, L* | 3.446 (904) | 3.560 (908) | 0,403 |
| FVC (% previsto)* | 77 (17) | 79 (18) | 0,529 |
| FEV1, L* | 2527 (824) | 2598 (864) | 0,581 |
| FEV1 (% previsto)* | 74 (20) | 75 (22) | 0,659 |
| Ratio FEV1/FVC* | 72 (11) | 71 (12) | 0,667 |
| TLC (% previsto)* | 81 (16) | 81 (14) | 0,838 |
| DLCO (% previsto)* | 75(18) | 77 (19) | 0,449 |
| FEV1/FVC < 70 | 21 (38,9%) | 148 (34,7%) | 0,319 |
| Descenso FVC >10% | 13 (25,0%) | 70 (17,4%) | 0.180 |
IA: índice acumulado; IMC: índice de masa corporal; FR: fenómeno de Raynaud; mMRC: índice de disnea del Medical Research Council modificada; AP: antecedentes personales; TBP: tuberculosis pulmonar; MNT: micobacteria no tuberculosa; HTAP: hipertensión arterial pulmonar; FVC: capacidad vital forzada; FEV1: volumen espiratorio forzado en el primer minuto; TLC: capacidad pulmonar total; DLCO: capacidad de difusión pulmonar.
En los pacientes con ERAS se observó un descenso de la FVC mayor del 10% en un 25,0% de los sujetos (13) y un 17,4% sin ERAS (p = 0,180).
En la tabla 2 se muestra la presencia de autoanticuerpos (FR, Anti-ENA, Anti CCP, ANCA y FR) en expuestos sin silicosis y en pacientes con silicosis. Se apreciaron mayores niveles de ANA en silicosis que en expuestos, sin apreciarse diferencias en FR, ANCA y Anti-CCP.
Autoanticuerpos en expuestos sin silicosis y en pacientes con silicosis
| Expuestos(n = 95) | Silicosis simple(n = 203) | Silicosis complicada(n = 286) | p valor | |
|---|---|---|---|---|
| ERAS | 8 (8,4%) | 22 (10,8%) | 32 (11,2%) | 0,744 |
| ANA (>1/80) | 7 (8,4%) | 33 (17,7%) | 53 (20,4%) | 0,045 |
| Anti-ENA (+) | 3 (3,5%) | 18 (9,8%) | 33 (12,7%) | 0,050 |
| ANCA (+) | 1 (1,3%) | 7 (4,0%) | 11 (4,4%) | 0,438 |
| Anti-CCP (>10 U/ml) | 1 (1,4%) | 3 (1,8%) | 4 (1,7%) | 0,966 |
| FR (>14 IU/ml) | 12 (17,1%) | 29 (17,5%) | 57 (23,2%) | 0,286 |
ANA: anticuerpos antinucleares; ERAS: enfermedad reumatológica autoinmunitaria sistémica; FR: factor reumatoide; Anti-ENA: antiantigenos extraibles del núcleo; Anti-CCP: anticuerpo antipéptido cíclico citrunilado; ANCA: anticuerpos anticitoplasma de neutrófilos.
En 26 (12,8%) pacientes con silicosis simple y 175 (61,2%) pacientes con silicosis complicada se apreció progresión radiológica. Los pacientes con ERAS presentaron progresión con cambio de categoría de silicosis de forma estadísticamente significativa (tabla 3).
Progresión radiológica según presencia de ERAS
| Pacientes con silicosis (n = 489) | p valor | ||
|---|---|---|---|
| Con ERASn = 54 | Sin ERASn = 435 | ||
| Progresión en Rx | 24 (44,4%) | 143 (32,9%) | 0,106 |
| Progresión en TC | 23 (42,6%) | 138 (31,7%) | 0,225 |
| Progresión con cambio de categoría | 12 (22,2%) | 51 (11,7%) | 0,030 |
| Progresión total | 28 (51,9%) | 173 (39,8%) | 0,089 |
TC: tomografía computarizada.
Al comparar los pacientes con ERAS y sin ERAS se observó un mayor número de vistas al Servicio de Urgencias (63,0 frente al 42,5%, p = 0,004), pero no en el número de visitas a Atención Primaria, ingresos hospitalarios o mortalidad (tabla 4). Tampoco se detectaron diferencias significativas en la supervivencia entre los pacientes con y sin ERAS (Log Rank = 0,06; p = 0,802).
Visitas a SU, AP, hospitalización y mortalidad
| Pacientes con silicosis (n = 489) | p valor | ||
|---|---|---|---|
| Con ERASn = 54 | Sin ERASn = 435 | ||
| Visitas a AP | 43 (79,6%) | 329 (75,6%) | 0,516 |
| Visitas a SU | 34 (63%) | 185 (42,5%) | 0,003 (*) |
| Hospitalización | 22 (40,7%) | 138 (31,7%) | 0,183 |
| Exitus | 11 (20,4%) | 71 (16,3%) | 0,453 |
AP: atención primaria; SU: Servicio de Urgencias.
En este estudio se ha determinado por primera vez la prevalencia de ERAS en una cohorte española de casos confirmados de silicosis (11%) y en casos de exposición relevante a inhalación de polvo de sílice sin silicosis (8,4%). Además, la presencia de ERAS en pacientes con silicosis se ha asociado con mayor número de visitas al Servicio de Urgencias y una mayor progresión en la categoría de silicosis.
Según las diferentes patologías y comparando con el estudio EPISER (Estudio epidemiológico de prevalencia de diversas enfermedades reumáticas en población adulta en España) hemos observado una mayor prevalencia de AR, LES, SS y artritis psoriásica21. Si bien nuestra muestra es solo de varones y con grupos de edad superiores a los analizados en el estudio EPISER21, estos resultados permiten vislumbrar una posible relación de ERAS con la exposición a inhalación de polvo de sílice.
Por otra parte, en un estudio de SSc en población española de referencia22 se observó una prevalencia del 0,03% frente al 2,0% del presente trabajo. En vasculitis el v-ANCA+ fue de 0,4% mientras que en población general de referencia fue de 0,003%23.
Al comparar la prevalencia de ERAS con otras publicaciones de pacientes con silicosis se observa bastante variabilidad. Un estudio realizado por Makol et al.24, determinó la prevalencia de diferentes ERAS en una cohorte de 790 casos de silicosis en trabajadores mayoritariamente de fundición, detectando una prevalencia de AR de 4,2%, superior al 2,4% en nuestra población de pacientes con silicosis, mientras que su prevalencia de SSc fue inferior al obtenido en la presente serie (0,3 frente a 2,0%). La prevalencia de SS asociada con silicosis, menos descrita en la literatura25, fue 0,6%, similar a su serie. Por otra parte, observamos tasas de LES de 2,0%, más elevadas que las aportadas por Makol et al.24 y similares a las tasas descritas por Parks et al.9.
A pesar de la heterogeneidad entre estudios, un metaanálisis de 2013 (seis estudios caso-control) apuntó a la asociación de exposición a inhalación de polvo de sílice y v-ANCA26. Bartůnková et al.27, en una serie de 86 hombres, con historia de exposición durante al menos cinco años a sílice, detectaron ANCA+ más frecuentemente en el grupo de expuestos (7,1%) y de silicosis (30,3%) que en el grupo control, aunque se limitan a describir la elevación del marcador pero no de la presencia de vasculitis. Nuestra cohorte con dos casos (0,4%) de vasculitis asociada a ANCA+ muestra tasas superiores a las estimadas de 0,003% por Koldingsnes et al.23 para una población del norte de Europa en la que esta patología es más frecuente y similares a lo mostrado por Makol et al.24.
En una serie de pacientes con silicosis avanzada, asociada con exposición a conglomerados artificiales de cuarzo, nueve de los 40 pacientes (23%) presentaban enfermedades reumatológicas autoinmunitarias28. En nuestra serie se presentaron nueve casos de silicosis en trabajadores expuestos a conglomerados artificiales de cuarzo, de estos, dos tenían ERAS (22%).
Un grupo de ocho pacientes (1,6%) tenía enfermedad reumatológica autoinmunitaria sin características específicas, hallazgo habitualmente no descrito pero concordante con la patogénesis de la silicosis como proceso inmune incontrolado29, y que podría postularse como una enfermedad autoinmunitaria indiferenciada asociada con sílice.
En silicosis es frecuente la presencia de autoanticuerpos como ANA, anti-Scl-70, anticentrómero y ANCA, incluso aunque no muestren síntomas de enfermedad autoinmunitaria30. En nuestra serie de silicosis la prevalencia de ANA+ fue de 17%, inferior a la observada por Lippmann et al.31 de 34%, pero superior a la de Zaghi et al.10.
Se han propuesto algunas hipótesis sobre la fisiopatología de los mecanismos subyacentes en la relación de la exposición a sílice con estas enfermedades autoinmunitarias30. Una de las hipótesis sostiene que la inhalación de las partículas de sílice provocaría la activación de los macrófagos y su apoptosis posterior, que conducirían a la activación de linfocitos T y B induciendo una respuesta autoinmunitaria32. Otra hipótesis sostiene que la apoptosis de los linfocitos, más dominante en linfocitos T reguladores que linfocitos T respondedores, conduciría a un desequilibrio autoinmunitario32,33.
Casi la mitad de nuestros pacientes con silicosis mostraba progresión durante el periodo de seguimiento. Es un resultado similar a lo mostrado por los escasos estudios publicados sobre la historia natural y progresión de la silicosis, que reflejan cómo entre un tercio y la mitad de los pacientes sufre progresión de la silicosis a pesar de abandonar la exposición34. Así, en el estudio de Lee et al.35, de 260 con silicosis por granito, de los cuales 141 tenían radiografías comparativas, un 37% de los pacientes mostraba progresión; y Karataş et al.36 en trabajadores de cerámica, en 165 seguidos al menos 24 meses y con al menos dos radiografías, 38% mostraba progresión. Muy pocos estudios han evaluado el papel de las ERAS en la progresión de la silicosis. En 1986 Sluis-Cremer et al.11 mostraron en un estudio de casos y controles que los mineros con artritis reumatoide mostraban una progresión más rápida de la silicosis y una tendencia hacia un mayor riesgo de fibrosis masiva progresiva. Los pacientes con ERAS (no solo AR) de nuestro estudio mostraron mayor frecuencia de progresión de la silicosis que los pacientes sin ERAS.
No conocemos datos de estancia hospitalaria y de mortalidad por silicosis en nuestro país, aunque en un estudio realizado en nuestro hospital, entre 2009 y 2016, el 30% de los pacientes con silicosis complicada ingresaron al menos una vez y tuvieron una mortalidad del 18% durante el periodo de seguimiento37,38. En este trabajo comprobamos que los ingresos y la mortalidad en los sujetos con ERAS son superiores, aunque no de forma estadísticamente significativa.
Hasta el momento no hay evidencia que haya evaluado el deterioro de la función pulmonar en relación con la presencia de ERAS en pacientes con silicosis39, en nuestros resultados hemos visto diferencias en la función pulmonar, aunque no han sido estadísticamente significativas.
El presente trabajo presenta algunas limitaciones. Aún siendo un diseño prospectivo, no se han especificado intervalos de tiempo predefinidos para la realización de estudios radiológicos o de función pulmonar, de forma que la evaluación de la evolución entre pruebas puede estar influida por las diferencias en los intervalos temporales. Para valorar la progresión radiológica, la estimación se hizo considerando que si no tenían las dos Rx de tórax y/o dos TC (tres pacientes no tenían dos Rx y 12 no tenían dos TC) no progresaban, lo cual puede infraestimar el porcentaje real de progresión. Por otra parte, los datos proceden de una única área geográfica, con unas características concretas de exposición laboral, materiales de trabajo o entorno climático, de forma que la validez externa de nuestros resultados debe considerarse con precaución.
En conclusión, nuestro estudio sugiere que la exposición a inhalación de polvo de sílice, y especialmente la silicosis, se asocian con el desarrollo de ERAS. La presencia de ERAS en los pacientes con silicosis se asocia con progresión radiológica y con una mayor frecuencia de las visitas al Servicio de Urgencias.
Reconociendo el papel principal de la prevención con el mantenimiento de los niveles de polvo respirable dentro de los límites legales y el diagnóstico de la enfermedad en los estadios iniciales, la posibilidad de presencia de diferentes ERAS debe estar presente en pacientes con silicosis y ser reevaluada en cada visita médica. Y viceversa, la exposición profesional a inhalación de polvo de sílice debe evaluarse ante una enfermedad reumatológica autoinmunitaria40.
FinanciaciónEl presente trabajo ha sido financiado por la Sociedad Española de Neumología y Cirugía Torácica, en la convocatoria de Ayudas a la Investigación SEPAR [núm. de proyecto 779, 2018].
A todos los profesionales del Servicio de Neumología.