Es bien sabido que la infección por Mycobacterium tuberculosis afecta hoy día a un tercio de la humanidad, es decir, a 2.000 millones de personas. Con semejante reservorio, el control de la tuberculosis parece una tarea de difícil abordaje. Las cifras de morbimortalidad son tremendas: se estima que cada año aparecen 8 millones de casos nuevos de la enfermedad tuberculosa y 2 millones de personas van a morir como consecuencia de esta enfermedad1. La estrategia esencial en países con una alta incidencia de tuberculosis es la detección de los casos de enfermedad, especialmente los que son capaces de infectar a otras personas, es decir, los pacientes bacilíferos, y garantizar su tratamiento completo mediante estrategias como la DOTS1. Por otra parte, desde la década de los sesenta se ha impulsado el tratamiento de las personas infectadas en países con suficiente poder económico para intentar recortar este enorme reservorio y reducir el riesgo de reactivaciones y casos de enfermedad en ambientes donde la incidencia de la enfermedad es muy baja2. Lamentablemente, esta estrategia ha encontrado una dificultad notable: el largo período de administración que la isoniazida requiere (9 meses) ha dificultado sobremanera el cumplimiento del tratamiento contra una infección que a la mayoría de las personas que la presentan no les ha originado el menor síntoma. Por ello no es extraño que el Comité para la Erradicación de la Tuberculosis de EE.UU. recomendara en 1998 la necesidad de poder obtener una vacuna terapéutica contra la infección por M. tuberculosis3.
Sin duda alguna, en la infección por M. tuberculosis hay un punto clave que se ha convertido en una de sus características más notorias; nos referimos a la aparición del bacilo latente. Probablemente la aparición de esta forma bacilar es uno de los aspectos que han estimulado (y está estimulando) más a los científicos estudiosos de la tuberculosis, hasta el extremo de denominar a la infección por M. tuberculosis "infección tuberculosa latente"2, hecho que todo el mundo acepta, pero que no deja de ser una exageración de una característica biológica muy habitual en el mundo microbiológico. Efectivamente, hay muchos microorganismos con una capacidad incluso mayor de poder persistir durante mucho tiempo en el interior de los tejidos del hospedador. Nos referimos esencialmente a una gran cantidad de virus, como los de la familia Herpes, por citar un ejemplo4. Volviendo a las bacterias, en todos los géneros que se han podido estudiar se ha detectado la aparición de formas resistentes y formas con un metabolismo enlentecido para hacer frente a un estímulo estresante, o simplemente ante la falta de nutrientes, cuando las poblaciones en crecimiento se estabilizan en la denominada fase estacionaria5. Además, en todas estas bacterias se ha podido demostrar que, en dicho estado, estas células tienen una capacidad de resistencia mayor ante estímulos ambientales nocivos6. Por otra parte, la genómica y proteómica aplicadas al estudio de M. tuberculosis han confirmado que su base genética no es tan diferente de la de Escherichia coli, por ejemplo7. Este conocimiento también ha permitido confirmar que M. tuberculosis es incapaz de generar una forma de resistencia ambiental similar a una espora. A lo sumo dispone de una pared celular hidrofóbica muy compleja8 y de una capacidad de crecimiento muy lenta. Pero esencialmente éstas no son características que debiéramos temer de una bacteria. ¿Cuáles fueron pues el origen y la importancia de este bacilo latente?
Sin duda alguna, el interés por el bacilo empieza con el inicio del tratamiento antibiótico con estreptomicina, en la década de los cincuenta, cuando con la introducción de los tratamientos múltiples los investigadores se dan cuenta de que hay recaídas de la enfermedad que no se pueden justificar por la adquisición de resistencias a los antibióticos utilizados9. Posteriormente, a finales de los años setenta el equipo de Mitchison10, al diseñar una pauta de tratamiento "corta" para M. tuberculosis tras el descubrimiento de la rifampicina, intenta explicar por qué, sin embargo, el tratamiento de la tuberculosis debe prolongarse durante 6 meses. La acción de la rifampicina, capaz de destruir los bacilos que activan su metabolismo durante cortos períodos, hace predecir a este autor que debe de haber una población bacilar que no tiene actividad metabólica, o la tiene muy disminuida. Estos descubrimientos dan sentido a antiguas observaciones experimentales sobre la capacidad de persistencia de M. tuberculosis en cultivos antiguos11 y corrobora observaciones clínicas en relación con la capacidad de reactivación endógena de la tuberculosis12,13.
La "visualización" del bacilo latente. Importancia de los macrófagos espumosos
En la década de los cincuenta el equipo de McCune14 establece un modelo experimental en ratones en el que se demuestra indirectamente la presencia del bacilo latente; es el modelo de Cornell. Tras una infección de corta duración (unas 2 semanas) los animales se tratan durante 14 semanas con isoniazida y pirazinamida, y se certifica que de sus tejidos no se puede aislar ninguna bacteria, al menos ninguna bacteria cultivable. Posteriormente, tras 3 meses de espera o tras un mes en el cual se ha administrado hidrocortisona, los bacilos vuelven a cultivarse a partir de los tejidos. Se postula pues que durante este período en que los tejidos permanecen "estériles" el bacilo se mantiene en una forma latente. Estos trabajos animaron a varios autores a estudiar los diferentes matices existentes en los bacilos viables pero no cultivables y en su recuperación (técnicamente "resucitación") o no y los requisitos necesarios15,16. De nuevo, tal como se ha señalado anteriormente, muchos otros científicos que trabajan en bacterias ambientales han hechos numerosas y decisivas aportaciones al respecto que han significado un apoyo decisivo5,17.
Por otra parte, un grupo numeroso de autores ha trabajado experimentalmente a partir de la hipótesis de que el bacilo latente debe de ser una célula que es capaz de adaptar su metabolismo para persistir en una presión de oxígeno muy baja, que es la que debe de existir en el tejido necrótico de los granulomas tuberculosos, uno de los focos más importantes de bacilos latentes10,18. Este hecho desencadena la producción de cierto número de artículos centrados en los cambios metabólicos sufridos por M. tuberculosis sometido a atmósferas de hipoxia e incluso anaeróbicas, identificándose al menos un importante cambio metabólico, esencialmente en el shunt glioxilato, con al menos 2 finalidades. En primer lugar, la obtención de NAD (nicotinamida-adenina-dinucleótido) reducida para poder llevar a cabo una respiración de tipo fermentador anaeróbica19 o simplemente para poder obtener energía a partir de compuestos lipídicos20.
En este contexto, Orme, probablemente el científico vivo que más ha trabajado en modelos experimentales de tuberculosis, lanzó un reto a la comunidad científica hace 3 años: "El bacilo tuberculoso latente (ya te avisaré si alguna vez encuentro uno)"21. Dejando aparte el estilo provocador del título, el profesor Orme esgrime teorías muy interesantes al respecto. En primer lugar, cuestiona la relación entre la positividad de la prueba de la tuberculina y la infección latente esgrimiendo uno de los pilares de la inmunología: la presencia de memoria inmunológica; en definitiva, no hace falta estar infectado para presentar reacción a la prueba de la tuberculina. También critica el modelo de Cornell y considera que probablemente lo que sucede en este modelo es que el bacilo se convierte en tolerante a la isoniazida22. Aunque los defensores del modelo demuestran que los bacilos recuperados siguen siendo sensibles a la isoniazida, Orme considera que el hecho de recuperarlos en un medio de cultivo rico quizá les permite revertir su resistencia a la isoniazida para poder crecer en mejores condiciones. Este hecho se relaciona con las observaciones clásicas de micobacterias que pueden persistir sin sintetizar la pared celular y que por tanto son resistentes a la isoniazida23. Este fenómeno de resistencia a los antibióticos evitando la síntesis de su pared celular se ha sido descrito en muchas otras especies bacterianas que reciben el nombre de "formas L"24.
En este terreno, nuestro grupo suele esgrimir que "hemos visto el bacilo latente". Efectivamente, dentro del contexto de estudio de la evolución histopatológica de los granulomas en el modelo de tuberculosis experimental en ratones, nos dimos cuenta de que alrededor de los macrófagos infectados se desarrollaba una corona de linfocitos que, a su vez, estaban envueltos por una capa de macrófagos espumosos que ocupaban los espacios alveolares que circundaban a los granulomas25,26. Pudimos demostrar este hecho porque existía una secuencia temporal a partir de un modelo en el que se inoculaba una dosis muy baja de bacilos a través de un aerosol. Lo más interesante era que algunos de estos macrófagos espumosos tenían un bacilo solitario en su interior y que posteriormente se podía observar la presencia de múltiples bacilos en el interior de macrófagos espumosos bastante deteriorados. De aquí probablemente la importancia de la lentitud del crecimiento de M. tuberculosis, ya que le permite pasar inadvertido aun cuando el estímulo agresivo generado contra él ha cedido, y al tardar en multiplicarse tiene cierto período suplementario para no ser reconocido. Finalmente, el bacilo puede reproducirse tranquilamente en los espacios intraalveolares, lejos de los focos granulomatosos, donde las concentraciones de citocinas protectoras, esencialmente interferón gamma (IFN-γ), son prácticamente inexistentes.
Para nosotros éste era el bacilo latente, es decir, aquél capaz de sobrevivir al ambiente estresante generado por los macrófagos activados mediante la respuesta inmunitaria, que destruye la mayoría de los bacilos y que pasa inadvertido para el mismo macrófago o, en caso de destrucción de éste, para el macrófago joven atraído hacia el granuloma, que procede a la "limpieza" del tejido necrótico y sale hacia el espacio alveolar para ser drenado, habitualmente, hacia los espacios bronquiales superiores y la tráquea27 y ser tragado o escupido. Posteriormente pudimos demostrar que el supuesto control de la infección desarrollado por el ratón infectado que llevó a que se le considerara capaz de desplegar un grado de resistencia similar al humano ante M. tuberculosis28 no era tal. En realidad, si bien las concentraciones bacilares se estabilizan en el pulmón y se mantienen bastante constantes durante mucho tiempo, no ocurre lo mismo con la ocupación del parénquima pulmonar, que se incrementa aritméticamente con el tiempo29. Este hecho tiene una enorme trascendencia, puesto que al final el ratón muere como consecuencia de la total ocupación del parénquima pulmonar por la estructura granulomatosa provocada por el bacilo, no como consecuencia de una reacción inflamatoria extraordinaria30,31.
Estas observaciones, recientemente confirmadas en el modelo de cobaya e incluso en muestras de autopsias de pacientes (datos no publicadas), nos dieron mucha información de cara al diseño de RUTI. La hipótesis que lanzábamos confirmaba la teoría de que la respuesta inmunitaria contra M. tuberculosis se centraba en la identificación de péptidos sintetizados por bacilos que se estaban multiplicando32. Así pues, entendíamos que para luchar contra el bacilo latente debería de inmunizarse al hospedador infectado con bacilos estructurales del bacilo, presentes tanto en bacilos en fase de multiplicación activa como en fase estacionaria o de latencia.
El origen de la necrosis intragranulomatosa en el granuloma tuberculoso
Una de las características más remarcables de la infección por M. tuberculosis en los humanos es la inducción de una necrosis intragranulomatosa33. Lamentablemente el ratón infectado es incapaz de generarla28. Este hecho, juzgado por ciertos autores como un ejemplo de respuesta eficaz y no tóxica contra el bacilo34, representaba una enorme desventaja, a nuestra manera de ver, para valorar nuevos antibióticos o nuevas vacunas, puesto que significaba la ausencia de la población bacilar extracelular. Por ello nos lanzamos al diseño de un modelo "humanizado" de tuberculosis en el ratón. El estudio bibliográfico nos orientó muchísimo. Por un lado, las experiencias clásicas de Lurie35 en conejos describían la presencia de la necrosis intragranulomatosa en el inicio de la infección. Por otro lado, otros autores36 relacionaban el fenómeno de Koch, denominación clásica del mecanismo que genera esta necrosis intragranulomatosa, con la reacción de Shwartzman. Esta reacción se describió originalmente como un fenómeno de reactividad cutánea local desencadenado por la inoculación intradérmica de una endotoxina (inyección preparadora), seguida a las 24 h por una inyección intravenosa del mismo producto (inyección provocadora). Aproximadamente a las 4 h se desarrollaba una necrosis hemorrágica en la piel, en el punto en que previamente se había inoculado la endotoxina37. Posteriormente se relacionó este fenómeno con inducción de la producción local de factor de necrosis tumoral (TNF). Puesto que el granuloma tuberculoso tiene concentraciones altas de esta citocina, y más todavía en la fase en que la concentración bacilar está más elevada, a las 3 semanas de la infección, decidimos inocular lipopolisacárido intranasal para reproducir el fenómeno38. Y funcionó.
El hecho de reproducir el fenómeno nos permitió sustentar una nueva hipótesis sobre el origen de la necrosis, desvinculándola de la hipersensibilidad retardada (la DTH). Entonces se consideraba la DTH una respuesta inmunitaria celular de tipo tóxico, en contraposición con la respuesta celular efectiva, es decir, la que generaba IFN-γ para poder activar los macrófagos infectados39. Por otra parte nos indicaba que, si queríamos inocular un producto a una persona infectada, deberíamos tener muy en cuenta no inocular ninguna endotoxina, para evitar reacciones de tipo tóxico.
La importancia del volumen del hospedador en la respuesta inflamatoria contra M. tuberculosis
Los estudios llevados a cabo para desarrollar un modelo "humanizado" en el ratón también nos hicieron reflexionar sobre un aspecto importante de la infección por M. tuberculosis y el modelo experimental del ratón. Puesto que la necrosis intragranulomatosa era inducida por un proceso inflamatorio inespecífico, la molécula endotóxica debía de estar en la propia estructura del bacilo, que al crecer masivamente al final de la fase de respuesta inespecífica aumentaba la concentración endotóxica y provocaba un fenómeno similar al de Shwartzman. Por otro lado, el incremento desmesurado de endotoxinas como consecuencia del crecimiento importante de la población bacilar también tiene lugar en el ratón. Entonces, ¿por qué no se provoca esta reacción inflamatoria masiva que da lugar a la necrosis intragranulomatosa en este hospedador?
La respuesta se hallaba en el fenómeno de tolerancia que debe desplegar el ratón contra muchas infecciones. Este hecho se sustenta en el simple hecho de observar su volumen. Es evidente que el ratón nunca podrá generar una caverna tuberculosa como generamos los humanos, entre otras cosas porque el volumen medio de una caverna supera el volumen total de un ratón. Así pues, no es de extrañar que el ratón "tolere" cierta concentración bacilar en sus tejidos, contra la cual tan sólo puede generar una respuesta "limpia" frente a lo que puede generar su muerte inmediata, es decir, contra el crecimiento desmesurado del bacilo. De hecho, los estudios realizados con ratones knock-out para IFN-γ reflejan que la muerte les puede sobrevenir a las 4 semanas de la infección40. En los animales inmunocompetentes el control y el declive de esta concentración no empieza hasta la semana 3 postinfección25,31.
Otro dato interesante es el que proviene de la dosis necesaria de tuberculina para desencadenar la DTH en el hospedador infectado. Esta dosis es de 0,04 µg en los humanos41, pero aumenta a 0,5 µg en cobayas y a 5 µg en ratones42. Este dato también refleja la mayor tolerancia de estos últimos a las proteínas provenientes de M. tuberculosis. Por otro lado, también puede reflejar la concentración bacilar remanente o latente en el humano infectado. Si esta concentración se estabiliza en unos 4 log10 en el ratón y 3 log10 en el cobaya infectados con dosis bajas, es decir, fisiológicas, de M. tuberculosis a través de un aerosol (datos no publicados), podemos suponer que esta concentración rondará los 2 log10 en humanos.
Toda esta información nos sugiere muchísimas cosas. Por un lado, el ser humano responde con mucha mayor eficacia a la infección por M. tuberculosis. Este hecho también se confirma con los datos epidemiológicos más ampliamente aceptados: de 100 humanos infectados, tan sólo 10 generarán la enfermedad, y de éstos la mitad morirá como consecuencia de ella. En los ratones, de 100 animales infectados, 100 morirán como consecuencia de la infección. Este dato es muy ilustrativo sobre el tipo de respuesta inmunitaria eficaz que cabe desarrollar contra M. tuberculosis. En los humanos esta respuesta es totalmente mixta, de tipo T helper (Th) 1/Th233, con la aparición de linfocitos Th1 capaces de activar los macrófagos infectados y de generar granulomas alrededor de los bacilos (respuesta DTH), pero también generando una importante respuesta de tipo Th2 que impulsa la síntesis de anticuerpos, capaces de controlar a los bacilos extracelulares y evitar su diseminación43,44 y la fibrosis efectiva de los granulomas a través de la interleucina 445; por último, un importante despliegue inflamatorio provoca la necrosis intragranulomatosa para acotar inicialmente la diseminación del bacilo. Lamentablemente, el desarrollo de la enfermedad parece ligado a una característica puramente anatómica en los humanos. La presencia de tejidos con una alta presión de oxígeno, como los lóbulos pulmonares apicales, favorece una inmunodepresión local y estimula el sobrecrecimiento bacilar46-49. Así pues, el desarrollo de la enfermedad tuberculosa en el paciente inmunocompetente sería el resultado de la adaptación del bacilo a un nicho ecológico muy concreto, fruto de centenares de años de evolución y, por tanto, de muy difícil resolución.
Por otro lado, tenemos la respuesta tolerante desplegada por el ratón, basada mayoritariamente en la síntesis de IFN-γ, que tan sólo le permite controlar los bacilos que se multiplican, con lo que consigue una concentración bacilar en los tejidos muy elevada y una constante diseminación de los bacilos. Está claro que este tipo de respuesta no es muy eficaz.
Estas evidencias nos sirvieron para reflexionar y deducir que la respuesta generada a través de una vacuna terapéutica debería de ser de tipo mixto, capaz de evitar la multiplicación intracelular del bacilo, pero también capaz de evitar su diseminación extracelular. La baja concentración bacilar esperable en los tejidos de los hospedadores nos hizo pensar en la necesidad de que esta vacuna fuera a la vez poliantigénica, para incrementar la posibilidad de que una bajísima concentración antigénica (tolerada) fuera capaz de generar una respuesta inflamatoria suficiente para movilizar las células del sistema inmunitario y conseguir su localización y destrucción.
La naturaleza dinámica de la infección latente
En el estudio de este proceso se ha obviado siempre un aspecto muy importante relacionado con la fisiología del hospedador. Se trata del recambio celular constante. Se estima que, como mucho, el tiempo de vida media de un macrófago alveolar es de unos 3 meses50. Así pues, está bien claro que el bacilo debe intentar replicarse constantemente para evitar su drenaje hacia el árbol bronquial. Se puede esgrimir que el tejido necrótico representa la fuente primordial de estos bacilos. Esto es cierto relativamente. Por lo común los anatomopatólogos tienen dificultades para observar bacilos ácido-alcohol resistentes en el interior de lesiones con necrosis intragranulomatosa indicativas de ser de origen tuberculoso51. Nosotros mismos tenemos dificultades para visualizar estos bacilos en granulomas con necrosis espontánea en cobayas, o en ratones con necrosis inducida (datos no publicados).
Otro aspecto muy importante deriva igualmente del modelo experimental en el ratón. Tal como hemos comentado previamente, en este modelo el tejido necrótico no existe. Sin embargo, tal como se detalla en el modelo de Cornell, al realizar un tratamiento antibiótico prolongado (p. ej., de 14 semanas) combinando pirazinamida e isoniazida se consigue la práctica eliminación de las lesiones en los pulmones, pero se sigue observando una reactivación al cabo de un cierto tiempo14. En este caso no hay tejido necrótico como reservorio, y tampoco una constante reactivación de los bacilos porque el tratamiento antibiótico lo impide. Debe de haber una tercera vía de mantenimiento de estos bacilos. Esta vía pasaría necesariamente por la inducción de la apoptosis en los macrófagos que fagocitan los bacilos latentes.
Llegados a este punto, cabe analizar otro aspecto interesante en relación con el bacilo latente que nadie ha decidido solucionar. Es bien sabido que una de las características de M. tuberculosis es su capacidad para evitar la unión fagolisosoma y con ello conseguir su supervivencia en el interior del macrófago52. Sin embargo, este proceso debe de requerir una acción activa por parte del bacilo, puesto que los bacilos muertos son incapaces de provocar esta acción. ¿Cual sería el comportamiento de un bacilo latente? Nuestra impresión abogaría porque, dada su baja capacidad metabólica, el bacilo latente se comportaría como un bacilo muerto. Con ello no podría evitar la unión fagolisosoma y se vería inmerso en un ambiente estresante, ya sea mediante la disminución del pH, la presencia de radicales de oxígeno o de nitrógeno, o de enzimas líticas. Este hecho puede producir su destrucción, pero probablemente no la ocasiona, al tratarse de un bacilo latente y, por ello, con mayor capacidad para resistir estas hostilidades53. Igualmente, el hecho de comportarse como un bacilo muerto no permite al bacilo latente evitar la presentación de sus antígenos por parte del macrófago que lo fagocitó, como sí efectivamente intenta el bacilo activo54. De nuevo el bacilo requiere un metabolismo activo para poder llevar a cabo esta acción.
Una vez más, ésta no es una particularidad privativa de M. tuberculosis. En general, las bacterias intracelulares evitan la apoptosis de las células fagocíticas que las contienen55, pero este hecho también requiere un proceso activo por parte de la bacteria. Al menos se desprende de las experiencias realizadas con Brucella suis, en que las células vivas evitaban la apoptosis, mientras que las muertas sí ocasionaban la apoptosis de los fagocitos56.
Es por ello que esta tercera vía en que debe de participar el bacilo latente es bastante inquietante por lo impredecible. Por un lado, puede ser destruido sin más por un macrófago alveolar circulante; por otro, puede sufrir varios procesos de estrés a través del mecanismo de resistencia al mismo e inducción de apoptosis, con la posterior fagocitosis, etc. Es verdad que en algún momento uno de estos macrófagos que lo fagocitan puede entrar en su dinámica habitual de ser drenado hacia el exterior del pulmón y, por tanto, el bacilo desaparezca con él. El problema surge si en el período que media entre la apoptosis y la posterior fagocitación y procesamiento el bacilo deja de estar momentáneamente sometido a una atmósfera hostil y por tanto decide multiplicarse. En este momento el macrófago está perdido. La respuesta inmunitaria del hospedador no llegará a tiempo, y el bacilo lo destruirá. Una gran parte de estos bacilos se diseminarán por el espacio intraalveolar, afectarán nuevos macrófagos, etc. Se reproducirán nuevos focos infectivos, con el riesgo de que alguno de ellos se pueda desarrollar en el ápex pulmonar, por ejemplo.
Así pues, este panorama nos ayuda de nuevo a decidir sobre la naturaleza de esta vacuna terapéutica. Por un lado, su administración debiera significar una reestimulación de la inmunidad adquirida con la infección y ampliar el abanico de epítopos reconocibles, para poder identificar a los macrófagos que transportan un bacilo latente. Por otra parte, debiera poder aumentar la producción de anticuerpos contra diferentes antígenos para poder restringir la diseminación de los bacilos hacia nuevas zonas anatómicas, en el caso de que alguno de estos bacilos sea capaz de multiplicarse y destruir al macrófago que los contiene. En esta situación, la respuesta inmunológica más eficaz e inmediata es la humoral.
Importancia del tratamiento antibiótico en la infección latente
El tratamiento antibiótico en la infección latente es también una materia de controversia. Por un lado, mucha gente no entiende por qué se administra isoniazida durante 9 meses. En realidad, es una muy buena pregunta. Puesto que los bacilos latentes no son susceptibles a estos quimioterápicos, ¿por qué se administran durante tanto tiempo? En primer lugar, para destruir la población bacilar en multiplicación activa que pueda encontrarse inicialmente, y en segundo lugar, para evitar la reactivación de cualquier bacilo latente que lo intente. Por último, la otra opción que nadie plantea es la de que los propios macrófagos, siguiendo su cinética habitual, drenen a los bacilos al exterior.
Al disminuir la inflamación y evitar la multiplicación de los bacilos, el tratamiento antibiótico también es muy recomendable para evitar la constante formación de macrófagos espumosos y su acumulación o deambulación a través de los espacios intraalveolares. Otro aspecto a tener en cuenta es que muchos de estos macrófagos son capaces de sintetizar óxido nítrico57,58, ya sea debido a la propia activación específica mediante IFN-γ, ya sea mediante una activación inespecífica a través de componentes de la pared celular de M. tuberculosis59. En el primer caso, el problema aparece con los macrófagos que transporten un bacilo latente; en el segundo caso, el problema reside en que esta estimulación inespecífica no proporciona una activación suficiente de los macrófagos y, en caso de fagocitar un bacilo extracelular, probablemente no serán capaces de destruirlos. Además, la producción de óxido nítrico genera una inmunodepresión transitoria en los linfocitos específicos que intentan activar a estos macrófagos60; por tanto, estos macrófagos espumosos inducen cierta inmunodepresión local que favorece la reactivación de los bacilos en su interior57.
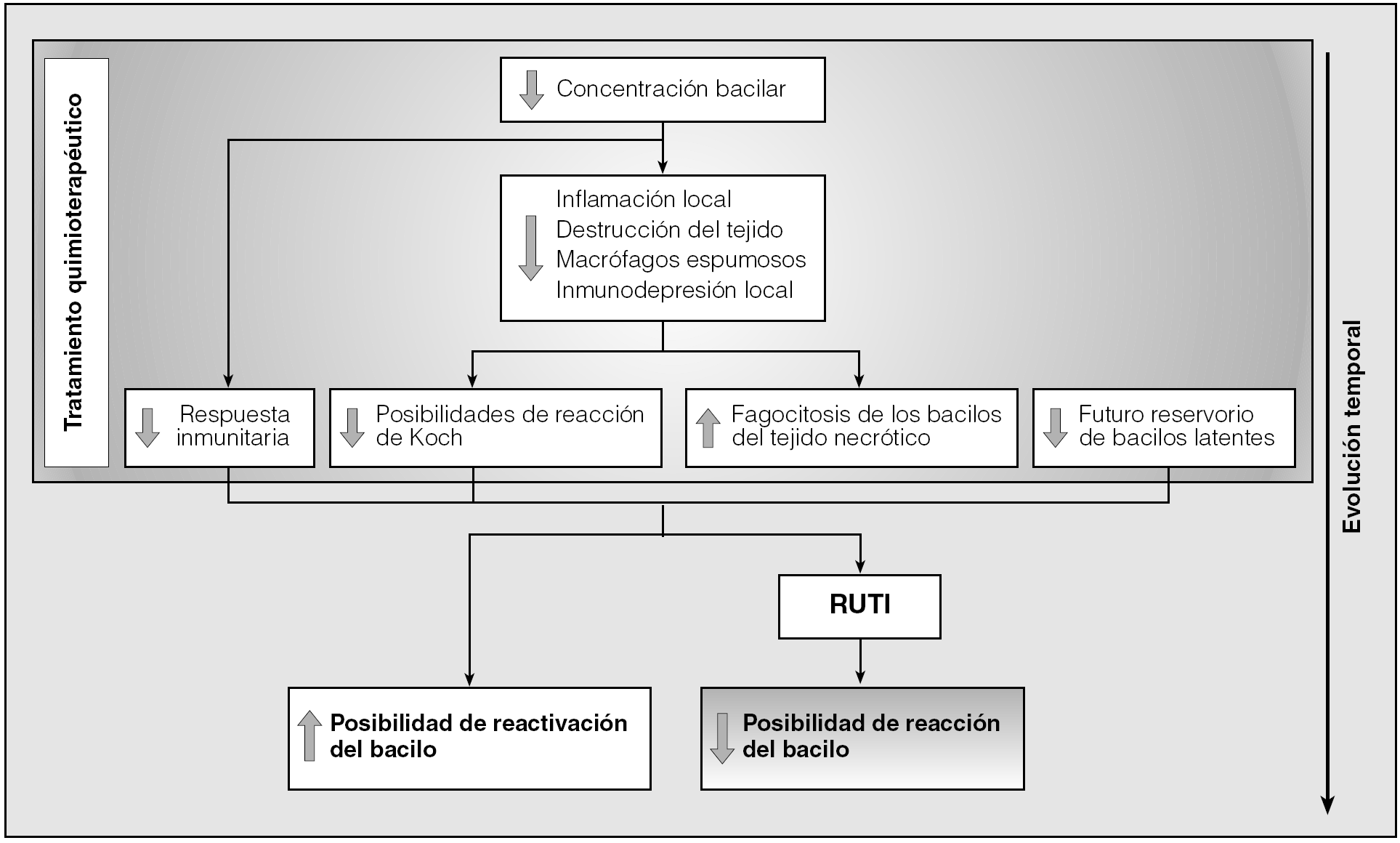
En conclusión, el tratamiento antibiótico permite una desinflamación importante de los tejidos infectados y la estabilización de la población bacilar hacia un mínimo totalmente inactivo, evita fenómenos de inmunodepresión locales y disminuye las posibilidades de generar una reacción de tipo Koch tóxica. Lamentablemente, el tratamiento antibiótico genera una inmunodepresión específica debido a que la concentración bacilar es tan baja que no llega al umbral estimulatorio para generar nuevas células efectoras61. Por ello resulta tan interesante poder realizar un tratamiento inmunoterapéutico tras la quimioterapia, con lo que se evita la reactivación bacilar consecuencia de la presencia de bacilos latentes en los tejidos (al realizarse un tratamiento quimioterápico corto), y la inducción de la inmunodepresión local específica. También por ello es muy importante ejercer una inmunoterapia como la desarrollada por RUTI para poder rebajar sustancialmente el período de quimioterapia al evitar de esta manera la reactivación de los bacilos latentes (fig. 1).
RUTI, ¿cuál es el futuro?
El planteamiento de RUTI surgió como respuesta a todas estas preguntas planteadas en relación con la fisiopatología de la infección. Por ello, después de realizar un tratamiento quimioterápico corto, de un mes como máximo, se ha de llevar a cabo una vacunación del paciente para poder destruir al bacilo latente que transporta.
Actualmente hemos podido demostrar que la administración de RUTI, formada por fragmentos celulares de M. tuberculosis biotransformado y liposomados, genera una respuesta poliantigénica muy importante, con un compotente Th1/Th2/Th3 muy equilibrado y con una producción de anticuerpos intensa, que es muy eficaz en varios modelos experimentales en ratón62 e incluso en cobaya (datos sin publicar). Actualmente estamos interesados en valorar su eficacia en un animal grande como el cerdo, capaz de desarrollar una respuesta inflamatoria muy similar a la humana63.
La vacuna RUTI significa un avance muy importante en el tema de la inmunoterapia de la tuberculosis, puesto que es el primer prototipo que ha podido demostrar su eficacia sin presentar toxicidad para el hospedador. Si bien en la actualidad se están llevando a cabo iniciativas para diseñar nuevos prototipos, la vacuna RUTI ya se está produciendo en una planta piloto para poder utilizarla en futuros ensayos clínicos. Esperando no perder esta ventaja y poder reunir las ayudas necesarias, RUTI podría significar en un tiempo razonable (unos 10 años) una alternativa interesante para disminuir el período de tratamiento de la infección por M. tuberculosis a un mínimo eficaz y asumible, y por supuesto, para reducir posteriormente el período de tratamiento de la enfermedad tuberculosa.
Estudio patrocinado por las becas FIS 01/0644 y 01/3104, así como por una beca SEPAR 2003.
Correspondencia: Dr. P.J. Cardona.
Unitat de Tuberculosi Experimental. Servei de Microbiologia.
Hospital Universitari Germans Trias i Pujol.
Ctra. del Canyet, s/n. 08916 Badalona. Barcelona. España.
Correo electrónico: pcardona@ns.hugtip.scs.es.
Recibido: 10-1-2005; aceptado para su publicación: 15-2-2005.