Introducción
La mayoría de los pacientes con carcinoma de pulmón no microcítico (CPNM) clasificados en estadio III (IIIA y IIIB) se consideran irresecables. El papel de la cirugía con o sin quimioterapia (QT) o radioterapia (RT) se ha examinado en ensayos recientes, y no parece aportar una ventaja clara en relación con la supervivencia1,2, si bien algunos pacientes con circunstancias muy concretas podrían beneficiarse de ella. De todos modos, éstos representan una muy pequeña proporción del total de los diagnosticados en estadio IIIC (estadio clínico, antes de aplicar ningún tratamiento). Una vez descartada la opción quirúrgica, el mejor tratamiento disponible en la actualidad es la combinación de QT con RT, cuya superioridad sobre la RT sola quedó demostrada hace años3-5. Estas pautas son aplicables siempre que no haya derrame pleural y las circunstancias del paciente (estado general y comorbilidad) lo permitan. Los últimos ensayos aleatorizados que han examinado cómo integrar la QT y RT indican una supervivencia mayor para las pautas concurrentes6,7. Sin embargo, dadas las mayores toxicidad y dificultad de aplicación práctica, hay todavía dudas sobre las condiciones necesarias para su empleo8. Tal vez esta mayor toxicidad deba exigir que seamos más selectivos en cuanto a los criterios para incluir a pacientes en estos protocolos concurrentes.
En este trabajo se han analizado la supervivencia y los efectos adversos del tratamiento combinado (QT y RT en pauta secuencial) de los pacientes con CPNM y estadio III diagnosticados en nuestro centro. También se ha examinado el valor pronóstico de diversas variables epidemiológicas, clínicas y analíticas, lo que puede ayudar a seleccionar mejor a los pacientes candidatos a pautas más agresivas.
Pacientes y métodos
Hemos efectuado un estudio retrospectivo de los pacientes diagnosticados de CPNM en nuestro centro entre enero de 1996 y diciembre de 2004 y tratados con pauta combinada de QT y RT. La práctica totalidad de ellos fueron diagnosticados en la sección de neumología y la mayoría de las variables analizadas se registraron y anotaron en el momento del diagnóstico, ya que los datos han contribuido a estudios de otra naturaleza.>
Se incluyó a los pacientes con diagnóstico citohistológico de CPNM, estadio III (IIIA y IIIB) y tratados sólo con QT y RT. Se excluyó a los resecados con cirugía en algún momento del proceso. El período de estudio abarcó a los diagnosticados desde enero de 1996 hasta 2004, y se incluyó sólo a los que tenían un tiempo de seguimiento mínimo de 18 meses al cierre del estudio.
Los criterios usados para incluir a los pacientes en el protocolo combinado de QT y RT fueron los siguientes: a) ausencia de derrame pleural neoplásico; b) estado clínico general (el performance status en la bibliografía anglosajona), valorado mediante la escala del Eastern Cooperative Oncological Group (ECOG), con grado igual o menor a 2; c) ausencia de comorbilidad lo suficientemente grave (enfermedad pulmonar obstructiva crónica grave, insuficiencia cardíaca, renal o hepática clínicamente relevantes, etc.) para que el médico responsable considerase contraindicado dicho tratamiento combinado, y d) consentimiento informado por escrito por parte del paciente y algún familiar.
Procedimientos de diagnóstico y estadificación
A todos los pacientes se les realizó, además del estudio básico (historia clínica, exploración, analítica elemental y radiografía de tórax), una tomografía axial computarizada (TAC) de tórax y abdomen superior, así como espirometría y electrocardiograma. El diagnóstico se confirmó mediante muestra citohistológica a través de fibrobroncoscopia u otros procedimientos (punción de adenopatía, punción transtorácica o mediastinoscopia). Si el paciente parecía potencialmente candidato a cirugía o tratamiento combinado, se efectuó un estudio craneal mediante TAC o resonancia magnética para descartar metástasis silentes. Otras pruebas (gammagrafía ósea, radiografía ósea o biopsia de órgano) se efectuaron según los síntomas.
En cuanto al estadio, se obtuvo una prueba citohistológica en el 52,2% de los pacientes: mediante mediastinoscopia en 33; mediante punción subcarinal o transtraqueal en otros 9, y por punción de adenopatía supraclavicular en 6. En otros 14 (15,2%) hubo evidencia clínica (7 con parálisis recurrencial, 4 con invasión y/o compresión traqueal y 3 con síndrome de vena cava) de afectación mediastínica o T4.
En los 30 casos restantes (32,6%) el estadio se clasificó sólo mediante métodos radiológicos (radiografía y TAC de tórax, con adenopatías evidentes, habitualmente de gran tamaño). Los subgrupos TNM se presentan más adelante.
Pautas de tratamiento
- QT. A lo largo de los años de inclusión de pacientes se aplicaron 3 pautas diferentes: a) carboplatino intravenoso (i.v.) área bajo la curva (AUC) de 6 el día 1 y 120 mg/m<² de superficie corporal i.v. de etopósido el día 1 y por vía oral los días 2 y 3, cada 21 días; b) paclitaxel, a dosis de 200 mg/m² de superficie corporal, y carboplatino i.v. (AUC de 6) el día 1, cada 21 días, y c) 1.500 mg/m² de superficie corporal de gencitabina los días 1 y 8, vía i.v., y carboplatino i.v. (AUC de 5) el día 1, cada 21 días. El número de ciclos programado fue de 3 a 6 durante los primeros 4 años, dependiendo de la pauta aplicada y la tolerancia del paciente a la QT. A partir del año 2000 se redujeron a 3 o 4 ciclos. Antes del comienzo de cada ciclo los pacientes recibieron una pauta antiemética con corticoides y antiserotoninérgicos.
- RT. Se programó entre 20 y 40 días después del último ciclo. Todos los pacientes se irradiaron a una dosis por fracción de 200 cGy, 5 días a la semana, hasta alcanzar una dosis de 5.000 cGy en las localizaciones de riesgo de enfermedad subclínica y 6.000 cGy en el volumen tumoral macroscópico (primario y ganglionar). La dosis total sobre la médula espinal fue igual o superior a 4.500 cGy. Los volúmenes tratados y la técnica de irradiación sufrieron modificaciones durante los 8 años del estudio.
Entre 1996 y 2000 los casos se planificaron bajo simulación convencional 2D; el volumen de tratamiento inicial incluyó habitualmente la afectación macroscópica radiológica pulmonar y mediastínica, el hilio pulmonar homolateral, estaciones mediastínicas 2 a 7 para las neoplasias de los lóbulos superiores y 2 a 9 para las de los lóbulos medios e inferiores, y en todos los casos ambas fosas supraclaviculares. El volumen de sobreimpresión consistió en la enfermedad macroscópica con un margen adicional. Se emplearon múltiples puertas de entrada con haces de 60Co y fotones de acelerador lineal de 18 MV. Las protecciones se conformaban con bloques de Cerroben®.
Desde 2001 las simulaciones se efectúan con TAC helicoidal y se planifican los tratamientos con una dosimetría 3D según las normas del informe 50 de la International Commission on Radiation Units and Measurements (ICRU)9. Para la planificación se introdujo, como criterio adicional a la dosis de tolerancia medular, la dosis de tolerancia pulmonar (riesgo de neumonitis) y V2010 (volumen pulmonar que recibe una dosis ≥ 20 Gy). El volumen de tratamiento se restringe a la afectación macroscópica tumoral y ganglionar (toda adenopatía ≥ 1 cm), sin intentar incluir de manera electiva las estaciones ganglionares no afectadas11-14. No obstante, en ocasiones, según criterio del clínico, algunos pacientes recibieron irradiación electiva mediastínica o supraclavicular. El tratamiento se ejecutó con un acelerador lineal de electrones, mediante múltiples haces isocéntricos de fotones de 15 MV y colimación de multiláminas.
Criterios de respuesta
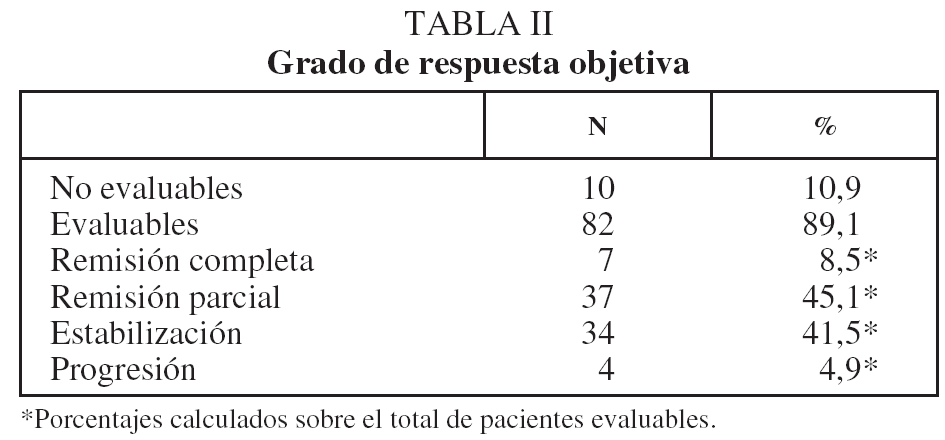
Para la evaluación de la respuesta objetiva se repitieron las pruebas radiológicas (radiografía de tórax y/o TAC) entre 20 y 30 días después de finalizado el tratamiento. Se utilizaron los criterios RECIST (Response Evaluation Criteria in Solid Tumors), basados en el cambio de longitud en uno de los diámetros de las lesiones medibles15. Se usaron los criterios habituales para clasificar la respuesta en remisión completa o parcial, estabilización o progresión.
El tiempo de supervivencia se calculó desde la fecha de comienzo del tratamiento hasta la de fallecimiento o última revisión, si el paciente continuaba vivo.
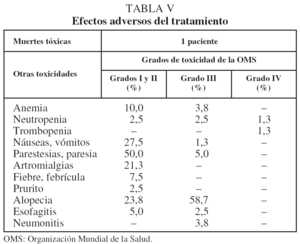
La toxicidad del tratamiento se evaluó mediante los criterios de la Organización Mundial de la Salud (OMS)16.
Análisis estadístico
Las curvas de supervivencia se elaboraron siguiendo el método de Kaplan-Meier. Para las comparaciones entre grupos se empleó la prueba de rangos logarítmicos. Una vez efectuado el análisis univariante con cada una de las variables, se seleccionaron las que habían alcanzado la significación estadística para incluirlas en un modelo multivariante de riesgos proporcionales (prueba de Cox), mediante un procedimiento de exclusión secuencial. La correlación entre variables se analizó mediante el coeficiente de Pearson. Para la ejecución de las pruebas se empleó el programa SPSS, versión 8.
Resultados
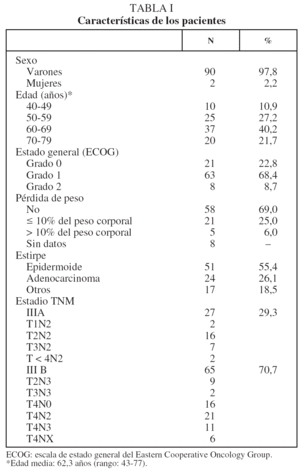
Desde enero de 1996 hasta diciembre de 2004 se incluyó en el protocolo de tratamiento combinado a 116 pacientes con CPNM a quienes no se había intervenido quirúrgicamente. Se excluyó del presente estudio a 24 pacientes: 12 presentaban estadios TNM I o II y otros 4, estadio IV; 2 recibieron una pauta de QT y RT concurrente, y en los 6 restantes el tiempo de seguimiento era insuficiente según los criterios de inclusión. Las características de los 92 pacientes finalmente incluidos, con los subgrupos TNM dentro de cada grupo (IIIA o IIIB), se muestran en la tabla I.
Cumplimiento del tratamiento
Seis pacientes (6,5%) recibieron menos de 3 ciclos (sólo 2) de QT. En cuanto a la dosis de RT, 79 (86%) completaron los 6.000 cGy programados, con ocasionales retrasos debidos a dificultades instrumentales. Los 13 restantes recibieron entre 2.000 y 5.000 cGy.
La evolución pudo evaluarse en todos los pacientes, salvo uno en quien se interrumpió el seguimiento después de 16 meses por traslado de residencia a lugar desconocido. Al cierre del estudio, 13 permanecían vivos. En estos últimos, la mediana del tiempo de seguimiento fue de 28 meses (mínimo: 18; máximo: 83).
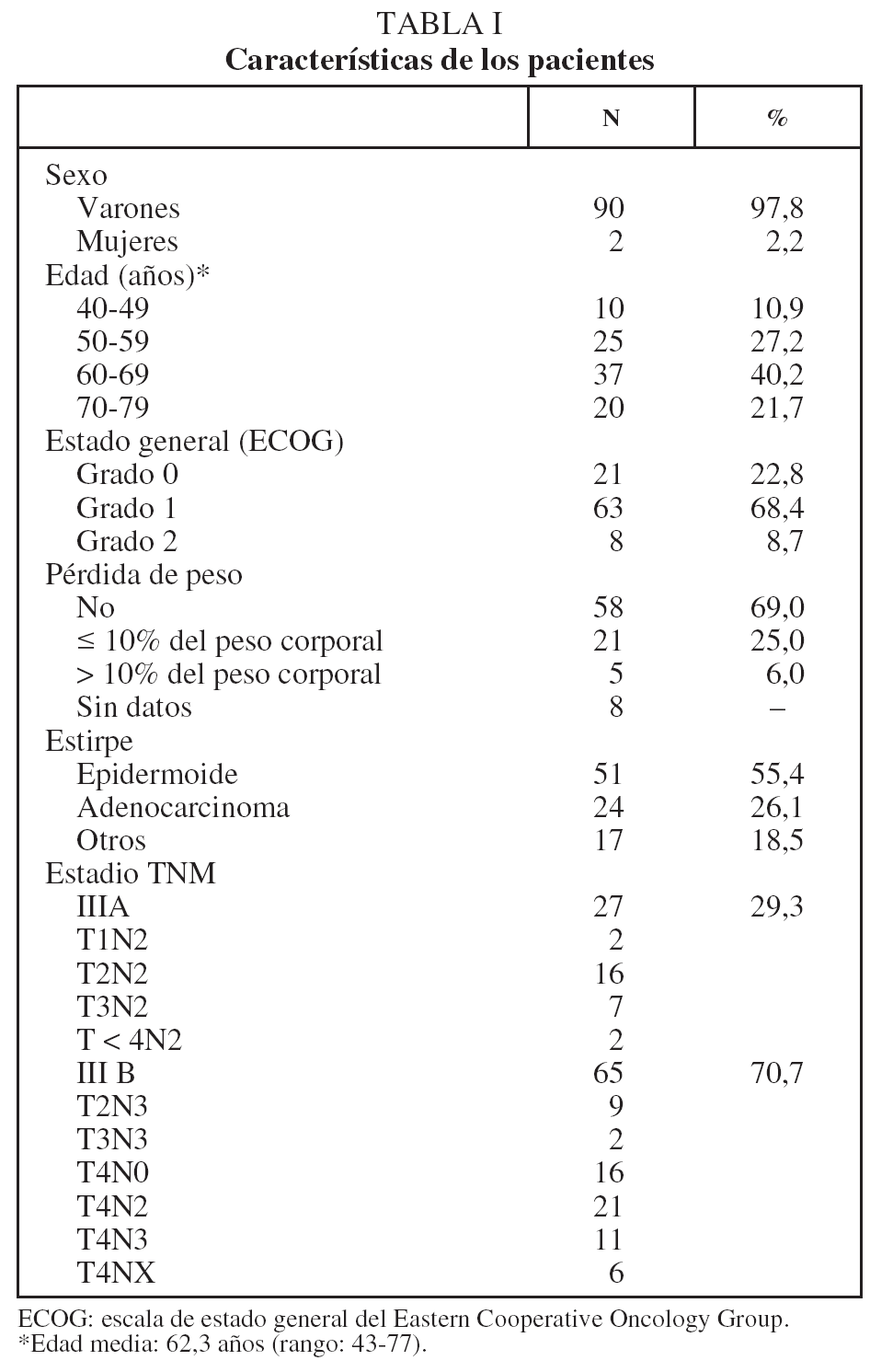
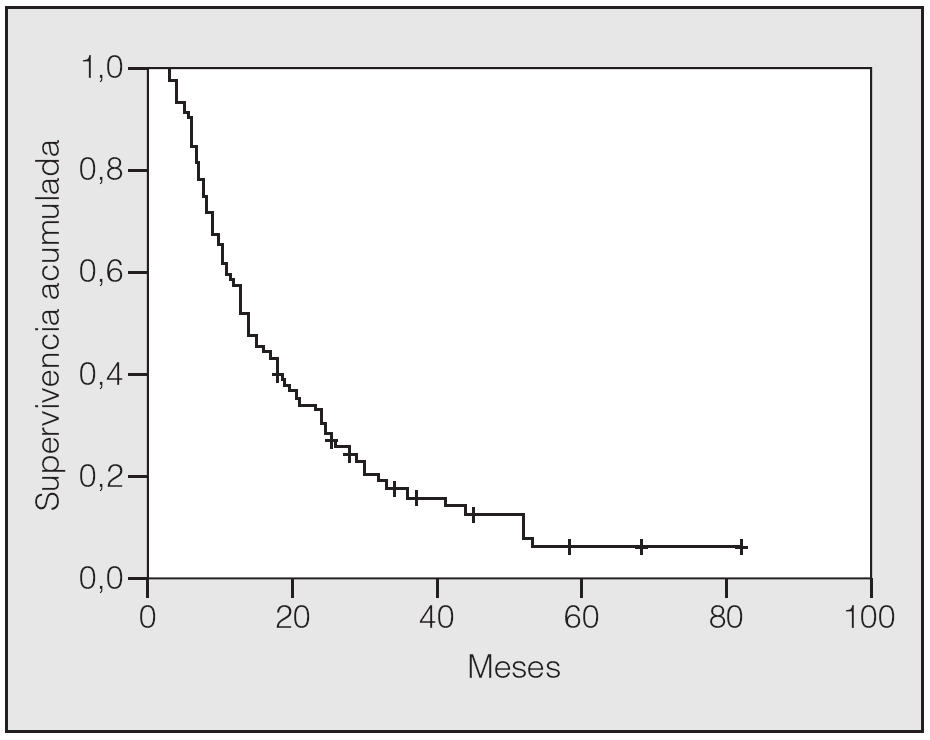
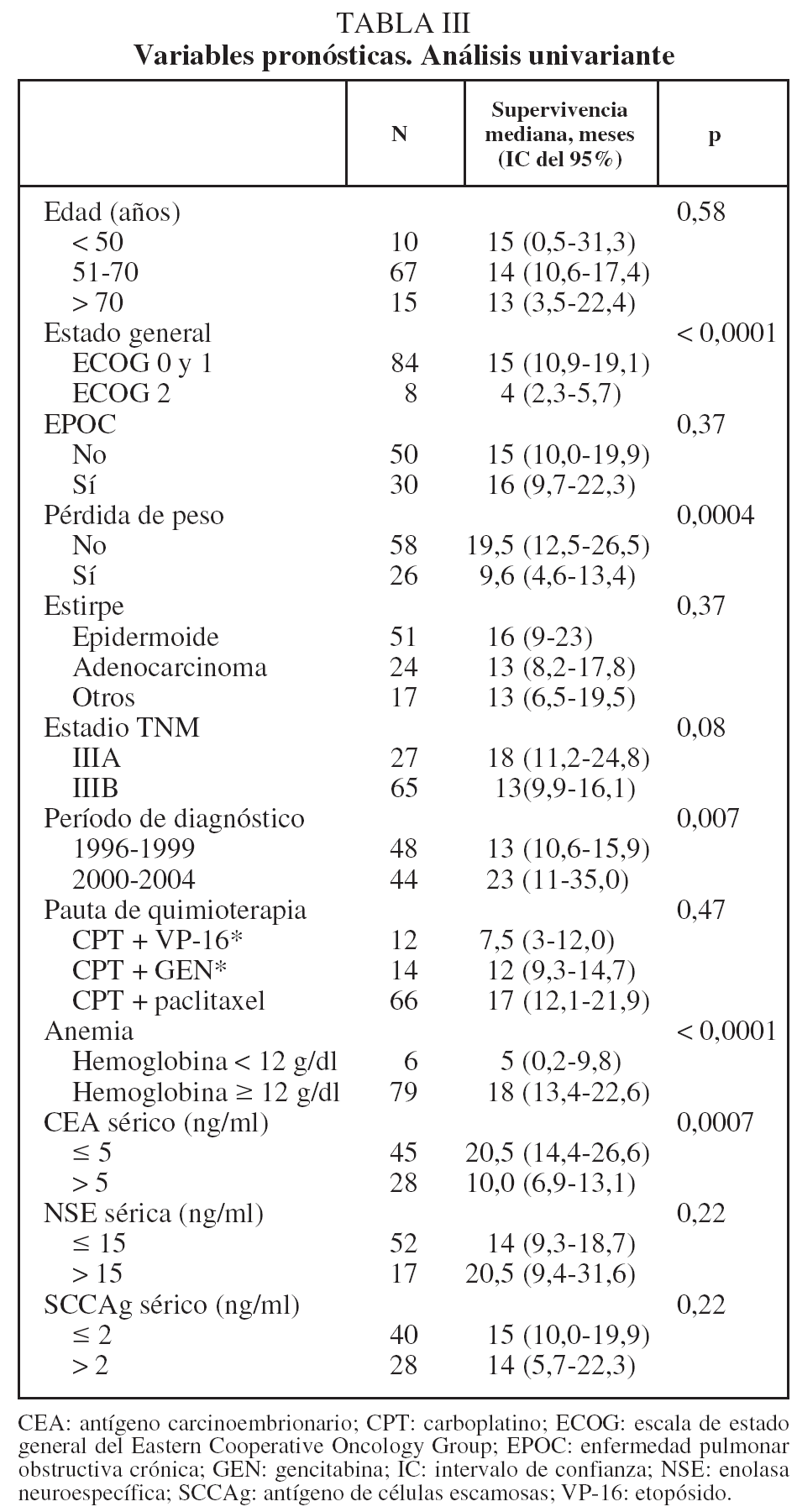
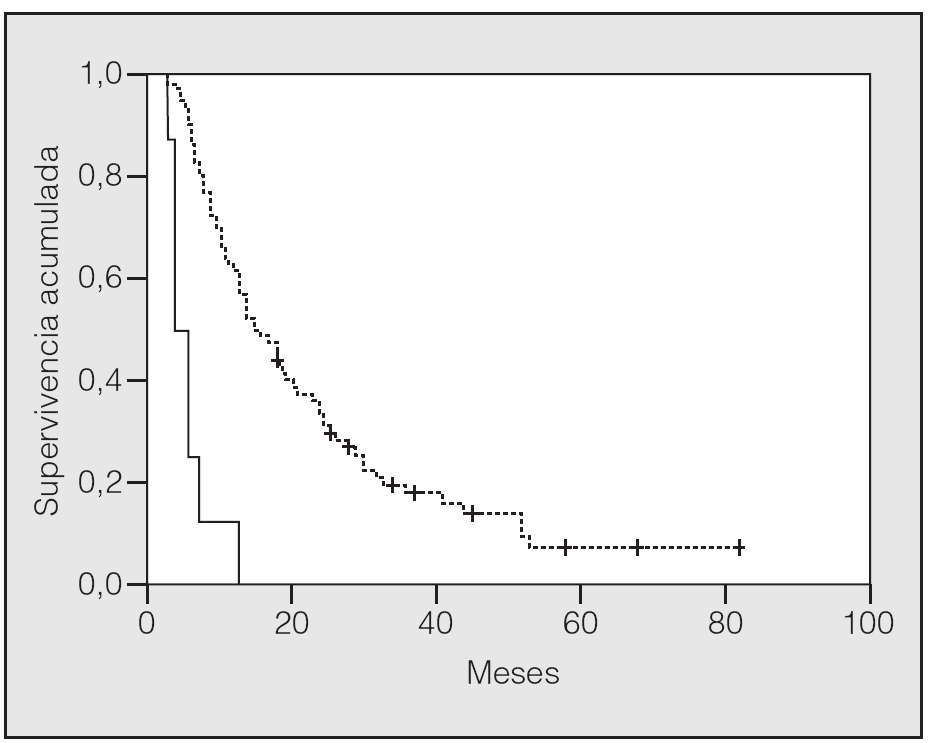
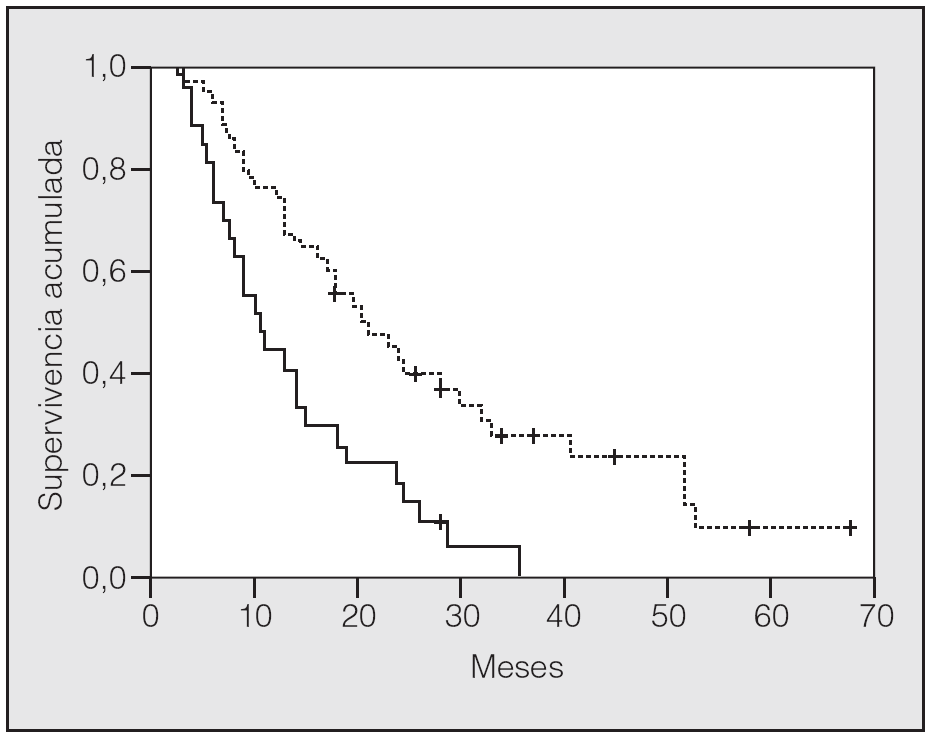
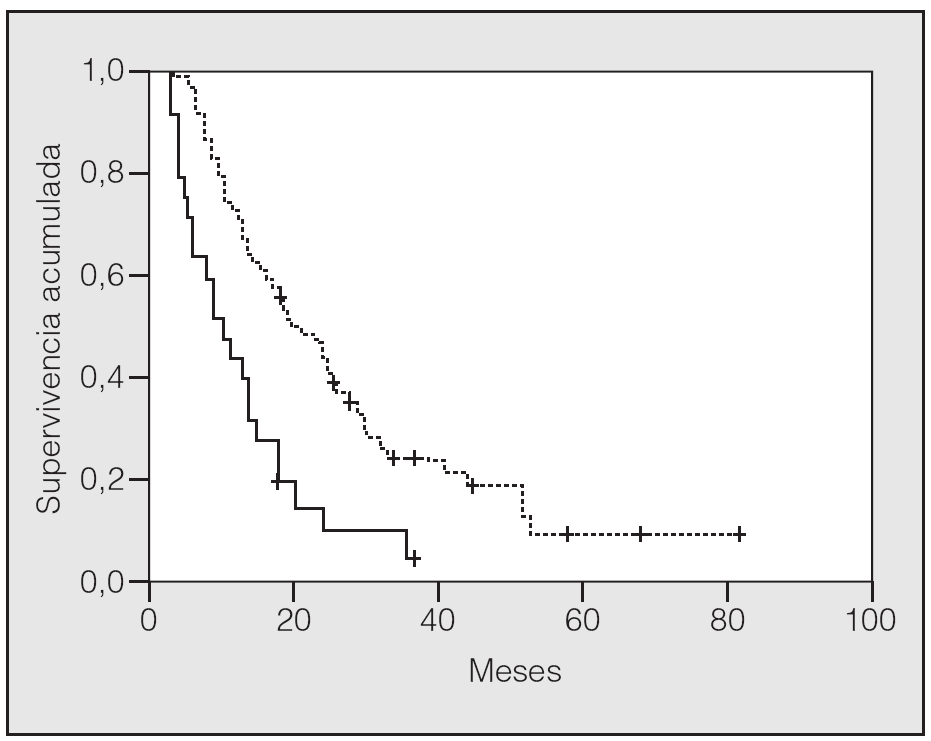
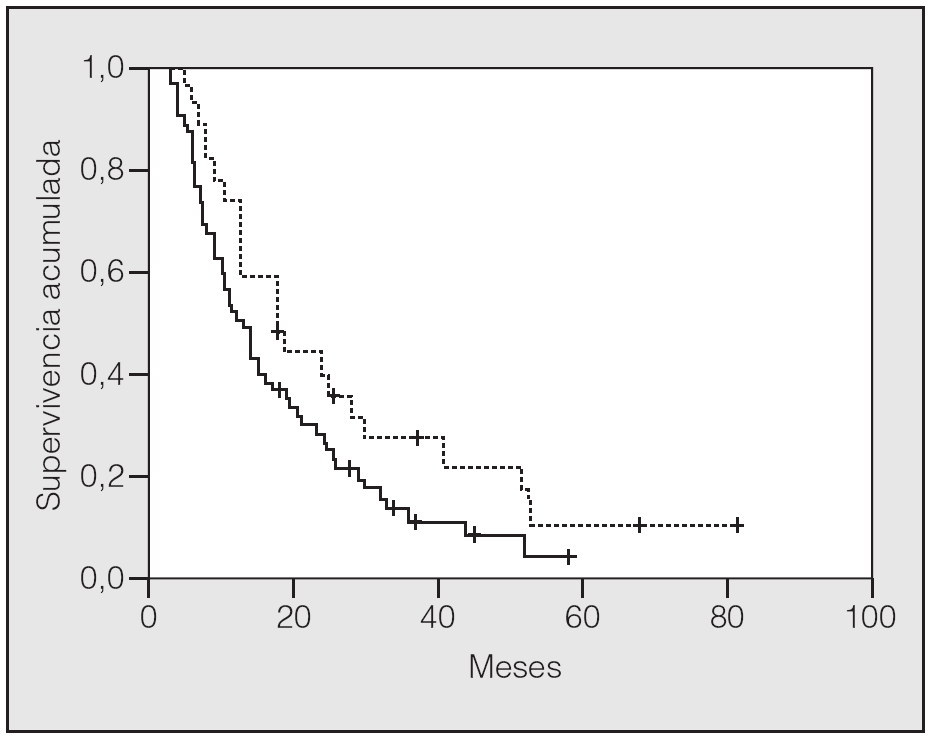
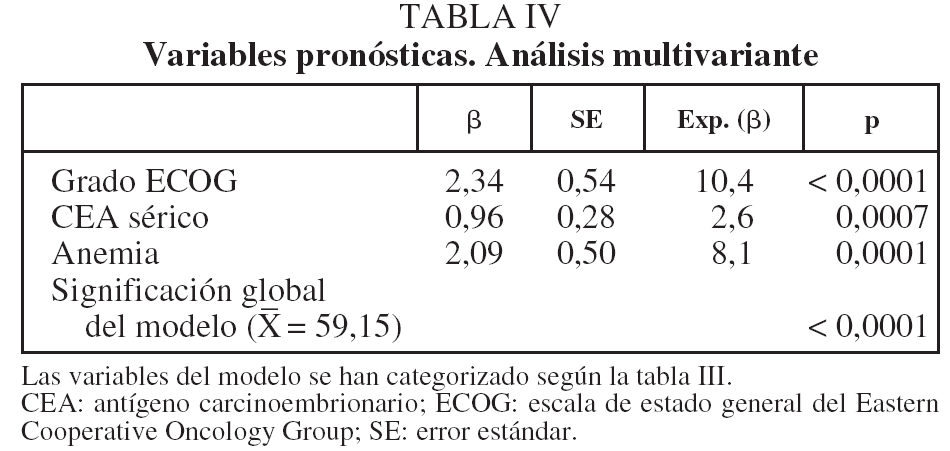
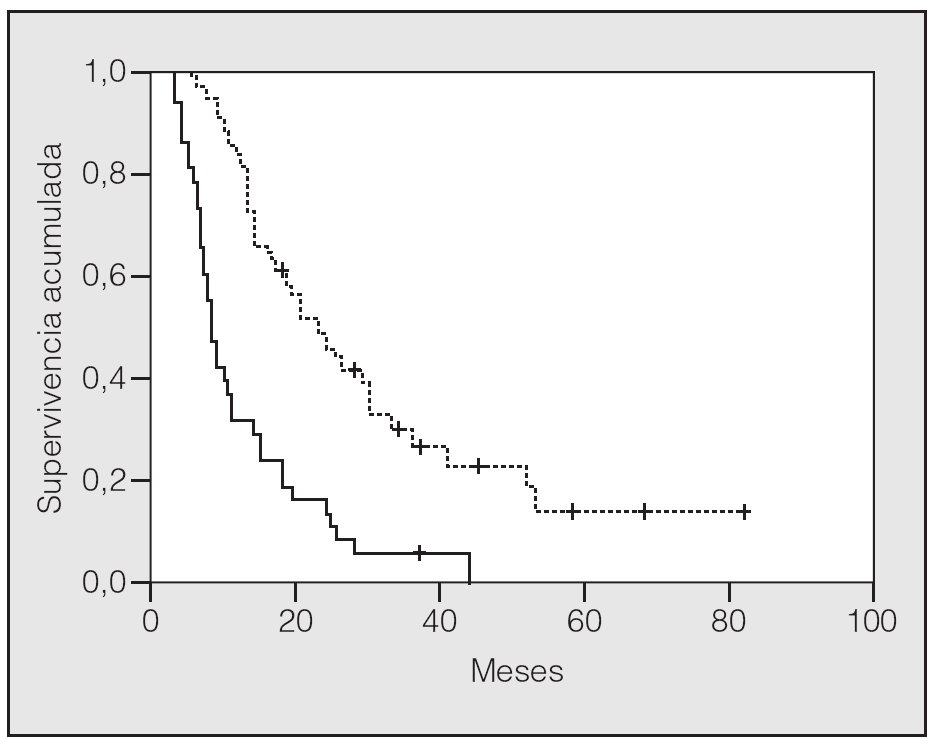
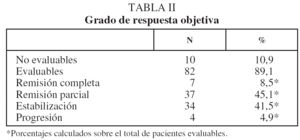
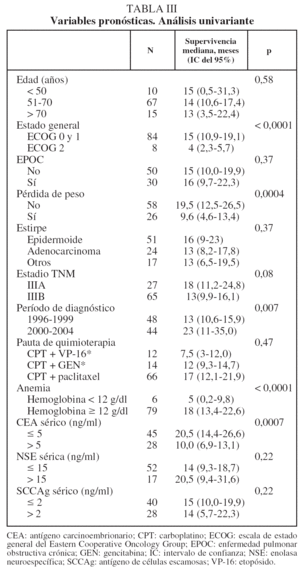
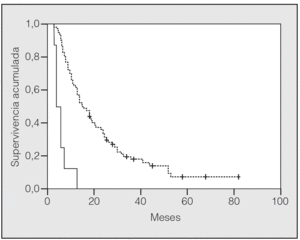
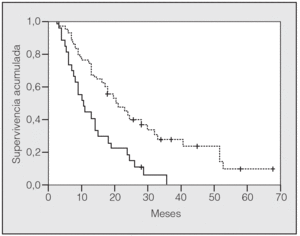
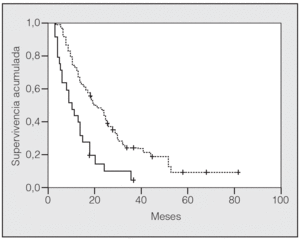
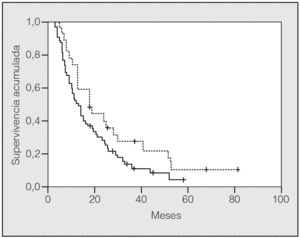
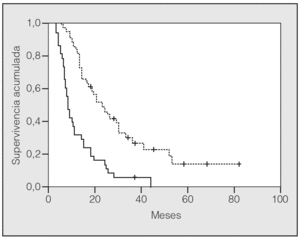
En lo que respecta a la estirpe histológica (tabla I), en el grupo de "otros" se incluyen 14 clasificados como "no microcíticos" sin mayor especificación, 2 indiferenciados de células grandes y uno mixto (adenoescamoso). El grado de respuesta (criterios RECIST15) se muestra en la tabla II. En la figura 1 se presenta la curva de supervivencia de todo el grupo. Como puede verse, la mediana fue de 14 meses (intervalo de confianza del 95%, 11-17 meses), y el porcentaje de supervivientes a los 3 años, del 16,1%. En la tabla III se muestra el análisis univariante de los factores pronósticos determinados en el momento del diagnóstico. En algunas variables, el número total de pacientes es inferior a 92, dado que no se pudieron recoger los datos en todos. Como puede verse, un mal estado general (ECOG grado 2), la presencia de anemia o pérdida de peso y una concentración sérica elevada de antígeno carcinoembrionario (CEA) tuvieron un significado pronóstico adverso. Igual significado tuvo el hecho de haber sido diagnosticado, y tratado, en la primera mitad del período de estudio (1996-1999). En cuanto al estadio TNM, los pacientes con IIIA tuvieron mejor pronóstico que los IIIB, aunque la diferencia no alcanzó la significación estadística. En las figuras 2-5 se presentan las curvas de supervivencia según los valores de algunos de los mencionados factores pronósticos. Al incluir en un modelo multivariante (método de Cox) las variables con significación (p < 0,05), se obtuvieron los resultados que se muestran en la tabla IV. La variable "pérdida de peso", de gran peso pronóstico en el análisis univariante, no entraba en el modelo final debido a su estrecha correlación con el grado ECOG (coeficiente de Pearson = 0,372; p < 0,01). La figura 6 muestra que la obtención de una respuesta objetiva favorable (remisión completa o parcial) se asoció a una supervivencia significativamente mayor.
Fig. 1. Supervivencia global de la serie. Mediana de supervivencia: 14 meses. Supervivencia a 1, 2 y 3 años del 57,6, el 30,1 y el 16,1%, respectivamente.
Fig. 2. Supervivencia según grado ECOG (escala de estado general del Eastern Cooperative Oncology Group). Línea discontinua: ECOG 0 y 1; línea continua: ECOG 2.
Fig. 3. Supervivencia según el valor sérico del antígeno carcinoembrionario fuera < 5 ng/ml (línea discontinua) o > 5 ng/ml (línea continua) (p = 0,0007).
Fig. 4. Supervivencia según pérdida de peso (p = 0,0005). Línea discontinua: sin pérdida de peso; línea continua: con pérdida de peso.
Fig. 5. Supervivencia según estadio TNM (p = 0,08). Línea discontinua: estadio IIIA; línea continua: estadio IIIB.
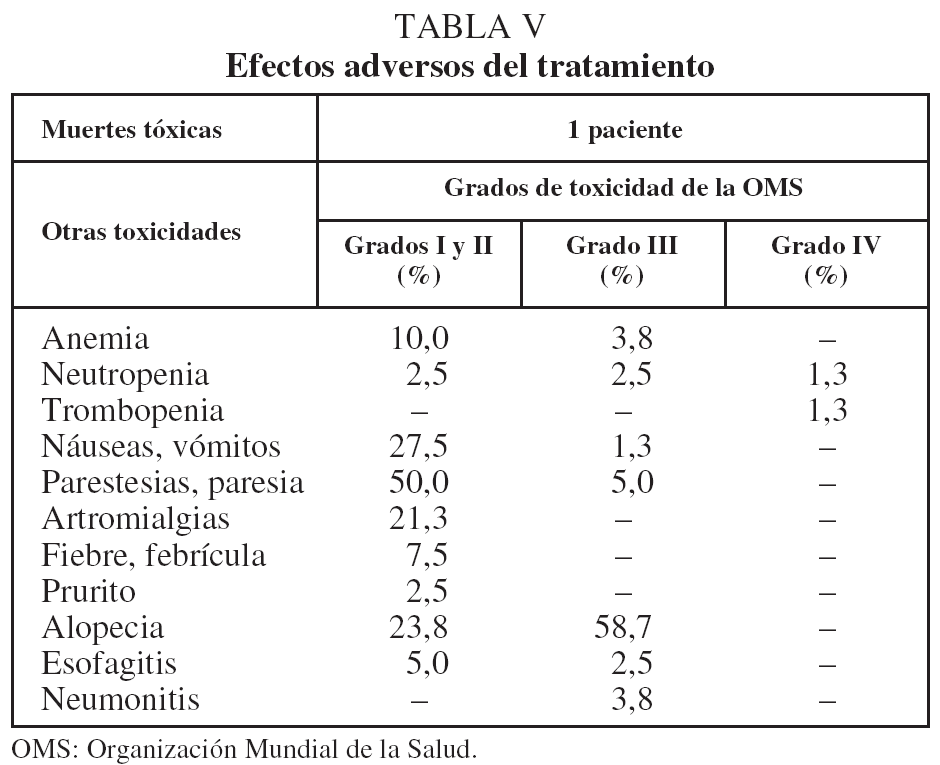
En cuanto a los efectos adversos, clasificados según los grados de la OMS16, se muestran en la tabla V.
Discusión
Desde que algunos ensayos aleatorizados3-5 y un metaanálisis17 en pacientes con CPNM y estadio III demostraron que las pautas combinadas (QT y RT) tenían una eficacia terapéutica mayor que la RT sola, que había sido el tratamiento tradicional durante años, diversos autores han examinado múltiples combinaciones con nuevos fármacos, nuevos esquemas de RT y nuevos modos de integración de QT y RT5,7,18-23. Algunos resultados preliminares de estos ensayos son prometedores, aunque aún se necesita más tiempo para conocer el alcance terapéutico de estas nuevas pautas.
Una de las limitaciones, común a muchos de los ensayos sobre tratamientos combinados sin cirugía en estadio III, es el bajo grado de certeza en la estadificación, que a menudo se basa (especialmente en cuanto a la afectación mediastínica) sólo en métodos de imagen o no se detalla6,7,18-24. Sin embargo, en dos tercios de los pacientes de nuestra serie pudimos disponer de confirmación citohistológica o evidencia clínica adecuada (parálisis recurrencial, síndrome de vena cava) de dicha afectación mediastínica. En los restantes, aun sin esa confirmación, la TAC de tórax mostró afectación ganglionar extensa del mediastino. Por otro lado, se efectuó sistemáticamente estudio radiológico intracraneal (mediante TAC o resonancia magnética) para descartar posibles metástasis silentes, que pueden estar presentes en un porcentaje no despreciable de pacientes25,26. Además, a diferencia de otras publicaciones que incluyen a pacientes con estadios I y II5,18,19,24, hemos limitado el análisis estrictamente al estadio III. En cuanto a las características propias de los pacientes, hemos incluido a algunos con ECOG de grado 2 o pérdida de peso mayor del 10% del peso corporal (tabla I), circunstancias que constituyen criterios de exclusión en algunos de los ensayos publicados5,18-23,27-29. Dada la importancia de los factores pronósticos dependientes del paciente, pequeñas diferencias en los criterios de inclusión pueden justificar las diferencias de supervivencia que se observan en los estudios, con medianas entre 11 y 17 meses5-7,19,20,27,28. Nuestros resultados (mediana de 14 meses y porcentaje de supervivientes a los 3 años del 16,1%) están dentro del rango referido en pacientes con estadio III, y son muy parecidos a los de una serie de pacientes tratados con pauta concurrente y cuyas circunstancias pronósticas menos favorables les impidieron participar en otros ensayos con cisplatino30.
Al analizar los posibles factores de valor pronóstico, encontramos que el estadio TNM (IIIA o IIIB) no alcanzó significación estadística, aunque hay que tener en cuenta el pequeño tamaño del grupo IIIA. Esto no ha de sorprender, y en otros estudios, como el del grupo RTOG29, incluso el estadio IIIB tuvo mejor supervivencia que el IIIA. Los autores atribuyeron ese resultado a la gran heterogeneidad que hay tanto dentro del grupo IIIA como del IIIB, además de a la dificultad (antes comentada) de una estadificación precisa. En nuestra opinión, incluso con una estadificación más exacta, en el contexto de tratamientos combinados sin cirugía, otras circunstancias tienen mayor peso pronóstico que el subgrupo TNM (IIIA o IIIB). Como es de esperar, los autores que incluyen en sus series a pacientes con estadios I y II sí encuentran habitualmente un valor pronóstico elevado para el estadio TNM, pero, a nuestro juicio, esos pacientes, a los que se ha dejado de operar por razones no siempre explícitas, requerirían un análisis por separado.
La capacidad para realizar las actividades habituales, incluido el cuidado personal (el estado funcional, evaluado habitualmente mediante las escalas de Karnofsky y la ECOG), tiene invariablemente un poder pronóstico elevado. Incluso algunos autores que excluyen para el tratamiento combinado a los pacientes con grado ECOG igual o mayor de 2 observan diferencias significativas entre los de grado 0 o 129. Nosotros, además de una elevadísima significación estadística, hemos comprobado que sólo uno de los pacientes con ECOG 2 apenas superó el año de supervivencia (13 meses). Por ello, concluimos que tales pacientes deberían ser subsidiarios de tratamientos menos agresivos y sólo excepcionalmente podría considerarse una pauta combinada con intención radical.
Aunque es conocido el mal pronóstico que supone la pérdida de peso en los 6 meses previos no achacable a otro motivo como trastorno metabólico (diabetes, etc.) o plan dietético29,30, y así lo comprobamos también en nuestra casuística, la alta significación estadística observada en el modelo univariante no se mantuvo en el multivariante, dado su estrecho paralelismo con un grado ECOG elevado, parámetro ya presente en el modelo.
En algunos de los ensayos realizados con pautas combinadas se establece un límite superior de edad como criterio de inclusión, habitualmente 75 años. El mayor de nuestros pacientes tenía 77, y apenas hay datos sobre estos tratamientos en los mayores de 80 años. No obstante, la edad per se no parece influir negativamente en los resultados28. En nuestra serie, tampoco hubo diferencias de supervivencia entre los mayores de 70 años y el resto. Sí parece que la toxicidad puede ser mayor, lo que probablemente esté en relación con la más frecuente comorbilidad asociada a la edad avanzada.
Al igual que otros estudios, especialmente el del grupo RTOG29, encontramos que la presencia de anemia inicial se asocia estrechamente a un peor pronóstico. De hecho, una cifra de hemoglobina inferior a 12 g/dl fue uno de los 3 parámetros que mantuvo un significado pronóstico independiente en el análisis multivariante. Dado que esta circunstancia es corregible mediante transfusiones o preparados de eritropoyetina, antes de excluir a estos pacientes para tratamientos agresivos debería considerarse el posible uso de esos tratamientos de soporte si reúnen otras circunstancias favorables29.
La concentración sérica de CEA, uno de los más antiguos y conocidos marcadores moleculares de cáncer en general, tiene un valor diagnóstico moderado en el CPNM31, y su valor para el pronóstico y seguimiento de los pacientes operados se ha analizado en varios estudios32, pero no hemos encontrado trabajos que analicen su significado en el contexto concreto de pacientes con estadio III que reciben pautas de QT y RT combinadas. En el presente estudio, comprobamos que una cifra por encima del límite normal (5 ng/ml) se asocia claramente a una supervivencia más corta, y esta capacidad discriminatoria es independiente de otros factores, como se muestra en el análisis multivariante. Este hallazgo indica la posibilidad de que una concentración elevada de CEA sérico traduzca una conducta biológica más agresiva del tumor.
Durante el último período temporal de inclusión de pacientes (2000-2004), la supervivencia fue significativamente mayor que durante la primera etapa (1996-1999) con unas medianas de 23 y 13 meses, respectivamente. Aunque la interpretación más inmediata sería la de un posible efecto de la experiencia tras una curva de aprendizaje inicial, es difícil prescindir de otras circunstancias asociadas estrechamente a la segunda etapa, como una mayor certeza en la estadificación, el uso de técnicas de planificación radioterapéuticas más precisas o el mayor empleo de la pauta de QT con paclitaxel y carboplatino, que deparó mejor supervivencia, aunque no se alcanzara la significación (difícil de obtener, dado el pequeño tamaño muestral de las otras pautas).
La respuesta favorable objetivada mediante métodos de imagen (remisión completa o parcial) es un dato difícil de medir e idealmente requeriría una evaluación externa (no efectuada en este trabajo). Además, recientemente se ha comprobado que la evaluación mediante TAC tiende a subestimar el porcentaje de remisiones completas patológicas33. Pese a tales limitaciones, la consecución de una remisión (completa o parcial), según criterios tradicionales, fue en nuestros pacientes un requisito previo para alcanzar una supervivencia larga (fig. 6).
Fig. 6. Supervivencia según la respuesta al tratamiento (p > 0,0001). Línea discontinua: remisión completa o parcial; línea continua: estabilización o progresión.
En cuanto a los tratamientos combinados, 2 ensayos recientes señalan que la pauta concurrente tiene una eficacia mayor que la secuencial6,7. Tales pautas producen también una mayor toxicidad, especialmente esofagitis y neumonitis. A este respecto, el porcentaje de toxicidades importantes (grados III y IV de la OMS) observado por nosotros con la pauta secuencial ha sido muy bajo, claramente por inferior a los referidos en otras series5-7,18-21,27. Esto indica un cierto margen para aumentar la agresividad terapéutica mediante la modalidad concurrente, lo que podría beneficiar al menos a pacientes con circunstancias más favorables (jóvenes, sin anemia, con un grado ECOG bajo, etc.). Además, en el futuro inmediato es probable que la incorporación de los nuevos avances tecnológicos (RT de intensidad modulada, RT acompasada al movimiento respiratorio o 4D, etc.)34 permita aumentar la dosis sobre el tejido tumoral, al limitar los efectos sobre el tejido sano.
En conclusión, la supervivencia mediana de nuestros pacientes con CPNM y estadio IIIA y B tratados con QT y RT combinadas de modo secuencial es de 14 meses, cifra similar a la de otras publicaciones. Un mal estado general (ECOG ≥ 2) debería considerarse una contraindicación seria para el uso de estas pautas combinadas. La presencia de anemia tiene pronóstico adverso, por lo que debe corregirse, si es posible, antes de aplicar pautas de QT y RT agresivas. Otras circunstancias, como la pérdida de peso y una concentración sérica elevada de CEA, también tienen mal pronóstico. Dada la relativa baja toxicidad de la pauta analizada, posiblemente los pacientes con circunstancias más favorables podrían beneficiarse de tratamientos de eficacia algo superior aunque más tóxicos, como son las pautas concurrentes.
Correspondencia: Dr. J. Sánchez de Cos Escuín.
Isla de Hierro, 2, 3.o C. 10001 Cáceres. España.
Correo electrónico: jsd01cc@saludalia.com
Recibido: 21-3-2006; aceptado para su publicación: 28-11-2006.