Introducción
Desde la década de 1960 hemos asistido a una sorprendente escalada de la prevalencia global de asma, así como de la morbilidad, mortalidad y carga económica a ella asociadas. A partir de los datos recogidos por la Global Initiative for Asthma (GINA)1, se estima que la prevalencia de asma en el mundo se está incrementando en un 50% cada década. En el caso de la Unión Europea, la prevalencia se ha doblado en el último decenio, lo que se traduce en una cifra actual cercana a los 30 millones de personas afectadas. En el caso de España, entre el 5,1 y el 7,5% de la población es asmática. El coste global del asma excede el coste combinado del virus de la inmunodeficiencia humana/sida y la tuberculosis, siendo en Europa de aproximadamente 17,7 billones de euros al año2,3. Ante estas cifras, resulta lógico que el asma sea el centro de una extensa actividad científica, que ha dado lugar a la publicación, como promedio, de un artículo original de investigación cada 3 h durante la última década4. El despliegue tecnológico que aceleradamente está propulsando todos los campos de investigación biomédica ha facilitado avances importantes en el conocimiento de los mecanismos patogénicos del asma y ha dado lugar a avances terapéuticos que han tenido un impacto significativo en el manejo y control de la enfermedad. Sin embargo, el número de asmáticos continúa aumentando y no se ha eliminado una proporción de la incidencia y prevalencia de asma que corresponde a enfermedad grave y de difícil manejo. Globalmente se atribuyen al asma unas 180.000 muertes al año. Aunque la distribución geográfica de los fallecimientos por asma muestra variaciones regionales en el mundo, factores como el tratamiento inadecuado, la pobreza y las limitaciones en la accesibilidad a servicios de salud apropiados explican sólo parcialmente la mortalidad por asma. En lugares sanitariamente privilegiados como la Unión Europea, la mortalidad por asma oscila entre el 0,78 y el 1 por 100.000 habitantes en los países centroeuropeos e islas británicas2, lo que supondría aproximadamente entre 8 y 10 muertes por asma al año en una población local de 1.000.000 de personas. En algunas zonas de la Unión Europea, la letalidad del asma alcanza 10 casos por 100.000 asmáticos y año1. El tratamiento inadecuado o el incumplimiento del tratamiento parecen explicar sólo un porcentaje limitado de estos fallecimientos. A la vista de este conjunto de datos sobre prevalencia y mortalidad, existe unanimidad en que la dimensión del problema del asma ha aumentado a pesar de los avances acaecidos, y el pulso entre el desarrollo científico y el comportamiento de la enfermedad continúa. En años recientes la investigación sobre asma ha dado lugar a giros conceptuales importantes, que probablemente se seguirán de implicaciones clínicas, algunas de las cuales ya se encuentran, en mayor o menor medida, en camino. El objetivo principal de la investigación traslacional en el asma es entender los mecanismos de su patogenia y, consecuentemente, desarrollar estrategias terapéuticas que hagan diana biológica sobre esos mecanismos. En este artículo se revisarán avances recientes en el conocimiento de la biología del asma y el estado actual de las innovaciones que este conocimiento puede aportar al manejo médico de la enfermedad.
Papel del sistema inmunitario adaptativo en la patogenia del asma y modulación biofarmacológica de la inflamación
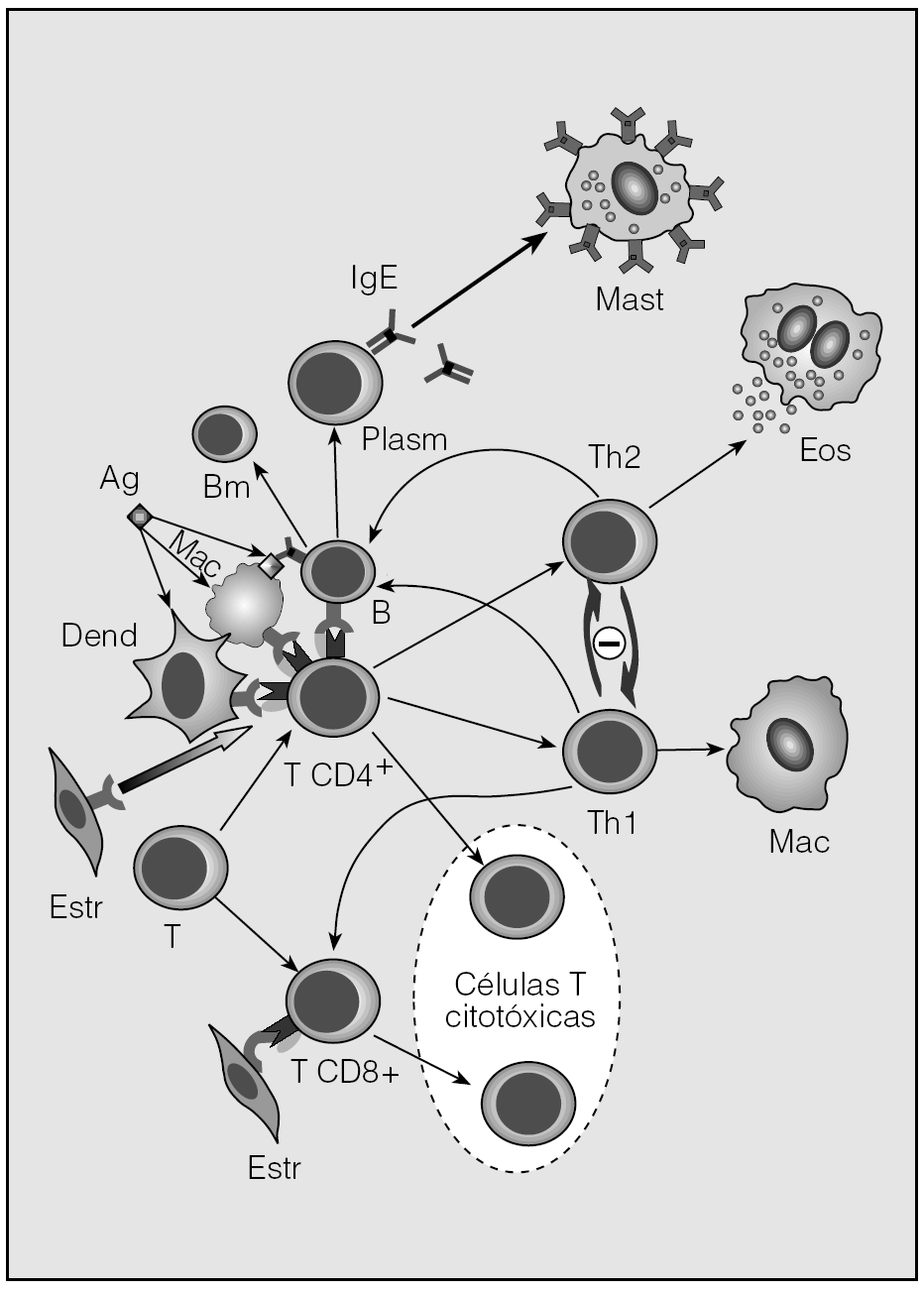
Un fenómeno cardinal en el asma es la inflamación crónica de las vías respiratorias, dirigida, como elemento coordinador central (fig. 1), por células T CD4+ con un fenotipo de activación denominado T helper-2 (Th2), que se define por su secreción de citocinas. La secuencia de mecanismos inmunobiológicos que originan esta inflamación se conoce mejor en el caso del asma de origen alérgico. El proceso de sensibilización alérgica y posteriores reencuentros con el alergeno conlleva la captación y procesamiento del antígeno alergénico por células presentadoras de antígeno, y la presentación de los péptidos resultantes a células T CD4+ específicas. Las principales células presentadoras "profesionales" de antígeno son las dendríticas, de las que las vías respiratorias cuentan con una tupida red subepitelial. La presentación de antígeno a las células T CD4+ conduce a su activación tipo Th2 y a la generación de fenotipos efectores y de memoria. La secreción de las citocinas interleucina (IL) 4, 5 y 13 por las células Th2 efectoras induce la maduración y el reclutamiento de eosinófilos a la vía respiratoria, así como la generación de inmunoglobulinas E (IgE) por células B, en las que se activa la síntesis de esta clase de inmunoglobulina y maduran hacia células plasmáticas productoras del anticuerpo. El anclaje de moléculas de IgE en receptores situados en mastocitos y su entrecruzamiento cuando interaccionan con el alergeno conducen a la activación de los mastocitos y a una rápida liberación de mediadores inflamatorios, que da lugar a respuestas alérgicas inmediatas de las vías respiratorias y obstrucción al flujo. Por otra parte, las células Th2 efectoras y de memoria modifican su patrón migratorio y adquieren la capacidad de infiltrar las vías respiratorias, donde inducen las respuestas alérgicas tardías, con obstrucción al flujo prolongada, y tienen vínculos mecanísticos causales con efectos sostenidos o "de fondo", que caracterizan a las formas tanto extrínseca como intrínseca de asma: la infiltración inflamatoria linfocitaria y eosinofílica persistente, y la hiperreactividad bronquial.
Fig. 1. La respuesta inmunitaria adaptativa. Las células T CD4+ y CD8+ se diferencian de una línea común pretímica. Diversos tipos celulares pueden capturar antígeno (Ag), procesarlo y presentarlo a las células T CD4+ acoplado a moléculas del complejo principal de histocompatibilidad (MHC) de clase II. La célula presentadora de antígeno más "profesional" es la célula dendrítica (Dend). Otras células que pueden ejercer esta función son los macrófagos (Mac), las células B y, facultativamente, algunas células estructurales (Estr). Por otra parte, las células estructurales pueden presentar otros antígenos bajo restricción del MHC de clase I a las células T CD8+, que adquieren función citotóxica. Algunas células T citotóxicas son CD4+. Tras la presentación antigénica con restricción del MHC de clase II, y en presencia de las señales coestimuladoras apropiadas, las células T CD4+ se activan, sufren expansión clonal y generan células con funciones efectora y de memoria. Durante el proceso de activación, se generan 2 posibles fenotipos denominados T helper(Th) 1 y 2, definidos por su secreción de citocinas y con inhibición recíproca. Una de las funciones de las células Th1 es la activación de macrófagos. Las células Th2 inducen sobre las células B el cambio de clase de inmunoglobulina expresada a inmunoglobulina E (IgE), la generación de células B de memoria (Bm) y la maduración hacia células plasmáticas (Plasm) productoras de anticuerpo. La IgE se une por su fracción constante a receptores situados en la superficie de los mastocitos (Mast) y estas células quedan preparadas para reconocer el antígeno ante un reencuentro, activarse y liberar sus productos inflamatorios. Otra función de las células Th2 es inducir la maduración, quimioatracción y activación de los eosinófilos (Eos).
La capacidad de los glucocorticoides para actuar en diversos puntos de los mecanismos de la inflamación ha hecho de esta familia de fármacos, en sus formas de administración inhalada, el eje del tratamiento del asma según los criterios actuales5. No obstante, la administración sistémica de corticoides, con su extensa inespecificidad de acción e importantes efectos secundarios, sigue siendo un recurso esencial para un control sólo parcialmente exitoso de la inflamación y sus efectos clínicos en el asma grave6. De ahí el interés y la necesidad de desarrollar nuevas estrategias terapéuticas que hagan diana en puntos más específicos de los mecanismos de la inflamación. Uno de los abordajes en esta línea consiste en el intento de neutralizar citocinas tipo Th2 mediante 3 estrategias básicas: a) anticuerpos bloqueantes anticitocina; b) receptores recombinantes solubles de alta afinidad que secuestren la citocina en su fase soluble, antes de que interaccione con sus receptores celulares, y c) formas mutantes inactivas de la citocina que competitivamente ocupen los receptores celulares. Parte de los intentos de neutralizar una citocina clave se han centrado en la IL-5, dado que es el principal regulador de la maduración, reclutamiento a la vía respiratoria y supervivencia de eosinófilos7. Para ello se desarrolla-ron 2 anticuerpos monoclonales contra la IL-5 humana8, que superaron las fases de desarrollo preclínico con resultados positivos y entraron en fase de ensayo clínico: el mepolizumab9,10 y SCH5570011. A pesar de que la idea de neutralizar la IL-5 para el tratamiento del asma cuenta con una sólida base biológica, los resultados de los ensayos clínicos con mepolizumab y SCH55700 no satisficieron las expectativas generadas. Los anticuerpos cumplieron al menos en parte su función bloqueante y redujeron las concentraciones de eosinófilos en sangre periférica y en muestras de pulmón tomadas de distintas formas según los estudios (esputo, lavado broncoalveolar y biopsia bronquial). Sin embargo, no modificaron satisfactoriamente los indicadores clínicos de asma medidos en los ensayos. Estos resultados contribuyeron a alimentar un debate aún abierto sobre la importancia real de los eosinófilos en el asma. Aparte de los anticuerpos monoclonales anti-IL-5, la investigación farmacéutica generó un antagonista no peptídico del receptor de la IL-5 (YM-90709) a partir de la modelación molecular de la subunidad alfa de este receptor, que mostró in vitro la capacidad de inhibir la supervivencia de los eosinófilos inducida por la IL-512. Sin embargo, el fracaso de los anticuerpos monoclonales anti-IL-5 en los ensayos clínicos hizo pensar que el desarrollo preclínico y clínico de YM-90709 no era una opción de inversión atractiva13. Otra citocina candidata a ser una nueva diana farmacológica es la IL-4, por su papel pleotrópico en el asma14. La IL-4 desempeña un papel esencial en la diferenciación Th2, induce el cambio de clase de inmunoglobulina hacia IgE en las células B, aumenta el número de receptores para IgE en los mastocitos, contribuye por varias vías al reclutamiento de eosinófilos en las vías respiratorias y estimula la proliferación de fibroblastos y células caliciformes productoras de moco. El bloqueo de la IL-4 se intentó mediante diferentes estrategias. Un receptor soluble recombinante en forma nebulizada, el altraquincept, resultó prometedor en ensayos clínicos en fases I y II15,16 porque evitó el descenso de los valores espirométricos en asmáticos a quienes se retiró la medicación esteroidea inhalada y estabilizó sus síntomas en una escala de puntuación clínica. Sin embargo, 2 ensayos a gran escala en fase III no demostraron la efectividad del fármaco y se abandonó su desarrollo17. Otros intentos de neutralizar la IL-4 fracasaron en etapas más incipientes. El pascolizumab, un anticuerpo monoclonal anti-IL-4, no demostró eficacia en un ensayo clínico de fase II18. Por su parte, versiones mutadas de la IL-4 (BAY-16-9996 y BAY-36-1677), que debían de competir por los receptores de la IL-4 e IL-13, fracasaron por su vida media excesivamente corta, junto con la falta de una formulación no inyectable18,19. Actualmente se encuentra en desarrollo preclínico un anticuerpo monoclonal contra la subunidad alfa del receptor de la IL-4 (IL-4Rα), que de momento ha mostrado eficacia a la hora de inhibir la producción de citocinas Th2, el reclutamiento de eosinófilos y la hiperreactividad bronquial en ratones20. En conjunto, todos los intentos de tratamiento antagonista de la IL-4 han fracasado, con la excepción del anticuerpo anti-IL-4Rα, aún en desarrollo preclínico. Una diana alternativa que ha suscitado un interés especial es la IL-13, por haber sido propuesta como "necesaria y suficiente" para el desarrollo de la hiperreactividad bronquial21, además de estimular la hipersecreción de moco y tener un efecto fibrogénico en la pared de la vía respiratoria. La abolición del gen que codifica la IL-13 en ratones knock-out anula la hiperreactividad bronquial tras provocación con alergeno, a pesar de una intensa respuesta eosinófila22, y ésta es una de las evidencias experimentales que disocian a los eosinófilos de la hiperreactividad bronquial. La subunidad α2 del receptor de la IL-13 (IL-13Rα2) es un receptor soluble de alta afinidad, que existe en forma natural y tiene capacidad para antagonizar a la IL-1321 mediante su secuestro en fase soluble, mecanismo con potencial para su explotación farmacológica. En la actualidad se hallan en desarrollo clínico formas de IL-13Rα2 y anticuerpos monoclonales anti-IL-1313. Se están desarrollando asimismo anticuerpos bloqueantes contra la IL-923, otra citocina Th2, que potencia tanto la liberación de mediadores de los mastocitos como la hipersecreción de moco en el asma y es fibrogénica.
Los mecanismos de tráfico celular que participan en el reclutamiento de los leucocitos constituyentes del infiltrado inflamatorio en las vías respiratorias de los asmáticos, principalmente células T CD4+ y eosinófilos, son otra fuente de posibles dianas terapéuticas novedosas. Estas células responden a gradientes de quimiocinas liberadas en las vías respiratorias asmáticas, y expresan en su superficie una serie de receptores de adhesión leucocitaria que, al interaccionar con los contrarreceptores correspondientes situados en el endotelio vascular y estructuras tisulares, dirigen y facilitan su extravasación y su navegación intersticial en los tejidos inflamados. Se conocen más de 50 quimiocinas implicadas en el reclutamiento de células inflamatorias que interaccionan con al menos 20 receptores de superficie celular, ofreciendo un amplio campo de intervención farmacológica24. Una vía quimiotáctica que ha llamado la atención es el conjunto de las quimiocinas CCL11 (eotaxina), CCL5 (RANTES, de regulated on activation, normal T cells expressed and secreted) y CCL13 (proteína-4 quimioatrayente de macrófagos, MCP-4), todas ellas con producción incrementada en el asma y que interaccionan con el receptor de quimiocinas CCR3 (cysteine-cysteine chemokine receptor-3), expresado en los eosinófilos, contribuyendo de forma importante a su reclutamiento a las vías respiratorias. Se desarrollaron varios inhibidores no peptídicos de bajo peso molecu-lar del receptor CCR3 (UCB35625, SB-297006 y SB-328437) y un anticuerpo antieotaxina (CAT-213). Los inhibidores de CCR3 han mostrado ser efectivos a la hora de inhibir el reclutamiento de eosinófilos a las vías respiratorias en modelos de asma experimental25, mientras el anticuerpo CAT-213 bloquea la actividad quimiotáctica sobre los eosinófilos de la eotaxina presente en esputo inducido de asmáticos26 y de eotaxina humana inyectada intradérmicamente en ratones27. Sin embargo, los planes de inversión en el desarrollo clínico de estos compuestos se ven complicados por resultados experimentales y clínicos, que indican que la inhibición del reclutamiento de eosinófilos a las vías respiratorias en el asma puede tener efectos pobres o no significativos sobre las manifestaciones clínicas de la enfermedad. Por una parte, ratones knock-out con abolición de los eosinófilos resultaron competentes en desarrollar inflamación Th2 e hiperreactividad bronquial tras sensibilización alérgica y broncoprovocación, a pesar de la ausencia absoluta de eosinófilos28. Los datos obtenidos en este estudio indicaron como resultado colateral que los eosinófilos contribuyen a inducir el componente fibrogénico de la remodelación de las vías respiratorias, pero el cuadro asmático experimental no resultó atenuado en los ratones knock-out. Con ello se aportó una razón más a la incertidumbre actual sobre el papel de los eosinófilos en el asma. Por otra parte, la experiencia frustrante de los ensayos clínicos con antagonistas de la IL-5 mostró que en el asma humana el hecho de hacer diana terapéutica sobre los eosinófilos puede no conducir a un beneficio clínico significativo8-11,29. Aparte del papel de las quimiocinas y sus receptores, los receptores de adhesión leucocitaria son otro aspecto de los mecanismos de reclutamiento de células inflamatorias que también proporciona un campo de posibles acciones farmacológicas. Una familia de glucoproteínas deno-minada integrinas proporciona 2 vías de adhesión leucocitaria implicadas en el tráfico de células T y eosinófilos: los receptores LFA-1 (lymphocyte function-associated antigen-1) y VLA-4 (very late activation antigen-4), ambos expresados en la superficie de célu-las T y eosinófilos, y sus contrarreceptores respectivos, ICAM-1 (molécula de adhesión intracelular-1) y VCAM-1 (molécula de adhesión de células vasculares-1), expresados en el endotelio vascular y células de tejidos conectivos tales como células musculares lisas y fibroblastos. El efalizumab, un anticuerpo monoclonal contra la subunidad alfa (CD11a) del receptor LFA-1 comercializado para el tratamiento de la psoriasis mediante administración subcutánea, se probó en pacientes con asma atópica, en los que mostró capacidad para disminuir la presencia de eosinófilos en esputo inducido tras provocación alergénica30. Sin embargo, en la línea de otras intervenciones efectivas en la disminución de eosinófilos, no se modificaron significativamente los indicadores funcionales de asma, en este caso, las respuestas alérgicas temprana y tardía tras provocación antigénica y la broncorreactividad a metacolina. Aparte del caso del omalizumab, el desarrollo de una serie de moléculas diseñadas para bloquear receptores de adhesión leucocitaria, se ha visto complicado por la posibilidad de que estos agentes interfieran de forma amplia con las respuestas inmunitarias normales, y pudieran así conducir a efectos adversos que comprometan la seguridad de su uso. Un caso especialmente ilustrativo es el del natalizumab, un anticuerpo monoclonal contra la subunidad α4 del receptor VLA-4, que mostró eficacia en el tratamiento de la enfermedad de Crohn31 y la esclerosis múltiple32, y fue aprobado en el año 2004 para el tratamiento de esta última. El fármaco tuvo que retirarse debido a la aparición de casos de leucoencefalopatía multifocal progresiva asociada a su uso, y atribuida a la reactivación en el sistema nervioso central de infección latente por Polyomavirus33, y sólo muy recientemente se ha aprobado su uso de forma cautelar y con restricciones34. La experiencia con el natalizumab ha mostrado las limitaciones a que puede verse sujeto el desarrollo clínico de inhibidores de VLA-4 que han mostrado ser efectivos en la inhibición de respuestas alérgicas experimentales en corderos35, o de inhibidores de ICAM-1 que inhiben la infiltración eosinófila e hiperreactividad bronquial en primates36.
La manipulación y potenciación de mecanismos naturales reguladores de las respuestas inmunitarias ofrecen otro campo de potencial intervención terapéutica que atrajo la atención y continúa resultando de interés en algunos aspectos. Estudios sobre la diferenciación fenotípica de las células T CD4+ hacia los perfiles de activación Th1 y Th2 mostraron la existencia de regulación cruzada entre estos 2 tipos de células efectoras, con inhibición recíproca. Este principio originó la "teoría de la desviación inmunitaria", según la cual la inducción de un entorno inmunitario tipo Th1 podría tener efecto terapéutico sobre alteraciones resultantes de respuestas tipo Th2 como las alergias y el asma. Recíprocamente, la inducción de una desviación en sentido Th2 podría resultar beneficiosa en el caso de ciertas enfermedades autoinmunitarias, como la esclerosis múltiple y la diabetes tipo 1, en las que se había demostrado un papel dominante de respuestas linfocitarias tipo Th1. La IL-12 e IL-18, citocinas que participan en el inicio de las respuestas tipo Th1, y el interferón-gamma (IFN-γ), principal citocina efectora Th1 e inhibidora de las células Th2, podrían emplearse como agentes terapéuticos en el asma. Sin embargo, a pesar de su atractivo fundamento teórico, este abordaje para el tratamiento del asma y otras enfermedades se topó con dificultades importantes. Las citocinas son mediadores que en ge-neral, en su papel biológico natural, actúan a bajas concentraciones en un microambiente celular local ejerciendo efectos autocrinos y paracrinos, y su administración farmacológica está limitada por la posibilidad de toxicidad importante y por tener una vida media muy corta. Por otra parte, los mecanismos patogénicos de las alteraciones inmunitarias que originan las alergias, el asma y las enfermedades autoinmunitarias resultaron ser más complejos que la dicotomía Th1/Th2 descrita originalmente en ratones37. En el caso del asma, aunque el papel de las células T CD4+ tipo Th2 está sólidamente establecido, ello no excluye su articulación con otras vías efectoras en forma compleja y con la posibilidad de variaciones en los efectos finales. Datos obtenidos de muestras humanas indicaron la presencia de IFN-γ en las vías respiratorias en el asma38-40, y en algunos estudios experimentales las células Th1 y el IFN-γ antagonizaron la inflamación alérgica41, mientras que en otros tuvieron efectos proinflamatorios42-44. La inmunoterapia específica mediante extractos alergénicos aumenta la producción de IFN-γ por células T circulantes, incrementa la cantidad de células productoras de esta citocina en biopsias nasales de pacientes con rinitis alérgica y ha mostrado beneficio en casos de asma bajo indicación apropiada45,46. Sin embargo, la administración intranasal de IFN-γ recombinante no ha mostrado tener un efecto reductor de inflamación significativo47, quizá porque no ha sido posible alcanzar una concentración suficiente de la citocina en las vías respiratorias, por lo que este intento terapéutico se ha abandonado. Una faceta diferente como campo de posibles intervenciones terapéuticas utilizando mecanismos de regulación inmunitaria, gira en torno a la reciente descripción de nuevas subpoblaciones linfocitarias con función reguladora48-50. Aunque los indicios de una función inmunológica "supresora" se remontan a los años 1960 (atribuida a células CD8+, o T8 según terminología obsoleta), la existencia de poblaciones celulares con esta función permaneció durante mucho tiempo como un ente teórico más que como una realidad fundada en datos. La complejidad de la biología de las células T CD4+ ha resultado ir mucho más allá de su tradicional función "cooperadora", y sólo muy recientemente ha sido posible la identificación inequívoca de subpoblaciones celulares T, actualmente denominadas reguladoras (Treg), dentro de esta categoría. Este nuevo campo se encuentra en evolución; los nuevos subtipos Treg son aún de definición confusa, y no está clara la interrelación entre ellos. Aunque se sabe de la existencia de células Treg CD4+/CD25+ derivadas del timo que son de aparición "natural" o constitutiva, también se conoce la generación de células Treg adaptativas, que se diferencian durante las respuestas inmunitarias, y está aún poco claro a qué subtipos corresponden estas células y cuál es la relación entre Treg constitutivas y adaptativas. Los mecanismos por los que las Treg ejercen su función reguladora también son poco conocidos. En cualquier caso, al margen de estas lagunas de conocimiento, sí parece haberse extendido y aceptado el concepto de que las Treg tienen la capacidad de inhibir las respuestas Th2 frente a alergenos y que estos mecanismos pueden ser defectuosos en las personas que desarrollan sensibilización alérgica. Esta circunstancia convierte a estas células y sus mecanismos de acción en un importante foco de atención actual como posible fuente de nuevas dianas terapéuticas. La IL-10 es una citocina con conocida función inmunomoduladora y es segregada por algunos subtipos de Treg. En personas no atópicas, la frecuencia de células T específicas de antígeno y productoras de IL-10 está aumentada con respecto a las alérgicas51. En un modelo murino de asma experimental, las células Treg CD4+/CD25+ fueron efectivas a la hora de suprimir la producción de citocinas Th2, el reclutamiento de eosinófilos y la hiperreactividad bronquial, además estas acciones estuvieron mediadas, al menos en parte, por la IL-1052. Aunque el uso de la IL-10 como agente farmacológico está sujeto a las limitaciones conocidas para otras citocinas, la IL-10 humana recombinante ha alcanzado la fase de desarrollo clínico, con resultados positivos para la enfermedad de Crohn53,54. No se han realizado hasta la fecha ensayos clínicos con IL-10 en el asma. Sin embargo, la estrategia de aumentar la expresión de IL-10 se consigue indirectamente como efecto de la inmunoterapia específica con extractos de alergenos, a cargo de una subpoblación de Treg que probablemente media los efectos del tratamiento55. Por otra parte, la eficacia de los corticoides, centrales en el tratamiento actual del asma, parece estar ligada a su capacidad de inducir la producción de IL-10 por células Treg. Las células T CD4+ de pacientes con asma refractaria a corticoides son deficientes en su capacidad de producir IL-10 bajo estimulación in vitro, en comparación con las células de pacientes sensibles a los corticoides56. Sorprendentemente, la vitamina D3 estimula en pacientes con asma refractaria a corticoides, la capacidad de las células T de producir IL-10 in vitro al mismo tiempo que, administrada oralmente, incrementa la capacidad de respuesta de producción de IL-10 frente a los corticoides en estos pacientes57,58, con lo que se abre una novedosa expectativa de tratamiento adyuvante para el asma refractaria.
Finalmente, un ejemplo de traslación exitosa de la biología a la clínica en el asma es el bloqueo de la IgE mediante el omalizumab59,60. La inmunoglobulina IgE específica contra un antígeno alergénico determinado es segregada por células plasmáticas que son el resultado de la activación de células B durante la fase de sensibilización alérgica. Parte de la IgE circulante se ancla por su fracción constante (Fc) en receptores de alta afinidad (FcεRI) expresados en la superficie de mastocitos61 y basófilos. El entrecruzamiento de 2 o más moléculas de IgE que interaccionen con el alergeno a través de su fracción de reconocimiento antigénico (Fab) desencadena la rápida liberación de mediadores inflamatorios preformados, así como la liberación sostenida de mediadores cuya nueva síntesis se activa. En los mastocitos, este conjunto de mediadores incluye autacoides (histamina, prostaglandina D2, leucotrieno C4), citocinas que participan en la activación Th2 de células T, la inflamación eosinófila y la síntesis de IgE (IL-4, IL-5 e IL-13), citocinas y factores de crecimiento fibrogénicos factor transformador del crecimiento beta (TGF-β), factor de crecimiento de fibroblastos-2 y enzimas proteolíticas que activan diversos receptores celulares (triptasa, quimasa, carboxipeptidasa). El papel de los mastocitos en el asma se está confirmando como prominente debido no sólo a su relación con la IgE y a la diversidad de efectos de sus mediadores, sino también a hallazgos recientes que indican que estas células infiltran el músculo liso de las vías respiratorias62,63; y es posible que tengan una relación directa importante con la hiperplasia e hipertrofia de las células musculares lisas y los mecanismos de la hiperreactividad bronquial. El omalizumab es un anticuerpo monoclonal anti-IgE recombinante (con fracciones variables reconocedoras de IgE generadas en el ratón, y el resto de dominios proteicos humanos para evitar el desarrollo de anticuerpos contra el omalizumab en los pacientes tratados). Este anticuerpo está diseñado para bloquear en la IgE libre la parte de su Fc reconocida por los receptores FcεRI de los mastocitos y basófilos, e impedir la cascada de efectos que es consecuencia de su unión a estas células59. Los complejos omalizumab-IgE son biológicamente inertes, no activan el sistema del complemento y son eliminados por el sistema reticuloendotelial. El omalizumab tuvo su desarrollo preclínico a mediados de los años 199064, tras lo cual se realizaron ensayos clínicos exitosos en fases I/II65-67 y III68-72, donde en conjunto mostró reducir drásticamente (95%) los títulos de IgE circulante, ser efec-tivo a la hora de reducir el descenso del volumen espiratorio forzado en el primer segundo durante las respuestas inmediata y tardía tras broncoprovocación alergénica, facilitar la reducción de corticoides y medicación de rescate, mejorar los síntomas de asma y disminuir la frecuencia de exacerbaciones. Aunque el uso clínico del omalizumab está en proceso de definición y todavía no forma parte de directrices establecidas, los pacientes más susceptibles de beneficiarse son los asmáticos con sensibilización a aeroalergenos perennes que requieren altas dosis de corticoides inhalados, así como los pacientes con enfermedad inestable y exacerbaciones frecuentes59. Los pacientes con asma grave que necesitan dosis orales diarias de corticoides pueden ser menos susceptibles de responder al omalizumab59. Es reseñable que el omalizumab, a pesar de reducir el componente inflamatorio de las vías respiratorias asmáticas, incluida la presencia de eosinófilos, no ha mostrado un efecto significativo sobre la hiperreactividad bronquial72. Su eficacia clínica en el asma alérgica grave subraya aunque la respuesta individual sea variable la importancia de la IgE y su anclaje sobre los mastocitos en esta forma de asma en particular. Sin embargo, los mastocitos parecen desempeñar un papel más general en la patogenia del asma, pues se ha observado que se encuentran en un estado de activación crónica que, probablemente, sucede por vías complejas independientes de la IgE61. Estas observaciones indican que el control de la liberación de mediadores inflamatorios por los mastocitos es una necesidad terapéutica aún sin resolver en el asma.
Papel del sistema inmunitario innato y tolerancia frente a inmunización
El siglo xx proporcionó los descubrimientos esenciales para comprender los mecanismos de la rama adaptativa del sistema inmunitario, es decir, las respuestas específicas frente a antígenos, la capacidad para distinguir entre lo propio y lo ajeno, el papel central de las células T en la coordinación y la regulación de estas respuestas, más la capacidad de memoria inmunológica. Este conocimiento resultó clave para avanzar en el entendimiento de la patogenia del asma en su fase eferente, cuando se establecen y perpetúan la inflamación de las vías respiratorias y sus efectos clínicos asociados. Sin embargo, sobre la fase aferente de la enfermedad existe aún un gran desconocimiento en proporción a lo que se sabe sobre el asma establecida. En esta fase la balanza se decanta hacia tolerancia o inmunización, y se produce la sensibilización alérgica. Aunque hoy día se dispone de un conocimiento avanzado que detalla a nivel celular y molecular los mecanismos de captación, procesamiento y presentación de antígeno a las células T, las razones primarias por las que se produce la sensibilización alérgica frente a antígenos medioambientales que deberían tolerarse continúan siendo una gran incógnita. La dimensión del misterio aumenta si se considera que sólo un porcentaje limitado de los casos de asma se dan en el contexto de un perfil atópico de respuesta alérgica a uno o más antígenos definidos. En el resto el conjunto de fenotipos de la enfermedad denominados "asma intrínseca" la cascada de respuestas del sistema inmunitario adaptativo se activa con un comportamiento prácticamente superponible al del asma alérgica en sus aspectos efectores a nivel celular y molecular, pero en ausencia de sensibilización alérgica identificable. En la interfase entre medio ambiente (externo e interno) y asma en la forma de enfermedad clínicamente manifiesta y con activación de los mecanismos inmunitarios adaptativos, se encuentra la vertiente innata del sistema inmunitario. Sus mecanismos y funciones son un tema de interés creciente en la actualidad, y su papel en el origen del asma oculta aún respuestas que probablemente serán de importancia crucial para entender por qué la incidencia y prevalencia del asma se incrementan de forma significativa y sostenida desde hace 4 décadas.
Las células dendríticas son un componente central de la vertiente innata del sistema inmunitario, y son el principal tipo celular especializado "profesionalmente" en una función que establece el puente fundamental entre el medio ambiente y la inducción de respuestas inmunitarias adaptativas: la presentación de antígeno. Estas células forman una red asociada a la membrana basal del epitelio y en la lámina propria de nuestras superficies de exposición al entorno: vías respiratorias, intestino y piel73. Tras la captación de antígeno, las células dendríticas migran a los tejidos linfoides de drenaje regional, donde presentarán a las células T péptidos procedentes del antígeno procesado, acoplados a moléculas de clase II del complejo principal de histocompatibilidad (MHC). Esta presentación antigénica, que determina la activación de las células T, se realiza en el contexto de una sinapsis inmunológica formada por las moléculas del MHC con péptidos acoplados y en interacción con los complejos moleculares que conforman el receptor de las células T para el reconocimiento antigénico, más diversos receptores de coestimulación en interacción con sus contrarreceptores respectivos, y señales químicas vehiculadas por citocinas. Un aspecto de particular interés acerca de la función de las células dendríticas es su capacidad, en ausencia de los mecanismos de reconocimiento específico propios del sistema inmunitario adaptativo, de discriminar entre antígenos asociados a microorganismos invasores y la inmensa diversidad de antígenos inocuos con los que interaccionamos constantemente. Las consecuencias de una y otra situación son por lo general la inducción de respuesta inmunitaria o de tolerancia, respectivamente. Si el sistema inmunitario innato genera señales equívocas, se puede producir sensibilización alérgica (¿o activación de una respuesta adaptativa en ausencia de sensibilización específica en el caso del asma "intrínseca"?; se desconoce por completo). Investigaciones recientes han desvelado que las células dendríticas ejercen su función según un "sentido del peligro" cuya base molecular reside en receptores conocidos como TLR (de toll-like receptors, receptores tipo toll), que reconocen patrones estructurales microbianos repetitivos y representan un sistema defensivo de gran antigüedad evolutiva. El descubrimiento de estos receptores y su función74-78 revirtió la escasa atención que el sistema inmunitario innato había atraído anteriormente y lo convirtió en un centro de nuevo interés en investigación. Hasta la fecha se ha identificado una importante variedad de ligandos de los TLR. Algunos ejemplos son el lipopolisacárido o endotoxina de la pared de bacterias gramnegativas, estructuras de la pared micobacteriana, varios glucolípidos bacterianos, proteínas y ARN bicatenario víricos, y ADN bacteriano con motivos CpG79. Estudios posteriores mostraron que las infecciones bacterianas activan varios TLR y que esta activación es necesaria para desencadenar respuestas Th1 específicas de antígeno80. Con ello, estas recientes investigaciones contribuyeron a aclarar mecanismos que vinculan el entorno antigénico medioambiental con las respuestas del sistema inmunitario adaptativo, al mostrar que los TLR controlan la activación de las vías efectoras Th1 y Th2. En torno al mismo año salían a la luz datos que apuntaban a que la exposición a productos bacterianos a edades tempranas reducía la aparición posterior de enfermedades alérgicas81-85. Estos datos sucedían a la observación previa de una relación inversa entre el riesgo de desarrollar fiebre del heno y el tamaño de la familia86. El conjunto de estas observaciones, más el descubrimiento de la función inmunológica de los TLR, originó la "teoría de la higiene", según la cual el modo de vida moderno en los países occidentalizados evita la exposición a edad temprana a agentes microbiológicos que desempeñan un papel en la maduración y balance de las respuestas del sistema inmunitario, a consecuencia de lo cual se producen una desviación hacia la vertiente Th2 y una propensión hacia el desarrollo de enfermedades alérgicas. Aunque la teoría de la higiene no satisface algunas complejidades, y es más un debate en evolución que una explicación consolidada al aumento de la frecuencia de enfermedades alérgicas y asma en nuestro medio87,88, ha contribuido a hilvanar la investigación actual sobre conceptos relativos al papel de la exposición a microorganismos diversos, incluidos comensales, el grado y la variedad de la exposición medioambiental, la interacción con factores genéticos individuales y la relación con las respuestas inmunitarias.
Hasta la fecha, las investigaciones en desarrollo sobre los mecanismos del sistema inmunitario innato y la teoría de la higiene no han tenido consecuencias prácticas relevantes en cuanto a su traslación a la clínica. Se ha ensayado la administración de IL-12, una citocina producida por las células dendríticas que está implicada en el inicio de la polarización de las células T CD4+ hacia el fenotipo Th1. Su administración redujo los títulos de eosinófilos en sangre y esputo, y atenuó el incremento de eosinófilos circulantes tras broncoprovocación alergénica, pero produjo efectos secundarios importantes y no redujo la hiperreactividad bronquial ni la broncoconstricción en la respuesta alérgica tardía89. Un intento preventivo basado muy directamente en la teoría de la higiene ha sido la administración de probióticos (Lactobacillus) a corta edad, que en un estudio preliminar mostró un efecto de reducción de la incidencia de dermatitis atópica90. En un modelo murino, la administración de secuencias inmunoestimulantes de ADN bacteriano con secuencias CpG fue efectiva a la hora de prevenir la inducción de asma experimental si se realizaba durante la sensibilización alérgica91, y revirtió la eosinofilia e hiperreactividad bronquial en el caso de enfermedad ya establecida92,93.
Remodelación de las vías respiratorias
El concepto de remodelación de las vías respiratorias ha conducido a un avance importante en la comprensión de la patogenia del asma94-96. Actualmente se entiende, sobre la base de un abundante y sólido cuerpo de datos científicos, que la remodelación estructural de las vías respiratorias desempeña un papel fundamental en la generación de los efectos clínicos del asma, incluidas la hiperreactividad bronquial y la obstrucción al flujo de forma episódica o, en algunos asmáticos, de forma persistente como consecuencia de un deterioro crónico y potencialmente irreversible de la función pulmonar. Los cambios estructurales que forman parte de la remodelación de las vías respiratorias en el asma incluyen hiperplasia epitelial con incremento del número de células caliciformes productoras de moco, fibrosis subepitelial por aumento del depósito de componentes de la matriz extracelular y alteraciones en su renovación, incremento del grosor de la capa de músculo liso debido a una combinación de hiperplasia e hipertrofia junto a probables alteraciones en la frecuencia de apoptosis, incremento del número y tamaño de las glándulas mucosas, angiogenia bronquial y aumento del espesor de la capa adventicia. En conjunto, estos cambios conducen a un engrosamiento de la pared de la vía respiratoria a costa de todas sus capas. La remodelación de las vías respiratorias parece iniciarse en estadios muy tempranos del asma, antes de que la enfermedad se haga clínicamente manifiesta, y sus causas residen probablemente en las respuestas inmunitarias que conducen a la inflamación crónica, con la que al menos en su inicio se asocia, en combinación con mecanismos de reparación alterados. En este sentido, es probable que la remodelación estructural patológica ocurra utilizando mecanismos normales, aquéllos programados en nuestro organismo para la reparación de tejidos.
Las investigaciones recientes y en curso sobre los mecanismos de la remodelación apuntan como partícipes a diversos efectores celulares y moleculares de las respuestas inmunitarias que subyacen al asma, y a las propias células estructurales de las vías respiratorias, a través de un conjunto de complejas vías e interacciones, cuyo conocimiento es limitado y se encuentra en rápida expansión. Por lo que se refiere a los mediadores moleculares, es ya muy abundante la lista de citocinas, quimiocinas, enzimas, factores de crecimiento, receptores, sistemas de señalización intracelular y factores de transcripción genética para los que se ha identificado alguna participación en la remodelación. Con ello se están desvelando posibles puntos de intervención que podrían constituir nuevas y potenciales dianas terapéuticas. Sin embargo, estos avances no conllevan aún una vertiente traslacional hacia la clínica, que permita entrever en un futuro próximo el desarrollo de tratamientos emergentes a partir del conocimiento de los mecanismos biológicos de la reparación y remodelación. Cabe mencionar que se ha estudiado el efecto sobre la remodelación de algunos agentes en investigación. La experiencia de neutralizar la IL-5 con anticuerpos monoclonales, a pesar de no haber satisfecho las expectativas de eficacia terapéutica que se habían generado, aportó información interesante sobre un probable papel de los eosinófilos en la remodelación de las vías respiratorias. En análisis de biopsias bronquiales, pacientes con asma tratados con mepolizumab mostraron una reducción del exceso de depósitos de tenascina, lumicán y procolágeno III, componentes de la matriz extracelular que contribuyen al engrosamiento de la lámina reticular en el asma97. Esto se asoció a una reducción del número y porcentaje de eosinófilos que transcribían la citocina fibrogénica TGF-β1 y a una disminución de esta citocina en el lavado broncoalveolar. Estos hallazgos clínicos indicativos de una contribución de los eosinófilos en la remodelación son coincidentes con hallazgos experimentales en el ratón28,98. La administración de oligonucleótidos de ADN con secuencias inmunoestimuladoras CpG también ha inhibido la fibrosis subepitelial, así como la hiperplasia de células caliciformes, en modelos experimentales de ratón y primate99,100.
El interés actual sobre las posibilidades terapéuticas o preventivas en el campo de la remodelación de las vías respiratorias se ha centrado más en analizar el efecto de los tratamientos disponibles, especialmente los corticoides. Experimentos en modelos animales han indicado que los corticoides inhalados tienen la capacidad de prevenir la remodelación de las vías respiratorias, pero no de revertir la remodelación ya establecida. En la rata, el propionato de fluticasona fue efectivo en la prevención del desarrollo de hiperreactividad bronquial y remodelación si se administraba desde el inicio de un protocolo de broncoprovocaciones repetidas con aler-geno101,102, pero fue inefectivo a la hora de revertir la remodelación e hiperreactividad ya establecidas si se introducía a partir del final del protocolo de broncoprovocaciones101. En humanos, los datos de varios estudios apuntan a que los corticoides inhalados pueden tener efectos sobre la remodelación establecida, pero su papel es objeto de debate. El tratamiento con corticoides inhalados redujo el espesor de la lámina reticular y el depósito subepitelial de colágeno en biopsias bronquiales de pacientes con asma comparadas antes y después de períodos de tratamiento de 6 meses103,104. Otro estudio no constató cambios en la lámina reticular, pero la duración del tratamiento fue únicamente de 4 semanas105. Los corticoides inhalados mostraron también capacidad para disminuir la densidad de vascularización de la lámina propria106. Un aspecto abordado en algunos estudios que resulta de especial interés, porque podría tener utilidad clínica tangible en un futuro a corto plazo, es el uso de pautas modificadas de corticoides inhalados para atenuar el desarrollo de la remodelación, acopladas al empleo de la medición de la reactividad bronquial como indicador funcional no invasivo de remodelación. En un ensayo clínico se comparó el ajuste del tratamiento con corticoides inhalados según las directrices existentes para el manejo del asma, con otro grupo de sujetos en el que se empleó el grado de reactividad bronquial como guía adicional para el ajuste de la medicación107. Se obtuvieron biopsias bronquiales en el momento de la incorporación de los pacientes al estudio y al cabo de 2 años de intervención mediante una estrategia o la otra. El ajuste de los corticoides inhalados según la hiperreactividad bronquial dio lugar a una reducción persistente del grosor de la lámina reticular; estos resultados indicarían que las directrices actuales para el manejo del asma pueden conducir a un control subóptimo de la enfermedad, y que la medición de la reactividad bronquial puede servir de guía para un mejor control del asma basado en la prevención o cierta reversión de la remodelación. Otros estudios aportaron también datos en esta línea: observaron una asociación entre el efecto de los corticoides sobre la remodelación y el control de la hiperreactividad bronquial103,104,108. En conjunto, estos estudios aunque los datos que aportan se centran en el componente fibrótico de la remodelación y hay una gran carencia de información acerca del músculo liso apuntan a que la estrategia actualmente más accesible para obtener algún beneficio clínico sobre la remodelación de las vías respiratorias sería actualizar el manejo de los corticoides inhalados de acuerdo con criterios revisados, e incorporar la medición protocolizada de la reactividad bronquial como guía de seguimiento funcional. Ambos aspectos plantean la necesidad de más estudios a fin de acumular evidencia lo suficientemente concluyente para consolidar una posible revisión de las directrices del manejo del asma.
La información acerca del efecto potencial de otros fármacos sobre la remodelación es mucho más escasa. Aunque las células musculares lisas expresan receptores para corticoides y agonistas beta-adrenérgicos, falta aún evidencia clínica respecto a los efectos del tratamiento combinado sobre la remodelación. Los antagonistas de leucotrienos han mostrado capacidad para inhibir el crecimiento del músculo liso en el asma experimental en ratas109 y disminuir la fibrosis subepitelial en el ratón110. En un reciente estudio en ratón, el montelukast, pero no la dexametasona, revirtió el aumento de masa de músculo liso y la fibrosis subepitelial ya establecidos111. Finalmente, el roflumilast, un inhibidor de la fosfodiesterasa-4 de reciente introducción, redujo el depósito subepitelial de colágeno y el grosor epitelial en un modelo murino112.
Conclusiones
El incremento sostenido de la prevalencia de asma y la existencia de formas de asma grave hacen necesario el desarrollo de nuevos tratamientos. Esta necesidad se presenta en un contexto muy diferente del momento en que los corticoides, cuyos mecanismos de acción son objeto de investigación aún hoy, se introdujeron como tratamiento antiinflamatorio para diversas aplicaciones clínicas, incluida el asma. Actualmente el desarrollo de tratamientos nuevos se basa en el conocimiento de los mecanismos de enfermedad a nivel celular y molecular, la identificación subsiguiente de posibles dianas terapéuticas, el diseño de agentes farmacológicos que interaccionan con esas dianas y su selección meticulosa. Sólo un porcentaje mínimo de las moléculas candidatas a convertirse en fármacos superan las etapas de su desarrollo preclínico y llegan a entrar en las fases de ensayo clínico. Una vez alcanzado este punto, y aún contando con un mecanismo de acción conocido y desarrollado sobre una sólida base fisiopatológica, un buen número de fármacos candidatos sucumbe durante los ensayos clínicos debido a que no cumplen las expectativas de eficacia o por efectos secundarios no esperados. La historia reciente del asma ilustra estas dificultades para la traslación de la biología a la clínica. Los avances en biología celular y molecular, inmunología y tecnología para la investigación han proporcionado un importante bagaje de conocimiento sobre el papel de las respuestas inmunitarias adaptativas en el asma, y más recientemente ha empezado a desvelarse la participación del sistema inmunitario innato y la remodelación de las vías respiratorias. El campo de mayor tradición, la función efectora de las respuestas inmunitarias adaptativas, ha originado diversos candidatos a agentes terapéuticos que se han desarrollado hasta entrar en fase clínica. Sin embargo, el único tratamiento novedoso, que se ha introducido recientemente en el mercado como traslación de la inmunobiología, es el bloqueo de la IgE mediante el omalizumab. Por lo demás, el fracaso debido a una efectividad insuficiente en ensayos clínicos ha sido el desenlace en la mayoría de los casos. Como nota ilustrativa de la complejidad a la que está sujeta la manipulación de mecanismos biológicos específicos con finalidad terapéutica, llaman la atención los diversos intentos que interceptaron de forma exitosa a los eosinófilos pero fracasaron en su efectividad terapéutica contra el asma (los antagonistas de IL-5, la administración de IL-12, el bloqueo del receptor LFA-1), o se abandonaron sin ensayos clínicos concluyentes (inhibidores del receptor de quimiocinas CCR3 y anticuerpo antieotaxina). A ello se suman datos en modelos animales que disocian a los eosinófilos de la hiperreactividad bronquial como variable funcional de asma experimental. Probablemente no es que los eosinófilos no tengan ninguna función efectora relevante en el asma, sino más bien que el asma, como efecto final, surge de un entramado multifactorial. En este sentido, el éxito tradicional de los corticoides y el conocimiento actual de la multiplicidad de vías por las que actúan invitan a pensar que, si bien el conocimiento biológico de los mecanismos de enfermedad nos faculta para definir dianas de tratamiento sumamente específicas, el diseño avanzado de abordajes combinatorios o "de sistema" será probablemente crucial para que nuevos tratamientos superen los ensayos clínicos y pasen del banco del laboratorio a la cama del enfermo.
D. Ramos-Barbón es investigador contratado del Sistema Nacional de Salud (Fondo de Investigación Sanitaria, exp. CP04/00313).
Correspondencia: Dr. D. Ramos-Barbón.
Centro de Investigación Biomédica. Anexo Hospital Materno-Infantil.
Complejo Hospitalario Universitario Juan Canalejo.
As Xubias de Arriba, 84. 15006 A Coruña.
Correo electrónico: david.ramos-barbon@canalejo.org.