Introducción
Los primeros trabajos experimentales sobre trasplante pulmonar se publicaron en España en 19631. Desde entonces tuvieron que pasar casi 30 años para que en febrero de 19902 se consiguiera realizar el primer trasplante cardiopulmonar con supervivencia a largo plazo, que está vivo en la actualidad, y los primeros trasplantes uni (1990)3 y bipulmonar (1992)4. En 1993 se trasplantó el primer paciente con fibrosis quística y en febrero de 1994 se realizó el primer trasplante pulmonar infantil, ambos realizados en Valencia5 y vivos en el momento de escribir este trabajo.
Tras este primer período de trasplantes ocasionales6, se fueron incorporando progresivamente otros hospitales7. Casi todos han sufrido en cierta medida la curva de aprendizaje y con mayor o menor fortuna se han incorporado al grupo de los 20 trasplantes anuales, alrededor o por encima del cual, según el registro internacional, se consiguen mejores resultados8. Los programas posteriores están aprovechando la experiencia de profesionales de otros grupos ya funcionantes para iniciar el programa de forma rápida, con escasa curva de aprendizaje9.
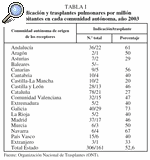
La creación de estos centros se ha venido realizando habitualmente por el interés de las gerencias de los hospitales o por el estímulo personal de profesionales motivados por el trasplante pulmonar. Esto ha dibujado un mapa de actividad que, si bien cubre las necesidades de trasplante generadas, establece claras diferencias entre las distintas comunidades respecto a la generación de donantes y receptores (tabla I).
En los últimos 14 años se han producido un intenso incremento de la actividad e importantes cambios en los diferentes aspectos del trasplante, desde la donación hasta el seguimiento a largo plazo. Programas con experiencia tienen una mortalidad inicial menor del 10% y una supervivencia alrededor del 80% en el primer año, con gran mejoría de la calidad de vida de los pacientes8. Esto se ha conseguido gracias a una mejoría en la preservación, en la técnica quirúrgica, en el manejo anestésico y en el seguimiento postoperatorio de los pacientes. El síndrome de bronquiolitis obliterante (BOS) sigue siendo la principal causa de mortalidad y el principal problema para conseguir mejores resultados a largo plazo.
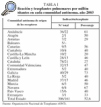
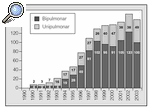
El registro internacional publica 3.047 trasplantes cardiopulmonares y 17.128 trasplantes pulmonares realizados8, si bien esta cifra es claramente inferior a la real, ya que numerosos grupos no envían sus datos a este registro. En España se han realizado 1.162 trasplantes (808 bipulmonares, incluidos los cardiopulmonares, y 354 unipulmonares) en los últimos 14 años (fig. 1), con un incremento progresivo durante los primeros 10 años, mientras que en los últimos 4 años se ha estabilizado la cifra de trasplantes pulmonares realizados en alrededor de los 150 anuales.
Fig. 1. Trasplantes pulmonares por años en España. Fuente: Organización Nacional de Trasplantes (ONT).
Receptores
El receptor de un trasplante pulmonar suele ser un paciente con una enfermedad de larga evolución y una calidad de vida enormemente limitada, que cuando es remitido para valoración de trasplante entra en un período de gran inseguridad debido, entre otros motivos, a la posible inclusión en lista de espera, a la posibilidad de fallecer durante la espera o en el acto del trasplante y a la necesidad de superar un postoperatorio complejo con un alto riesgo de complicaciones, todo ello para conseguir recuperar frecuentemente una vida normal. Es importante tenerlo presente a la hora de valorar a los candidatos.
Proceso de selección de potenciales candidatos
Debe incluir a pacientes con enfermedades pulmonares en estadio avanzado y no reversible sin respuesta a otros tratamientos alternativos, y debe identificar a pacientes con altas probabilidades de supervivencia10,11.
Desde que el trasplante pulmonar es una realidad clínica se han incrementado progresivamente las indicaciones. En la práctica clínica y de forma global, sólo las enfermedades tumorales malignas y aquellas que afectan de forma irreversible a órganos vitales no trasplantables son las principales contraindicaciones absolutas. Además, los pacientes con enfermedades como la hepatitis B, la infección por el virus de la inmunodeficiencia humana o algunas colagenosis, que alteran la respuesta inmunitaria o cuya esperanza de vida es supuestamente corta, se consideran en el momento actual candidatos inadecuados para el trasplante pulmonar. La edad máxima está actualmente entre los 65 y 70 años, y debe valorarse más la edad biológica que la cronológica.
Indicaciones
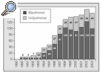
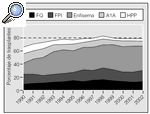
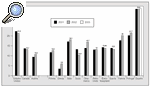
Las indicaciones más frecuentes son las enfermedades obstructivas12, las supurativas13,14, las intersticiales15,16 y las vasculares. El registro internacional8 (fig. 2) muestra un progresivo incremento de la indicación de trasplante en el enfisema, mientras que ha disminuido la indicación por enfermedades vasculares debido, principalmente, a la mayor eficacia de los nuevos tratamientos médicos17-20 y la septostomía21.
Fig. 2. Evolución de las enfermedades pulmonares en que se realizan trasplantes, por años. Fuente: registro internacional. FQ: fibrosis quística; FPI: fibrosis pulmonar idiopática; A1A: déficit de alfa-1-antitripsina; HPP: hipertensión pulmonar primaria.
Los documentos de consenso establecen los parámetros que habitualmente se siguen en la selección de receptores22. Un excelente trabajo es la guía internacional publicada en 1988 por Maurer et al23. Recientemente se han publicado las normas de la Sociedad Española de Neumología y Cirugía Torácica, donde se recoge la opinión de la mayor parte de los grupos españoles24.
No existe evidencia de que varios factores de riesgo preoperatorio puedan contraindicar un trasplante pulmonar, por lo que, en función de la experiencia o la presión de la lista de espera, entre otros factores, los grupos de trasplante aceptan a pacientes con mayor complejidad o riesgo25.
Algunos casos excepcionales publicados (carcinoma bronquiloalveolar26, agammaglobulinemia27 o leiomiosarcoma28) confirman la ampliación progresiva de las indicaciones, que siempre debieran considerarse con cautela y en casos seleccionados.
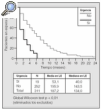
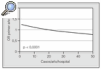
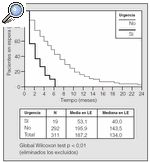
El momento de remitir al paciente se debe poner en la balanza el beneficio del trasplante y el riesgo de la cirugía y la posterior inmunodepresión. Debido a la rápida progresión de los estadios avanzados en la hipertensión pulmonar primaria o la fibrosis pulmonar idiopática, y para poder tratar activamente las posibles complicaciones o corregir las comorbilidades, es aconsejable enviar a los pacientes para valoraración de forma temprana. El privilegio de los grupos españoles es tener una mediana de tiempo en lista espera de 180 días (fig. 3), que en el Complejo Hospitalario Juan Canalejo fue de 60 días en 2003, lo que permite flexibilizar el momento de inclusión en lista y seleccionar a pacientes con criterios de preferencia o urgencia relativa sin que aumente la mortalidad preoperatoria.
Fig. 3. Tiempo en lista de espera (LE) con y sin urgencia. Fuente: Organización Nacional de Trasplantes (ONT).
Urgencia cero
Éste es un concepto que no existe de forma habitual en otros países de nuestro entorno y mediante el cual damos prioridad en la lista de espera a los pacientes incluidos en ella que presentan urgencia vital. En los primeros años se consideraron urgencia cero los casos que precisaban intubación y ventilación mecánica29. Posteriormente, se ha modificado el criterio para permitir a cada grupo definir la urgencia cero y así facilitar el acceso al primer órgano generado sin que esto suponga prioridad nacional.
La urgencia cero ha permitido en España recuperar a un grupo de pacientes que, debido a la rápida progresión de su enfermedad, han evolucionado a una situación terminal que no les permitiría esperar su turno habitual.
El análisis de los resultados de los pacientes trasplantados en urgencia cero demuestra una supervivencia a corto plazo algo inferior a la de los casos no urgentes, pero en los que sobreviven al período inicial la supervivencia sigue una curva similar a la de los casos trasplantados sin urgencia30.
Donantes
El trasplante pulmonar está limitado por la escasez de donantes, y los equipos de trasplante son responsables de la correcta utilización y máximo aprovechamiento de este preciado bien. La regulación legal y la estricta organización de la distribución y logística de los órganos, en las que España es pionera a través de la Organización Nacional de Trasplantes, son imprescindibles para conseguir una amplia aceptación social de la donación.
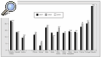
La excelente red de coordinadores y la comprensión y solidaridad de la población han hecho que España esté claramente a la cabeza de todos los países, con un índice de donación que se mantiene en alrededor de 34 por 1.000.000 de habitantes (fig. 4).
Fig. 4. Donantes de órganos por países. Tasa anual por 1.000.000 de habitantes. Fuente: Organización Nacional de Trasplantes (ONT).
El perfil de los donantes ha cambiado a lo largo de los años: si antes predominaba el donante joven con traumatismo, ahora predominan los donantes de mayor edad que han fallecido de infartos o hemorragias cerebrales, sin que exista, hasta el momento, evidencia de que este cambio haya influido en los resultados a medio plazo31,32 (tabla II).
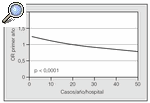
Fig. 5. Número de trasplantes realizados por hospital. Fuente: registro internacional. OR:odds ratio.
El porcentaje de donantes pulmonares con respecto al conjunto de donantes es bajo, por lo que debemos insistir en la necesidad de pensar en el pulmón desde el principio de la generación del donante multiorgánico.
Criterios de selección
Los criterios de selección de donantes son compartidos por todos los trasplantadores y han sido revisados recientemente33,34. Incluyen edad máxima alrededor de 55 años, compatibilidad de grupo, radiografía de tórax normal en el pulmón a utilizar, presión arterial de oxígeno superior a 300 mmHg con fracción inspiratoria de oxígeno de 1 y presión positiva al final de la espiración de 5 cmH2O, fumador de menos de 20 años/paquete, con cultivo de secreciones bronquiales negativo y ausencia de traumatismo, aspiración e infección en el pulmón a trasplantar.
La controversia se plantea en torno a cuál es el mejor modo de incrementar el número de donantes.
Desde un punto de vista ético, en la decisión de utilizar un donante subóptimo se debe tener presente que estos donantes pueden comprometer un postoperatorio frecuentemente complejo y que el retrasplante pulmonar en esas condiciones tiene una mortalidad muy elevada, por lo que debemos intentar trasplantar siempre un órgano con grandes probabilidades de éxito.
La aceptación de un donante se realiza siempre de forma individualizada, basándose en la situación tanto de éste como del receptor. Ciertos donantes subóptimos con lesiones focales, atelectasias o contusiones, o edad límite suelen tener escasa repercusión en el postoperatorio. El problema se plantea con donantes mayores de 60 años o con sospecha de broncoaspiración o tinción de Gram positiva en el aspirado bronquial pero sin repercusión clínica o analítica o con broncoscopia normal en el pulmón a trasplantar. Son donantes válidos desde un punto de vista ético, especialmente para pacientes en urgencia o con una evolución rápida de su enfermedad. Por último, los donantes con procesos que producen importante repercusión clínica o analítica, fumadores de más de 30 años/paquete, con secreciones purulentas o con presión arterial de oxígeno por debajo de 300 mmHg tras un correcto tratamiento médico son donantes cuya aceptación puede ser éticamente cuestionable35. Para conseguir buenos resultados con donantes subóptimos se plantea que debieran utilizarse preferentemente en trasplantes bipulmonares y, a ser posible, con enfermedades quirúrgicamente poco complejas8.
La falta de evidencia clínica en muchos aspectos del trasplante obliga, con relativa frecuencia, a tomar decisiones basadas en la experiencia del médico responsable y en la evolución o la respuesta individual de cada caso, y esto es aplicable a la selección de donantes.
Es importante optimizar la utilización de los órganos utilizando ambos pulmones cuando se efectúan trasplantes unipulmonares36, lo que podría facilitarse realizando la extracción de ambos pulmones por el grupo local cuando fuera preciso37 y practicando trasplante unipulmonar cuando se considere suficiente para garantizar una correcta calidad de vida. El registro internacional recoge en los últimos años alrededor del 50% de trasplantes unipulmonares sobre la cifra global de trasplantes, mientras que en España el porcentaje es de un 25-30%.
La utilización de donantes en asistolia es una excelente apuesta si se dispone de un servicio de urgencias que permita la rápida actuación y toma de decisiones en los casos dentro y fuera del hospital38. Los buenos resultados obtenidos por el grupo de Clínica de Puerta de Hierro39 en los primeros casos animan a proseguir en esa línea.
Los resultados obtenidos con donante vivo40 son estimulantes y es una opción en casos infantiles de evolución rápida donde tan difícil suele ser encontrar un donante válido. La bipartición del pulmón (split)41 es otra posibilidad a valorar en receptores infantiles o pacientes con toráx de pequeño tamaño.
Preservación
La preservación ha sufrido variaciones a lo largo de estos años. Aunque los primeros resultados positivos se consiguieron con pulmones enfriados tópicamente como único mecanismo de preservación, pronto se comprobó que la perfusión pulmonar minimiza los efectos de la isquemia, con lo que la integridad morfológica y funcional del pulmón se conserva durante un período más prolongado de tiempo. Un trabajo reciente42 revisa de forma clara las normas para un buen cuidado del donante pulmonar y el método habitualmente utilizado para la preservación pulmonar. Los cuidados del donante deben incluir una correcta ventilación y limpieza de las vías respiratorias que impida la producción de atelectasias y un balance hídrico negativo que evite el edema pulmonar neurogénico, frecuente tras la muerte cerebral. En la perfusión pulmonar, se tiende a utilizar soluciones bajas en potasio a 4-8 ºC, 60 ml/kg por vía anterógrada y 15 ml/kg por vía retrógrada, antes del implante, administradas a 10-15 mmHg de presión, mientras se mantiene una fracción inspiratoria de oxígeno de alrededor del 40% y un volumen corriente de 10 ml/kg. El transporte debe hacerse a 4-8 ºC y con una presión de insuflación inferior a 20 cmH2O. Una revisión de las distintas soluciones de preservación y de sus mecanismos de actuación se ha publicado recientemente en esta Revista43. El artículo señala que, aunque existan múltiples trabajos experimentales sobre los distintos aspectos de la preservación y la reperfusión pulmonar, son escasos los trabajos clínicos prospectivos que aporten evidencias sobre estos temas.
La solución de Eurocollins modificada fue la más utilizada durante los primeros 10 años de trasplante pulmonar en España. Diversos trabajos experimentales44-46 señalaron que la mejor preservación del pulmón se conseguía con soluciones bajas en potasio. El empleo clínico de esta solución ha demostrado menos complicaciones quirúrgicas al evitar los trastornos del ritmo y las ocasionales paradas cardíacas por hiperpotasemia que se producían con la solución de Eurocollins y, por otra parte, se han observado menos trastornos de reperfusión, por lo que se ha adoptado como preservación habitual en la mayor parte de los grupos españoles. La solucion de Celsior, también baja en potasio, parece conseguir buenos resultados en algún estudio con pocos casos clínicos, por lo que serán necesarios más estudios para confirmar las primeras impresiones47.
La técnica de preservación también se ha modificado al considerar que la preservación retrógrada48,49, adoptada inicialmente en España por el grupo de CPH, permite una mejor preservación del bronquio donante50. Por ello, es habitual realizar la preservación mixta, anterógrada en el momento de la extracción y retrógrada antes del trasplante en cirugía de banco51-53.
Aunque existe consenso en que el tiempo de isquemia fría debiera ser menor de 7 h para conseguir buenos resultados, todos los grupos tienen casos con preservaciones más prolongadas y buenos resultados.
Tipo de intervención (unipulmonar, bipulmonar o cardiopulmonar)
El trasplante bipulmonar ha demostrado mejores resultados estadísticos a largo plazo que el unipulmonar en algunas revisiones54,55. Habitualmente, en estos estudios, se ha realizado trasplante unipulmonar a pacientes de alto riesgo y edad avanzada, lo cual puede suponer un sesgo importante en el análisis definitivo de los datos. Además, la enfermedad en que se realiza trasplante unipulmonar con mayor frecuencia es la fibrosis pulmonar, que tiene una supervivencia a largo plazo inferior al enfisema, la fibrosis quística o las bronquiectasias, en las que se realizaba trasplante bipulmonar de forma habitual. Esto supone una selección previa que puede influir en los resultados.
Existe controversia sobre la realización de trasplante unipulmonar en las enfermedades no infecciosas. Si consideramos que el trasplante unipulmonar tiene menor morbimortalidad operatoria, proporciona buena calidad de vida y los trabajos publicados sobre la patología del pulmón nativo no demuestran que éste tenga gran importancia en la evolución del pulmón trasplantado56,57, parece que el trasplante unipulmonar pudiera considerarse de elección en las enfermedades no infecciosas.
En el año 2003, en el Complejo Hospitalario Juan Canalejo realizamos 30 trasplantes (19 unipulmonares, 9 de éstos por enfisema, y 11 bipulmonares), con una mortalidad hospitalaria del 10% (2 trasplantes bipulmonares y uno unipulmonar). Al sexto mes de evolución, fallecieron 2 pacientes, uno con trasplante bipulmonar por colagenosis y uno con trasplante unipulmonar por fibrosis pulmonar idiopática. Estos resultados refuerzan la posibilidad de conseguir buenos resultados a medio plazo con el trasplante unipulmonar. La cuidadosa selección de donante y receptor es especialmente importante en los buenos resultados del trasplante unipulmonar en el enfisema. La reducción de volumen del pulmón nativo es una buena opción para recuperar función en los pacientes con gran hiperdistensión pulmonar58-63.
El tratamiento de la hipertensión pulmonar primaria con trasplante unipulmonar se ha demostrado posible cuando lo realizan grupos con experiencia64. En el momento actual ha disminuido el número de pacientes con esta enfermedad que entran en lista de espera, por lo que es difícil encontrar grupos con amplia experiencia en el manejo de este tipo de pacientes. La tendencia, en los grupos españoles, es realizar trasplante bipulmonar como primera opción.
El trasplante cardiopulmonar ha disminuido sus indicaciones debido a la experiencia de los centros para recuperar el órgano menos afectado, a la mayor necesidad de órganos y a la elevada morbimortalidad a corto y medio plazo de este tipo de trasplante65.
Técnica quirúrgica
Los trabajos de Veith et al66, Pearson67, Cooper et al68 o Patterson et al69 en la década de 1980 establecieron las bases técnicas que facilitaron el inicio del trasplante clínico, las cuales se han modificado y refinado desde entonces70.
Gracias a la experiencia conseguida en los primeros años, en el momento actual es excepcional que se contraindique un trasplante pulmonar por dificultad quirúrgica. Los pacientes con intervenciones previas, paquipleuritis o conglomerados hiliares exigen cirujanos con mayor experiencia, pero no deben constituir contraindicaciones al trasplante. Merece la pena recordar que la pleurectomía y el talcaje suelen ser innecesarios en procesos benignos como neumotórax, reducción de volumen o cirugía de bullas, por lo que nunca debieran realizarse en pacientes que pudieran precisar, en el futuro, cualquier intervención quirúrgica en el tórax, incluido el trasplante pulmonar, ya que complican enormemente la técnica quirúrgica.
Ocasionalmente, puede considerarse para trasplante a pacientes con toracoplastias, plombajes o frenectomías y afectaciones parietales por enfermedades fúngicas que habitualmente son causas claras de contraindicación.
La mejora en la preservación y en la técnica quirúrgica (especialmente mediante el acortamiento del bronquio donante), la extubación temprana y la profilaxis de las infecciones han mejorado la cicatrización de la sutura bronquial sin necesidad de recubrirla con epiplón o revascularizarla, incluso el telescopaje de éstas ha quedado más como recurso técnico para facilitar la sutura en bronquios de calibres desiguales que como un detalle imprescindible para conseguir buenos resultados.
La verticalización del corazón facilita el abordaje del hilio izquierdo, especialmente de la vena inferior y del ligamento triangular izquierdo en pacientes con cardiomegalia y adherencias intensas, y el cierre del pericardio facilita la cirugía en caso de necesitar retrasplante pulmonar.
En mi experiencia, los problemas en la cicatrización esternal son muy poco frecuentes (menos del 2% de los casos), pero para evitarlos algún grupo71 decidió realizar el trasplante bipulmonar a través de 2 toracotomías anteriores en vez de realizar toracosternotomía trasversa. Los resultados han demostrado que es posible esta vía de acceso incluso si fuera necesaria la utilización de circulación extracorpórea72.
Complicaciones en el postoperatorio inicial
Las complicaciones quirúrgicas han disminuido, aunque siguen siendo un factor de riesgo de morbimortalidad postoperatoria73.
Disfunción primaria del injerto
Constituye la principal causa de morbimortalidad del postoperatorio inmediato8. Se debe principalmente a los trastornos de isquemia-reperfusión en los que están implicados potentes mediadores y diferentes grupos celulares42,74,75. Recientemente se ha realizado una completa puesta al día del tema en esta Revista43. Diversos trabajos76-78 confirman que la utilización de mejores soluciones de preservación, la disminución de los tiempos de isquemia y la mejor selección y cuidado de los donantes han disminuido los casos que presentan clínica de disfunción primaria del injerto y han reducido enormemente la mortalidad por dicha causa8. Resultados experimentales muestran que la antitrombina III previene el desarrollo de trastornos de isquemia-reperfusión debido a un aumento de la producción de prostaciclina79.
La mejor preservación pulmonar47 y la correcta utilización de óxido nítrico, prostaglandinas y otros fármacos vasoactivos han supuesto una menor necesidad de circulación extracorpórea en el trasplante pulmonar. Por una parte, ya no se utiliza de forma sistemática en la hipertensión pulmonar, es muy infrecuente su necesidad en el trasplante unipulmonar y poco frecuente en el bipulmonar, ya que pocas veces se observa disfunción del primer injerto, que es la causa más frecuente de circulación extracórporea en el trasplante bipulmonar8.
Complicaciones de la sutura bronquial
Las complicaciones de la sutura bronquial fueron la principal causa de mortalidad en el período previo al desarrollo clínico del trasplante pulmonar y el principal factor del retraso en su desarrollo. En la década de 1980 y primeros años de la de 1990 era una de las principales causas de morbimortalidad y numerosos trabajos, especialmente los publicados por Couraud et al80, permitieron comprender la patogenia, diagnosticar y clasificar las lesiones y aprender a realizar los tratamientos adecuados.
En el momento actual han disminuido enormemente las complicaciones bronquiales81 debido a la mejor preservación, técnica quirúrgica y manejo postoperatorio de los pacientes. Se diagnostican tempranamente con el uso de la espirometría, broncoscopio y las reconstrucciones radiológicas, y se tratan eficazmente mediante la utilización de dilataciones, láser y prótesis expansibles, lo que ha disminuido la importancia de dicha complicación y ha hecho que la mortalidad debida a problemas de cicatrización bronquial sea muy infrecuente. En el Complejo Hospitalario Juan Canalejo no tuvimos complicaciones de la sutura bronquial en los primeros 70 casos realizados y la incidencia actual es de un 3% sin mortalidad.
Las estenosis bronquiales fuera de la sutura82 constituyen una complicación poco frecuente, cuya causa puede ser la mala vascularización bronquial, que se presenta preferentemente en el bronquio intermediario y que hay que diagnosticar tempranamente si se quiere evitar el cierre de la luz bronquial.
Rechazo agudo
Es una complicación muy frecuente en el postoperatorio inicial del trasplante de pulmón83. Sólo un 24% de los trasplantes de pulmón no presentan evidencia histológica de rechazo agudo en el primer año de trasplante. Esta elevada frecuencia posiblemente se deba a la arquitectura altamente vascular y a la amplia red linfática del pulmón, unido a la continua exposición a patógenos e irritantes externos84.
La prueba diagnóstica con mayor validez es la biopsia pulmonar realizada por fibrobroncoscopia y tomando un mínimo de 6 muestras, preferiblemente de los lóbulos inferiores85.
La clasificación histológica ha permitido que se pueda hablar el mismo lenguaje en el diagnóstico y tratamiento de estos pacientes. Debe incluir la afectación perivascular y la afectación peribronquial. La bronquiolitis linfocítica puede intervenir de forma especial en el desarrollo del BOS86.
Diversas experiencias con análisis celular o de moléculas procedentes de la activación de los linfocitos en el lavado broncoalveolar no han conseguido unos resultados que permitan incorporar a la clínica habitual esta prueba como una aproximación diagnóstica al rechazo87. Sería deseable que en el futuro el análisis de biomarcadores en el aire espirado al menos sea capaz de seleccionar a un grupo de pacientes con elevadas probabilidades de diagnóstico de rechazo88.
La realización de biopsias de seguimiento ha suscitado una gran controversia desde el inicio del trasplante pulmonar. Se han descrito desde un 15 a un 40% de biopsias positivas, lo que supone una posible progresión de estos estadios clínicos hacia el desarrollo del BOS84. Por otro lado, la mayor parte de los casos detectados son estadios iniciales que frecuentemente se resuelven de manera espontánea89, lo que plantea el problema de qué debe hacerse con estos estadios iniciales asintomáticos y hasta cuándo debemos realizar estas biopsias de seguimiento90. La recomendación más frecuente es tratar incluso los estadios iniciales y prolongar el seguimiento por lo menos un año.
El rechazo agudo es la única variable sistemáticamente asociada al desarrollo del BOS91, especialmente si estos rechazos son repetidos y tardíos84,92.
Las distintas pautas terapéuticas con ciclosporina neoral/tacrolimus o azatioprina/mofetil micofenolato no han demostrado significación estadística respecto a la incidencia de rechazo93-95. Los ensayos multicéntricos en marcha, con amplia participación de grupos españoles, debieran acercarnos a la realidad sobre este tema.
Existe evidencia de que la inducción reduce el número de rechazos de forma estadísticamente significativa96-98. El estudio hispano-canadiense que utiliza como inducción basiliximab debiera confirmar la evidencia existente en la actualidad.
Hay unanimidad sobre el tratamiento del rechazo con bolos de corticoides. Sin embargo, para tratar el rechazo refractario se han empleado múltiples recursos (OKT3, radiación total, metotrexato, fotoforesis extracorpórea), sin que se hayan obtenido resultados concluyentes, en parte debido al escaso número de casos recogidos en los diferentes trabajos84. Un ensayo prospectivo reciente con ciclosporina inhalada muestra una reducción significativa de la tasa de rechazos agudos y del desarrollo del BOS99.
El rechazo agudo sigue siendo un importante problema en el postoperatorio inmediato del trasplante pulmonar y el mayor reto es su prevención, por la estrecha relación que guarda con el desarrollo del BOS.
Infección bacteriana
Es la complicación más frecuente de los primeros meses de postoperatorio100. A menudo se asocia a otras complicaciones y es la causa más frecuente de mortalidad en este período8. La extubación temprana y la profilaxis antibiótica con un antibiótico adecuado a los gérmenes más frecuentes aislados en las unidades de reanimación o una asociación de antibióticos sensibles a los gérmenes conocidos de donante o receptor suele ser la forma habitual de proteger al paciente trasplantado en los primeros días de postoperatorio, mientras llegan los primeros cultivos recogidos en el acto quirúrgico101. Incluso la presencia de gérmenes panresistentes suele producir resultados similares, salvo Burkolderia cepacia genomovar III, que, por sus malos resultados, algunos consideran contraindicación al trasplante102,103.
Infecciones virales
La infeccion viral que más importancia ha tenido en el trasplante pulmonar es la producida por citomegalovirus (CMV), no solamente por la morbimortalidad que produce en el postoperatorio, sino también por las implicaciones que esta infección tiene en el desarrollo del BOS. Una reciente revisión retrospectiva no ha encontrado influencia de la compatibilidad de CMV en el desarrollo de bronquiolitis o en la supervivencia si se hace un correcto diagnóstico, profilaxis y tratamiento104. En nuestro entorno, se opta preferentemente por la profilaxis con ganciclovir en vez del tratamiento anticipado, seguimiento y tratamiento ante la positividad de la antigenemia. Es posible que esta actitud, junto a la inmunodepresión utilizada y la mala biodisponibilidad del ganciclovir oral utilizado, sea la causa de las recidivas frecuentes y las resistencias encontradas en los últimos años. Confiamos en que la mejor absorción del valganciclovir, fármaco de reciente utilización, sea capaz de mejorar los resultados. El tratamiento con anticuerpos específicos ha encontrado sus indicaciones en la profilaxis de receptores negativos con donante positivo y en el tratamiento de recidivas, siempre asociado al ganciclovir105.
Colonización fúngica
La colonización fúngica por diferentes especies de Candida y Aspergillus es frecuente durante todo el postoperatorio del trasplante. La profilaxis con aerosoles de anfotericina106,107, posiblemente asociada a fluconazol o itraconazol, se ha demostrado muy eficaz para evitar el desarrollo de estas infecciones en pacientes con correcta evolución de su trasplante108. El pulmón nativo pudiera ser reservorio de hongos en el trasplante unipulmonar, por lo que su detección en el preoperatorio debiera aconsejar la realización de trasplante bipulmonar. La infección fúngica se asocia también a los aumentos de la inmunodepresión por rechazo agudo o crónico, a pacientes que precisan intubación prolongada o que presentan infecciones bacterianas recidivantes, por lo que es aconsejable mantener la profilaxis en esos casos.
El tratamiento de estas infecciones viene condicionado por la sensibilidad del fármaco, por la nefrotoxicidad de éste y por la competencia en el metabolismo hepático con los inhibidores de la calcineurina, lo que obliga a controles frecuentes de las concentraciones sanguíneas de anticalciniurínicos, creatinina y urea. Los nuevos fármacos voriconazol y caspofungina y sus posibles asociaciones con las anfotericinas liposómicas permiten esperar mejores resultados en el tratamiento de las infecciones pulmonares fúngicas en pacientes inmunodeprimidos.
Infección por Pneumocystis carinii
La infección por P. carinii es infrecuente desde que se realiza profilaxis con trimetropin-sulfametoxazol. Sin embargo, se debe recordar la necesidad de mantener dicha profilaxis cuando se aumenta la inmunodepresión para tratar episodios de rechazo agudo o crónico.
Complicacions pleurales
Las complicaciones pleurales son también relativamente frecuentes y pueden influir en la pérdida de función del órgano trasplantado109.
Complicaciones en el postoperatorio tardío
El BOS es un diagnóstico clínico que describe una pérdida de función pulmonar progresiva y con características obstructivas, siempre que se ha descartado la presencia de rechazo agudo, infección y obstrucción de la vía respiratoria. Habitualmente se utiliza el volumen espiratorio forzado en el primer segundo (FEV1) para cuantificar esta caída, si bien en una revisión reciente se ha incluido el FEV25-75 (flujo medio espiratorio forzado entre el 25 y el 75% de la capacidad vital forzada) porque puede detectar más tempranamente el inicio del BOS. Se ha establecido el concepto del BOS potencial cuando existe una caída del FEV1 de un 10% con un descenso del FEV25-75 del 25%.
En 1993 se creó una clasificación que permite establecer el grado clínico e histológico110, y que ha sido revisada recientemente por la International Society for Heart and Lung Transplantation111.
Cuando un paciente presenta signos clínicos de BOS, el proceso fibroproliferativo endobronquial suele estar desarrollado y por tanto la función perdida puede ser irrecuperable. Durante años se ha relacionado el desarrollo de BOS con mecanismos inmunológicos. Sin embargo, recientemente se ha demostrado que otros factores como la broncoaspiración en procesos de reflujo gástrico112,113 presentan significación estadística en su desarrollo. El BOS sería el proceso de reparación del daño producido en el pulmón por trastornos inmunológicos (rechazos clínicos o subclínicos) favorecidos o provocados, en ocasiones, por mecanismos no inmunológicos. Esto indicaría que posiblemente diversos procesos inflamatorios facilitan alteraciones en el proceso inmunológico que participarían en el desarrollo del BOS.
Las dudas sobre la etiología y el desconocimiento actual de la patogenia del BOS explican que la respuesta al tratamiento no sea frecuentemente la esperada. Parece claro que es aconsejable prevenir su desarrollo evitando los factores que suponemos implicados en su etiología. La determinación de los valores de óxido nítrico en el aire expirado podría aportar un diagnóstico temprano mediante una prueba incruenta que obligaría a la confirmación diagnóstica114,115. El hallazgo de bronquiolitis linfocítica en las biopsias es otro factor que debiéramos tratar como rechazo o al menos con corticoides inhalados por su significativa relación en el desarrollo del BOS.
La inducción reduce el número de rechazos, por lo que es posible que disminuya o retrase el desarrollo de la BOS. Por ello estamos pendientes de los resultados que aporte un estudio prospectivo multicéntrico cuyo primer objetivo es valorar la influencia de los anticuerpos antiinterleucina 2 en el desarrollo del BOS.
El cambio de ciclosporina por tacrolimus o azatioprina por mofetil micofenolato parece mostrar en ocasiones una tendencia hacia la estabilización, pero deberán confirmarlo los estudios amplios y multicéntricos que están en marcha.
El tratamiento citolítico no ha probado estadísticamente que modifique la evolución del BOS. El metotrexato, la ciclofosfamida, la fotoforesis extracorpórea, la irradiación total o la rapamicina se han utilizado en pequeños grupos de casos con resultados dispares116.
Los estudios que aclaren la patogenia del BOS parecen el mejor camino para prevenir su desarrollo o conseguir tratamientos eficaces.
Otras complicaciones a largo plazo, como tumores, insuficiencia renal, hipertensión, hiperlipemia o diabetes, son principalmente debidas a los efectos secundarios de la inmunodepresión recibida y compartidas globalmente con el resto de los trasplantes.
Resultados
Es difícil evaluar los resultados en España ya que no existe un registro nacional de trasplante pulmonar y, además, existen apreciables diferencias entre las enfermedades y complejidad aceptadas por los diferentes grupos.
La supervivencia publicada por el registro internacional8 sobre 15.267 pacientes trasplantados, recogidos de múltiples grupos entre 1990 y 2002, fue del 84% a los 3 meses, del 74% al año, del 58% a los 3 años y del 47% a los 5 años; destaca el claro incremento de la supervivencia en el postoperatorio inmediato en los últimos años, cuando se compara con épocas previas. El principal factor que influye en la supervivencia es la enfermedad de base (mejores resultado en el enfisema12 y la fibrosis quística5,14,117,118) y la situación clínica del paciente en el momento del trasplante25. Merece la pena destacar la importancia del número de trasplantes por centro en la supervivencia al primer año8 (fig. 5). Revisiones de un único centro con experiencia prolongada publican supervivencias del 84% al primer año y del 55% a los 5 años8. La experiencia del Complejo Hospitalario Juan Canalejo en los primeros 90 casos muestra una supervivencia actuarial del 78% al primer año y del 53% a los 5 años, que asciende haste el 90 y el 68%, respectivamente, si consideramos sólo los pacientes con enfisema.
Resulta incuestionable la mejoría de la calidad de vida de los trasplantados pulmonares119,120 y podemos apreciarlo en los resultados publicados por el registro internacional8, ya que el 83% de los pacientes que sobreviven lleva una vida normal y sin limitaciones al cabo de un año y este porcentaje se mantine a los 5 años.
Se puede concluir que el trasplante pulmonar, en estos últimos 15 años, se ha convertido en España en una realidad clínica que ha ampliado las indicaciones, ha mejorado sus resultados, especialmente en el primer año de postoperatorio, y debe solucionar el mayor crecimiento de la lista de receptores respecto a los donantes generados. Su principal reto es comprender, para poder prevenir, el desarrollo del BOS a fin de conseguir mejores resultados a largo plazo.