En este artículo se presentan las recomendaciones sobre el diagnóstico y tratamiento del síndrome de agudización de la enfermedad pulmonar obstructiva crónica (EPOC) (SAE) de GesEPOC 2021. Como principales novedades, la guía propone una definición y aproximación sindrómica, una nueva clasificación de gravedad y el reconocimiento de diferentes rasgos tratables (RT), lo que supone un nuevo paso hacia la medicina personalizada. La evaluación de la evidencia se realiza mediante la metodología Grading of Recommendations Assessment, Development and Evaluation (GRADE), con la incorporación de seis nuevas preguntas con enfoque paciente, intervención, comparación y resultados (PICO). El proceso diagnóstico comprende cuatro etapas: 1) establecer el diagnóstico del SAE, 2) valorar la gravedad del episodio, 3) identificar el factor desencadenante y 4) abordar los RT. En este proceso diagnóstico se diferencia una aproximación ambulatoria, en la que se recomienda incluir una batería básica de pruebas y una hospitalaria, más exhaustiva, en la que se contempla el estudio de diferentes biomarcadores y pruebas de imagen. El tratamiento broncodilatador destinado al alivio inmediato de los síntomas se considera esencial para todos los pacientes, mientras que el uso de antibióticos, corticoides sistémicos, oxigenoterapia, ventilación asistida o el tratamiento de las comorbilidades variará en función de la gravedad y de los posibles RT. El empleo de antibióticos estará especialmente indicado ante un cambio en el color del esputo, cuando se requiera asistencia ventilatoria, en los casos que cursen con neumonía y también para aquellos con proteína-C reactiva elevada (≥ 20 mg/L). Los corticoides sistémicos se recomiendan en el SAE que necesita ingreso y se sugieren en el SAE moderado. La eficacia de estos fármacos es mayor en pacientes con recuento de eosinófilos en sangre ≥ 300 células/mm3. La ventilación mecánica no invasiva en fase aguda se establece fundamentalmente para pacientes con SAE que cursen con acidosis respiratoria, a pesar del tratamiento inicial.
This article details the GesEPOC 2021 recommendations on the diagnosis and treatment of COPD exacerbation syndrome (CES). The guidelines propose a definition-based syndromic approach, a new classification of severity, and the recognition of different treatable traits (TT), representing a new step toward personalized medicine. The evidence is evaluated using GRADE methodology, with the incorporation of 6 new PICO questions. The diagnostic process comprises four stages: 1) establish a diagnosis of CES, 2) assess the severity of the episode, 3) identify the trigger, and 4) address TTs. This diagnostic process differentiates an outpatient approach, that recommends the inclusion of a basic battery of tests, from a more comprehensive hospital approach, that includes the study of different biomarkers and imaging tests. Bronchodilator treatment for immediate relief of symptoms is considered essential for all patients, while the use of antibiotics, systemic corticosteroids, oxygen therapy, and assisted ventilation and the treatment of comorbidities will vary depending on severity and possible TTs. The use of antibiotics will be indicated particularly if sputum color changes, when ventilatory assistance is required, in cases involving pneumonia, and in patients with elevated C-reactive protein (≥ 20 mg/L). Systemic corticosteroids are recommended in CES that requires admission and are suggested in moderate CES. These drugs are more effective in patients with blood eosinophil counts ≥ 300 cells/mm3. Acute-phase non-invasive mechanical ventilation is specified primarily for patients with CES who develop respiratory acidosis despite initial treatment.
Han trascurrido cuatro años desde que, en el 2017, la Guía Española de la Enfermedad Pulmonar Obstructiva Crónica (GesEPOC) publicase su última normativa, en la que se incluía un capítulo específico destinado a la agudización de la enfermedad1. Desde entonces, se han producido diversos avances científicos que hacen necesaria la actualización2–4. El reconocimiento actual de que la agudización es un síndrome consecuencia de distintos mecanismos etiopatogénicos, todos ellos con una expresión clínica similar, y la necesidad permanente de evolucionar el conocimiento hacia una medicina cada vez más personalizada2,5 ha llevado al comité científico de GesEPOC a renovar sus recomendaciones, incorporando las últimas evidencias y algunas nuevas propuestas, como una definición y aproximación sindrómica, la clasificación de gravedad o la identificación de diversos rasgos tratables (RT).
En este artículo, se presentan las recomendaciones sobre el diagnóstico y tratamiento del síndrome de agudización de la enfermedad pulmonar obstructiva crónica (EPOC) (SAE) perteneciente a la nueva GesEPOC 2021. En la elaboración de la guía han participado representantes de las sociedades científicas implicadas en la atención a pacientes con EPOC y del Foro Español de Pacientes. Para su desarrollo, se ha seguido la metodología Grading of Recommendations Assessment, Development and Evaluation (GRADE)6. En esta edición de la guía, se han elaborado seis nuevas preguntas con enfoque en paciente, intervención, comparación y resultados (PICO). Los detalles del protocolo que incluyen las preguntas PICO, la búsqueda bibliográfica y las tablas de evidencia se pueden consultar en el material suplementario. La tabla 1 recoge los puntos clave de esta actualización.
Puntos clave
| La agudización del paciente con EPOC se considera un síndrome consecuencia de distintos mecanismos etiopatogénicos, todos ellos con una expresión clínica similar.En aquellas circunstancias donde sea difícil discriminar si el empeoramiento clínico es consecuencia de la EPOC o de alguna comorbilidad, se recomienda diagnosticar y tratar ambos procesos.La neumonía se incluye dentro del SAE.La gravedad del SAE será evaluada de acuerdo con a la estratificación de riesgo basal (bajo o alto riesgo) y la intensidad del episodio agudo (nivel de disnea, nivel de consciencia, frecuencia respiratoria e intercambio de gases).El tratamiento de elección del SAE son los broncodilatadores de acción corta y rápida.Los corticoides sistémicos se sugieren para el SAE moderado y se recomiendan para todos los pacientes con SAE grave o muy grave. Su eficacia es mayor en presencia de un recuento de eosinófilos en sangre periférica ≥ 300 células/mm3El resto del tratamiento vendrá guiado por el nivel de gravedad y la identificación de diferentes rasgos tratables. |
EPOC: enfermedad pulmonar obstructiva crónica; SAE: síndrome de agudización de la enfermedad pulmonar obstructiva crónica
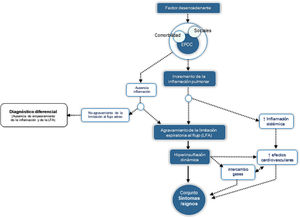
El SAE se define como un episodio de inestabilidad clínica que se produce en un paciente con EPOC como consecuencia del agravamiento de la limitación espiratoria al flujo aéreo o del proceso inflamatorio subyacente y se caracteriza por un empeoramiento agudo de los síntomas respiratorios respecto de la situación basal del individuo. Desde el punto de vista fisiopatológico, el SAE es un evento complejo y heterogéneo que comprende un conjunto de alteraciones diversas, que bien de forma aislada o más frecuentemente combinada se expresan clínicamente de manera similar en el paciente con EPOC. La figura 1 presenta de forma esquemática los elementos fisiopatológicos esenciales del SAE.
Muchos SAE se observan agrupados en racimos, lo que plantea la duda de si realmente son nuevos eventos o resoluciones incompletas de episodios precedente. Para distinguir estas situaciones se establecen las siguientes definiciones1:
Fracaso terapéutico: se define como un empeoramiento de síntomas que sucede durante el propio SAE y que requiere un tratamiento adicional7. La recuperación media después de sufrir un SAE es de aproximadamente dos semanas. No obstante, algunos pacientes no se recuperan de forma completa hasta las cuatro a seis semanas8,9.
Recaída: cuando se produce un nuevo empeoramiento de síntomas entre la finalización del tratamiento del SAE y las cuatro semanas posteriores.
Recurrencia: se produce cuando los síntomas reaparecen en un plazo inferior a un año desde el SAE precedente, después de un período de relativo buen estado de salud. Para ello, se establece que deben haber transcurrido al menos cuatro semanas después de completar el tratamiento del SAE previo o bien seis semanas desde que se iniciaron los síntomas7. Las recurrencias se consideran nuevos episodios de SAE.
DiagnósticoPara diagnosticar y categorizar adecuadamente el SAE se deberá, en primer lugar, confirmar que estamos ante un síndrome de agudización en un paciente con EPOC, realizando previamente el oportuno diagnóstico diferencial. Posteriormente, se establecerá la gravedad, se valorarán los factores desencadenantes y se identificarán los posibles RT. La aproximación diagnóstica puede diferir según se trate de un SAE ambulatorio u hospitalario.
Paso 1: diagnóstico del síndrome de agudización de la EPOCLa sospecha clínica se establecerá ante un empeoramiento agudo, mantenido y significativo de síntomas respiratorios (disnea, tos, cambios en el color o en el volumen del esputo) respecto a la situación basal en un paciente con diagnóstico previo de EPOC. El síntoma cardinal del SAE es el incremento significativo de la disnea. Para documentar que existe empeoramiento de la disnea se deberá conocer y describir cuál es la situación basal del paciente. GesEPOC recomienda el uso de la escala modificada de la Medical Research Council (mMRC) para valorar el grado de disnea10. El aumento de la tos o los cambios en el color y/o el incremento en el volumen del esputo también se consideran síntomas de SAE. Se confirmará el diagnóstico cuando, además de los criterios anteriores, se haya realizado el correspondiente diagnóstico diferencial.
Diagnóstico diferencialLa tabla 2 muestra las principales enfermedades a considerar en el diagnóstico diferencial. En algunas ocasiones, es difícil discriminar si el origen del cuadro es propio de la EPOC o está relacionado con la comorbilidad. En estos casos, se recomienda diagnosticar y tratar ambos procesos. Por ejemplo, se ha descrito que entre un 20 a 30% de los SAE graves asocian insuficiencia cardiaca11,12 o que entre un 15 a 20% presentan daño miocárdico con elevación de troponinas13.
Aproximadamente un 20% de los pacientes con SAE presentan infiltrados parenquimatosos en la radiografía de tórax14,15 y algo más de un tercio de los casos graves también los muestran en la tomografía computarizada (TC), a pesar de no apreciarse en la radiografía simple de tórax16. Tradicionalmente, estos infiltrados, etiquetados como neumonía, se han considerado comorbilidad en la EPOC. Sin embargo, existe una línea muy sutil entre la agudización de la EPOC y la neumonía. La sintomatología es prácticamente idéntica y los mecanismos subyacentes parecidos, por lo que, desde un punto de vista sindrómico, ambas situaciones se encuadran bajo el SAE. El microbioma pulmonar entre pacientes EPOC con o sin infiltrado pulmonar no difiere, los factores desencadenantes son similares y también el tratamiento15. La principal diferencia la observamos en el hecho de que, en presencia de neumonía, la inflamación es superior y el pronóstico peor14,17, lo que sugiere que posiblemente estemos ante diferentes expresiones de un mismo proceso patológico. Por este motivo, la neumonía, clasificada en anteriores ediciones de GesEPOC como una comorbilidad1, se considera actualmente un tipo de SAE.
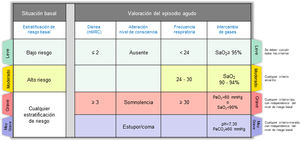
Paso 2: Valorar la gravedad del episodioUna vez establecido el diagnóstico de SAE, es muy importante describir la gravedad del episodio, que en la mayoría de las ocasiones es el resultado de la interacción entre la enfermedad de base y la intensidad del episodio agudo. La figura 2 muestra los criterios de gravedad propuestos por GesEPOC. La estratificación de riesgo basal se realizará de acuerdo con la última actualización de GesEPOC 2021 para la fase estable de la enfermedad4, mientras que la gravedad del episodio será evaluada de acuerdo al nivel de disnea, nivel de consciencia, frecuencia respiratoria e intercambio de gases.
Criterios de gravedad del SAE. Leve: se deben cumplir todos los criterios que aparecen con el color verde; moderado: ante la presencia de cualquier criterio amarillo; grave: cualquier criterio de color rojo, con independencia de la estratificación basal de riesgo; muy grave: cualquier criterio morado, con independencia de la estratificación basal de riesgo.
SAE: síndrome de agudización de la enfermedad pulmonar obstructiva crónica.
Disponer de escalas predictivas de riesgo puede ser de gran interés de cara a estratificar a los pacientes y a diseñar circuitos asistenciales de diferente intensidad y/o complejidad18–23. Una de escalas más estudiadas es el índice DECAF, desarrollado por Steer et al.20 en pacientes hospitalizados por SAE, a partir de los cinco predictores de mortalidad con más peso específico (disnea basal, eosinopenia, consolidación, acidemia y fibrilación auricular) (tabla 3). Este índice ha demostrado una excelente discriminación para mortalidad, siendo más preciso que otros predictores clínicos de mortalidad20–23. En los pacientes con riesgo bajo (0 a un punto), la mortalidad intrahospitalaria fue del 0,5 a 2,1% y la mortalidad a los 30 días osciló entre el 1,5 a 3,8%, para los casos de riesgo intermedio (dos puntos) la mortalidad intrahospitalaria fue del 8,4% y a los 30 días, del 11,9%. Los pacientes con DECAF ≥3 puntos presentaron una mortalidad intrahospitalaria del 24 al 70% y a los 30 días osciló del 27,2 a 70%17. GesEPOC recomienda el uso adicional de escalas predictivas de riesgo, como el índice DECAF, en pacientes con SAE hospitalario (grave o muy grave).
Índice DECAF para pacientes hospitalizados por SAE
| Variable | Puntuación |
|---|---|
| DisneaeMRCD 5aeMRCD 5b | 12 |
| Eosinopenia (<0,05 x 109/L) | 1 |
| Consolidación | 1 |
| Acidemia (pH<7,3) | 1 |
| Fibrilación auricular | 1 |
DECAF: Disnea, Eosinopenia, Consolidación, Acidemia y Fibrilación auricular; eMRCD: escala de disnea de la Medical Research Council extendida, donde el grado 5 de disnea equivale al grado 4 de la escala mMRC (10); eMRCD 5 a: pacientes que son capaces de lavarse o vestirse de forma independiente; eMRCD 5 b: el paciente requiere asistencia para lavarse y vestirse; SAE: síndrome de agudización de la enfermedad pulmonar obstructiva crónica.
Tomado con permiso de Steer et al.20.
La tabla 4 recoge los desencadenantes más frecuentes del SAE24. Identificarlos es de gran importancia para un adecuado tratamiento. Sin embargo, aproximadamente en un tercio de los casos no se llegan a establecer. Entre los factores desencadenantes más reconocidos se encuentran las infecciones respiratorias, tanto víricas como bacterianas. El criterio que mejor predice la infección bacteriana es el cambio en la coloración del esputo25. Por el contrario, el esputo mucoso pocas veces se asocia a infección bacteriana26. El análisis de esputo (tinción de gram y cultivo) estará especialmente indicado en aquellos pacientes con SAE graves o muy graves que presenten frecuentes agudizaciones, necesidad de ventilación asistida o ante un fracaso terapéutico. Utilizando técnicas moleculares como la reacción en cadena de polimerasa con transcriptasa inversa (RT-PCR) se ha podido comprobar que entre el 22 al 64% de las agudizaciones de EPOC son víricas27. También, se ha identificado una proporción importante de coinfección vírica-bacteriana28. Recientemente, se han comercializado sistemas de diagnóstico molecular automatizado que permiten detectar simultáneamente diversos virus respiratorios. El precio de estas determinaciones no permite todavía generalizar su uso en la práctica clínica. Sin embargo, es muy probable que en un futuro inmediato este tipo de técnicas se puedan incorporar al esquema diagnóstico del SAE. La pandemia por SARS-CoV-2 ha acelerado el uso en la práctica clínica de la búsqueda de virus a través de la RT-PCR.
Factores desencadenantes del SAE
| Virus | Rhinovirus (resfriado común)InfluenzaParainfluenzaCoronavirus (incluyendo el SARS-CoV-2)AdenovirusVirus respiratorio sincitial |
| Bacterias | Haemophilus influenzaeStreptococcus pneumoniaeMoraxella catarrhalisPseudomonas aeruginosaOrganismos atípicos;Chlamydophila pneumoniaeMycoplasma pneumoniae. |
| Contaminación ambiental | Ozono (O3)Partículas en suspensión ≤ 10 μm de diámetro (PM10)Dióxido de sulfuro (SO2)Dióxido de nitrógeno (NO2) |
SAE: síndrome de agudización de la enfermedad pulmonar obstructiva crónica
Existe una gran actividad de investigación sobre biomarcadores de infección bacteriana en el SAE. La revisión sistemática realizada por esta guía, centrada en la agudización tradicional de la EPOC y en la que se excluye la neumonía, señala que tanto la proteína C reactiva (PCR) como la procalcitonina (PCT) son útiles para guiar el tratamiento antibiótico, asociándose a una menor prescripción de este tipo de fármacos, sin que se aprecien diferencias en la tasa de fracasos terapéuticos, recurrencias, hospitalizaciones o mortalidad (tabla 5, anexo 1). La PCR puede ser evaluada tanto en medio hospitalario como ambulatorio, mediante determinación capilar29,30. En pacientes con PCR elevada (≥ 20 mg/L), incluso con esputo no concluyente, se sugiere emplear antibióticos en personas con SAE (tabla 5, anexo 1). La PCT también es útil para reducir el consumo de antibióticos31,32. No obstante, su mayor coste, su menor disponibilidad y la posibilidad de contar con parámetros clínicos, como el color del esputo o biomarcadores de mayor accesibilidad como la PCR, no sugieren su empleo regular para la agudización de la EPOC (tabla 5, anexo 1). Tampoco se sugiere el uso de PCT en los casos con neumonía adquirida en la comunidad o de neumonía nosocomial33,34.
Resumen de preguntas PICO
| Pregunta PICO | Recomendación | Especificaciones | Fuerza de la recomendación | Nivel de evidencia |
|---|---|---|---|---|
| 1. ¿Se deben prescribir antibióticos en agudizaciones de la EPOC? | En los pacientes que presentan una agudización ambulatoria de la de la EPOC se sugiere el uso de antibióticos.En los pacientes que presentan una agudización de la EPOC que requieren ingreso hospitalario se sugiere el uso de antibióticos.Se recomienda el uso de antibióticos en todos los pacientes que presentan una agudización de la EPOC y requieren ingreso en UCI. | Muchas de las agudizaciones tratadas con placebo no presentan fracaso terapéutico, lo que sugiere que el antibiótico no siempre es necesario. El cambio en el color del esputo (de mucoso a oscuro) se asocia con mayor aislamiento de gérmenes potencialmente patógenos por lo que se considera un parámetro útil para la administración de antibióticos. En presencia de esputo no concluyente, el empleo de la PCR (≥20 mg/L) también se considera de utilidad para el uso de antibióticos. Los pacientes que requieren soporte ventilatorio tienen mayor riesgo de infección bacteriana. En estas circunstancias también se aconseja el empleo de antibióticos. | DébilDébilFuerte | BajaBajaModerada |
| 2. ¿La presencia de un cambio en el color del esputo, es útil para guiar la administración de antibióticos en los pacientes con una agudización de la EPOC? | Se sugiere el uso de antibióticos ante la presencia de un cambio en el color del esputo (de mucoso a oscuro) en los pacientes con una agudización de la EPOC. | Débil | Muy baja | |
| 3. ¿La determinación de la proteína C reactiva (PCR), es útil para guiar la administración de antibióticos en los pacientes con una agudización de la EPOC? | Se sugiere guiar el tratamiento antibiótico con la determinación PCR en los pacientes con una agudización de la EPOC en los que la valoración del cambio en el color del esputo no sea concluyente. | En pacientes con PCR elevada (≥20 mg/L) estará indicado el tratamiento con antibióticos. Este biomarcador puede ser empleado tanto en medio hospitalario, como ambulatorio (PCR capilar). | Débil | Baja |
| 4. ¿La determinación de la procalcitonina (PCT), es útil para guiar la administración de antibióticos en los pacientes con una agudización de la EPOC? | No se sugiere el empleo regular de la procalcitonina para guiar el uso de antibióticos durante la agudización de la EPOC. | La procalcitonina es útil para reducir el consumo de antibióticos. No obstante, su mayor coste, su menor disponibilidad y la posibilidad de contar con parámetros clínicos, como el color del esputo, o biomarcadores de mayor accesibilidad como la PCR, no aconsejan su empleo regular para la agudización de la EPOC. | Débil | Baja |
| 5. ¿Se deben prescribir corticoides orales en las agudizaciones de la EPOC? | Se recomienda el uso de corticoides orales en pacientes con agudización grave.Se sugiere el uso de corticoides orales en pacientes con agudización moderada. | La dosis recomendada de corticoides orales es de 0,5 mg/kg/día de prednisona o equivalente, durante un máximo de 5 días en agudizaciones moderadas y durante un máximo de 14 días en agudizaciones graves. La vía parenteral es preferible para las agudizaciones muy graves. | FuerteDébil | ModeradaModerada |
| 6. ¿La determinación de los eosinófilos, es útil para guiar la administración de corticoides orales en los pacientes con una agudización de la EPOC? | Se recomienda administrar el uso de corticoides orales en pacientes con recuento de eosinófilos ≥ 300 células/mm3. | La eficacia de los corticoides orales en las agudizaciones de la EPOC es mayor en pacientes con recuento de eosinófilos ≥ 300 células/mm3. | Débil | Baja |
EPOC: enfermedad pulmonar obstructiva crónica; PICO: paciente, intervención, comparación y resultados; UCI: unidad de cuidados intensivos
Los RT son características clínicas, fisiológicas o biológicas presentes en cada paciente individual, que se pueden identificar mediante pruebas diagnósticas o biomarcadores y que tienen un tratamiento específico4,35,36. La tabla 6 recoge los principales RT del SAE.
Rasgos tratables del síndrome de agudización de la EPOC
| Rasgos tratables | Biomarcador | Tratamiento |
|---|---|---|
| RT endotípicos | ||
| Infección bacteriana | Color del esputoPCR (≥20 mg/L) | Antibiótico |
| Inflamación T2 | Eosinofilia periférica (≥300 cél/mm3) | Corticoides sistémicos |
| Disfunción ventricular | NT-proBNP | Diuréticos, beta-bloqueantes,ARA-II, IECAs |
| Isquemia miocárdica | Troponina | Antiagregantes,beta-bloqueantes |
| RT funcionales | ||
| Insuficiencia respiratoria aguda hipoxémica | PaO2 inferior a 60 mmHg | Oxigenoterapia |
| Insuficiencia respiratoria aguda hipercápnica | PaCO2 > 45 mmHg | Evitar sedantes |
| Acidosis respiratoria | pH<7,35 | Considerar ventilación no invasiva. |
| RT imagen(Rx tórax/TC torácico) | ||
| NeumoníaEmbolia pulmonarHipertensión pulmonar Bronquiolitis infecciosaBronquiectasias | Infiltrado parénquima pulmonarDefecto de replección vascularRelación arteria pulmonar/aorta >1Árbol en broteBronquiectasias | AntibióticoAnticoagulaciónValorar oxigenoterapiaValorar antibióticoValorar antibiótico |
| RT de estilo de vida/conductuales | ||
| Baja adhesión terapéutica | Cuestionarios de adhesión (TAI, etc.) | Educación sanitaria |
| Técnica inhalatoria incorrecta. | Revisión de la técnica (cuestionarios) | Entrenamiento |
| Problemática social | Evaluación social y de dependencia (Pfeiffer, etc..) | Programas de apoyo social |
ARA-II: Antagonistas del receptor de la angiotensina II; EPOC: enfermedad pulmonar obstructiva crónica; IECAS: inhibidor del enzima convertidor de la angiotensina; NT-proBNP: fracción N-Terminal del propéptido natriurétrico cerebral o tipo B; PCR: proteína C reactiva; RT: rasgo tratable; Rx: radiografía; TC: tomografía computarizada.
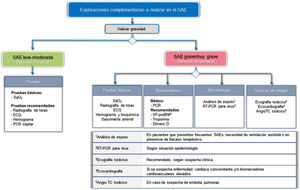
Para tratar de establecer la gravedad, identificar el factor desencadenante y los RT, se propone una aproximación diferente según el nivel asistencial donde se atienda el SAE. La figura 3 muestra las exploraciones complementarias básicas y recomendadas, en función del nivel asistencial.
Exploraciones complementarias recomendadas para el SAE, en función del nivel asistencial.
AngioTC: angiografía pulmonar por tomografía computarizada; ECG: electrocardiograma; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; PCR: proteína C reactiva; RT-PCR: reacción en cadena de polimerasa con transcriptasa inversa; SaO2: Saturación arterial de oxígeno.
En el ámbito de la atención primaria, se considera básica la determinación de la saturación arterial de oxígeno (SaO2), siendo recomendable la realización de una radiografía, electrocardiograma (ECG) y analítica, junto con la determinación capilar de la PCR.
En el hospital, el estudio deberá ser mucho más exhaustivo. GesEPOC considera pruebas básicas la realización de una radiografía de tórax, ECG, gasometría arterial y analítica (hemograma y bioquímica estándar), en la que se incluya como mínimo la determinación de la PCR. También se recomienda el uso de otros biomarcadores como la troponina, fracción N-terminal del propéptido natriurético cerebral (NT-proBNP) o el dímero D. La búsqueda de virus, mediante el uso de paneles de RT-PCR, deberá valorarse en función de la situación epidemiológica. La ecocardiografía estará indicada ante la sospecha de cardiopatía concomitante o elevación de biomarcadores cardiovasculares. La angiografía pulmonar por TC (AngioTC) se valorará ante sospecha de embolia pulmonar, aconsejándose el uso de herramientas de probabilidad clínica pretest, como la escala de Wells o de Ginebra37.
La ecografía torácica se ha desarrollado en los últimos años y ha demostrado ser de gran utilidad para el diagnóstico rápido y a pie de cama de la insuficiencia cardiaca descompensada, neumonía, tromboembolismo pulmonar, neumotórax, derrame pleural y pericárdico, o de la disfunción muscular diafragmática38–42. Existen diferentes aproximaciones sistemáticas, como por ejemplo el protocolo Bedside Lung Ultrasonography in Emergency (BLUE), con una precisión diagnóstica global que oscila entre el 77,5 al 90,5% en pacientes con disnea aguda41,42. La sensibilidad y especificidad para la agudización clásica de la EPOC es algo menor (sensibilidad del 98,2 y especificidad del 69%)42. Sin embargo, este tipo de aproximaciones integrales basadas en la ecografía torácica pueden ser de gran utilidad para la nueva aproximación sindrómica del SAE.
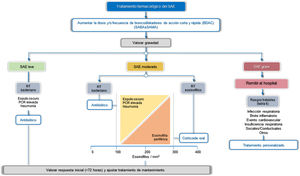
TratamientoLas pautas de tratamiento deberán ser adecuadas a cada paciente en función de los posibles factores desencadenantes, su gravedad y los RT identificados. En este sentido, se distinguen dos escenarios de tratamiento, el ambulatorio y el hospitalario (fig. 4). Más del 80% de las agudizaciones se manejan de forma ambulatoria43. La tabla 5 resume las principales preguntas PICO referidas al tratamiento del SAE.
El tratamiento broncodilatador destinado al alivio inmediato de los síntomas se considera esencial para todos los pacientes, mientras que el uso de antibióticos, corticoides sistémicos, oxigenoterapia, ventilación asistida o el tratamiento de la propia comorbilidad variará en función de la gravedad o de los posibles RT del SAE (fig. 4, tabla 6).
Tratamiento farmacológicoBroncodilatadoresEn el SAE de cualquier intensidad, la principal intervención consiste en la optimización de la broncodilatación, aumentando la dosis o la frecuencia de los broncodilatadores44. Los broncodilatadores de acción corta son de elección para el tratamiento del SAE. Se deberán emplear fármacos de acción rápida como los β2-agonistas (salbutamol y terbutalina), y se puede añadir, si fuera necesario, un anticolinérgico de acción corta (ipratropio).
Para administrar los fármacos inhalados durante la agudización, se pueden utilizar dispositivos presurizados de dosis medida (pMDI) con cámara de inhalación o nebulizadores. Una revisión sistemática sobre las formas de administración de los broncodilatadores de acción corta concluye que cuando la técnica inhalatoria es buena, no hay diferencias significativas sobre el volumen espiratorio forzado durante el primer segundo (FEV1) entre los cartuchos presurizados con o sin cámara espaciadora y los nebulizadores45.
Las dosis recomendadas son, para el caso del salbutamol, de 400 a 600 μg/4 a 6 h (4-6 inhalaciones/ 4-6 h) o terbutalina 500 a 1.000 μg/4-6 h (1-2 inhalaciones/6 h) y en el caso de ipratropio de 80 a 120 μg/4-6 h (4-6 inhalaciones c/4-6 h). En el caso de utilizar la medicación nebulizada la pauta será de 2,5 a 5 mg de salbutamol y/o 0,5 a 1 mg de ipratropio cada cuatro a seis horas.
Los broncodilatadores de larga duración (BDLD) constituyen el tratamiento de base de la EPOC y su eficacia en el SAE no está suficientemente documentada46. Sin embargo, es importante recordar que, si el paciente ya utiliza BDLD para el control de su enfermedad de base, estos no deberán suspenderse durante el tratamiento del SAE ambulatorio.
AntibióticosEn las agudizaciones ambulatorias y en los pacientes ingresados, el uso de antibióticos reduce el riesgo de fracaso terapéutico e incrementa el tiempo hasta la siguiente agudización, sin afectar a la calidad de vida relacionada con la salud (CVRS), las recurrencias o la mortalidad47–49. En los casos que requieren ingreso en la Unidad de Cuidados Intensivos (UCI), el tratamiento antibiótico se ha asociado a una reducción significativa de la mortalidad por cualquier causa, a menor fracaso terapéutico y una menor duración de la estancia hospitalaria47,50. En general, se sugiere el empleo de antibióticos durante un SAE ambulatorio u hospitalario, recomendándose especialmente su administración en todos los pacientes que necesiten ingreso en UCI (tabla 5, suplemento 1). Muchos de los SAE tratados con placebo evolucionan favorablemente, lo que sugiere que el antibiótico no siempre es necesario. La administración de antibiótico estará especialmente indicada ante un cambio en el color del esputo (de mucoso a oscuro)47–49; cuando el paciente requiere asistencia ventilatoria tanto invasiva como no invasiva50 y en los casos con PCR elevada (≥20 mg/dL), aunque el aspecto del esputo no sea concluyente29,30. También, se recomienda el empleo de antibióticos en todos los pacientes con SAE que cursen con neumonía, de acuerdo con las recomendaciones que establecen las guías de práctica clínica de la neumonía33,34,51
La tabla 7 indica cuáles son los principales antibióticos para considerar durante el SAE. Esta elección dependerá del conocimiento de las especies bacterianas involucradas, resistencias antibióticas locales, de la gravedad de la propia agudización y del riesgo de infección por Pseudomonas aeruginosa. Este riesgo se define por el uso de cuatro o más ciclos de tratamiento antibiótico en el último año, una función pulmonar con un FEV1 <50% del predicho, la presencia de bronquiectasias significativas o el aislamiento previo de Pseudomonas en esputo en fase estable o en una agudización previa1,52,53.
Recomendación sobre el uso de antibióticos en el SAE
| Gravedad agudización | Gérmenes | Antibiótico de elección |
|---|---|---|
| SAE leve | H. influenzae.S. pneumoniae.M. catarrhalis | Amoxicilina-ácido clavulánicoCefditorenoLevofloxacinoaMoxifloxacinoa |
| SAE moderado | Igual que grupo A+S. pneumoniae con sensibilidad reducida a penicilina.Enterobacterias | Amoxicilina-ácido clavulánicoCefditorenoLevofloxacinoaMoxifloxacinoa |
| SAE grave-muy grave sin riesgo de infección por Pseudomonas | Igual que grupo A+S. pneumoniae con sensibilidad reducida a penicilina.Enterobacterias | Amoxicilina-ácido clavulánicoCeftriaxonaCefotaximaLevofloxacinoaMoxifloxacinoa |
| SAE grave-muy grave con riesgo de infección por Pseudomonas | Igual que grupo B+P. aeruginosa | b-lactámico con actividad antipseudomonabAlternativa: quinolonasa con actividad antipseudomonicac |
SAE: síndrome de agudización de la enfermedad pulmonar obstructiva crónica
La administración de medicamentos y alimentos de los Estados Unidos (FDA) y la Agencia Europea de Medicamentos (EMA) recomiendan evitar fluoroquinolonas si existe alternativa terapéutica debido a sus efectos adversos.
Los corticoides sistémicos han demostrado acelerar la recuperación de los síntomas, mejorar la función pulmonar y disminuir los fracasos terapéuticos, aunque sin reducir la mortalidad47,54. Sin embargo, estudios recientes indican que estos fármacos pueden ser menos eficaces en pacientes con cifras bajas de eosinófilos en sangre55,56. De acuerdo con la revisión sistemática realizada por esta guía y con carácter general, se recomienda el empleo de corticoides orales en pacientes con SAE grave o muy grave y se sugiere su uso para el SAE moderado (tabla 5, anexo 1). La eficacia de estos fármacos en el SAE es mayor en pacientes con recuento de eosinófilos ≥ 300 células/mm3. La dosis recomendada es de 0,5 mg/kg/día de prednisona o equivalente durante un máximo de cinco días en el SAE moderado y un máximo de 14 días en el grave o muy grave47,57. Aunque no se han observado diferencias entre la administración intravenosa o la oral47, la vía parenteral es preferible para los SAE muy graves.
Profilaxis de la enfermedad tromboembólica venosa (ETV)El SAE graves o muy grave de la EPOC comportan un riesgo elevado de ETV, por lo que se recomienda el uso de heparinas de bajo peso molecular a dosis profilácticas de alto riesgo58. En el SAE moderado, en el que el paciente permanece encamado o inactivo tres o más días, también está indicado su uso.
Optimizar el tratamiento de la comorbilidadEn la EPOC es frecuente la coexistencia de distintas comorbilidades como la hipertensión arterial, cardiopatía isquémica, arritmias, insuficiencia cardiaca o diabetes. Por ello, será necesario optimizar su tratamiento, de acuerdo con las recomendaciones establecidas por las guías de práctica clínica específicas. En pacientes cardiópatas, tanto los β2-agonistas como los anticolinérgicos de acción corta se han asociado a un incremento de arritmias, por lo que se debe ser cauteloso con la dosis empleada, especialmente con los dispositivos nebulizados59.
Tratamiento no farmacológicoOxigenoterapiaLa administración de oxígeno suplementario se considera una de las piezas clave del tratamiento del SAE grave de la EPOC que cursa con insuficiencia respiratoria. El objetivo de la oxigenoterapia es alcanzar una SaO2 entre 88 a 92%. Sin embargo, la administración de oxígeno debe realizarse de forma controlada, ya que en algunos pacientes el principal estímulo del centro respiratorio depende del grado de hipoxemia más que del habitual estímulo hipercápnico. La administración de oxígeno de forma incontrolada puede producir supresión del estímulo respiratorio, carbonarcosis e incluso parada respiratoria. En la práctica clínica, se deben administrar bajas concentraciones inspiratorias de oxígeno, bien 24 o 28%, mediante mascarillas de alto flujo tipo Venturi o mediante gafas nasales a bajos flujos de 2 a 4 L/min.
Oxigenoterapia de alto flujo (OAF)La terapia de alto flujo permite suministrar gas a flujos altos (hasta de 60 L/min) con proporciones variables de aire y oxígeno mediante una cánula nasal, con el gas administrado a nivel de temperatura y humedad ideales (37°C y 100% de humedad relativa). En el SAE la OAF ha demostrado mejorar la oxigenación y la ventilación, disminuyendo la hipercapnia y mejorando la CVRS60–62. Algunos ensayos no controlados y uno aleatorizado reciente de no inferioridad han comparado el uso de la OAF frente a la ventilación no invasiva (VNI) en pacientes con EPOC con acidosis leves-moderadas (pH: 7,25 a 7,35), sin encontrar diferencias significativas, aunque con mejor tolerancia para el OAF63–65. A pesar de estos potenciales beneficios, se necesita incorporar más evidencia para poder establecer las recomendaciones específicas de uso en el SAE.
Ventilación asistidaEn los casos donde existe un fracaso ventilatorio grave, con alteración del nivel de consciencia o acidosis respiratoria, a pesar de tratamiento médico óptimo, se debe considerar el empleo de soporte ventilatorio1. La ventilación mecánica puede ser administrada de forma no invasiva o invasiva (VI).
Ventilación mecánica no invasivaEn pacientes con fallo respiratorio agudo hipercápnico la VNI disminuye la mortalidad, la necesidad de intubación y las complicaciones del tratamiento respecto a la terapia habitual sin soporte ventilatorio. También disminuye la estancia hospitalaria y en la UCI1,47,66. La tabla 8 señala cuáles son las indicaciones y contraindicaciones de la VNI.
Indicaciones y contraindicaciones relativas de la ventilación no invasiva (VNI)
| Indicaciones |
| Acidosis respiratoria (pH <7,35) con hipercapnia (PaCO2 >45 mmHg) a pesar de tratamiento óptimo |
| Contraindicaciones |
| Parada respiratoriaInestabilidad cardiovascularSomnolencia que impida la colaboración del pacienteAlto riesgo de aspiraciónCirugía facial o gastroesofágica recienteAnomalías nasofaríngeasQuemados |
Debe considerarse en los casos de parada respiratoria, intolerancia o fracaso de la VNI, empeoramiento de la acidosis respiratoria (pH < 7,25), inestabilidad hemodinámica o disminución del nivel de consciencia, que no mejora con tratamiento correcto1.
Rehabilitación respiratoria precozEn pacientes hospitalizados por una agudización de EPOC, los programas de rehabilitación pulmonar temprana reducen los reingresos, mejora la CVRS y la capacidad de ejercicio67. No obstante, estos resultados son variables según el momento de inicio del programa. La disminución de reingresos únicamente es significativa para programas iniciados tras cuatro semanas del alta hospitalaria.
Criterios de ingreso y alta hospitalariaLa tabla 9 muestra los criterios de ingreso hospitalario. La duración de la estancia hospitalaria es variable de unos pacientes a otros, y no existen suficientes datos para establecer la duración óptima de la hospitalización en pacientes individuales con SAE. En el momento del alta hospitalaria, se deberá adecuar el tratamiento de base4, con especial énfasis en reducir las posibles recaídas y recurrencias (tabla 10).
Criterios de ingreso hospitalario en sala de hospitalización
| Ausencia de mejoría tras tratamiento correcto y observación de 6-12 horasAcidosis respiratoria (pH <7,35)PaO2 < 55 mmHgPaCO2 >50 mmHg en pacientes sin hipercapnia previaNecesidad de ventilación mecánica no invasivaNeumonía, siempre que se cumplan los criterios específicos de gravedad de la neumonía que indican ingresoPresencia de complicaciones o comorbilidades graves:Derrame pleuralNeumotóraxEnfermedad venosa tromboembólicaTraumatismo torácico con fracturas costalesAlteraciones cardiovasculares (insuficiencia cardiaca, cardiopatía isquémica, arritmias no controladas)Anemia graveSoporte domiciliario insuficiente |
Recomendaciones de tratamiento al alta hospitalaria
| Abstinencia tabáquicaRecomendación de ejercicio regular. Valorar rehabilitación pulmonar tras hospitalización.Mantener y ajustar el tratamiento habitual, según fenotipo clínico y rasgos tratables:Revisar la técnica inhalatoria del enfermoFenotipo no agudizador: LAMA + LABAFenotipo agudizador no eosinofílico: LAMA + LABA. Se puede considerar añadir CSI (triple terapia) en pacientes con recuento de eosinófilos en sangre periférica >100 células/mm3.Fenotipo agudizador eosinofílico: LABA/CSI o triple terapia (LAMA + LABA + CSI), según intensidad del cuadro.Evaluar y tratar diferentes rasgos tratables.Oxígenoterapia: reajustar según necesidadesAntibióticos si se cumplen las indicacionesCorticoides orales: 0,5 mg/kg/día durante 5-14 días.Ventilación mecánica no invasiva domiciliaria. Considerarla en pacientes con agudizaciones acidóticas recurrentes y/o en paciente que asocien hipoventilación por otras causas (síndrome de apnea-hipoapnea, obesidad-hipoventilación, etc.)Control clínico en 72 horas y revisión en 2-4 semanasAsegurar adhesión terapéuticaPlanificación de cuidados de enfermeríaGarantizar continuidad asistencial |
LABA: β2-adrenérgicos de acción prolongada; LAMA: antimuscarínicos de acción prolongada; CSI: corticoides inhalados
Para el SAE ambulatorio, se establece un control evolutivo a las 72 horas del inicio del tratamiento, en el ámbito de atención primaria, con la intención de valorar la evolución del proceso e identificar la existencia de posibles fracasos terapéuticos precoces. En el caso de que el paciente haya requerido ingreso hospitalario, el control evolutivo inicial deberá realizarse entre dos y cuatro semanas tras el alta hospitalaria, aconsejándose una visita adicional a las ocho-12 semanas.
En la consulta, se evaluará el grado de control68–71 y la respuesta terapéutica, se detectarán los casos con dificultad para la comprensión de las indicaciones, aquellas situaciones de riesgo especial y se revisarán aspectos diagnósticos, de adhesión y tolerancia del tratamiento, la técnica inhalatoria, se insistirá en aspectos educativos y preventivos y se potenciará la implicación de los pacientes y cuidadores en aspectos de autocuidado. Las personas con hospitalizaciones frecuentes pueden beneficiarse de programas de cuidados específicos para reducir los ingresos y mejorar la CVRS72. En todos aquellos pacientes que no dispongan de espirometría previa, se deberá realizar una de confirmación en fase de estabilidad.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesJuan José Soler-Cataluña ha recibido honorarios por asesoría científica y/o por impartir conferencias de AstraZeneca, Bial, Boehringer Ingelheim, Chiesi, Grupo Ferrer, GlaxoSmithKline, Laboratorios Esteve, Teva, Menarini, Mundipharma, Novartis, Rovi y Zambon. Pascual Piñera declara no tener conflicto de interés. Juan Antonio Trigueros ha recibido honorarios por actividades formativas y participación en estudios clínicos de Astra Zéneca, Boehringer Ingelheim, Chiesi, Esteve, GlaxoSmithKline, Mundipharma, Menarini, Pfizer y Teva. Myriam Calle ha recibido honorarios por impartir conferencias de Novartis, Chiesi, AstraZeneca, Boehringer Ingelheim, AstraZeneca y GlaxoSmithKline. Juan Ciro Casanova ha recibido en los últimos tres años honorarios por impartir conferencias y/o asesoría científica y/o ayudas para proyectos de investigación de Astra-Zeneca, Bial, Boehringer-Ingelheim, Chiesi, GlaxoSmithKline, Menarini y Novartis. Borja G. Cosío ha recibido honorarios por asesoría científica y/o por impartir conferencias de Chiesi, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Laboratorios Esteve, Faes Farma, Teva, Menarini, Sanofi y Novartis. José Luis López-Campos ha recibido honorarios en los últimos tres años por proporcionar conferencias, asesoramiento científico, participación en estudios clínicos o redacción de publicaciones para: AstraZeneca, Boehringer Ingelheim, Chiesi, CSL Behring, Esteve, Ferrer, Gebro, GlaxoSmithKline, Grifols, Menarini, Novartis, Rovi y Teva. Jesús Molina ha recibido honorarios en los últimos tres años por asesoría científica y/o por impartir conferencias de Astra-Zeneca, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Menarini, Novartis y Pfizer. Pere Almagro ha recibido honorarios por asesoría científica y/o por impartir conferencias de Chiesi, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Laboratorios Esteve, Menarini, y Novartis. José-Tomás Gómez ha recibido honorarios por asesoría científica y/o impartir conferencias de Astra-Zeneca, BIAL, Chiesi, Laboratorios Esteve, Grifols, GlaxoSmithKline, Mylan, Reig-Jofré, ROVI, TEVA y Zambon. Juan Antonio Riesco ha recibido honorarios por asesoría científica y/o por impartir conferencias de Astra-Zeneca, Bial, Boehringer Ingelheim, Chiesi, GlaxoSmithKline, Menarini, Mundipharma, Novartis, Pfizer, Rovi y Teva. Pere Simonet ha recibido honorarios por actividades de formación continuada de Boehringer Ingelheim, Menarini, Mundipharma, GlaxoSmithKline, Chiesi y AstraZeneca. David Rigau no tiene conflictos de interés. Joan B. Soriano ha recibido financiación para realizar investigación médica y becas desde 2016 a 2021 de Chiesi, GSK, Linde, y Novartis vía el IIS del Hospital Universitario de La Princesa; ha participado en actividades formativas, conferencias, comités asesores y/o consultoría durante el período 2015-2019 patrocinadas por: AirLiquide, Almirall, AstraZeneca, Boehringer-Ingelheim, CHEST, Chiesi, ERS, IHME, GEBRO, Grifols, GSK, Laminar, Linde, Lipopharma, Menarini, Mundipharma, Novartis, Pfizer, RiRL, Rovi, SEPAR, Takeda, y Zambon; no ha recibido (ni directa ni indirectamente) fondos de la industria del tabaco o sus afiliados. Julio Ancochea ha recibido honorarios por asesoría científica y/o por impartir conferencias de Actelion, Air Liquide, Almirall, AstraZeneca, Boehringer Ingelheim, Carburos Médica, Chiesi, Faes Farma, Ferrer, GlaxoSmithKline, InterMune, Linde Healthcare, Menarini, MSD, Mundipharma, Novartis, Pfizer, Roche, Rovi, Sandoz, Takeda y Teva. Marc Miravitlles ha recibido honorarios como ponente de AstraZeneca, Boehringer Ingelheim, Chiesi, Cipla, AstraZeneca, Menarini, Rovi, Bial, Sandoz, Zambon, CSL Behring, Grifols y Novartis; honorarios de consultoría de AstraZeneca, Boehringer Ingelheim, Chiesi, Ferrer, GlaxoSmithKline, Bial, Gebro Pharma, Kamada, CSL Behring, Laboratorios Esteve, Ferrer, Mereo Biopharma, Verona Pharma, TEVA, Spin Therapeutics, pH Pharma, Novartis, Sanofi y Grifols, y ayudas para la investigación de Grifols.
Coordinador: Marc Miravitlles, Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Comité Ejecutivo: Pere Almagro, Sociedad Española de Medicina Interna (SEMI); Julio Ancochea, Myriam Calle, Ciro Casanova, Eusebi Chiner, Borja G. Cosío, Elena Gimeno-Santos, Carme Hernández, José Luis López-Campos, Juan Antonio Riesco, Nuria Seijas, Joan B. Soriano, Juan José Soler-Cataluña (SEPAR); Jesús Molina, Sociedad Española de Medicina Familiar y Comunitaria (semFYC); Dolors Navarro; Asociación de Pacientes y Familiares de EPOC y Apneas del Sueño (APEAS), Federación Nacional de Asociaciones de Pacientes Respiratorios (FENAER), Foro Español de Pacientes (FEP); Leopoldo Palacios Gómez, Federación de Asociaciones de Enfermería Comunitaria y Atención Primaria (FAECAP); Pascual Piñera Salmerón, Sociedad Española de Medicina de Urgencias y Emergencias (SEMES); Eulogio Pleguezuelos, Sociedad Española de Rehabilitación y Medicina Física (SERMEF), Sociedad de Rehabilitación Cardiorrespiratoria (SORECAR); Sebastià Santaeugenia, Sociedad Española de Geriatría y Gerontología (SEGG); Pere Simonet, Grupo de Respiratorio en Atención Primaria (GRAP); José Tomás Gómez, Sociedad Española de Médicos de Atención Primaria (SEMERGEN); Juan Antonio Trigueros, Sociedad Española de Médicos Generales y de Familia (SEMG). Metodología: David Rigau, Centro Cochrane Iberoamericano, Barcelona, España.