Varón de 57 años con tos, disnea, hemoptisis y epistaxis, sin exposición a fármacos, tóxicos ni agentes químicos. Diagnosticado previamente de enfermedad por IgG4 mediante biopsia lacrimal, con gastritis crónica, hipotiroidismo autoinmune, hipogonadismo hipergonadotrófico, anemia crónica y nefropatía crónica estadio V. Exploración física: afebril, taquipneico, con epistaxis. La auscultación pulmonar presentaba crepitantes húmedos en ambos hemitórax.
Laboratorio: hematíes: 3,12/mm3, Hto: 29,5% Hb: 9,1g/dL, leucocitos: 15,360/mm3 (82% neutrófilos), plaquetas: 277,000, glucosa 109mg/dL, creatinina: 12,46mg/dL urea: 161mg/dL, CPK: 72 U/L, Na: 142 mEq/L, K: 5,6 mEq/L, PRO-BNP: 22.644 pg/mL, PCR: 20,91mg/dL, PCT: 0,929 ng/dL. Gasometría arterial (FiO2: 0,21): pH 7,47, pCO2: 34,4mmHg, pO2: 59mmHg, HCO3– 25,4. Función hepática y coagulación normal. Radiografía de tórax con patrón alveolar bilateral. TC torácico, craneal y de vías aéreas superiores, confirmó la consolidación alveolar con engrosamiento de la mucosa del seno maxilar izquierdo (fig. 1a).
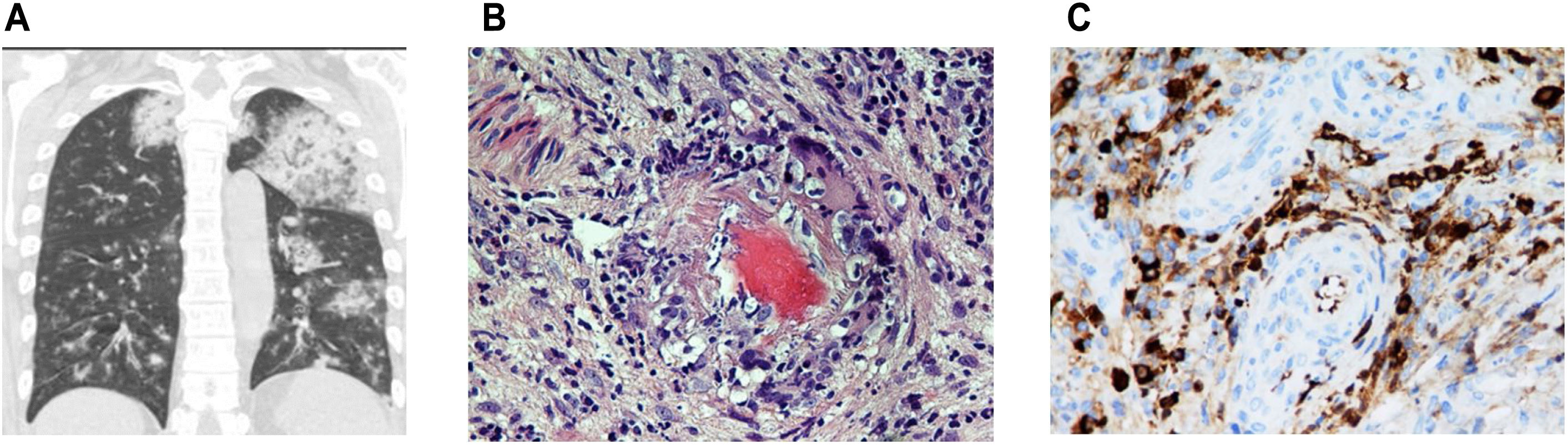
A. TAC torácico con cortes coronales con presencia de opacidades bilaterales asociadas con hemorragia alveolar. Modificada. B. Biopsia nasal con afectación de la pared vascular con presencia de vasculitis. C. Tinción inmunohistoquímica específica positiva para IgG4 (25 células plasmáticas IgG4 + por campo de gran aumento) junto al infiltrado linfoplasmocítico e histiocitos. Presencia de congestión vascular.
La fibrobroncoscopia reveló sangrado activo en árbol bronquial izquierdo y el lavado broncoalveolar con más de 15% de hemosiderófagos. El test de DLCO: 120% KCO: 154%, estaba elevado.
La autoinmunidad, positiva para p-ANCA (Anti- MPO: 33UI/mL), y negativas para ANAs, ENAs, C3: 83mg/dL, C4: 30mg/dL, AMA, AML, anti- MBG y crioglobulinas. La IgG: 934mg/dL y la IgG4: 38mg/dL séricas normales.
La biopsia nasal (cornete inferior y medio) mostró dos estructuras vasculares de calibre medio con paredes ocupadas por polimorfonucleares neutrófilos, mostrando degeneración fibrinoide, compatible con el diagnóstico de vasculitis leucocitoclástica (fig. 1b). La tinción inmunohistoquímica específica fue positiva para IgG4 (25 células plasmáticas IgG4+por campo de gran aumento) junto al infiltrado linfoplasmocítico y la congestión vascular (fig. 1c). El paciente fue diagnosticado de vasculitis tipo PAM microscópica con p-ANCA, hemorragia alveolar y fallo renal agudo, así como enfermedad por IgG4 (ER-IgG4).
El tratamiento con ciclofosfamida, prednisona: 70mg/kg/día, plasmaféresis (alterna) y hemodiálisis, tuvo evolución satisfactoria, sin recidivas de hemorragia alveolar, con negativización de p-ANCA. El deterioro de la función renal obligó a mantener la hemodiálisis. A los cuatro años del diagnóstico, recibió un trasplante renal con evolución favorable al año.
DiscusiónEl síndrome de asociación (VAA- ER-IgG4) es una nueva entidad reconocida en 20171. Estos hallazgos son conocidos desde 2011 en pacientes con nefritis túbulointersticial con ER-IgG4 y vasculitis2.
El estudio de Danlos F-X et al.1 incluyó a 18 pacientes de edad media de 55 años, con VAA y ER-IgG4, según criterios de Chapel Hill 20133, y según los criterios internacionales de CDC para ER-IgG4 (posible, probable y definitiva)2. En el 72% el diagnóstico fue concomitante; un 17% la VAA precedió a la ER-IgG4 y en el 11% la ER-IgG4 precedió a la VAA. El diagnóstico de ER-IgG4 se estableció en un 28% definitivo, probable en un 28% y posible en un 44%1,2.
El recambio plasmático más glucocorticoides fue cuestionado en el estudio PEXIVAS4, por escasa efectividad en reducir la mortalidad y en preservar la función renal. El consenso de la ACR 2021 para manejo de la VAA-ANCAS recomienda su uso si hay alto riesgo de insuficiencia renal severa. Rituximab puede ser un tratamiento de primera línea en ambas entidades5. Son deseables estudios multicéntricos para un mejor conocimiento y comprensión de esta nueva entidad.