A pesar de que las recomendaciones de las principales guías clínicas han restringido las indicaciones de los corticoides inhalados en la enfermedad pulmonar obstructiva crónica (EPOC), actualmente más del 80% de los pacientes están recibiendo este tratamiento en España, en su mayoría con dosis elevadas. Una revisión detallada de la literatura no justifica el uso de estas dosis elevadas, posicionamiento que está de acuerdo con las recomendaciones de la FDA. Una revaloración de su seguridad, la consistencia de los datos de eficacia, que muestran resultados similares con dosis moderadas, y una mejor selección de los pacientes exige un replanteamiento del uso de este tratamiento en el paciente con EPOC.
Despite the fact that the recommendations of the main clinical guidelines have restricted the indications for inhaled corticosteroids in chronic obstructive pulmonary disease (COPD), currently more than 80% of patients are receiving this treatment in Spain, mostly with high doses. A detailed review of the literature does not justify the use of these high doses, a position that agrees with the recommendations of the FDA. A re-evaluation of their safety, the consistency of the data on their efficacy showing similar results with moderate doses and a better patient selection require the use of this treatment in COPD patients to be reconsidered.
En la década de los noventa, la mayor parte de los estudios con corticoides inhalados (CI) presentaron resultados negativos en pacientes con enfermedad pulmonar obstructiva crónica (EPOC). Varios ensayos clínicos confirmaron que los CI no modificaban la caída de la función pulmonar y solo tenían un leve impacto sobre los síntomas1–3. Estos hallazgos sustentaron el concepto de que la EPOC es una enfermedad resistente a los corticoides, con una visión negativa a la hora de recomendarlos en el tratamiento. Sin embargo, en el año 2000, aunque su uso no estaba incluido en las principales guías clínicas, en España el 54% de los pacientes con EPOC leve y el 63,4% de los pacientes graves atendidos por neumología estaban recibiendo CI para su enfermedad4.
La publicación del estudio ISOLDE en 2000 produjo varios cambios relevantes5: a) por primera vez se planteaba que podíamos mejorar a los pacientes con EPOC con fármacos antiinflamatorios, aunque estos no presenten características asmáticas; b) se empezaron a valorar aspectos importantes en el tratamiento, que iban más allá de una mejoría en el FEV1 (exacerbaciones, calidad de vida, etc.); c) los CI podían incidir favorablemente en el curso clínico del paciente aunque no se modificara la pérdida acelerada de función pulmonar. En aquel momento se consideraba que la inflamación de la EPOC era relativamente resistente a los CI, por lo que se planteó el uso de dosis elevadas. Las dosis utilizadas en el estudio ISOLDE (500mcg de fluticasona cada 12h) han permanecido durante la pasada década, en Europa, como el estándar en pacientes con EPOC.
A pesar de las recomendaciones restrictivas de las principales guías clínicas publicadas en 20016,7, en 2005 el 71% de los pacientes estaban recibiendo CI8, en su gran mayoría con dosis elevadas de 500mcg de fluticasona cada 12h. En 2008, el porcentaje de pacientes tratados con CI en España superaba ampliamente el 80%9. Gran parte de este gran uso de altas dosis de CI se basa en estudios con resultados positivos sobre exacerbaciones y calidad de vida, pero también en las expectativas que se generaron en la década pasada sobre una modificación del riesgo cardiovascular y una posible reducción de la mortalidad, expectativas basadas en estudios observacionales, con importantes limitaciones metodológicas, que no se han visto confirmadas posteriormente en estudios controlados10,11. Estas expectativas se vieron amplificadas por una atractiva hipótesis que asociaba inflamación pulmonar y sistémica, hipótesis que tampoco se ha visto confirmada12,13.
El objetivo de esta revisión es analizar la evidencia científica en la que se basa el uso actual de altas dosis de CI en la EPOC y establecer si este tratamiento debe ser revalorado en nuestra estrategia terapéutica. Se considerarán dosis elevadas 500mcg de fluticasona cada 12h, dosis moderadas 250mcg de fluticasona o 320mcg de budesonida cada 12h, y dosis bajas por debajo de estos valores. Esta clasificación es válida para otros CI cuando se ajustan a dosis equipotentes.
¿Ficha técnica o mejor evidencia disponible?No siempre la dosis recogida en la ficha técnica de un producto es la más adecuada para el paciente. Las recomendaciones de las fichas técnicas se basan en estudios realizados específicamente para el registro de un fármaco, que posteriormente las agencias reguladoras toman como referencia para establecer la indicación en su área de referencia; sin embargo, la historia de un fármaco no acaba en el registro. Lo habitual es que paralelamente o después de este registro se siga aportando información que puede hacer recomendable replantear una determinada indicación. Diversos aspectos administrativos y la falta de coordinación que ha existido en los años previos entre las dos principales agencias reguladoras (EMEA y FDA) han dificultado la incorporación de esta nueva información en las recomendaciones de la ficha técnica. Esta forma de trabajo, poco coordinada de las agencias reguladoras, a veces genera situaciones que no siempre son fáciles de entender por el clínico14.
En Estados Unidos, la dosis aprobada de salmeterol-fluticasona para el tratamiento de la EPOC es de 50/250mcg cada 12h, basada inicialmente en 2 estudios de 6 meses de duración (SFCA 3006 y SFCA 3007), que fueron realizados fundamentalmente en pacientes con bronquitis crónica15. De los pacientes incluidos, el 54% tenían prueba broncodilatadora positiva (>12% y 200ml). En estos estudios, la dosis de 50/500mcg no proporcionó ventajas adicionales, de modo que la FDA no la recomendó para su uso en pacientes con EPOC. Estudios posteriores con 250 y 500mcg de fluticasona (SCO 30003, SFCB 3024, SCO 40043 y SCO 100250)10,15–17 permitieron extender la indicación a pacientes con bronquitis crónica y enfisema, ya que en estos estudios se incluían ambos grupos. De nuevo, los resultados fueron concluyentes, de modo que la dosis de 50/500mcg no proporcionó ningún beneficio adicional sobre 50/250mcg, ni en la función pulmonar ni en las exacerbaciones. La situación actual es que en Estados Unidos no está autorizado el uso de 500mcg de fluticasona para el tratamiento de la EPOC, basado en estudios comparativos con 250mcg.
En 2009, la FDA también aprobó budesonida-formoterol 160/4,5mcg cada 12h para el tratamiento de la obstrucción, tanto en pacientes con predominio de bronquitis crónica como de enfisema. Esta aprobación se basó en los resultados de dos estudios pivotales con 6 meses18 y 12 meses19 de seguimiento. En ambos, se evalúo la eficacia de budesonida-formoterol en el tratamiento de mantenimiento de la obstrucción al flujo aéreo, incluyendo un total de 3.668 pacientes con EPOC. El FEV1 prebroncodilatador medio al inicio del estudio fue del 34% del teórico. Los pacientes que recibieron budesonida-formoterol 320/9mcg, dos veces al día, tuvieron mejores resultados que los otros grupos de tratamiento en las 2 variables principales (FEV1 predosis y posdosis), por lo que es la dosis aprobada por la FDA. Sin embargo, una visión global sobre función pulmonar, exacerbaciones y calidad de vida no mostró ventajas relevantes sobre 160/9mcg.
En Europa, la dosis autorizada y recomendada de fluticasona para el tratamiento de la EPOC es de 500mcg cada 12h, dado que los estudios de registro se realizaron con esta dosis, aunque sin que se hayan valorado en estudios comparativos las ventajas e inconvenientes frente a dosis más moderadas, como 250mcg. También en Europa, la EMEA ha autorizado, para el tratamiento de la EPOC, formoterol asociado a 320mcg de budesonida. Esta dosis, en el rango moderado, equivale a aproximadamente la mitad de 500mcg de fluticasona. Frente al posicionamiento de la FDA, que solo acepta como adecuadas las dosis moderadas, tanto para fluticasona como para budesonida, la EMEA asume como buenas, con una evidente incongruencia clínica, dosis moderadas para budesonida y dosis elevadas para fluticasona, ignorando los estudios con 250mcg de fluticasona evaluados por la FDA. Frente a una política de transparencia de la FDA, la EMEA apenas aporta información sobre los criterios en los que basa sus decisiones, por lo que no siempre es posible evaluarlas correctamente, sobre todo en una primera fase en la que no todos los datos están publicados. Afortunadamente, este no es el caso para los CI, por lo que el clínico tiene información suficiente para decidir si es correcta la decisión de esta agencia de mantener dosis elevadas de fluticasona como tratamiento estándar en el paciente con EPOC15,20.
¿A quién tratar con corticoides inhalados?El mensaje más extendido es que los CI, asociados a agonistas β2-adrenérgicos de acción prolongada (LABA), tienen efectos beneficiosos sobre los síntomas respiratorios, la calidad de vida y las exacerbaciones, especialmente en pacientes con EPOC moderada y grave. Su posicionamiento actual en pacientes con un determinado valor de FEV1 asume que todos los pacientes con EPOC son similares si se ajustan por los valores del FEV1. Afortunadamente este es un concepto ya superado. Incluso en el estudio ISOLDE, cuando los pacientes se seleccionaron por el valor del FEV1, un porcentaje no despreciable con valores por encima del 50% también tenían historia de exacerbaciones frecuentes, hallazgo recientemente confirmado en el estudio ECLIPSE21. Actualmente, una historia de exacerbaciones frecuentes es el principal criterio para establecer la indicación de CI en la EPOC; ¿estos pacientes no son merecedores de un tratamiento que mejore sus síntomas o que reduzca sus exacerbaciones solo porque su FEV1 esté por encima del 50%? Resulta evidente que el FEV1 nos ayuda a tener una visión general de una población, pero no es un criterio válido para establecer este tratamiento en la práctica clínica en un determinado paciente.
La EPOC es un trastorno heterogéneo con diferentes perfiles clínicos, que frecuentemente se asocian a diferentes sustratos patogénicos22,23. Desde un punto de vista teórico, los pacientes que más se pueden beneficiar del tratamiento con CI son los que presentan alguna característica común con el asma24,25, es decir, que presentan una reversibilidad relevante (no solo una única prueba broncodilatadora con un incremento en el FEV1 del 12% o de 200ml), eosinofilia en esputo o concentraciones elevadas de óxido nítrico en aire exhalado26. Los estudios con roflumilast nos han enseñado que cuando existe un efecto favorable de un fármaco en una determinada población, si agregamos pacientes en los que el fármaco no es eficaz, también es posible observar un efecto beneficioso global. El resultado será algo más pobre, pero en muchos casos es posible alcanzar la significación estadística aumentando el tamaño de la muestra. El resultado, aunque menos llamativo, permite ampliar la indicación a mayores poblaciones, con un beneficio comercial muy relevante. Dado que el efecto queda diluido al mezclar diferentes pacientes, se habla de resistencia y la respuesta suele ser aumentar la dosis. Si analizamos la suma de los estudios 111 y 112 con roflumilast es posible ver de una forma clara este efecto27,28.
Estos estudios también nos demuestran que la solución no pasa por aumentar la dosis sino por identificar la población que más se puede beneficiar del tratamiento, aunque esto, desde el punto de vista comercial, suponga una pérdida parcial de mercado y no asistamos como en años previos a los denominados «blockbuster». En estos casos, la eficacia no se mejora aumentando la dosis sino identificando al paciente que más se va a beneficiar del tratamiento. El resultado es que recibirán CI aquellos pacientes que realmente se benefician del tratamiento y no será necesario dar dosis inapropiadas para vencer una teórica resistencia, que puede ser solo el efecto estadístico de mezclar poblaciones, en algunas de las cuales el balance riesgo/beneficio puede no ser favorable29.
Estudios recientes indican que la aproximación realizada con roflumilast también puede ser válida para los CI, por lo que aunque en esta revisión se valora el uso de dosis elevadas de CI (500mcg de fluticasona dos veces al día) frente a dosis moderadas (250mcg de fluticasona o 320mcg de budesonida dos veces al día), posiblemente una mejor evaluación de los pacientes pueda apoyar el uso de dosis aun inferiores en poblaciones concretas, sin pérdida de eficacia19,30. Por otro lado, los datos actualmente disponibles indican que si hablamos de resistencia en términos básicos, esta resistencia ocurre en cualquier estadio de la enfermedad31, por lo que la selección por valores del FEV1 no parece justificada.
¿Cuál es la dosis más adecuada en términos de eficacia?La identificación de la dosis más adecuada en el paciente susceptible de mejorar con CI debería ser una línea de investigación prioritaria en la EPOC, ya que el perfil de seguridad está relacionado en gran medida con la dosis empleada. ¿De qué datos disponemos actualmente para optimizar este tratamiento en nuestros pacientes?
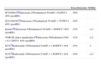
Sin et al.32 analizaron el impacto de varias dosis de CI en la mortalidad por EPOC con los datos obtenidos al alta tras una hospitalización. Estos autores observaron que los pacientes con dosis moderadas o altas presentaron una reducción del 25% en el riesgo de mortalidad por cualquier causa, y este riesgo era menor que cuando se prescribieron dosis más bajas. Aparentemente este estudio apoya el uso de dosis altas; sin embargo, presenta importantes limitaciones, ya que no se diferenciaba entre dosis moderadas y altas y se usaron bases de datos sin confirmación espirométrica del diagnóstico. Además, el efecto favorable sobre mortalidad descrito en estudios observacionales como el de Sin no se han confirmado en estudios controlados. De hecho, en el estudio TORCH, dosis de 500mcg de fluticasona cada 12h se asociaron a un incremento (no significativo) del 6% en la mortalidad. Los datos de este estudio desaconsejan el uso de CI en monoterapia. Afortunadamente también existe suficiente información de la eficacia de los CI asociados a un broncodilatador. De forma consistente, dosis de 500mcg de fluticasona cada 12h no han aportado ninguna ventaja en términos de eficacia (función pulmonar, calidad de vida y exacerbaciones) frente a dosis más reducidas, tanto en monoterapia frente a placebo (tabla 1) como frente a un LABA (tabla 2).
Resultados de los principales ensayos clínicos con CI asociados a LABA. Eficacia sobre exacerbaciones, calidad de vida y función pulmonar frente a placebo
| Exacerbaciones | SGRQ | FEV1 | |
| Szafransky59Budesonida 320/formoterol 9 bidN=812FEV1 36% (preBD) | –24% | –3,9% | +144ml |
| Calverley60Budesonida 320/formoterol 9 bidN=1.022FEV1 36% (preBD) | –23% | –7,5 | +137ml |
| Tristan61Fluticasona 500/salmeterol 50 bidN=1.465FEV1 44% (preBD) | –25% | –2,2 | +133ml |
| TORCH (datos anualizados)10Fluticasona 500/salmeterol 50 bidN=6.112FEV1 44% (postBD) | –25% | –3,1 | +92ml |
| SUN19Budesonida 320/formoterol 9 bidN=1.964FEV1 39% (postBD) | –37% | –2,4 | +140ml |
| SUN19Budesonida 160/formoterol 9 bidN=1.964FEV1 39% (postBD) | –41% | –3,8 | +110ml |
bid: cada 12 horas; postBD: postbroncodilatador; preBD: prebroncodilatador; SGRQ: Cuestionario Respiratorio St. George.
Resultados de los principales ensayos clínicos con CI asociados a LABA. Eficacia sobre exacerbaciones y calidad de vida frente a LABA
| Exacerbaciones | SGRQ | |
| SCO4004316Fluticasona 250/salmeterol 50 bidN=782FEV1 40% (postBD) | –30% | |
| SCO10025017Fluticasona 250/salmeterol 50 bidN=797FEV1 40% (postBD) | –30% | |
| Kardos62Fluticasona 500/salmeterol 50 bidN=994FEV1 40% (postBD) | –35% | –2,3 |
| TORCH (datos anualizados)10Fluticasona 500/salmeterol 50N=6.112FEV1 44% (postBD) | –12% | –2,2 |
| SUN19Budesonida 320/formoterol 9 bidN=1.964FEV1 44% (postBD) | –25% | –1 |
| SUN19Budesonida 160/formoterol 9 bidN=1.964FEV1 44% (postBD) | –29% | –2,4 |
bid: cada 12 horas; postBD: postbroncodilatador; preBD: prebroncodilatador; SGRQ: Cuestionario Respiratorio St. George.
Otro argumento que ha posicionado los CI en el paciente con EPOC es su posible beneficio adicional sobre comorbilidades cardiovasculares33,34. En una reciente revisión sistemática realizada por Loke et al.11 sobre 23 ensayos clínicos de alta calidad, concluyen que los CI no inciden favorablemente en la reducción de infarto de miocardio (RR=0,95; p=0,68) ni en la muerte por causa cardiovascular (RR=1,02; p=0,89). Como ha sucedido con la mortalidad global por cualquier causa, estos estudios, con mayor rigor científico, no han confirmado los resultados favorables obtenidos de estudios observacionales o de análisis post hoc, que tanto ayudaron a posicionar el uso de los CI en la práctica clínica. En el momento actual, no solo disponemos de datos con mayor nivel de evidencia sobre la ausencia de un efecto favorable sobre el riesgo cardiovascular o sobre la inflamación sistémica, sino que el propio concepto de inflamación sistémica en la EPOC debe revalorarse, dado que solo un pequeño porcentaje de pacientes presentan marcadores inflamatorios elevados de forma mantenida y algunos de los marcadores que más se han asociado a la enfermedad cardiovascular (proteínaC reactiva) pueden estar relacionados, no con la inflamación pulmonar, sino con factores colaterales que se observan en algunos pacientes con EPOC (obesidad, nivel de actividad física, etc.), que difícilmente van a mejorar con altas dosis de CI35,36.
¿Importa la seguridad cuando usamos corticoides inhalados?Los CI pueden producir diversos efectos locales. Un reciente metaanálisis ha confirmado que todos los efectos secundarios locales aumentan con las dosis más elevadas37. Además, es sobradamente conocido que altas dosis de CI tienen efectos sistémicos debido a su absorción pulmonar38. Una de las principales estrategias para evitar estos efectos adversos a largo plazo es utilizar la menor dosis que consiga el mejor control posible del paciente. ¿Estamos actuando así en la EPOC?
En España, la edad media de los pacientes con EPOC vistos en consultas externas o en hospitalización oscila alrededor de los 70 años8,9,39. Los pacientes de edad avanzada son especialmente susceptibles a los efectos adversos de los CI, aunque para que puedan detectarse en la clínica algunos puedan requerir periodos prolongados de exposición al fármaco, más allá del tiempo de seguimiento de la mayoría de los ensayos clínicos. Las dosis de 1.000mcg de fluticasona al día se han asociado con efectos sistémicos significativos como neumonía, glaucoma, cataratas, diabetes, supresión adrenal y pérdida de densidad ósea40.
Riesgo de fracturasEn un reciente metaanálisis, el uso prolongado de CI se asoció con un incremento significativo en el riesgo de fracturas, tanto en los estudios controlados como en los estudios observacionales, en los que este riesgo aumentó un 9% por cada incremento de dosis equivalentes a 500μg de beclometasona41. Aunque este incremento dependiente de la dosis en el riesgo de fracturas se observa en pacientes mayores sin EPOC42, en pacientes con EPOC el riesgo es aún mayor, ya que la propia enfermedad se asocia con osteoporosis, y el tabaquismo, la reducción en la actividad física y aspectos nutricionales son factores de riesgo adicionales43,44. La corrección de estos factores de riesgo y evitar dosis elevadas de CI son las principales medidas para evitar esta complicación45.
DiabetesEl uso de CI se asocia con un incremento en el riesgo de desarrollar diabetes y de progresión del proceso cuando está establecido. Este riesgo es más acentuado con las dosis elevadas. Aunque en la mayor parte de los ensayos controlados en EPOC no se describe una elevación en el riesgo de diabetes asociada al uso de CI, estos estudios carecen de poder estadístico para detectarlo. Recientemente Suissa et al.46 han realizado un estudio poblacional de cohortes para evaluar el impacto del uso de CI y de la dosis en el desarrollo de diabetes, y si su uso condiciona el inicio de insulina en pacientes ya diagnosticados de diabetes tipo 2. Tras ajustar para diferentes covariables, el uso de CI se asoció con un incremento significativo del 34% en la tasa de diabetes (RR=1,34, IC95%=1,29-1,39). También se confirmó una clara relación con la dosis, siendo mayor este efecto cuando se utilizaban dosis equivalentes a 1.000mcg de fluticasona (RR=1,64; IC95%=1,52-1,76). El porcentaje fue similar en la primera prescripción de insulina para los pacientes que tomaban antidiabéticos orales (RR=1,34: IC95%=1,17-1,53). Como comentan los autores, con una incidencia de diabetes de 14,2/1.000/año en su cohorte de EPOC-asma, los ensayos clínicos publicados hasta la fecha, incluido el estudio TORCH, carecen de potencia estadística para detectar este efecto.
CataratasLos pacientes de edad avanzada tratados con CI son especialmente susceptibles. En esta población, incluso dosis reducidas de CI se han asociado con un mayor riesgo de cataratas. Un estudio realizado en Quebec47 confirmó este efecto secundario con el uso de CI, pero lo más destacable es que aunque este efecto ya se observa con dosis bajas, se eleva de forma considerable con dosis más elevadas, de manera que este riesgo aumenta un 19% por cada 1.000mcg/día de beclometasona o una dosis equipotente de otro CI. Estos mismos autores observaron que cuando se evaluaban los pacientes remitidos para cirugía de cataratas, este riesgo era 3 veces superior en los que habían sido tratados con dosis elevadas de CI durante más de 2 años. Esta asociación entre dosis elevadas de CI y un mayor riesgo de cataratas se ha confirmado de forma consistente en otras series, especialmente cuando se analizan poblaciones de edad avanzada y cuando se evalúan tiempos prolongados de exposición al fármaco, perfil característico del paciente con EPOC38,48–50.
GlaucomaTambién en la esfera oftalmológica, el mayor riesgo de glaucoma se detecta especialmente en los que utilizan dosis elevadas51. Sin embargo, en una larga cohorte de pacientes de edad avanzada no se confirmó que el uso de dosis altas de CI aumentara el riesgo de glaucoma. Sin embargo, este tema sigue siendo controvertido, ya que los mismos autores previamente publicaron resultados opuestos52,53.
Supresión suprarrenalPosiblemente sea uno de los mejores marcadores de los efectos sistémicos de los CI, aunque su trascendencia clínica a corto plazo sea poco importante. La presencia de niveles bajos de cortisol endógeno habitualmente no es clínicamente relevante, ya que se compensa con el corticoide exógeno. Tras la administración de 250 y 500mcg de fluticasona, dos veces al día, los niveles de cortisol sérico fueron un 10 y un 21% menores, respectivamente, que en el grupo placebo, indicando un incremento de los efectos sistémicos con dosis elevadas. Si tuviéramos que equiparar el efecto de los CI al observado con los corticoides sistémicos, dosis de fluticasona de 0,44-1,76mcg/día originan efectos similares sobre el cortisol sérico que 5-20mg/día de prednisona. La equivalencia relativa calculada entre fluticasona y prednisona sería de 8,5:1. De este modo podemos extrapolar que aproximadamente 1.000mcg de fluticasona equivaldrían a 8,5mg de prednisona al día en términos de actividad sistémica54.
Neumonías y seguridad a 3 años en el estudio TORCHEl estudio TORCH (SCO30003) objetivó un incremento de neumonías en los dos grupos tratados con fluticasona. Al margen de las múltiples discusiones que ha generado este hallazgo, ya que no se exigió confirmación radiológica, los resultados generaron una alerta sobre la seguridad y la necesidad de usar dosis elevadas de CI. Posteriormente, en el análisis combinado de los estudios SCO40043 y SCO100250 (50/250mcg de salmeterol/fluticasona frente a 50mcg de salmeterol) también se confirmó un mayor riesgo de neumonías (8,1 vs. 4,3%) que en el grupo tratado solo con salmeterol. Estos resultados son similares a los observados en el estudio TORCH si se ajusta por tiempo de exposición. Sin embargo, un reciente metaanálisis no ha objetivado una mayor incidencia de neumonías con budesonida, por lo que, en aspectos de seguridad, es importante la dosis, pero también puede haber efectos relacionados con el tipo de molécula55.
Algunos mensajes procedentes de estudio TORCH han transmitido que existe una elevada seguridad con el uso de altas dosis de CI; sin embargo, esta interpretación puede no ser correcta. Aunque no se demostró estadísticamente que la mayor incidencia de neumonías se asociara con un incremento de la mortalidad, el estudio no estaba diseñado para responder esta cuestión y carece de potencia estadística para poder sacar conclusiones. Evidentemente, una neumonía en un paciente con EPOC genera un impacto negativo en el curso evolutivo, independientemente de que posteriormente evolucione mejor o peor con el uso concomitante de CI56,57. En un estudio reciente realizado en España, la EPOC fue un factor de riesgo independiente en pacientes con neumonía adquirida en la comunidad58.
Los pacientes con EPOC moderada-grave presentan varios factores de riesgo que predisponen a la osteoporosis. En el estudio TORCH, los pacientes con menor densidad mineral ósea (DMO) se retiraron más precozmente que aquellos con DMO normal, por lo que la información que se aporta en este estudio es poco valorable. Aunque también se hizo un examen oftalmológico (cataratas y glaucoma) y se midió cortisol urinario en un subgrupo de pacientes, el nivel de información es limitado. No se pueden obtener conclusiones válidas sobre seguridad en la aparición de cataratas, dada la elevada incidencia de cataratas al inicio del estudio (hay que destacar que antes de ser incluidos en el ensayo muchos pacientes ya estaban recibiendo altas dosis de CI). Otras posibles complicaciones, o no se analizaron, o la información fue inadecuada para poder extraer conclusiones46.
ConclusiónAlgunos autores postulan que el hecho de que en la mayor parte de los países europeos más del 70% de los pacientes con EPOC estén siendo tratados con dosis elevadas de CI es el resultado de ciertas campañas de marketing, a pesar de que existe una evidencia cada vez más consistente de que las dosis elevadas recomendadas actualmente en Europa no son las más adecuadas22. Agencias oficiales como la EMEA promueven el uso de dosis elevadas, a pesar de que esta misma agencia posiciona al mismo nivel dosis moderadas de budesonida. Esta situación incongruente y la falta de coordinación con otras agencias como la FDA no ayudan a reducir el nivel de confusión. Al margen de este posicionamiento, la evidencia disponible no permite demostrar ningún beneficio adicional con el uso de dosis elevadas y sí es posible demostrar una mayor incidencia de efectos secundarios, no fácilmente evaluables por el clínico. Estos efectos adversos pueden ser especialmente graves cuando se usan de forma muy prolongada en pacientes con edad avanzada y enfermedades asociadas, rasgos característicos de los pacientes con EPOC.
Conflicto de interesesEl Dr. J.L. Izquierdo declara haber recibido honorarios de Almirall, AstraZéneca, Bayer, Boehringer Ingelheim, Chiesi, Faes, Ferrer, GSK, Novartis, Nycomed y Pfizer por conferencias y asesoría.