El trasplante pulmonar es actualmente una terapia consolidada para pacientes con insuficiencia respiratoria terminal en los que se han agotado todas las alternativas terapéuticas y tienen un expectativa de vida limitada.
Una de las variantes del trasplante pulmonar, el trasplante lobar, supone la utilización de lóbulos pulmonares en lugar del injerto completo. El objetivo es adecuar el tamaño del donante al de la cavidad torácica del receptor. De este modo, es posible trasplantar a pacientes con cavidades pleurales con una restricción severa, bien por su enfermedad de base o bien porque son pacientes pediátricos, sin que esta situación particular suponga un tiempo en lista de espera significativamente más largo hasta encontrar un donante del tamaño adecuado. Varios grupos han publicado su experiencia en trasplantes lobares con aceptables resultados1,2.
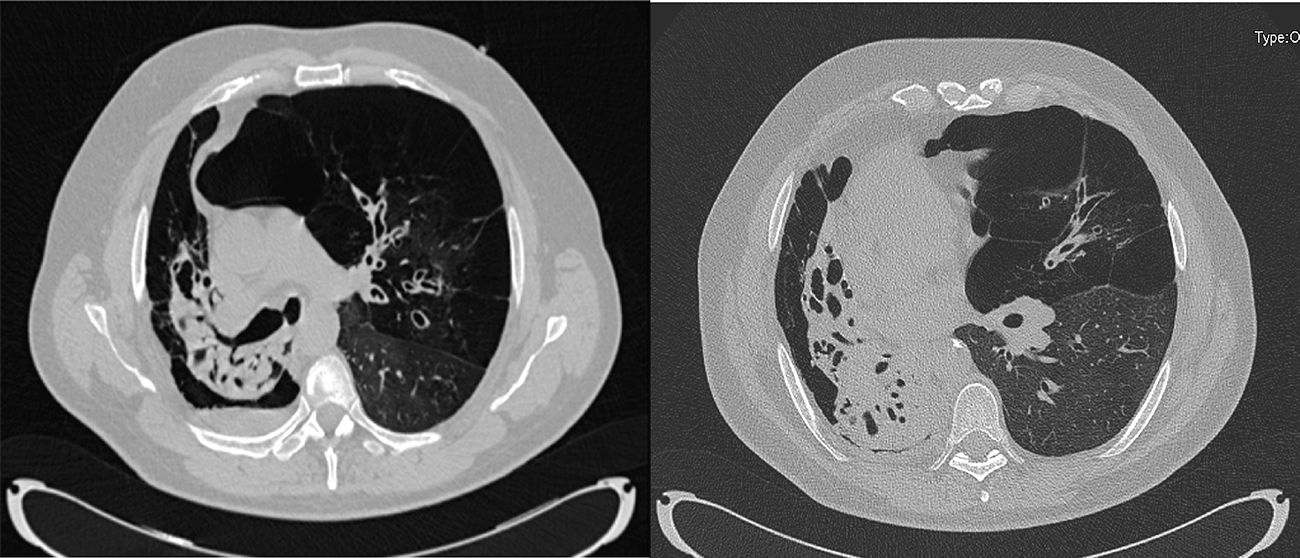
Presentamos el caso de un paciente de 54 años diagnosticado de EPOC asociada a una destrucción parenquimatosa del pulmón derecho, en especial del lóbulo inferior derecho, por bronquiectasias (fig. 1). De hecho, la gammagrafía de perfusión pulmonar determinaba una perfusión del 6,5% para el lado derecho y de un 93,5% para el izquierdo. La restricción de la cavidad derecha tan importante obligó a plantear un trasplante bilobar (lóbulo medio y lóbulo inferior) en el lado derecho a través de una toracotomía posterolateral, seguido de un trasplante unipulmonar izquierdo en ECMO (extracorporeal membrane oxigenation, en sus siglas en inglés) central y en decúbito supino. El abordaje poco usual para el lado derecho y el modo de proteger el injerto lobar recién implantado son los 2detalles técnicos que hacen interesante el caso.
Cortes de TAC en los que se aprecia un colapso del pulmón derecho a expensas de la presencia de múltiples bronquiectasias, tan solo quedan aireadas las áreas de pulmón enfisematoso, con cambios bullosos. También se visualiza pequeño nivel hidroaéreo sugestivo de sobreinfección en los cambios bullosos descritos. Se objetiva, además, una importante hiperinsuflación del pulmón izquierdo con extensas áreas de enfisema panacinar en el lóbulo superior. Dicha hiperinsuflación, sumada al colapso del pulmón derecho, provoca un importante desplazamiento del mediastino hacia el lado contralateral.
En cuanto a los volúmenes pulmonares, el receptor tenía una capacidad pulmonar total predicha de 6,8 y real de 6,5 L. El donante tenía 60 años, una relación PaO2/FiO2 de 436, radiografía de tórax y fibrobroncoscopia normales, y una capacidad pulmonar total de 6,7 L.
El receptor se posicionó inicialmente en decúbito lateral izquierdo y se realizó una toracotomía posterolateral derecha. Tras despegar y coagular las abundantes adherencias del pulmón, sobre todo el lóbulo inferior derecho destruido por las bronquiectasias se llevó a cabo la neumonectomía derecha. El hilio pulmonar se preparó de manera convencional, abriendo el pericardio alrededor de la venas y arteria pulmonares, y cortando el bronquio a 2cartílagos de la carina traqueal. Mientras, se realizó la cirugía de banco sobre el injerto derecho preservando el lóbulo medio y el inferior. Con el objetivo de tener un parche de aurícula izquierda donante suficientemente grande, la vena pulmonar superior derecha se ligó en lugar de cortar la aurícula.
A pesar del infrecuente abordaje y del mayor tiempo empleado, el implante derecho se llevó a cabo sin incidencias. Tras ello, la arteria pulmonar se aisló y rodeó doblemente con un torniquete, manteniéndola cerrada con la intención de proteger el injerto lobar recién trasplantado del flujo sanguíneo anterógrado. En esa situación, sin flujo arterial hacia el injerto y sin ventilación, se cerró la toracotomía posterolateral y se recolocó al paciente en decúbito supino. Se realizó una toracotomía submamaria bilateral con esternotomía transversa y se instauró una asistencia cardiorrespiratoria central de tipo ECMO. Después, se abrió el torniquete de la arteria pulmonar derecha, lo que permitió la reperfusión del injerto lobar y el inicio de su ventilación. Tras esta maniobra, se realizó el trasplante del pulmón izquierdo de la manera habitual. El tiempo de isquemia fría fue de 8 y 10 h para los injertos derecho e izquierdo, respectivamente.
Dada la correcta función del corazón del receptor, comprobada con ecocardiografía transesofágica intraoperatoria, y con el objetivo de proteger los injertos, se decidió cambiar el ECMO central a una configuración veno-venosa periférica, usando la vena femoral para la extracción de sangre y la vena yugular interna para infundir de nuevo la sangre una vez oxigenada por la asistencia.
Por la salida del quirófano con ECMO, sumada a que la primera radiografía postrasplante mostró edema bilateral, se catalogó el caso como disfunción precoz del injerto grado 33. Sin embargo, a los 6 días postrasplante, la relación PaO2/FiO2 mejoró notablemente y la radiografía de tórax era prácticamente normal. Se realizó una traqueostomía precoz al cuarto día postoperatorio y se consiguió destetar al paciente de cualquier tipo de asistencia ventilatoria al día 50. La estancia en la Unidad de Cuidados Posquirúrgicos y en el hospital fue de 54 y 122 días, respectivamente. Como otras complicaciones, el paciente tuvo una dehiscencia de los planos superficiales de las toracotomías submamarias, que se trató con una terapia de vacío. Además, desarrolló un episodio de rechazo agudo celular A1 e insuficiencia renal, ambas situaciones resueltas al alta.
En definitiva, el trasplante lobar es una opción válida para optimizar el uso de donantes y adecuar el tamaño para situaciones especiales, como son el trasplante pediátrico o las cavidades torácicas pequeñas, en las que los receptores no pueden esperar a que surja un donante del tamaño perfecto. No obstante, es importante considerar entre las opciones para proteger los injertos lobares alguna modalidad de asistencia cardiorrespiratoria en el intraoperatorio (circulación extracorpórea o ECMO) y en el postoperatorio (fundamentalmente con ECMO), si así lo requiere el paciente y en función de la política del grupo quirúrgico. En este caso particular, se combina un trasplante lobar con un abordaje poco frecuente, como es la toracotomía posterolateral. Por esta razón, y hasta poder instaurar el ECMO central, se decidió mantener el injerto lobar sin flujo y sin ventilación.
Otras estrategias alternativas para realizar este trasplante se tuvieron en cuenta, aunque fueron descartadas. Se desechó la posibilidad de una neumonectomía derecha, con la implantación única del pulmón izquierdo, debido a los problemas que podrían aparecer relacionados con la cicatrización del muñón bronquial y la cavidad de neumonectomía. La idea de realizar el trasplante instaurando previamente un ECMO veno-arterial periférico también se descartó para evitar salidas accidentales de las cánulas en los cambios de posición que se realizaron.
En conclusión, dado que el volumen pulmonar máximo que aceptaba la cavidad derecha del paciente era de 2lóbulos y que el mejor abordaje para este implante era la toracotomía posterolateral, consideramos que mantener el injerto bilobar sin flujo ni ventilación hasta instaurar la asistencia cardiorrespiratoria fue una estrategia válida.
Al Servicio de Neumología, Anestesiología y a la Coordinación de Trasplantes del Hospital Universitario Puerta de Hierro-Majadahonda.