La pandemia por SARS-CoV-2 es el mayor desafío sanitario en los últimos 100 años, ocasionando el mayor exceso de mortalidad no bélico en este período en el mundo occidental. Ante una enfermedad de elevada contagiosidad y asintomática en un tercio de los casos, es fundamental disponer de modelos que predigan su evolución. Pretendemos desarrollar un modelo de predicción de infección por COVID-19 en provincias españolas.
MétodoAnálisis de componentes principales funcional de datos epidemiológicos de las provincias españolas en función de su curva epidémica entre el 24 de febrero y el 8 de junio. Con este método se han clasificado las provincias en función de su evolución (peor, intermedia y mejor). Se han empleado los datos del Centro Nacional de Epidemiología.
ResultadosSe identificaron 2 componentes que explican el 99% de la variabilidad de las 52 curvas. La primera componente es la tendencia global de la tasa de incidencia, y la segunda componente es la velocidad de crecimiento o decrecimiento de la incidencia durante el período. Se identificaron 10 provincias en el grupo de peor evolución y 17 en el de evolución intermedia. Los valores umbrales de la tasa de incidencia a 7 días fueron 134 casos/100.000 habitantes para un nivel de alerta 1 (medio) y 167 para el nivel 2 (alto), consiguiendo un elevado poder de discriminación entre provincias.
ConclusionesEstos niveles de alerta podrían ser de utilidad para decidir medidas que puedan afectar a la movilidad de la población, siempre y cuando haya una situación de transmisión comunitaria de SARS-CoV-2. Esta información sería intercomparable entre áreas sanitarias o comunidades autónomas.
The SARS-CoV-2 pandemic is the most important health challenge observed in 100 years, and since its emergence has generated the highest excess of non-war-related deaths in the western world. Since this disease is highly contagious and 33% of cases are asymptomatic, it is crucial to develop methods to predict its course. We developed a predictive model for Covid-19 infection in Spanish provinces.
MethodsWe applied main components analysis to epidemiological data for Spanish provinces obtained from the National Centre of Epidemiology, based on the epidemiological curve between 24 February and 8 June 2020. Using this method, we classified provinces according to their epidemiological progress (worst, intermediate, and good).
ResultsWe identified 2 components that explained 99% of variability in the 52 epidemiological curves. The first component can be interpreted as the crude incidence rate trend and the second component as the speed of increase or decrease in the incidence rate during the period analysed. We identified 10 provinces in the group with the worst progress and 17 in the intermediate group. The threshold values for the 7-day incidence rate for an alert 1 (intermediate) were 134 cases/100,000 inhabitants, and 167 for alert 2 (high), respectively, showing a high discriminative power between provinces.
ConclusionsThese alert levels might be useful for deciding which measures may affect population mobility and other public health decisions when considering community transmission of SARS-CoV-2 in a given geographical area. This information would also facilitate intercomparison between healthcare areas and Autonomous Communities.
La pandemia por SARS-CoV-2 ha ocasionado un alto impacto en la salud pública y en la economía a nivel mundial y su trascendencia futura probablemente marque una generación. El 11 de marzo de 2020 la OMS declara la enfermedad producida por el SARS-CoV-2 como pandemia1, mientras en los países europeos ya existía transmisión descontrolada del virus.
Tras un fallo colosal de los mecanismos de detección, alarma y control de la enfermedad, agudizado por la falta de pruebas diagnósticas, comenzó la transmisión comunitaria1 en la mayor parte de los países, lo que obligó a tomar medidas excepcionales de salud pública, como el confinamiento forzoso de la mayor parte de la población para cortar las cadenas de transmisión del SARS-CoV-2 2. En España, el confinamiento se aplicó a nivel nacional, pero con una situación epidemiológica muy desigual entre las provincias españolas3. En algunas provincias este confinamiento llegó tarde y no se pudo evitar el colapso del sistema sanitario4, mientras que, en otras, debido a la baja transmisión comunitaria, el SARS-CoV-2 causó un impacto en hospitalizaciones y fallecimientos mucho menor5. El confinamiento logró progresivamente el control de la enfermedad, pero también un indudable impacto económico6.
Disponer de umbrales epidemiológicos de fácil interpretación y que, con pocos datos, permitan predecir la evolución de la pandemia en áreas pequeñas (a nivel de provincia o incluso de áreas más pequeñas), podría permitir a las autoridades sanitarias actuar de forma más eficiente a través del establecimiento de medidas de salud pública más o menos drásticas ante aumentos de incidencia que conlleven transmisión comunitaria no controlada. Hay que destacar que estos umbrales reflejan múltiples características intrínsecas de un país y de una población, desde los comportamientos y contactos sociales hasta la propia estructura de la atención primaria y atención hospitalaria, por lo que umbrales epidemiológicos «de disparo» en un país concreto, no tienen necesariamente por qué ser aplicables en nuestro país. Por esta razón, desarrollar umbrales o niveles de alerta propios podría evitar que las autoridades sanitarias tomasen decisiones erróneas como, por un lado, confinamientos innecesarios (falso positivo) y, por otro, decidir no confinar cuando esta acción es necesaria (falso negativo).
El objetivo de este trabajo es clasificar las provincias españolas en función de la evolución de la pandemia de SARS-CoV-2 durante el período de febrero a junio de 2020 y proponer valores umbrales en las tasas de incidencia que indiquen diferentes niveles de alerta para la vigilancia epidemiológica, que pueden ser útiles para la toma de decisiones que afecten a la movilidad de la población u otras medidas.
MétodosFuentes de informaciónLa base de casos diarios de COVID-19 por provincias y ciudades autónomas (en adelante se denominan conjuntamente provincias) se descargó el 1 de julio de 2020 de la página web del Centro Nacional de Epidemiología (CNE) y contenía información desde el 31 de enero hasta el 28 de junio de 20203. Estos datos proceden de la encuesta epidemiológica de caso que cada comunidad autónoma (CA) cumplimenta ante la identificación de un caso de COVID-19 y que declaran a la Red Nacional de Vigilancia Epidemiológica (RENAVE) que gestiona el CNE. En la base se incluyen, para cada día y provincia: el número de casos totales (confirmados o probables); el número de casos con prueba de laboratorio PCR o técnicas moleculares; el número de casos con prueba de laboratorio de test rápido de anticuerpos; el número de casos con otras pruebas de laboratorio, mayoritariamente por detección de antígeno o técnica Elisa; y el número de casos sin información sobre la prueba de laboratorio. Para este trabajo se utilizó el número total de casos excluyendo los diagnosticados con test rápidos debido a su limitada fiabilidad con fines diagnósticos ya que no aportaban información sobre si la enfermedad estaba activa. La fecha de declaración de los casos es la de inicio de síntomas o, en su defecto, la fecha de diagnóstico menos 6 días.
Para el cálculo de las tasas se usaron las estimaciones de población residente a 1 de enero de 2020 del Instituto Nacional de Estadística7. Las tasas de incidencia a 7 días por fecha de diagnóstico y referidas al día 15 de marzo de 2020 se calcularon a partir de los datos publicados por provincia por el proyecto colaborativo EsCOVID19data8. Algunos datos que no estaban disponibles para esa fecha se completaron con la información publicada por las comunidades autónomas (CCAA) en su página web oficial. Las CCAA en las que se buscó información específica fueron: Andalucía, Aragón, Asturias, Cantabria, Castilla y León, Castilla-La Mancha, Cataluña y Comunidad Valenciana.
Las prevalencias de la primera ronda del estudio nacional de seroepidemiología de la infección por SARS-COV-2 en España (ENE-COVID19)9 se obtuvieron del informe preliminar del 13 de mayo de 2020. Estas prevalencias son necesarias para calcular la tasa de detección de COVID-19 para cada provincia.
Análisis estadísticoEl análisis estadístico de este trabajo comprende 2 procedimientos diferenciados, con datos distintos para cada uno de ellos. En primer lugar, se realizó una clasificación de las provincias españolas en función de la evolución de la pandemia en cada una de ellas, usando como datos la base de casos diarios de la RENAVE. En una segunda etapa, se utilizaron los grupos identificados para calcular puntos de corte en la tasa de incidencia a 7 días que tenían las provincias el día 15 de marzo de 2020; en este caso se consideró como fecha de referencia de los casos la de diagnóstico, y no la de inicio de síntomas, razón por la cual no se pudieron calcular las tasas a partir de la base de casos diarios de la RENAVE. A continuación, se describen con detalle los 2 procedimientos.
La clasificación de las provincias españolas en función de la evolución de la pandemia se realizó a partir de las 52 curvas de incidencia acumulada (casos por 100.000). Siguiendo el criterio del CNE, se consideró como fecha de inicio del análisis el primer día con incidencia acumulada de 5 casos COVID-19/100.000 habitantes en la CA a la que perteneciese cada provincia; el número de días de análisis (92) se calculó como el número de días transcurridos desde la primera fecha con casos (24 de febrero) hasta el 25 de mayo, cuando todas las CCAA estaban al menos en la Fase I de la desescalada. De este modo, la fecha de fin del período de estudio es igual o posterior al 25 de mayo para todas las provincias, y todas tienen el mismo número de días de análisis.
El método de clasificación utilizado comprende 2 pasos. En el primero se extrajeron las componentes principales de las 52 curvas de incidencia acumulada mediante un método funcional de reducción de la dimensión10–12. Cada componente es una combinación lineal de las 52 curvas, y el coeficiente de cada provincia en esa expresión es la coordenada de la provincia asociada a la componente. De este modo, se simplifica o reduce la información de las provincias, que pasa de ser una curva o variable funcional (es decir, una función en el tiempo) a un número pequeño k de coordenadas o, dicho de otra forma, variables unidimensionales.
A partir de los datos de cada provincia se realizó una clasificación en 3 grupos (peor evolución, evolución intermedia y mejor evolución) mediante un análisis clúster de medianas con distancia euclídea13.
A continuación, se calculó para cada provincia la tasa de incidencia a 7 días en el día de declaración del estado de alarma (15-03-2020). Teniendo en cuenta el infradiagnóstico de casos en la primera ola de la pandemia, la tasa de cada provincia se corrigió dividiéndola entre la tasa de detección estimada para su CA desde el inicio de la pandemia hasta el 11 de mayo (factor de corrección=1/tasa de detección). La tasa de detección de una CA se estimó como el cociente entre el número de casos diagnosticados hasta el 11 de mayo (informe n.o 103 del Ministerio de Sanidad)14 y el número de casos estimados a partir de las prevalencias de infección por SARS-CoV-2 en la primera ronda del estudio ENE-COVID19, que terminó el día 11 de mayo9.
Las tasas de incidencia provinciales corregidas a 7 días se utilizaron para determinar, mediante la metodología de las curvas ROC, un punto de corte o valor umbral en las tasas que identifique a las provincias de peor evolución de la pandemia (nivel de alerta 2) y a las de evolución intermedia (nivel de alerta 1). El criterio para el cálculo del punto de corte de la curva ROC fue maximizar el índice de Youden (sensibilidad+especificidad-1). Si la sensibilidad es máxima se minimiza la tasa de falsos negativos, es decir, el porcentaje de provincias con una tasa por debajo del umbral y que realmente tuvieron mala evolución; de igual modo, si la especificidad es máxima se minimiza la tasa de falsos positivos, que en este caso sería el porcentaje de provincias con una tasa por encima del umbral pero que no tuvieron mala evolución. Además, se calcularon medidas de precisión asociadas a los puntos de corte: sensibilidad, especificidad y valores predictivos positivo y negativo, con intervalos de confianza del 95% (IC95%). También se presenta el área bajo la curva ROC con su IC95%. El análisis se realizó con Stata v14.2 y con R (paquetes fda.usc y cluster).
ResultadosEntre el 31 de enero y el 28 de junio de 2020 se notificaron de forma individual a la RENAVE, en función de la fecha de inicio de síntomas, 269.976 casos totales de COVID-19, de los que 20.670 (7,7%) fueron diagnosticados con pruebas rápidas y se descartaron para este análisis. Los 249.306 casos restantes suponen una incidencia acumulada de 526,74 casos por 100.000 habitantes.
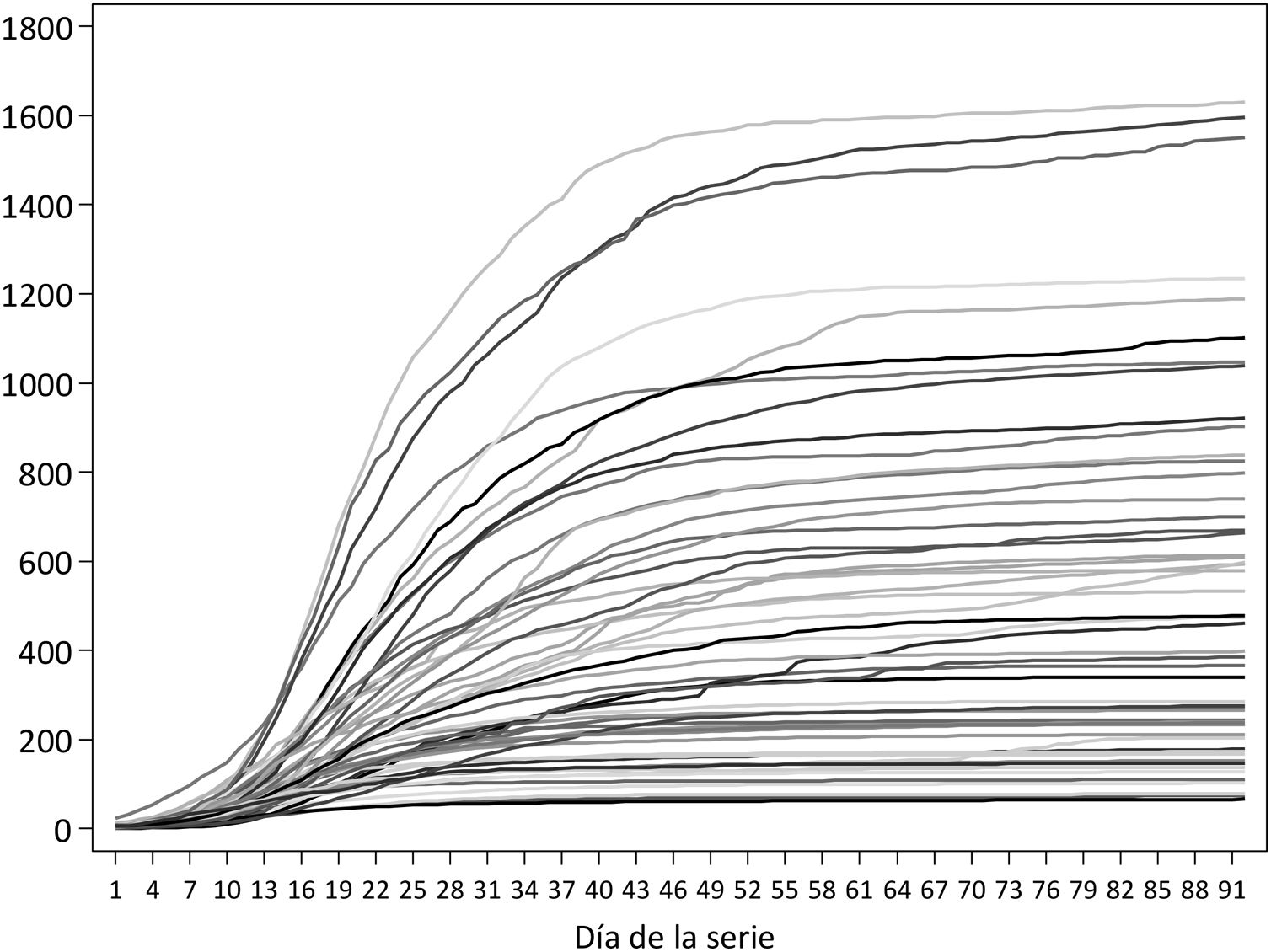
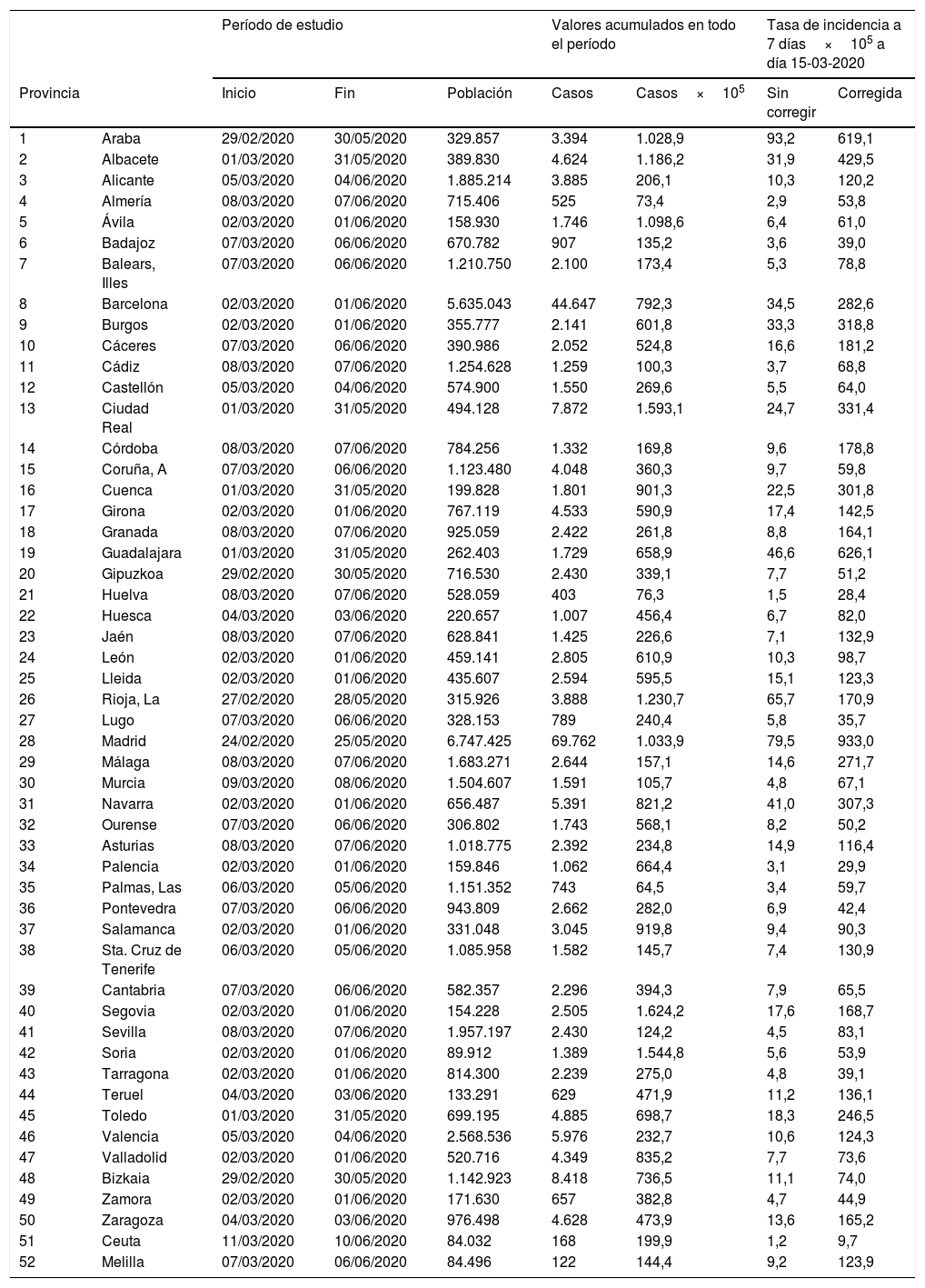
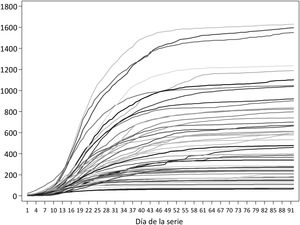
Las series de incidencia acumulada para la clasificación de las provincias incluyen 92 días, con fechas de inicio entre el 24 de febrero (Madrid) y el 11 de marzo (Ceuta); en 9 provincias, la fecha de inicio fue el 8 de marzo. En ese período, las provincias con mayor incidencia acumulada fueron Segovia, Ciudad Real y Soria, las 3 con más de 1.500 casos por 100.000, mientras que Huelva, Almería y Las Palmas tuvieron en ese período menos de 100 casos/100.000 (tabla 1 y fig. 1). A nivel estatal, el pico de casos se alcanzó el 20 de marzo, con 10.390; por provincias, la fecha del pico varía entre el 13 de marzo en Melilla y el 21 de abril en Huesca.
Fechas de inicio y fin del período de estudio de 92 días, número acumulado de casos de COVID-19 en ese período e incidencia acumulada por 100.000 habitantes en las 52 provincias. Tasas de incidencia a 7 días el 15 de marzo de 2020, sin corregir y corregidas
| Período de estudio | Valores acumulados en todo el período | Tasa de incidencia a 7 días×105 a día 15-03-2020 | ||||||
|---|---|---|---|---|---|---|---|---|
| Provincia | Inicio | Fin | Población | Casos | Casos×105 | Sin corregir | Corregida | |
| 1 | Araba | 29/02/2020 | 30/05/2020 | 329.857 | 3.394 | 1.028,9 | 93,2 | 619,1 |
| 2 | Albacete | 01/03/2020 | 31/05/2020 | 389.830 | 4.624 | 1.186,2 | 31,9 | 429,5 |
| 3 | Alicante | 05/03/2020 | 04/06/2020 | 1.885.214 | 3.885 | 206,1 | 10,3 | 120,2 |
| 4 | Almería | 08/03/2020 | 07/06/2020 | 715.406 | 525 | 73,4 | 2,9 | 53,8 |
| 5 | Ávila | 02/03/2020 | 01/06/2020 | 158.930 | 1.746 | 1.098,6 | 6,4 | 61,0 |
| 6 | Badajoz | 07/03/2020 | 06/06/2020 | 670.782 | 907 | 135,2 | 3,6 | 39,0 |
| 7 | Balears, Illes | 07/03/2020 | 06/06/2020 | 1.210.750 | 2.100 | 173,4 | 5,3 | 78,8 |
| 8 | Barcelona | 02/03/2020 | 01/06/2020 | 5.635.043 | 44.647 | 792,3 | 34,5 | 282,6 |
| 9 | Burgos | 02/03/2020 | 01/06/2020 | 355.777 | 2.141 | 601,8 | 33,3 | 318,8 |
| 10 | Cáceres | 07/03/2020 | 06/06/2020 | 390.986 | 2.052 | 524,8 | 16,6 | 181,2 |
| 11 | Cádiz | 08/03/2020 | 07/06/2020 | 1.254.628 | 1.259 | 100,3 | 3,7 | 68,8 |
| 12 | Castellón | 05/03/2020 | 04/06/2020 | 574.900 | 1.550 | 269,6 | 5,5 | 64,0 |
| 13 | Ciudad Real | 01/03/2020 | 31/05/2020 | 494.128 | 7.872 | 1.593,1 | 24,7 | 331,4 |
| 14 | Córdoba | 08/03/2020 | 07/06/2020 | 784.256 | 1.332 | 169,8 | 9,6 | 178,8 |
| 15 | Coruña, A | 07/03/2020 | 06/06/2020 | 1.123.480 | 4.048 | 360,3 | 9,7 | 59,8 |
| 16 | Cuenca | 01/03/2020 | 31/05/2020 | 199.828 | 1.801 | 901,3 | 22,5 | 301,8 |
| 17 | Girona | 02/03/2020 | 01/06/2020 | 767.119 | 4.533 | 590,9 | 17,4 | 142,5 |
| 18 | Granada | 08/03/2020 | 07/06/2020 | 925.059 | 2.422 | 261,8 | 8,8 | 164,1 |
| 19 | Guadalajara | 01/03/2020 | 31/05/2020 | 262.403 | 1.729 | 658,9 | 46,6 | 626,1 |
| 20 | Gipuzkoa | 29/02/2020 | 30/05/2020 | 716.530 | 2.430 | 339,1 | 7,7 | 51,2 |
| 21 | Huelva | 08/03/2020 | 07/06/2020 | 528.059 | 403 | 76,3 | 1,5 | 28,4 |
| 22 | Huesca | 04/03/2020 | 03/06/2020 | 220.657 | 1.007 | 456,4 | 6,7 | 82,0 |
| 23 | Jaén | 08/03/2020 | 07/06/2020 | 628.841 | 1.425 | 226,6 | 7,1 | 132,9 |
| 24 | León | 02/03/2020 | 01/06/2020 | 459.141 | 2.805 | 610,9 | 10,3 | 98,7 |
| 25 | Lleida | 02/03/2020 | 01/06/2020 | 435.607 | 2.594 | 595,5 | 15,1 | 123,3 |
| 26 | Rioja, La | 27/02/2020 | 28/05/2020 | 315.926 | 3.888 | 1.230,7 | 65,7 | 170,9 |
| 27 | Lugo | 07/03/2020 | 06/06/2020 | 328.153 | 789 | 240,4 | 5,8 | 35,7 |
| 28 | Madrid | 24/02/2020 | 25/05/2020 | 6.747.425 | 69.762 | 1.033,9 | 79,5 | 933,0 |
| 29 | Málaga | 08/03/2020 | 07/06/2020 | 1.683.271 | 2.644 | 157,1 | 14,6 | 271,7 |
| 30 | Murcia | 09/03/2020 | 08/06/2020 | 1.504.607 | 1.591 | 105,7 | 4,8 | 67,1 |
| 31 | Navarra | 02/03/2020 | 01/06/2020 | 656.487 | 5.391 | 821,2 | 41,0 | 307,3 |
| 32 | Ourense | 07/03/2020 | 06/06/2020 | 306.802 | 1.743 | 568,1 | 8,2 | 50,2 |
| 33 | Asturias | 08/03/2020 | 07/06/2020 | 1.018.775 | 2.392 | 234,8 | 14,9 | 116,4 |
| 34 | Palencia | 02/03/2020 | 01/06/2020 | 159.846 | 1.062 | 664,4 | 3,1 | 29,9 |
| 35 | Palmas, Las | 06/03/2020 | 05/06/2020 | 1.151.352 | 743 | 64,5 | 3,4 | 59,7 |
| 36 | Pontevedra | 07/03/2020 | 06/06/2020 | 943.809 | 2.662 | 282,0 | 6,9 | 42,4 |
| 37 | Salamanca | 02/03/2020 | 01/06/2020 | 331.048 | 3.045 | 919,8 | 9,4 | 90,3 |
| 38 | Sta. Cruz de Tenerife | 06/03/2020 | 05/06/2020 | 1.085.958 | 1.582 | 145,7 | 7,4 | 130,9 |
| 39 | Cantabria | 07/03/2020 | 06/06/2020 | 582.357 | 2.296 | 394,3 | 7,9 | 65,5 |
| 40 | Segovia | 02/03/2020 | 01/06/2020 | 154.228 | 2.505 | 1.624,2 | 17,6 | 168,7 |
| 41 | Sevilla | 08/03/2020 | 07/06/2020 | 1.957.197 | 2.430 | 124,2 | 4,5 | 83,1 |
| 42 | Soria | 02/03/2020 | 01/06/2020 | 89.912 | 1.389 | 1.544,8 | 5,6 | 53,9 |
| 43 | Tarragona | 02/03/2020 | 01/06/2020 | 814.300 | 2.239 | 275,0 | 4,8 | 39,1 |
| 44 | Teruel | 04/03/2020 | 03/06/2020 | 133.291 | 629 | 471,9 | 11,2 | 136,1 |
| 45 | Toledo | 01/03/2020 | 31/05/2020 | 699.195 | 4.885 | 698,7 | 18,3 | 246,5 |
| 46 | Valencia | 05/03/2020 | 04/06/2020 | 2.568.536 | 5.976 | 232,7 | 10,6 | 124,3 |
| 47 | Valladolid | 02/03/2020 | 01/06/2020 | 520.716 | 4.349 | 835,2 | 7,7 | 73,6 |
| 48 | Bizkaia | 29/02/2020 | 30/05/2020 | 1.142.923 | 8.418 | 736,5 | 11,1 | 74,0 |
| 49 | Zamora | 02/03/2020 | 01/06/2020 | 171.630 | 657 | 382,8 | 4,7 | 44,9 |
| 50 | Zaragoza | 04/03/2020 | 03/06/2020 | 976.498 | 4.628 | 473,9 | 13,6 | 165,2 |
| 51 | Ceuta | 11/03/2020 | 10/06/2020 | 84.032 | 168 | 199,9 | 1,2 | 9,7 |
| 52 | Melilla | 07/03/2020 | 06/06/2020 | 84.496 | 122 | 144,4 | 9,2 | 123,9 |
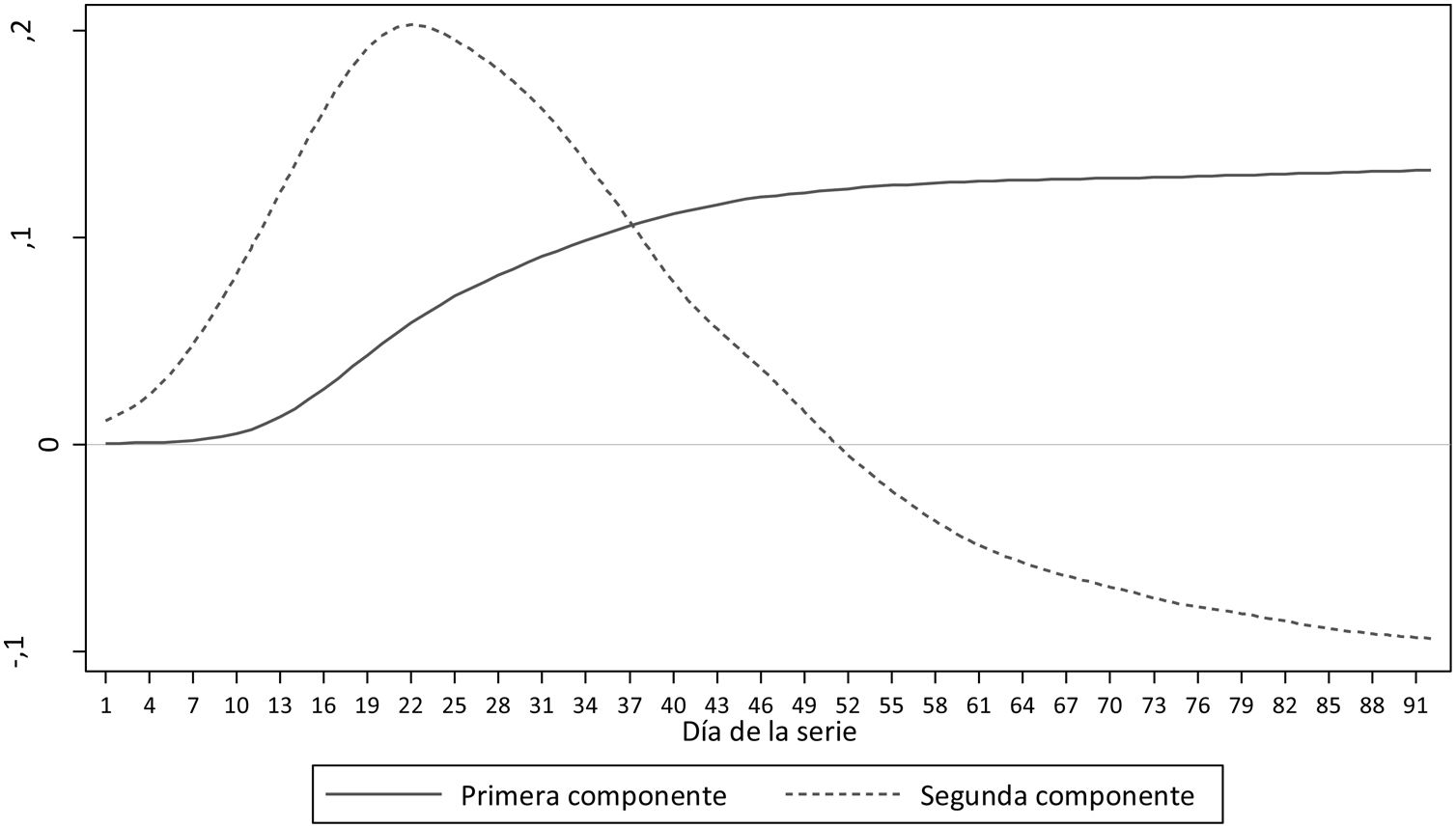
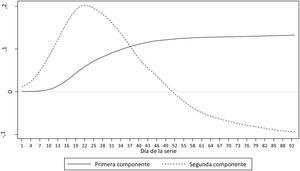
Al aplicar el análisis de componentes principales funcional se identificaron 2 componentes (fig. 2) que explican el 99% de la variabilidad de las 52 curvas. La primera componente se puede interpretar como la tendencia global de la incidencia acumulada, y la segunda componente como la velocidad de crecimiento o decrecimiento de la incidencia a lo largo del período de análisis.
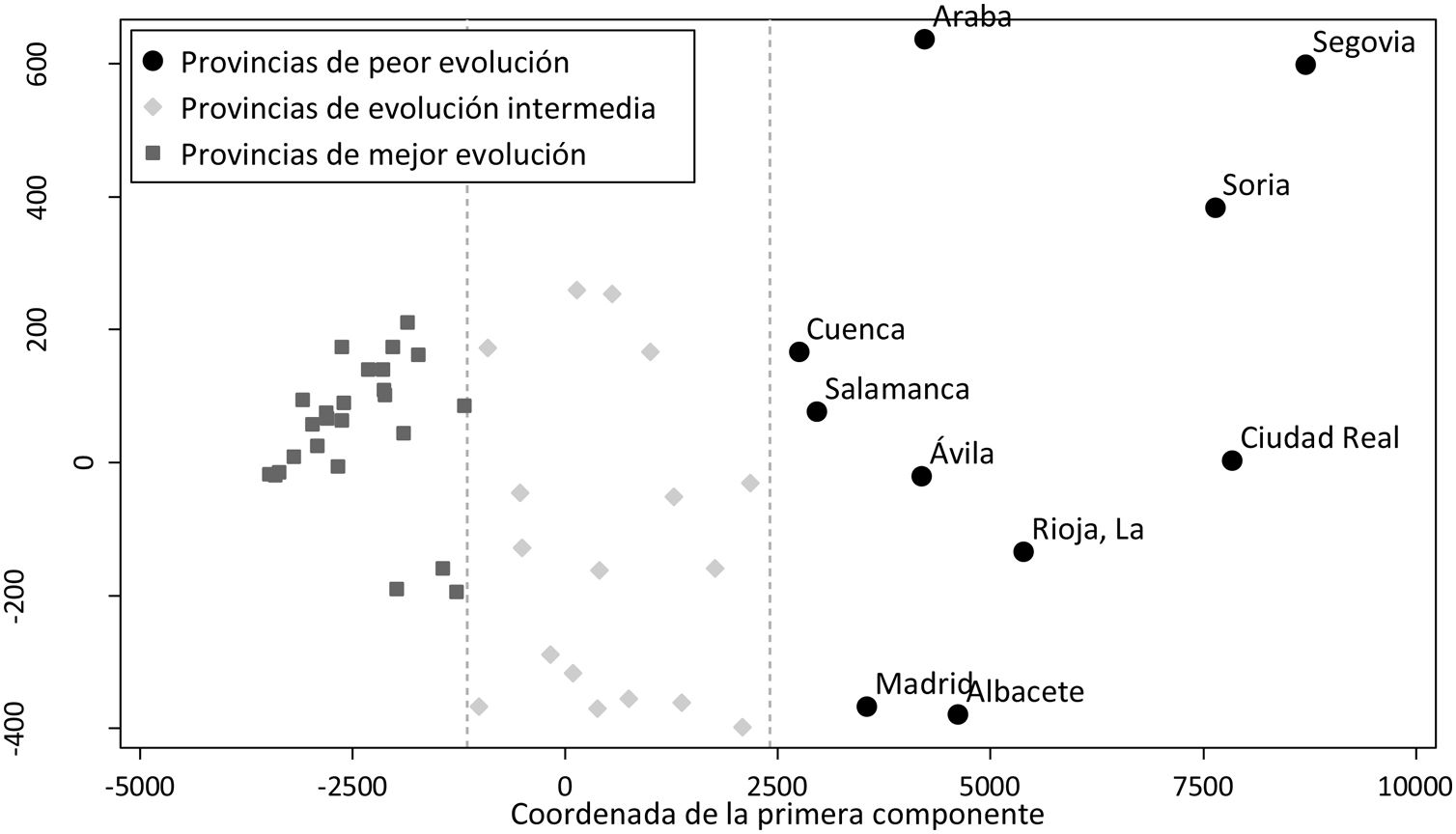
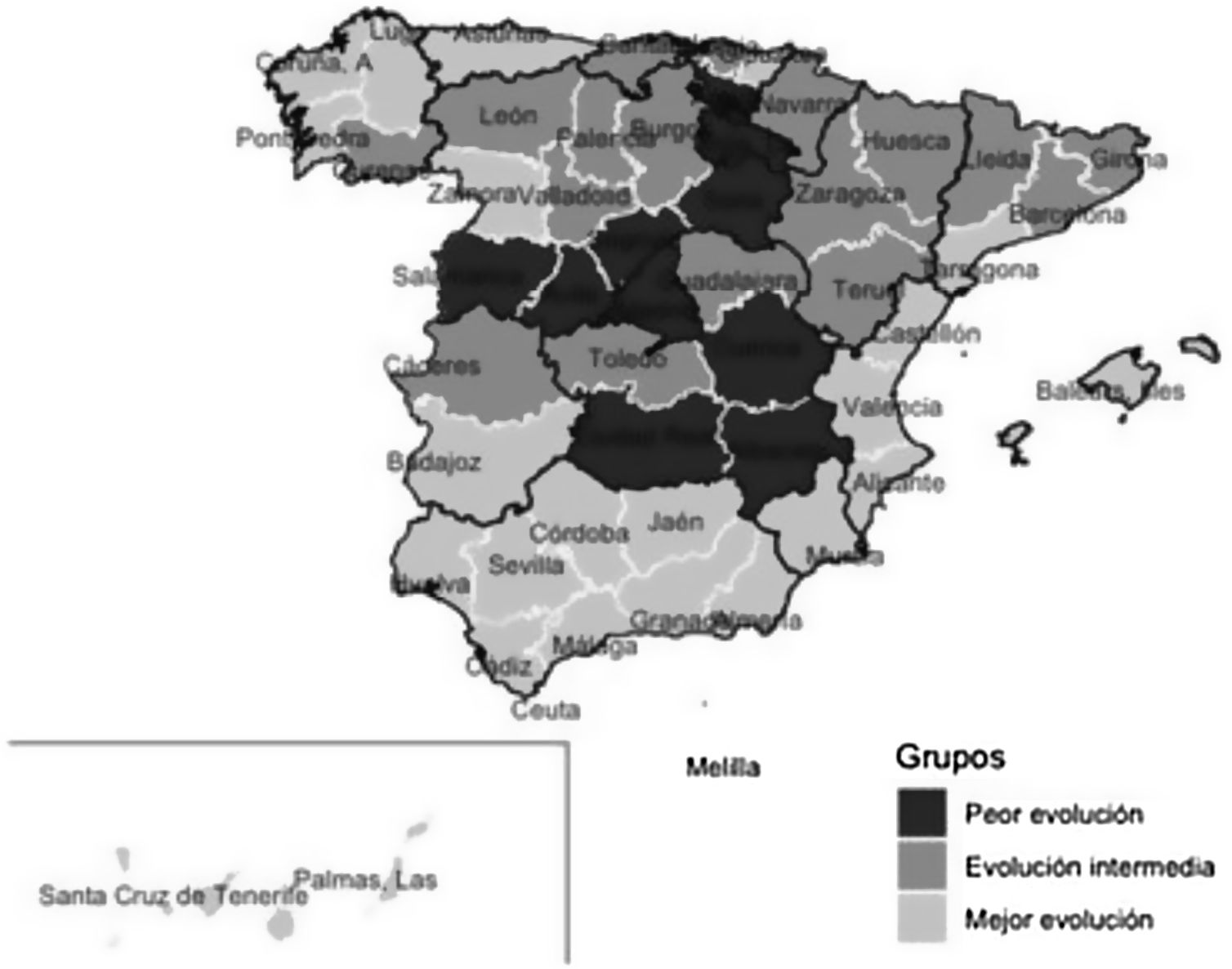
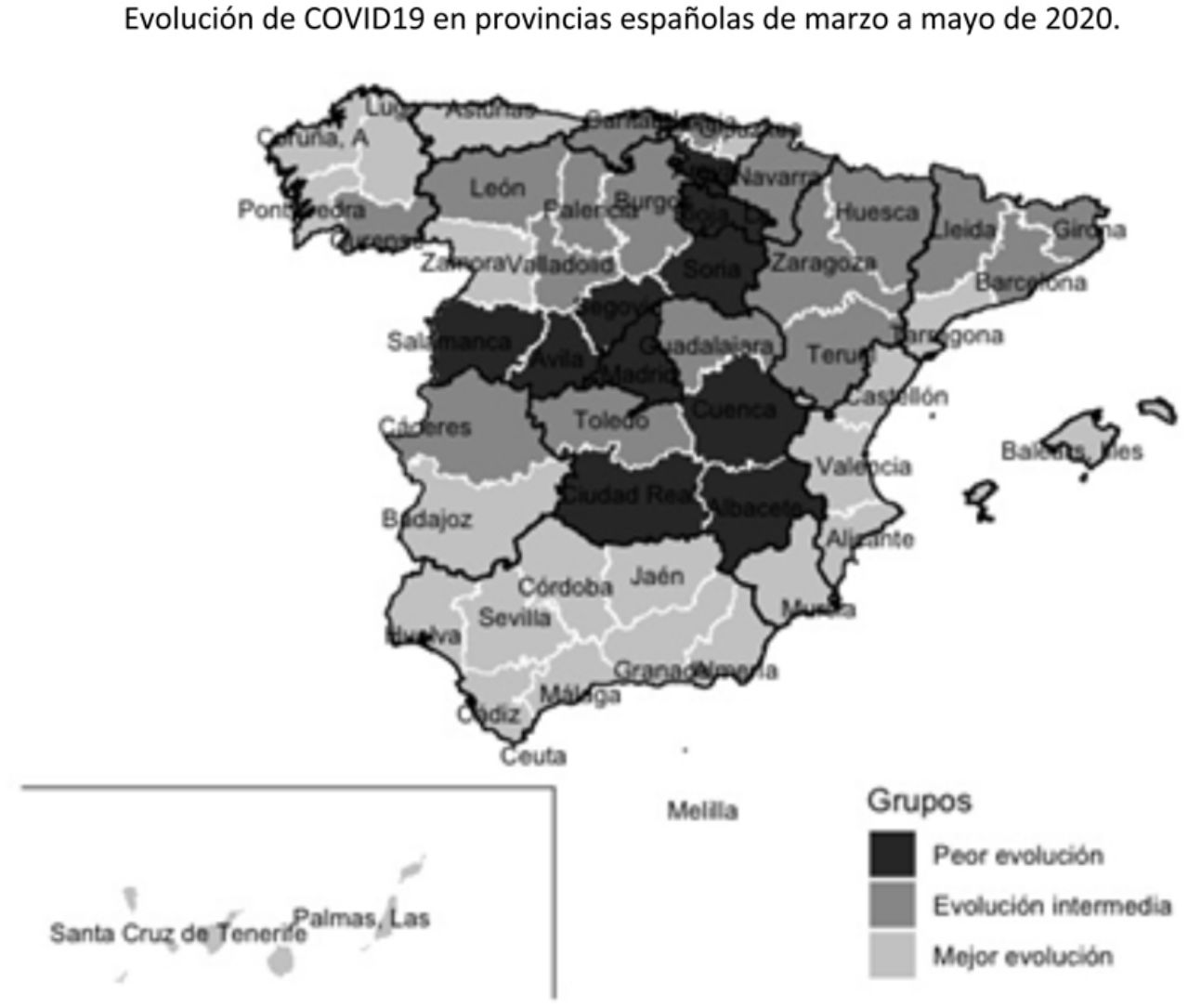
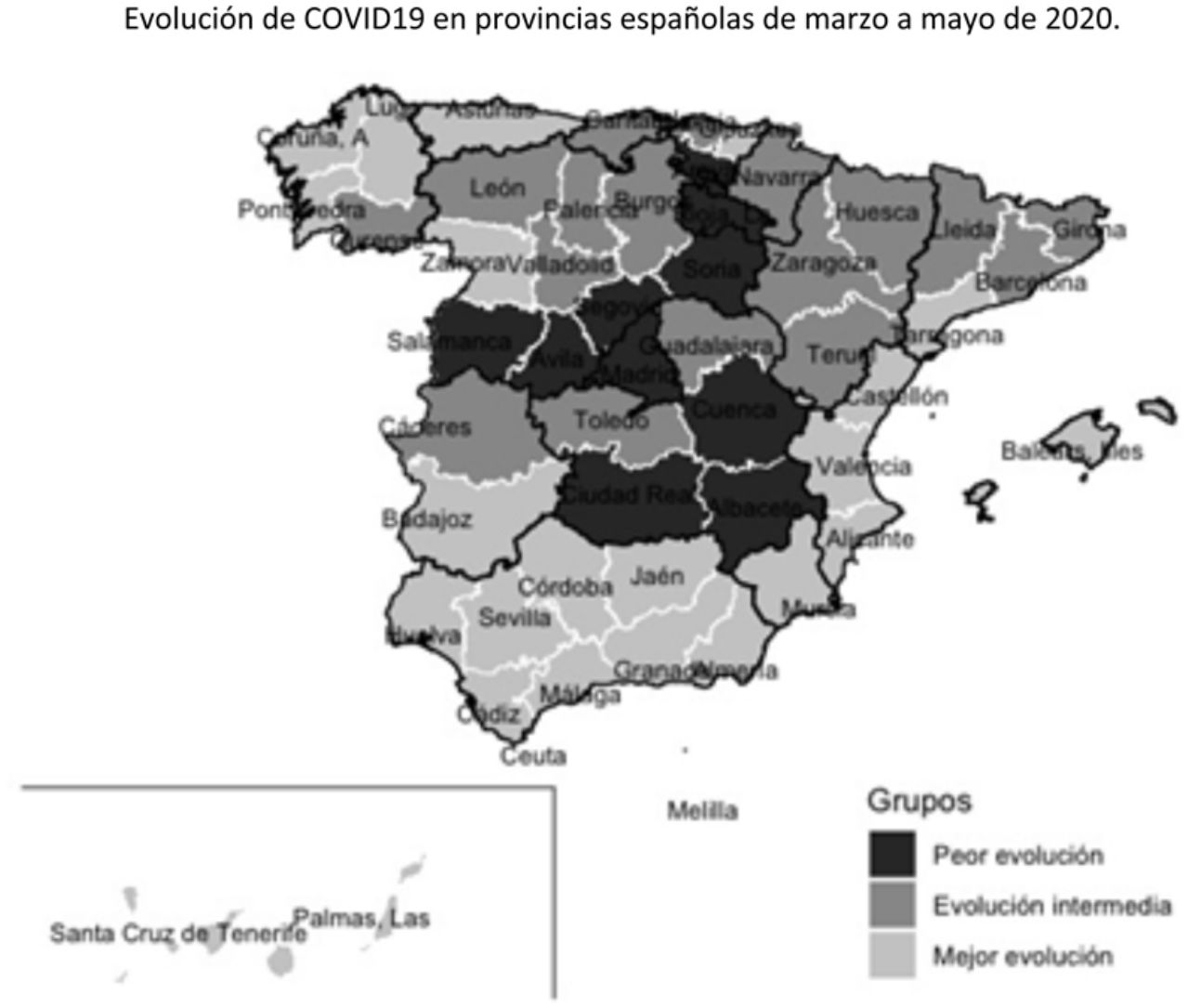
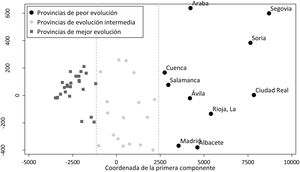
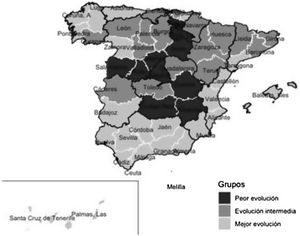
Tras aplicar el análisis clúster a las coordenadas de las 2 componentes principales se identificaron 10 provincias en el grupo de peor evolución, 17 en el de evolución intermedia y 25 en el de mejor evolución. Los grupos están definidos fundamentalmente por la coordenada de la primera componente, como se puede observar en la figura 3. En el mapa de España (fig. 4) se observa que las provincias de mejor evolución se concentran en el sureste de la península (Andalucía, Murcia, Comunitat Valenciana, además de Badajoz y Tarragona) y en el noroeste (Galicia – excepto Ourense – Asturias, Zamora, además de Navarra), y las de peor evolución forman un arco desde Salamanca a Álava pasando por Madrid, además de Cuenca, Albacete y Ciudad Real.
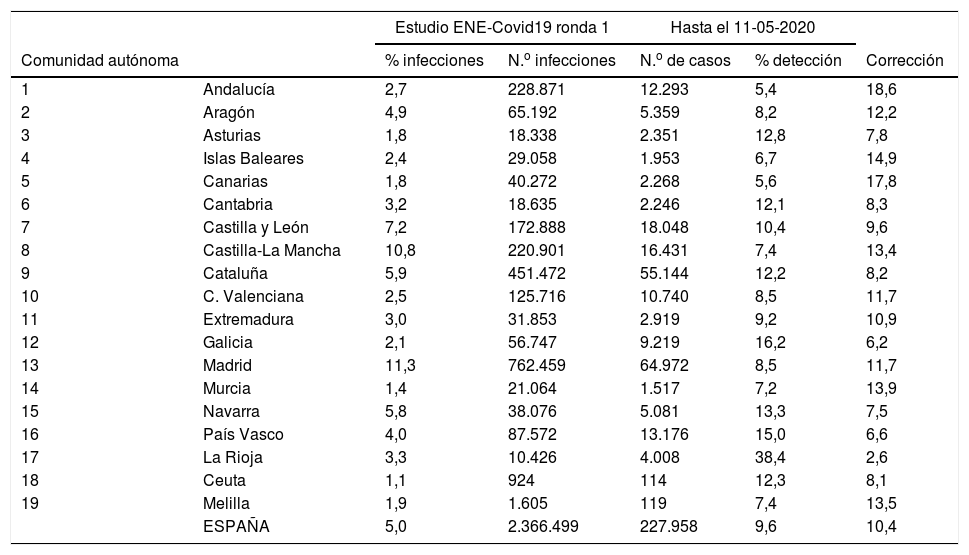
En España se diagnosticaron 227.958 casos de COVID-19 desde el inicio de la pandemia hasta el 11 de mayo y se estimó que el número de infectados hasta esa fecha fue de 2.366.499 (prevalencia del 5% del estudio ENE-COVID19), lo que resulta en una tasa de detección del 9,6%. Las tasas de detección por CA varían entre el 5,4% en Andalucía y el 38,2% en La Rioja (tabla 2) y los factores de corrección varían, por tanto, entre 18,6 y 2,6 (tabla 1).
Prevalencia y número estimado de casos de infección por COVID-19 en España en la primera ronda del estudio ENE-Covid19, número de casos diagnosticados hasta el 11 de mayo, tasa de detección estimada (%) y su inverso (corrección)
| Estudio ENE-Covid19 ronda 1 | Hasta el 11-05-2020 | |||||
|---|---|---|---|---|---|---|
| Comunidad autónoma | % infecciones | N.o infecciones | N.o de casos | % detección | Corrección | |
| 1 | Andalucía | 2,7 | 228.871 | 12.293 | 5,4 | 18,6 |
| 2 | Aragón | 4,9 | 65.192 | 5.359 | 8,2 | 12,2 |
| 3 | Asturias | 1,8 | 18.338 | 2.351 | 12,8 | 7,8 |
| 4 | Islas Baleares | 2,4 | 29.058 | 1.953 | 6,7 | 14,9 |
| 5 | Canarias | 1,8 | 40.272 | 2.268 | 5,6 | 17,8 |
| 6 | Cantabria | 3,2 | 18.635 | 2.246 | 12,1 | 8,3 |
| 7 | Castilla y León | 7,2 | 172.888 | 18.048 | 10,4 | 9,6 |
| 8 | Castilla-La Mancha | 10,8 | 220.901 | 16.431 | 7,4 | 13,4 |
| 9 | Cataluña | 5,9 | 451.472 | 55.144 | 12,2 | 8,2 |
| 10 | C. Valenciana | 2,5 | 125.716 | 10.740 | 8,5 | 11,7 |
| 11 | Extremadura | 3,0 | 31.853 | 2.919 | 9,2 | 10,9 |
| 12 | Galicia | 2,1 | 56.747 | 9.219 | 16,2 | 6,2 |
| 13 | Madrid | 11,3 | 762.459 | 64.972 | 8,5 | 11,7 |
| 14 | Murcia | 1,4 | 21.064 | 1.517 | 7,2 | 13,9 |
| 15 | Navarra | 5,8 | 38.076 | 5.081 | 13,3 | 7,5 |
| 16 | País Vasco | 4,0 | 87.572 | 13.176 | 15,0 | 6,6 |
| 17 | La Rioja | 3,3 | 10.426 | 4.008 | 38,4 | 2,6 |
| 18 | Ceuta | 1,1 | 924 | 114 | 12,3 | 8,1 |
| 19 | Melilla | 1,9 | 1.605 | 119 | 7,4 | 13,5 |
| ESPAÑA | 5,0 | 2.366.499 | 227.958 | 9,6 | 10,4 | |
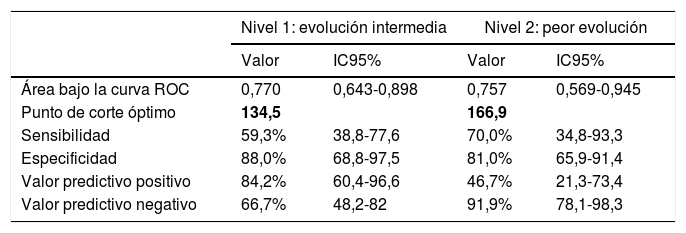
La mediana de las tasas de incidencia corregidas provinciales a 7 días el día 15 de marzo de 2020 fue de 236,4 casos por 100.000 en el grupo de peor evolución, 136,1 en el grupo intermedio y 67,1 en el de mejor evolución, con un recorrido intercuartílico de 339,2; 172,6 y 79,1 respectivamente. Para el cálculo de los valores umbrales en las tasas mediante curvas ROC se consideraron 2 situaciones que resultan de tomar como marcador la tasa corregida y como estatus el grupo de peor evolución o evolución intermedia. El área bajo la curva ROC fue 0,757 y 0,770, respectivamente y los puntos de corte en la tasa de incidencia a 7 días fueron 134 casos por 100.000 para el nivel de alerta 1 (medio) y 167 para el nivel 2 (alto); en ambos casos, la especificidad asociada a estos puntos de corte es más alta que la sensibilidad (tabla 3).
Área bajo la curva ROC de la tasa de incidencia a 7 días el 15 de marzo de 2020, punto de corte óptimo de la curva y medidas de precisión asociadas al punto de corte para 2 niveles de alerta
| Nivel 1: evolución intermedia | Nivel 2: peor evolución | |||
|---|---|---|---|---|
| Valor | IC95% | Valor | IC95% | |
| Área bajo la curva ROC | 0,770 | 0,643-0,898 | 0,757 | 0,569-0,945 |
| Punto de corte óptimo | 134,5 | 166,9 | ||
| Sensibilidad | 59,3% | 38,8-77,6 | 70,0% | 34,8-93,3 |
| Especificidad | 88,0% | 68,8-97,5 | 81,0% | 65,9-91,4 |
| Valor predictivo positivo | 84,2% | 60,4-96,6 | 46,7% | 21,3-73,4 |
| Valor predictivo negativo | 66,7% | 48,2-82 | 91,9% | 78,1-98,3 |
En negrita, puntos de corte.
Los resultados de esta investigación ponen de manifiesto que fijar determinados umbrales en forma de tasas de incidencia a 7 días podría predecir la evolución posterior de la epidemia de SARS-CoV-2 en zonas geográficas concretas. Esos umbrales indican que se puede discriminar adecuadamente con un bajo margen de error entre zonas geográficas de peor evolución, de evolución intermedia y de buena evolución, cuando existe transmisión comunitaria de SARS-CoV-2. La metodología propuesta podría ser útil para otros países, aunque previamente sería necesario hacer estudios similares para comprobar su utilidad y si se mantiene el grado de discriminación. Que sepamos, este es el primer estudio que aplica esta metodología para predecir el comportamiento de la pandemia basado en la incidencia de la enfermedad.
En España y en otros países, ante una situación nueva y desconocida hasta la fecha, se aplicaron medidas de confinamiento extraordinarias. Los resultados de este estudio indican que, con esos umbrales, el confinamiento podría haber llegado tarde en algunas provincias y que en otras quizá habría podido ser evitado o acortado. Si se comparan estos resultados con los observados en el estudio nacional ENE-COVID19 9, puede observarse que, de las 10 provincias identificadas en nuestro estudio como de peor evolución, 6 coinciden con las que han obtenido más de un 10% de incidencia en dicho estudio. De las 23 provincias identificadas en nuestro estudio como de mejor evolución, 16 presentaron una incidencia menor del 2,5% según el estudio ENE-COVID19. No obstante, debe destacarse que ambos estudios no son comparables. Mientras el presente estudio trata de predecir la buena o mala evolución y clasificarla en diferentes escenarios, el estudio ENE-COVID19 tiene como objetivo conocer la incidencia de SARS-CoV-2 e indirectamente la prevalencia por provincia con el objetivo último de obtener información sobre la inmunidad de grupo. Así, la propuesta que presentamos mide también la velocidad de infección por SARS-CoV-2, que es uno de los 2 componentes que explican el 99% de la variabilidad y que tiene un impacto directo en la peor evolución. Se puede alcanzar una misma incidencia acumulada de enfermedad al cabo de 2 meses en una misma provincia, pero a través de diferentes mecanismos de transmisión, uno que podría ser lento y sostenido en el tiempo (aplanar la curva) y otro explosivo que satura el sistema sanitario, equivalente al escenario de peor evolución. La combinación de ambos componentes, siendo el primero la tendencia global de la incidencia acumulada por cada provincia y el segundo la velocidad de crecimiento o decrecimiento de la incidencia a lo largo del período explica la práctica totalidad de la evolución de la pandemia en cada provincia analizada, tal y como se puede observar en la figura 2.
Si bien puede parecer que los umbrales propuestos no tienen en cuenta el confinamiento y que algunas provincias alcanzaron el pico de contagios posteriormente al Decreto de Estado de Alarma, para definir las curvas ROC se ha considerado la tasa acumulada a 7 días pero calculada a 15 de marzo y el área bajo la curva es superior a 0,7 en los 2 casos, con lo que los umbrales establecidos de 134 y 167 casos por 100.000 habitantes son capaces de discriminar el nivel de alerta medio y alto, respectivamente.
A la hora de aplicar estos modelos en nuevos contextos como en la situación actual deben hacerse varias consideraciones. En primer lugar, el modelo es fundamentalmente aplicable en situaciones en las que existe transmisión comunitaria, de origen desconocido y no trazable. En situaciones en las que el número de casos, aunque sea elevado, es de origen conocido y pueden trazarse sus contactos, la velocidad de transmisión puede ser muy alta, pero durante un tiempo muy limitado, por lo que no podría hablarse de una mala evolución sino de un aumento puntual y localizado del número de casos. Finalmente, se ha decidido eliminar de los modelos los casos confirmados a través de test rápidos debido a que su uso heterogéneo en las distintas provincias españolas podría afectar a los resultados, al igual que cierta variabilidad en su fiabilidad diagnóstica. Debemos destacar además que su sensibilidad y especificidad son menores que la prueba de PCR y que en cualquier caso solo supusieron un 7,7% del total. Por provincias, la variación fue importante, entre el 0% y el 45%, con una mediana del 11,2%.
No hemos podido considerar en estos modelos el número de ingresos hospitalarios por provincia, ingresos en UCI o fallecimientos, debido a que no estaban disponibles. De todos modos, haber incluido información de estas características hubiese supuesto introducir como elemento distorsionador la diferente preparación de los sistemas de atención sanitaria ante la pandemia.
Los umbrales obtenidos en nuestro estudio son comparables a los propuestos por otros organismos. Así, el propuesto por el Harvard Global Health Institute especifica, para el nivel máximo de alerta, 25 casos diarios por 100.000 habitantes15. Nuestro modelo indica como este nivel de alerta 167 casos a 7 días, lo que significa 24 (167/7) casos diarios, prácticamente igual al propuesto por esta institución. Sin embargo, los 2 niveles intermedios calculados no son similares. Hay que destacar que nuestro modelo ha sido propuesto de manera ciega y totalmente independiente a lo propuesto por esta institución académica norteamericana. Existen múltiples estudios de modelización de COVID-19 pero se han centrado en aspectos diversos, como predicción de carga hospitalaria, predicción de mortalidad, etc.16–18, pero pocos han sido realizados para establecer la utilidad de umbrales epidemiológicos que puedan predecir la evolución de la pandemia. Otro documento de revisión canadiense indica que el umbral que puede predecir capacidad hospitalaria es el de 30-50 casos por 100.000 habitantes19 (bastante cercano al corte que proponemos de 24 casos por 100.000), pero la OMS no establece umbrales de acción basados en tasas de incidencia sino en la existencia de transmisión comunitaria o clústers de casos20.
Por otra parte, la principal fortaleza del método estadístico empleado está en que permite hacer la clasificación de las provincias teniendo en cuenta su evolución a lo largo del período epidémico, utilizando para ello toda la información de las curvas de tasas de incidencia por 100.000 habitantes. Otra ventaja es que creemos que este tipo de modelos podrían ser aplicables a esta o futuras pandemias, modelizando los 2 componentes analizados en función de las características epidémicas de ese potencial nuevo agente biológico (tiempo de inducción, infectividad).
Finalmente, en cuanto a las limitaciones del estudio, tenemos que decir que la tasa de detección utilizada para hacer la corrección de las tasas a 7 días calculada el 15 de marzo está estimada con los datos de todo el período hasta el 11 de mayo y se ha asumido que es válida a día 15 de marzo. Además, debido a la falta de datos a nivel provincial, se aplicó a todas las provincias de una CA la tasa de detección de la CA, pero podría haber diferencias interprovinciales. También, las tasas de incidencia empleadas para la clasificación de las provincias son por inicio de síntomas, debido a la no disponibilidad de datos por fecha de diagnóstico, que serían los deseables para este estudio.
Para concluir, los umbrales propuestos para establecer una evolución intermedia o una peor evolución en forma de tasa de incidencia a 7 días podrían ser de utilidad para las administraciones sanitarias a la hora de decidir medidas que puedan afectar a la movilidad de la población, siempre y cuando una zona geográfica se encuentre en una situación de transmisión comunitaria de SARS-CoV-2. Esta información es sencilla de obtener a través de los sistemas de información de Salud Pública de las distintas CCAA y puede ser intercomparable entre áreas sanitarias o CCAA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.