Un pulmón no expansible (PNE) es una complicación mecánica por la cual el pulmón no se expande hasta contactar con la pared torácica, lo que impide una normal aposición entre ambas hojas pleurales. El principal mecanismo implicado es la restricción de la pleura visceral al formarse una capa fibrosa a lo largo de toda esta hoja pleural. Ocurre por la presencia de una enfermedad pleural activa (pulmón en proceso de atrapamiento [PPA]), que se puede resolver si se toman las medidas terapéuticas oportunas, o remota (pulmón atrapado [PA]), en el que ya se ha formado la capa fibrosa pleural irreversible. La sospecha clínica viene dada por la presencia de un hidroneumotórax post-toracocentesis o un derrame pleural que no se puede drenar por la aparición de dolor torácico. Su diagnóstico se basa en el análisis del líquido pleural, en la determinación de las presiones pleurales a medida que drenamos el derrame, y en la TC de tórax con contraste de aire. Dado que ambos representan la continuidad de un mismo proceso, los resultados dependerán del momento en que llevemos a cabo estos procedimientos. Si en el PPA no se toman con prontitud medidas terapéuticas apropiadas, el resultado final será un PA. En este, la mayoría de pacientes se encuentran asintomáticos o tienen una pequeña disnea de esfuerzo, por lo que no suelen requerir tratamiento pero, en casos de disnea incapacitante, puede ser necesario realizar una decorticación pleural para conseguir la resolución de los síntomas.
Unexpandable lung is a mechanical complication by which the lung does not expand to the chest wall, impeding a normal apposition between the two pleural layers. The main mechanism involved is the restriction of the visceral pleura due to the formation of a fibrous layer along this pleural membrane. This happens because of the presence of an active pleural disease (lung entrapment), which can be resolved if proper therapeutic measures are taken, or a remote disease (trapped lung), in which an irreversible fibrous pleural layer has been formed. The clinical suspicion arises with the presence of post-thoracocentesis hydropneumothorax or a pleural effusion that cannot be drained due to the appearance of thoracic pain. The diagnosis is based on the analysis of the pleural liquid, the determination of pleural pressures as we drain the effusion and on air-contrast chest CT. As both represent the continuity of one same process, the results will depend on the time at which these procedures are done. If, when given a lung that is becoming entrapped, the necessary therapeutic measures are not taken, the final result will be a trapped lung. In this instance, most patients are asymptomatic or have mild exertional dyspnea and therefore they do not require treatment. Nevertheless, in cases of incapacitating dyspnea, it may be necessary to use pleural decortication in order to resolve the symptoms.
Un pulmón no expansible (PNE) es una complicación mecánica por la cual el pulmón no es capaz de expandirse hasta la pared torácica, lo que impide la normal aposición entre las pleuras visceral y parietal. Los mecanismos patológicos implicados son: atelectasia secundaria a obstrucción endobronquial, fibrosis severa del parénquima pulmonar y restricción de la pleura visceral1,2.
El PNE debido a una restricción de la pleura visceral se subdivide, a su vez, en 2 categorías: pulmón en proceso de atrapamiento (PPA) y pulmón atrapado (PA) (tabla 1). El primero se debe a un proceso activo que afecta a la pleura visceral y que generalmente es de etiología maligna o inflamatoria. Puede ser progresivo o bien resolverse espontáneamente o con tratamiento específico. El segundo es la secuela de una inflamación antigua del espacio pleural que deriva en la formación de una membrana fibrosa a nivel de la pleura visceral que impide la expansión pulmonar durante la extracción del líquido pleural3. En este caso, el tratamiento no suele ser necesario y la mejoría espontánea no se producirá4. Las diferencias entre PPA y PA se irán describiendo a lo largo del artículo y se resumen en la tabla 2. Dado que ni el PNE debido a una atelectasia secundaria a obstrucción endobronquial capaz de producir un colapso lobar, ni el debido a una fibrosis severa del parénquima pulmonar, se han descrito en la literatura, esta revisión se centrará en los PNE secundarios a una restricción de la pleura visceral.
Diferencias entre pulmón en proceso de atrapamiento y pulmón atrapado
| Pulmón en proceso de atrapamiento | Pulmón atrapado | |
| Mecanismo | Proceso inflamatorio activo persistente que provoca un derrame con restricción pleural | Proceso inflamatorio antiguo. El proceso de reparación pleural conlleva que se forme una capa fibrosa en la superficie pleural que crea una presión intrapleural negativa |
| Clínica | Disnea dependiendo del tamaño del derrame | Disnea causada por la restricción pulmonar y no por el derrame pleural |
| Radiografía de tórax | Desplazamiento contralateral del mediastino | Sin desplazamiento contralateral del mediastino |
| Presión del líquido pleural | Inicialmente positiva | Inicialmente negativa |
| Curva presión/volumen | Bimodal | Lineal |
| Elastancia espacio pleural | Normal o alta | Alta (>14,5cmH2O/l) |
| Análisis del líquido pleural | Exudado linfocítico | Trasudado |
| Manejo | En función de la enfermedad subyacente | Decorticación si hay disnea incapacitante |
Así, una inflamación pleural debida a un hemotórax o a enfermedades malignas o inflamatorias puede dar lugar a un cierto grado de restricción a nivel de la pleura visceral, a lo que llamaremos PPA. Si estas enfermedades no se tratan a tiempo, los mecanismos de reparación de la pleura pueden fallar, lo que daría lugar a la formación de una capa fibrosa a lo largo de la superficie de la pleura visceral. Se crearía así una presión intrapleural negativa que impediría la aposición completa de ambas capas pleurales, derivando en un PA. Por lo tanto, el PPA y el PA representan una continuidad del mismo proceso y, dependiendo de en qué momento llevemos a cabo las pruebas complementarias, se pueden obtener distintos patrones de comportamiento que pueden tener importantes connotaciones en el seguimiento y en el tratamiento de estos pacientes.
Diagnóstico del pulmón no expansiblePara el diagnóstico del PNE debido a una restricción de la pleura visceral (PPA y PA) se parte de una sospecha clínica en el contexto de un paciente con un hidroneumotórax post-toracocentesis o un derrame pleural que no se puede drenar en su totalidad por la aparición de un dolor torácico anterior5. Heidecker et al. han demostrado que el PNE es la causa más frecuente de neumotórax (neumotórax ex vacuo) tras una toracocentesis6. El mecanismo por el cual se produce este neumotórax tras una toracocentesis bajo guía ecográfica —procedimiento en el que el riesgo de introducir aire atmosférico o de daño directo de la pleura visceral por parte del catéter están controlados— se cree que se debe a la creación de fuerzas de deformación locales a nivel de la pleura visceral como consecuencia de la disminución de la presión pleural (PP), lo que puede causar pequeños desgarros en la pleural visceral con el consiguiente paso de aire al espacio pleural6. Este mecanismo fisiopatológico ha sido apoyado por los datos de Cerfolio et al., que retiran drenajes torácicos en post-lobectomías a pesar de la presencia de fugas de aire o de un neumotórax7. Esto ha llevado a algunos autores a que, ante la sospecha de un PNE, prefieran drenar el derrame con un sistema de jeringa (como el que se utiliza en la manometría pleural) antes que con un drenaje conectado a una campana con vacío (vacuum), ya que este último parece aumentar el riesgo de neumotórax8. Esto se debe probablemente al hecho de que una campana con vacío seguirá drenando aunque se haya sobrepasado la PP máxima, mientras que con la jeringa el procedimiento se detendrá tan pronto como el paciente presente cualquier tipo de sintomatología o se alcance una PP determinada.
Por tanto, para diferenciar un PPA de un PA hay que saber si existe un proceso activo que afecte a la pleural visceral o si, por el contrario, se trata de un proceso inflamatorio antiguo y estable en el tiempo. Un PPA puede ocurrir en el marco de un derrame pleural secundario a una neoplasia, artritis reumatoide, uremia, infección (derrame complicado/empiema) o poscirugía de revascularización mediante bypass aortocoronario, entre otros2. La clínica de estos pacientes estará relacionada con la enfermedad de fondo, a la que se puede añadir disnea dependiendo del tamaño del derrame, y en la radiografía de tórax se puede observar un desplazamiento contralateral del mediastino9,10.
El diagnóstico de PA requiere una cronicidad y estabilidad en el tiempo. Suele ser un diagnóstico tardío, bien porque es una posibilidad que no se tiene en cuenta en un principio o bien porque es difícil saber el tiempo transcurrido desde la lesión inicial11. Algunas de las enfermedades asociadas al desarrollo del PA son la cirugía de revascularización mediante bypass aortocoronario12, el empiema, el hemotórax, las pleuritis tuberculosa y urémica, y la artritis reumatoide, entre otras13. Los síntomas suelen ser poco floridos e incluso inexistentes, y la radiografía de tórax no presenta desplazamiento contralateral del mediastino9.
El diagnóstico de un PNE debido a una restricción de la pleura visceral se basa, además de en la sospecha clínica, en el análisis del líquido pleural, en las determinaciones seriadas de la PP mediante manometría, y en la tomografía computarizada (TC) de tórax. A continuación se hace un análisis detallado de las características más relevantes que se observan con estos procedimientos para establecer el diagnóstico de un PNE.
Líquido pleuralEn condiciones normales, en el espacio pleural existe un pequeño flujo continuo de líquido que forma una película de alrededor de 10μm de grosor entre las superficies de las pleuras parietal y visceral14. El líquido se filtra a través de la pleura parietal, fluye hacia las regiones más declives del pulmón y se reabsorbe a través de los linfáticos de la pleura parietal localizados, fundamentalmente, en las caras diafragmática y mediastínica15. La formación de líquido pleural depende de la diferencia entre las presiones hidrostática y oncótica del espacio pleural y de los capilares de ambas hojas pleurales. El movimiento del líquido a través de cada capa pleural dependerá, a su vez, del área de superficie y del coeficiente de filtración de cada membrana, así como del coeficiente de reflexión de cada soluto, siguiendo para ello la ley de Starling16. El líquido pleural filtrado a través de la pleura parietal proviene de los capilares sistémicos y el de la pleura visceral de los pulmonares, por lo que los primeros generarán un mayor gradiente de presión que los segundos. Por tanto, en condiciones normales la pleural visceral juega un papel residual en la entrada de líquido en el espacio pleural17.
Estudios llevados a cabo en animales18 han demostrado que la tasa neta de formación de líquido pleural es de 0,01 ml/kg/h, y la de reabsorción linfática, de 0,28 ml/kg/h. Por tanto, para que se produzca un derrame pleural se necesita un aumento significativo de la producción de líquido pleural (hasta 28 veces más para que supere la tasa de reabsorción de los linfáticos), una disminución de la reabsorción linfática, o ambas circunstancias. En los derrames pleurales metastásicos se produce una liberación de citoquinas, entre las que hay que destacar el factor de crecimiento endotelial vascular19. Estas citoquinas ocasionarán, por una parte, un aumento de la permeabilidad capilar y, por otra, un mayor aflujo de líquido al espacio pleural. Ambas circunstancias provocarán la acumulación de un líquido que bioquímicamente corresponderá a un exudado. En el caso de un PA se dan 2 circunstancias distintas a la de la situación anterior: por un lado existe una capa fibrosa a nivel de la pleura visceral y, por otra, no hay afectación del endotelio vascular de los capilares pleurales. La primera imposibilita la expansión del pulmón, lo que genera una presión muy negativa en el espacio pleural. Esta diferencia de presiones hidrostáticas entre los capilares sistémicos de la pleura parietal y el espacio pleural provocará un aumento del flujo neto de líquido pleural hacia la cavidad pleural, con lo que la diferencia de presiones se igualará. Por tanto, el líquido así generado, dado que no existe un aumento de la permeabilidad capilar, será un trasudado.
El análisis del líquido es siempre útil para diferenciar procesos inflamatorios/malignos activos, de procesos crónicos con poca o ninguna actividad. Para el análisis de los exudados pleurales se usará la terminología de exudado concordante y exudado discordante utilizada por Agrawal et al.20. Los primeros son aquellos con un cociente de proteínas líquido pleural/suero (PLP/S) >0,5 y una concentración de lactato deshidrogenasa en líquido pleural (LDHLP) mayor de los 2/3 del límite superior del valor normal en sangre. Los exudados discordantes son derrames clasificados como exudados por el PLP/S o por el LDHLP, pero no por ambos. A su vez, estos exudados discordantes pueden clasificarse en exudados proteín-discordantes, si el PLP/S es mayor de 0,5 con un LDHLP bajo, o exudados LDH-discordantes si sucede lo contrario. La interpretación de estas discordancias es que en el caso de los proteín-discordantes subyace un proceso fisiopatológico de fuga capilar (lo que podría justificar los niveles de PLP/S elevados), mientras que en el de los LDH-discordantes el proceso de base existente es más de índole inflamatoria, motivo por el que la LDHLP podría estar aumentada. En el PPA, el análisis del líquido pleural muestra un exudado concordante, aunque conforme el proceso inflamatorio se va resolviendo el exudado puede cumplir solo uno de los criterios, predominando el exudado LDH-discordante. Asimismo, hay un aumento del número total de células, con un predominio de neutrófilos o de linfocitos, según sea la etiología del derrame pleural13. En el caso del PA, el líquido pleural se suele comportar bioquímicamente como un trasudado. Sin embargo, en un artículo reciente13, 5 de los 11 casos con un PA tenían niveles de proteínas en el líquido pleural en el rango de los exudados. Ya que el PA y el PPA representan la continuidad de un mismo proceso, los autores justifican este hallazgo por el momento en que se lleva a cabo la toracocentesis. En estos casos de PA persistiría todavía una determinada fuga de proteínas al existir un cierto aumento de la permeabilidad capilar. El hallazgo de una LDHLP elevada es un indicador de la presencia de una enfermedad pleural activa y, por tanto, el diagnóstico de PA debería cuestionarse. Pero como en el caso anterior, el momento en que se lleva a cabo la toracocentesis es clave y podrían aceptarse como válidos valores ligeramente elevados de LDH que estarían reflejando una ligera inflamación subyacente que está en vías de desaparición13. El líquido de los derrames por un PA suele ser paucicelular, con predominio de mononucleares. La presencia de polimorfonucleares o de eosinófilos no es consistente con el diagnóstico de PA, ya que sugieren un proceso pleural activo. Si el número de células mononucleares es ligeramente elevado, se podrían tener en cuenta las mismas consideraciones que en el hallazgo de una LDHLP alta13.
Manometría pleuralLa medición de la PP durante la realización de una toracocentesis (mediante manometría pleural) aumenta la seguridad del paciente al reducir la probabilidad de la aparición de un edema por re-expansión pulmonar, que se caracteriza por el desarrollo de un edema pulmonar unilateral al reinsuflarse rápidamente un pulmón previamente colapsado, sea por un derrame pleural o por un neumotórax. Aunque clásicamente se recomienda no retirar más de 1-1,5l en una sola maniobra, se ha visto que con la manometría pleural se puede extraer una mayor cantidad de líquido siempre que la PP no alcance valores muy negativos1,21. Además, la manometría pleural se usa para el diagnóstico de un PNE, así como para predecir el éxito de la pleurodesis en el derrame pleural maligno22.
A capacidad residual funcional, la presión a nivel del espacio pleural es ligeramente negativa (entre –3 a –5 cmH2O), lo que permite un equilibrio entre las fuerzas de retroceso elástico del pulmón y la tendencia de la pared torácica a expandirse15. Esta presión no es uniforme a lo largo de todo el espacio pleural, de tal forma que se hace más negativa a medida que ascendemos desde la base pulmonar hacia el vértice, debido a que el gradiente en la presión del líquido pleural es distinto al de la presión de superficie. Se han propuesto varias teorías para explicar esta diferencia, si bien la más considerada en la actualidad mantiene que la presión del líquido pleural es siempre igual a la presión de la superficie pleural. Esta teoría sostiene que el gradiente de presión vertical es consecuencia de un flujo constante y viscoso que genera una columna continua de líquido a través del espacio pleural que evita el contacto entre las hojas pleurales. Esta circulación dependerá de la gravedad así como de las fuerzas ventilatorias y cardiogénicas23.
La medición directa de la PP en el espacio pleural normal es un reto tecnológico ya que, debido a la proximidad de las 2 hojas pleurales, la introducción de un catéter provocará una distorsión geométrica y producirá unas fuerzas de deformación que no reflejarán la presión pleural existente24. Sin embargo, si existe un derrame pleural, el catéter no dará lugar a estas fuerzas de deformación que influyen en la medición de la presión, por lo que, en este caso, sí reflejaría la presión existente para ese tamaño de derrame.
Los cambios de presión que se producen como consecuencia de la extracción de líquido se deben a 3 factores: a las fuerzas elásticas del pulmón y de la pared torácica que se ven alteradas por los cambios en la geometría del espacio pleural; al desplazamiento vertical de la acumulación de líquido provocada por los cambios geométricos, y a la disminución de la extensión vertical del líquido acumulado22,23,25. Hay que tener en cuenta que cuanto menos líquido tengamos —como pasa en la fase final del drenaje pleural—, más prevalecerán las fuerzas locales de deformación alrededor del catéter, por lo que los cambios de presión que se registren en ese momento estarán condicionados por la presencia del catéter9.
La información más importante que se obtiene con la manometría pleural es el conocimiento de las propiedades elásticas de la cavidad pleural. Asumiendo esto, los cambios de presión en el espacio pleural obtenidos tras la extracción de líquido reflejan los cambios en las fuerzas de retroceso y pueden ser evaluados en relación a la cantidad de líquido extraído con el cálculo de la elastancia del espacio pleural (PEL) (cambio en la presión del líquido pleural en cmH2O por litro de líquido extraído)9.
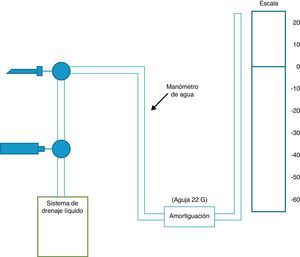
La medición de la presión en el líquido pleural se puede llevar a cabo mediante un simple manómetro de columna de agua, con amortiguación (mediante el uso de una aguja 22G) o sin ella, o bien mediante un sistema electrónico conectado a un transductor hemodinámico estándar9. El uso de amortiguación en el manómetro de agua sirve para reducir las oscilaciones de la columna de agua que se producen con los movimientos respiratorios (fig. 1). En la actualidad no existen manómetros digitales disponibles en el mercado, por lo que se utiliza un transductor de hemodinámica para registrar valores de presión pleural, tal y como lo describen Doelken et al.9. De todas formas, existe una buena correlación entre las mediciones obtenidas con los manómetros de agua con amortiguación y los digitales (r=0,97)9.
Esquema de un sistema de manometría pleural. El catéter que se introduce en el espacio pleural se conecta a una llave de 3 vías que permitirá medir la presión pleural o drenar el derrame, según en qué sentido se abra la llave de paso. En el manómetro de agua se instalará un sistema de amortiguación (aguja de 22G) para impedir grandes oscilaciones de la columna de agua con los movimientos respiratorios teniendo la precaución de que el punto cero de la escala de agua esté al mismo nivel que el catéter.
En cuanto a la técnica, esta se describe detalladamente en estudios previos9,26. Básicamente consiste en insertar un catéter en la zona más apical del derrame para evitar la fuerza vertical dependiente del peso del derrame y así poder registrar una presión inicial o de apertura más cercana a la real. Posteriormente se marca el punto cero (presión cero) de la columna de agua al mismo nivel donde se ha insertado el catéter, si bien el extremo distal de este puede estar por debajo. Tras medir la presión de apertura, se retira líquido pleural a través de otro sistema de vías conectado al catéter, y a continuación se vuelve a medir la presión pleural media, y así sucesivamente. Existen distintos protocolos en cuanto a qué cantidad de líquido retirar por cada medición. Al principio de la prueba se puede medir la presión tras el drenaje de 250cc, pero una vez que hemos retirado una cantidad de líquido importante, es más prudente hacerlo cada 50-100cc para evitar caídas muy bruscas de la PP9,27.
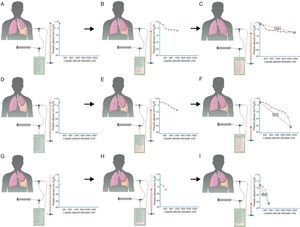
La presión inicial o de apertura es una medición que nos puede orientar sobre si un pulmón se expandirá de forma normal, de forma parcial (PPA) o no lo hará (PA). En los pulmones normales la PP inicial será ligeramente positiva, y a medida que se vaya retirando líquido la PP irá descendiendo lentamente, lo que sugiere que el pulmón vuelve progresivamente a su sitio hasta conseguir la aposición de ambas hojas pleurales, si somos capaces de retirar todo el líquido (fig. 2A-C). En el caso del PPA, la PP inicial también suele ser positiva y la primera parte de la curva se comportará como un pulmón normal. Sin embargo, llegado un momento, la PP caerá rápidamente, ya que el pulmón, que está en fase de atrapamiento, no es capaz de expandirse más. Es lo que se llama una curva bimodal (fig. 2D-F). Por último, en el PA, en el que existe una capa fibrosa a lo largo de la pleura visceral que impide la expansión del pulmón, la PP inicial es negativa y caerá rápidamente desde el inicio, a medida que se vaya retirando líquido (fig. 2G-I).
En un derrame pleural con un pulmón normal (2A) la PP inicial será ligeramente positiva. A medida que se retira líquido (2B) la PP descenderá lentamente y el pulmón se irá expandiendo progresivamente. Una vez retirado todo el derrame (2C) el pulmón contactará con la pared torácica y la PEL será normal. En el PPA la pleura visceral tendrá un ligero engrosamiento y la PP inicial será, como en el pulmón normal, ligeramente positiva (2D). Al retirar líquido, en un principio, el pulmón se expandirá progresivamente y la PP descenderá lentamente (2E). Llegado un punto, el pulmón queda atrapado, no se puede expandir más y la PP caerá rápidamente dando lugar a una PEL elevada con una curva presión/volumen bimodal (2F). En el PA, la pleura visceral tiene un capa de fibrina más gruesa que impide que el pulmón se expanda, por lo que la PP inicial será negativa (2G). La retirada de líquido, por un lado, y la rigidez del pulmón, por otro, provocarán un rápido descenso de la PP (2H) que conducirá a una PEL elevada (2I). (Modificado de Feller-Kopman et al.16, con permiso: http://chestjournal.chestpubs.org/site/misc/videos/diagrams1/index.htm).
La elasticidad del espacio pleural, es decir, la capacidad que tiene el pulmón de volver a su posición natural a medida que se extrae el líquido pleural, podemos medirla a través de la PEL. Para ello se construye un diagrama con curvas de presión/volumen. En el caso de un pulmón expansible, se obtiene una curva monofásica en la que la presión descenderá lentamente a medida que se extrae el líquido y la PEL será <14,5cmH2O/l9,27,28 (fig. 2C). En el PPA la curva será bifásica o bimodal: partiendo de una PP inicial ligeramente positiva, la PP caerá lentamente y durante esta fase la PEL será normal. Posteriormente, la PP comenzará a caer rápidamente, ya que el pulmón no puede expandirse más y la PEL se elevará (fig. 2F). Por último, en el PA la curva será, también, monofásica. La PP inicial es negativa y descenderá rápidamente desde el principio, por lo que la PEL será elevada (fig. 2I). Una PEL >14,5cmH2O/l sugiere un PNE y valores mayores de 19cmH2O/l se relacionan con fallo en la pleurodesis22.
La manometría pleural es una herramienta valiosa para documentar la mecánica anormal del espacio pleural pero, por sí misma, no es diagnóstica de un PA, ya que una PEL elevada también puede observarse en un PPA por una enfermedad maligna o inflamatoria. Igualmente, esta técnica nos permite llevar a cabo una toracocentesis evacuadora sin el riesgo de que se produzca un edema por re-expansión pulmonar ya que, en ese momento, la PP descendería rápidamente y se debería suspender el procedimiento. En 3 estudios en los que se llevó a cabo una manometría pleural para controlar las toracocentesis terapéuticas y que incluían más de 350pacientes no se describió ningún caso de edema por re-expansión pulmonar13,26,27. Dos estudios realizados en animales demostraron que el desarrollo de un edema por re-expansión pulmonar se correlaciona con la duración del derrame y con presiones pleurales excesivamente negativas29,30. En base a estos resultados se asume que una presión que no exceda de –20cmH2O es razonablemente segura, mientras que una presión de –40cmH2O es de alto riesgo para que se produzca un edema pulmonar. En el derrame pleural maligno la manometría pleural nos ayuda a predecir el éxito de la pleurodesis, ya que valores de PEL mayores de 19,5cmH2O se asocian a un fracaso de la misma y sería más conveniente utilizar otras modalidades terapéuticas, como la colocación de un catéter permanente. Por último, si durante una toracocentesis terapéutica se produce una caída brusca de la PP y el paciente desarrolla dolor torácico o disnea, la manometría pleural nos puede permitir restablecer la PP en el rango fisiológico al poder inducir un neumotórax dejando entrar aire de forma controlada en el espacio pleural, a través del propio sistema, hasta que esto se consiga13.
La prevalencia del PNE no es desdeñable. En una serie de 291 pacientes a los que se les realizó una toracocentesis terapéutica controlada con manometría pleural, uno de cada 3 (93/291; 32%) presentaban un PNE debido a una restricción pleural. Un total de 52 casos tenían un PA, y 41 tenían un PPA. Entre estos últimos, el 66% estaban relacionados, directa o indirectamente, con enfermedad maligna. Por tanto, parece razonable la sugerencia de los autores de que en los pacientes a los que se les realice una toracocentesis terapéutica es conveniente medir, de forma rutinaria, la PP por las implicaciones pronósticas y terapéuticas que esto conlleva31.
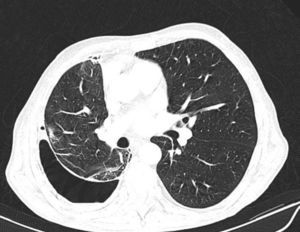
Tomografía computarizada de tóraxComo se ha mencionado anteriormente, los pacientes con un PPA o un PA tienen un engrosamiento de la pleura visceral. Sin embargo, es muy difícil observarlo en la radiografía de tórax, o incluso en la TC convencional, ya que su grosor suele ser de menos de 3mm. Para poder demostrarlo, Huggins et al. sugieren llevar a cabo lo que ellos denominan una TC con contraste de aire (fig. 3). La técnica consiste en realizar un neumotórax durante la manometría pleural a los pacientes que cumplan los siguientes criterios: aparición de una PP (menor de –25cmH2O) y exclusión —por la historia clínica y el análisis del líquido pleural— de una malignidad o de una inflamación pleural activa. La realización del neumotórax permite, por una parte, poner de manifiesto el engrosamiento de la pleura visceral y, por otra, poder seguir drenando líquido, si fuera necesario, y aliviar el dolor torácico generado por unas presiones excesivamente negativas. El procedimiento consiste en abrir una llave del circuito del manómetro para permitir la entrada de aire al espacio pleural hasta alcanzar presiones intrapleurales fisiológicas (presión media del líquido pleural de –5cmH2O). Este procedimiento solo puede realizarse bajo la monitorización y uso de un manómetro digital. Aun así, la demostración de un engrosamiento pleural, la persistencia de un neumotórax en condiciones de PP negativas y una PEL elevada, en ausencia de otras causas de PNE, establece la presencia de unas condiciones mecánicas consistentes —pero no diagnósticas— de un PA13.
En resumen, para establecer el diagnóstico de un PNE por una restricción de la pleura visceral se parte de una situación de sospecha clínica (hidroneumotórax post-toracocentesis o un derrame pleural que no se puede drenar por aparición de dolor torácico) y se necesita llevar a cabo un análisis del líquido pleural, determinar las presiones pleurales a medida que se drena el derrame y hacer una TC de tórax con contraste de aire. Dado que el PPA y el PA representan la continuidad de un mismo proceso, si se deja evolucionar, los resultados que se obtengan dependerán del momento en que se lleven a cabo estos procedimientos. El derrame pleural de un PPA se comportará bioquímicamente como un exudado y cursará con un número elevado de células (neutrófilos o linfocitos). Si se convierte en un PA, las características del líquido serán las de un trasudado con un pequeño contenido celular (linfocitos). En esta transformación se pueden encontrar derrames con un nivel proteico en el rango de los exudados o una LDH ligeramente elevada. La PP inicial en el caso de los PPA será ligeramente positiva y la primera parte de la curva se comportará como la de un pulmón normal. Pero a medida que se retira líquido la PP caerá rápidamente porque el pulmón queda atrapado, la curva tendrá forma bimodal y la PEL será normal o alta. En los PA la PP inicial es negativa y la curva descenderá rápidamente a medida que se drena el líquido con una PEL elevada. Por último, con la TC de tórax con contraste de aire se confirma el engrosamiento de la pleura visceral y se puede observar la persistencia del neumotórax en condiciones de una PP negativa.
TratamientoEn el PPA es básico tratar el proceso de base que ocasiona el derrame pleural lo antes posible. En el caso de un hemotórax hay que drenarlo rápidamente, y en las neumonías que cursen con un derrame paraneumónico hay que instaurar un tratamiento antibiótico precoz o un drenaje torácico si el derrame es complicado. En el derrame pleural maligno sintomático, y teniendo en cuenta que el PPA lleva consigo una disminución de la efectividad de la pleurodesis22, la primera opción terapéutica sería colocar un drenaje pleural permanente32. Si las medidas terapéuticas apropiadas no se toman con prontitud, el resultado final será un PA.
En el PA, la mayoría de pacientes se encuentran asintomáticos o bien tienen una pequeña disnea con el esfuerzo, por lo que no suelen requerir tratamiento alguno. La persistencia del derrame pleural no debe llevar a realizar toracocentesis evacuadoras repetidas, ya que el líquido se acumulará rápidamente en la misma cantidad que antes de ser vaciado en un intento de «normalizar» la PP negativa. En los casos en los que la disnea sea incapacitante para el paciente es muy importante excluir otras causas antes de llevar a cabo una decorticación pleural. Algunos autores opinan que intentar conseguir la re-expansión pulmonar con tubos de toracostomía solamente debería intentarse en pacientes sintomáticos con un PA y que sean malos candidatos para la cirugía13.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Fernando Vázquez Vázquez por el dibujo de las figuras.