Introducción
Además de la supresión del tabaquismo, que continúa siendo el principal elemento para reducir el riesgo de EPOC y controlar su progresión, y del tratamiento broncodilatador, otros tratamientos farmacológicos pueden resultar útiles en algunos de estos enfermos1. Así, los corticoides inhalados, los mucolíticos y los antioxidantes deben ser considerados como fármacos complementarios para el tratamiento de la EPOC.
Corticoides inhalados
El interés creciente por el papel de los corticoides inhalados en el control funcional y sintomático de la EPOC proviene del reconocimiento de su componente inflamatorio y de la buena respuesta del asma a estos fármacos. Sin embargo, es obvio que los resultados obtenidos en el asma no son necesariamente extrapolables a la EPOC.
Acción antiinflamatoria
Se especula que los corticoides inhalados podrían tener algún efecto sobre el desequilibrio del sistema proteasas/antiproteasas y sobre la reacción inflamatoria que caracteriza a la EPOC, con predominio de linfocitos T CD8+, células mononucleares, neutrófilos y macrófagos.
Los primeros estudios sobre las alteraciones inmunológicas y celulares inducidas por los corticoides inhalados en la EPOC se llevaron a cabo con muestras obtenidas mediante lavado broncoalveolar2 y esputo inducido3-5. Algunos de ellos resultaron negativos3, mientras que en otros se observó que los corticoides inhalados disminuían el número y la proporción de neutrófilos en el esputo inducido4. También se ha descrito una reducción de la actividad quimiotáctica y de la relación proteinasa/antiproteinasa en el esputo5. Sin embargo, la mayoría de estos trabajos resultaban contradictorios, lo que podría deberse a sus pequeños tamaños muestrales, al corto período de seguimiento y a la inclusión de pacientes con respuesta muy acusada a los broncodilatadores, que podrían ser asmáticos.
Balbi et al6 demostraron que 6 semanas de tratamiento con beclometasona (500 μg/8 h) originaban una reducción de la interleucina (IL) 8 y de la mieloperoxidasa en el lavado broncoalveolar, así como una disminución de las células totales y del porcentaje de neutrófilos, y un aumento de los macrófagos y linfocitos. La inhibición de la IL8 resulta de especial importancia, puesto que esta citocina, activada por el humo del tabaco, favorece la recogida de células inflamatorias en la vía aérea, especialmente granulocitos. Además, activa estas células para promover la liberación de mediadores inflamatorios, tales como la mieloperoxidasa.
Recientemente, se ha comprobado que la fluticasona disminuye la relación CD8/CD4 del epitelio bronquial y reduce el número de mastocitos subepiteliales, implicados por diversos datos in vitro e in vivo en la secreción de mocosidad7,8. Ha resultado más sorprendente la ausencia de efecto sobre los linfocitos T CD8+ o CD68+ y sobre los neutrófilos8. En función de estos hallazgos, se ha propuesto que los corticoides inhalados podrían prevenir el aumento de linfocitos T CD4+ en la mucosa bronquial, y reducir así el deterioro clínico de los enfermos y las exacerbaciones.
En cualquier caso, y aunque su mecanismo de acción no está completamente definido, los corticoides inhalados son capaces de alterar la reacción inflamatoria de la EPOC, como se comprueba por la reducción del óxido nítrico exhalado, aun sin ocasionar cambios significativos en el volumen espiratorio forzado en el primer segundo (FEV1)9. También cabe esperar que tengan más efecto en las formas leves o moderadas de la EPOC que en las graves, puesto que en estas últimas el daño de las vías aéreas y del parénquima pulmonar está más avanzado.
Efecto sobre la historia natural de la enfermedad
Diversos estudios han analizado la repercusión a corto plazo de los corticoides inhalados sobre la función pulmonar en la EPOC10-13. Algunos de ellos no detectaron mejoría funcional, mientras que otros demostraron una reducción de la hiperrespuesta bronquial10, de la tasa de deterioro de la función pulmonar11 o de los síntomas respiratorios12. Sin embargo, todos estos estudios presentan importantes limitaciones que cuestionan sus resultados. Algunos de ellos no son controlados11, emplean tamaños muestrales muy pequeños13 y, sobre todo, no sólo incluyen a pacientes con EPOC10,11,13.
Durante los últimos años se han efectuado algunos ensayos clínicos encaminados a valorar el efecto de los corticoides inhalados sobre la función pulmonar a más largo plazo. Paggiaro et al14 compararon el efecto de un tratamiento de 6 meses con fluticasona frente a placebo en 281 fumadores activos (49%) y ex fumadores con EPOC (FEV1 medio del 57%) sin reversibilidad bronquial (edad media de 62 años). Estos autores observaron que la fluticasona aumenta el FEV1, la FVC y los flujos mesoespiratorios, disminuye la tos y el volumen del esputo, e incrementa la distancia recorrida en la prueba de caminar 6 min, aunque sólo en 27 m. Sin embargo, la mejoría encontrada en la función pulmonar podría resultar transitoria, y este ensayo carece del tiempo de seguimiento necesario para valorar si los corticoides afectan al declinar anual del FEV1.
El Copenhagen City Heart Study (CCHS)15 incluyó a 290 pacientes evaluables (edad media de 59 años) con una EPOC de grado I (FEV1 medio del 86,2%), sin reversibilidad bronquial. Este ensayo, que no contempló el hábito tabáquico, comparó budesonida inhalada con placebo durante 36 meses, y no se detectaron diferencias en el deterioro anual del FEV1 entre la budesonida y el placebo (45,1 frente a 41,8 ml/año) ni en los síntomas respiratorios.
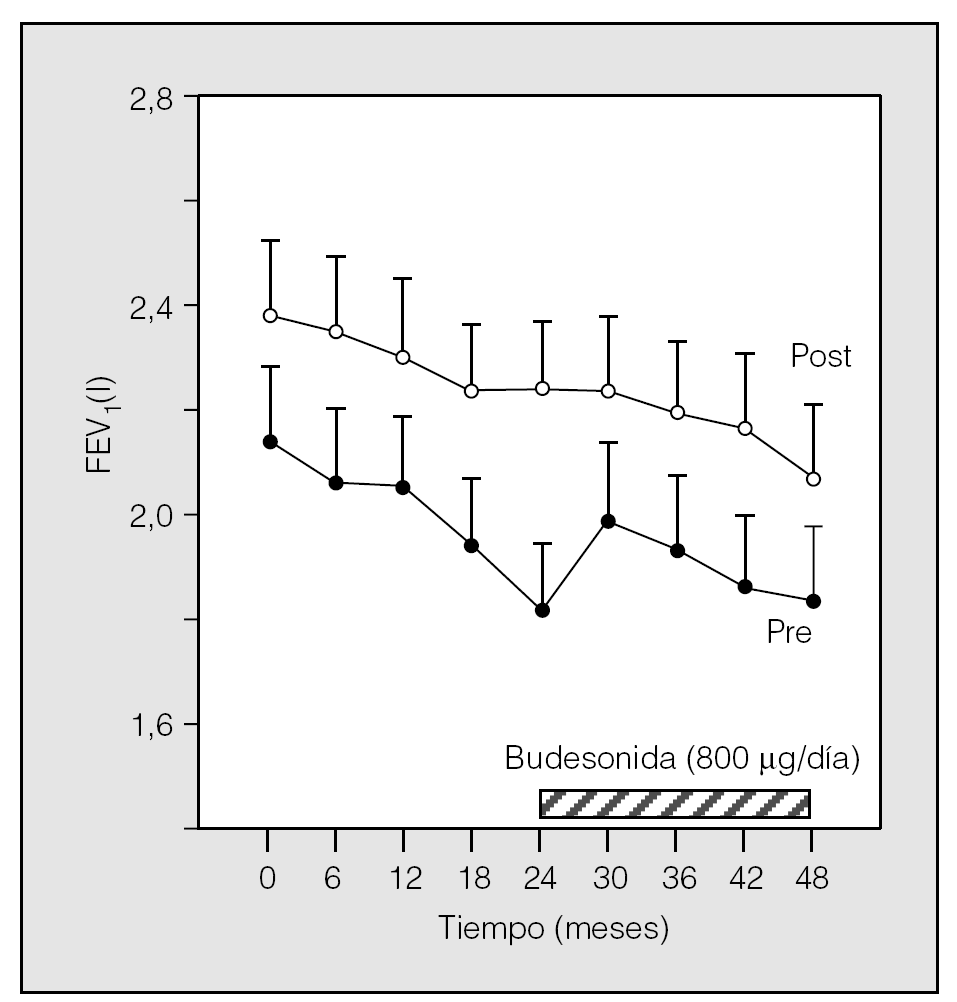
La comparación entre budesonida y placebo se repitió en el estudio EUROSCOP16, que evaluó su efecto a los 3 años en 1.277 fumadores activos, de 52 años de edad media, con una EPOC de grados I o IIA (FEV1 medio del 76,8%) sin reversibilidad bronquial. El grupo tratado con budesonida experimentó un incremento del FEV1 equivalente a 17 ml/año en los primeros 6 meses. Sin embargo, a partir de los 9 meses alcanzó un ritmo de deterioro similar al del grupo placebo (57 frente a 65 ml/año) (fig. 1). Al final de los 3 años de tratamiento, la pérdida global de FEV1 fue similar en el grupo tratado con budesonida y en el que recibió placebo (140 ml [4,3%] frente a 180 ml [5,3%]). En definitiva, de los datos de este ensayo se desprende que el beneficio de la budesonida sobre la función pulmonar en la EPOC se limita a los primeros 6 meses de tratamiento. Este hallazgo es concordante con lo descrito por Dompeling et al11 con la beclometasona.
Fig. 1. Evolución del volumen espiratorio forzado en el primer segundo (FEV1) pre y posbroncodilatador del grupo de pacientes tratados con budesonida en el estudio EUROSCOP. (Modificado de Pawels et al16.)
El Lung Health Study (LHS)17 evaluó a 1.116 enfermos, de 56 años de edad media, con un FEV1 medio del 68,5% (30-90%). La mayoría de los sujetos incluidos eran fumadores activos (90,5%) y fueron tratados con triamcinolona o placebo durante 40 meses. Aunque el deterioro del FEV1 resultó similar en ambos grupos, los pacientes que recibieron triamcinolona experimentaron una atenuación de la hiperrespuesta bronquial, de los síntomas respiratorios, principalmente tos y disnea, y del número de visitas médicas por problemas respiratorios.
Por último, el ensayo clínico ISOLDE incluyó a 751 pacientes de 64 años de edad media, con EPOC (FEV1 medio del 50,3%), sin reversibilidad bronquial18. Un 36% de estos pacientes eran fumadores activos y el resto, ex fumadores. Los enfermos fueron tratados durante 36 meses con fluticasona o placebo. Tampoco se detectó efecto alguno sobre el deterioro anual del FEV1, aunque una de las críticas que más se le plantean a este ensayo es la deficiente valoración de los pacientes con un deterioro rápidamente progresivo que abandonaron el estudio precozmente.
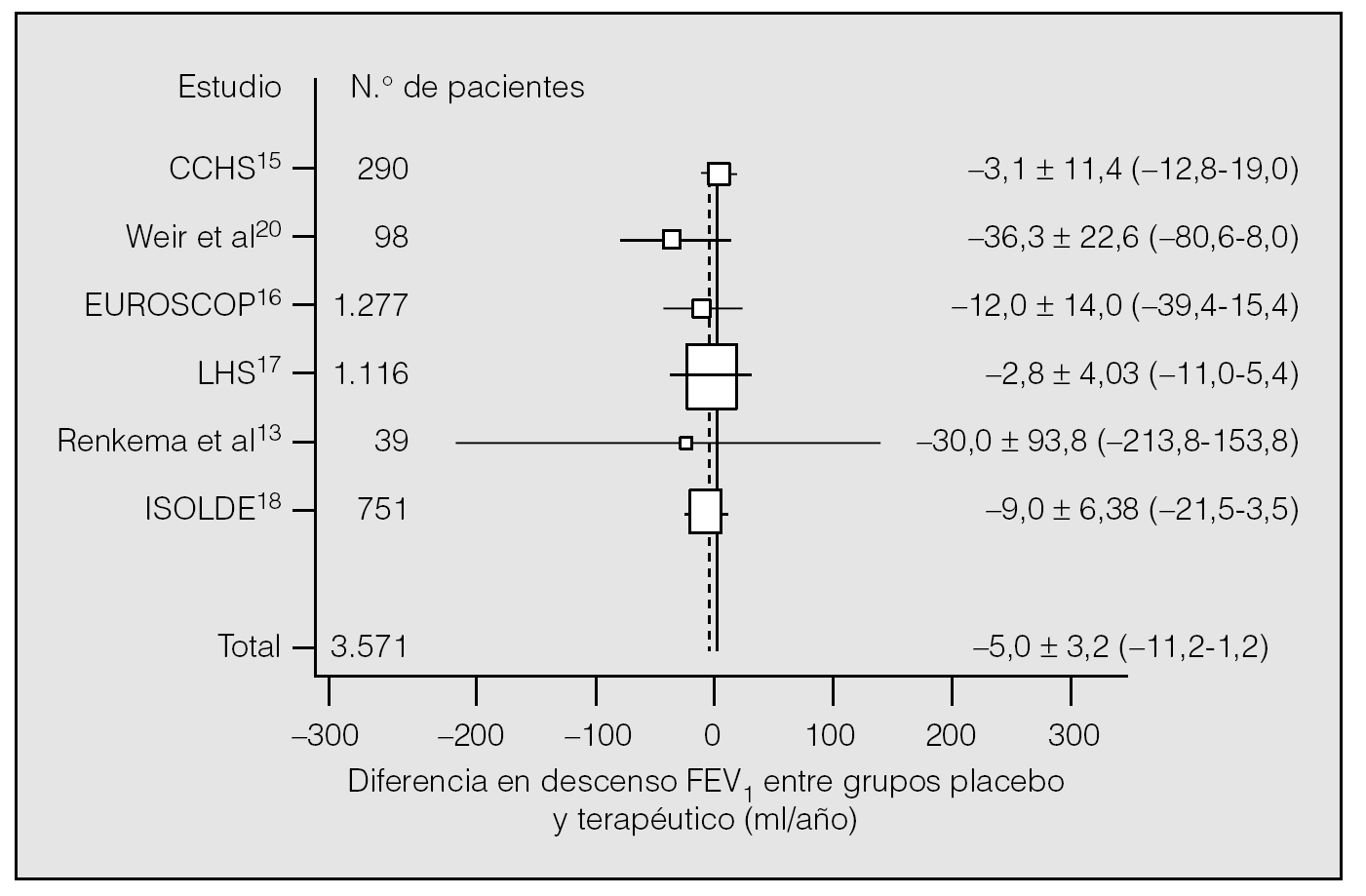
Un reciente metaanálisis ha seleccionado los ensayos clínicos aleatorizados y controlados con placebo llevados a cabo en pacientes con EPOC, con adecuada exclusión de asmáticos, y en los que la principal variable analizada fuese el deterioro del FEV1 con un período mínimo de seguimiento de 24 meses19. Además de los 4 ensayos clásicos ya mencionados15-18, se seleccionaron los estudios de Weir et al20 y de Renkena et al13, que incluyeron a un total de 3.571 pacientes, 1.784 de los cuales pertenecían a la rama de tratamiento. El análisis global identificó una diferencia en el deterioro del FEV1 de 5,0 ± 3,2 ml/año (intervalo de confianza [IC] del 95%: 11,2 a 1,2 ml/año) entre el grupo tratado y el placebo, por lo que se concluyó que los corticoides inhalados no tenían efecto sobre la función pulmonar a largo plazo (fig. 2).
Fig. 2. Efecto estimado de los corticoides inhalados en el deterioro del volumen espiratorio forzado en el primer segundo (FEV1) e intervalo de confianza del 95% de cada estudio analizado. El tamaño de la caja es representativo de la precisión de cada estudio. (Modificado de Highland et al19.)
Descartada la influencia de los corticoides inhalados sobre la historia natural de la EPOC, el estudio ISOLDE planteó otra alternativa para valorar el efecto de estos fármacos. En la fase de lavado previa a la aleatorización, los pacientes debían permanecer sin corticoides inhalados durante 7 semanas. En dicho período, se produjo un 38% de exacerbaciones en el grupo que había suspendido los corticoides, mientras que las agudizaciones sólo afectaron al 6% de los pacientes que previamente no usaban corticoides inhalados21. Este hallazgo sugiere que la abrupta supresión de los corticoides inhalados podría favorecer el desarrollo de reagudizaciones. Además, contrasta con la relativa inocuidad de la supresión de los corticoides sistémicos, que no incrementa el número de exacerbaciones ni modifica los parámetros espirométricos, la disnea ni la calidad de vida relacionada con la salud22.
Las consecuencias de la supresión del tratamiento con corticoides inhalados fueron ratificadas en un pequeño estudio prospectivo controlado con placebo, cruzado, aleatorizado y doble ciego, en el que se valoró la continuación con beclometasona o la administración de placebo durante 6 semanas en 15 ancianos con EPOC (FEV1 medio del 47%)23. Se comprobó que la retirada de los corticoides inhalados se asociaba con una disminución del FEV1 y un incremento de la disnea inducida por el ejercicio, sin cambios en la distancia recorrida en la prueba de caminar 6 min, en el análisis del esputo inducido ni en la calidad de vida.
El estudio COPE es la aproximación más completa al efecto de la supresión de los corticoides inhalados en la EPOC24. Este estudio incluyó a 244 pacientes con un FEV1 medio del 57%, tratados con fluticasona durante al menos 4 meses. Pasado dicho tiempo, los enfermos fueron aleatorizados para seguir con el mismo tratamiento o sustituir el corticoide por placebo durante 6 meses. Se comprobó que no se producían cambios entre los dos grupos en el FEV1 ni en la distancia recorrida en la prueba de la caminata de 6 min. No obstante, los pacientes tratados con placebo desarrollaron más exacerbaciones que los tratados con fluticasona (el 57 frente al 47%) y el tiempo hasta la primera exacerbación fue menor. Además, un 21,5% de los pacientes del grupo placebo desarrolló rápidas y repetidas agudizaciones que obligaron a reintroducir los corticoides. Por último, la supresión de la fluticasona se acompañó de un deterioro de la calidad de vida relacionada con la salud, con afección principal de los dominios de actividad y síntomas del cuestionario St. George.
En definitiva, los datos disponibles en la actualidad indican que la supresión del tratamiento con corticoides inhalados en pacientes con EPOC origina un inicio más rápido de las agudizaciones, un mayor riesgo de exacerbaciones recurrentes y un deterioro significativo de su calidad de vida. Sin embargo, es necesario recordar que hasta un 40% de los pacientes del estudio COPE no experimentó cambios con la supresión de los esteroides. En la actualidad, no se dispone de criterios que permitan identificar al subgrupo de pacientes con EPOC con mala tolerancia a la retirada de los corticoides inhalados.
Prevención de las exacerbaciones
Es un hecho reconocido que el FEV1 guarda una débil relación con la morbimortalidad de la EPOC25. Además, existen datos que sugieren que la mejoría del estado de salud inducida por el tratamiento puede no acompañarse de cambios relevantes en el FEV1. Ello ha llevado a seleccionar otros índices para valorar la respuesta a los corticoides inhalados en la EPOC, como los síntomas, la tasa de exacerbaciones, el estado de salud o la hiperrespuesta bronquial, que sí parecen tener capacidad predictora de la morbimortalidad de la enfermedad26,27.
En las formas moderadas-graves de EPOC (grados IIB y III), las exacerbaciones son una importante fuente de gasto sanitario y originan un deterioro de la calidad de vida. Como estudios preliminares en los que se incluía a enfermos con EPOC y asma sugerían que los corticoides inhalados podrían reducir el riesgo de exacerbaciones de la EPOC11, este aspecto fue valorado en algunos de los ensayos clínicos de larga duración que se han mencionado.
Paggiaro et al14 comprobaron, en pacientes con EPOC moderada-grave (grados IIB y III), que los corticoides inhalados no disminuyen el número de exacerbaciones, pero sí reducen el porcentaje de agudizaciones moderadas-graves de un 86 a un 60%. Las principales limitaciones de su estudio en este aspecto son su tamaño muestral, que no resulta demasiado amplio, el escaso número de agudizaciones experimentadas por los pacientes incluidos (menos de un tercio de los participantes) y la problemática definición de exacerbación.
El estudio EUROSCOP16 no valoró exacerbaciones, y el Copenhagen City Heart Study15 no detectó efecto del tratamiento sobre síntomas ni agudizaciones. Por el contrario, el Lung Health Study17 apreció una disminución de los síntomas respiratorios y de las visitas médicas por problemas respiratorios entre los enfermos que recibieron corticoides inhalados. Además, existía una tendencia no significativa a disminuir el número de hospitalizaciones en el grupo tratado con corticoides inhalados17.
La utilización de fluticasona en el estudio ISOLDE18 se asoció con una reducción del 25% en las exacerbaciones y del 24% en las interrupciones del estudio por problemas respiratorios. Además, la menor incidencia de agudizaciones detectada en el grupo tratado con corticoides inhalados se acompañó de una tasa de deterioro de la calidad de vida relacionada con la salud menos acusada18.
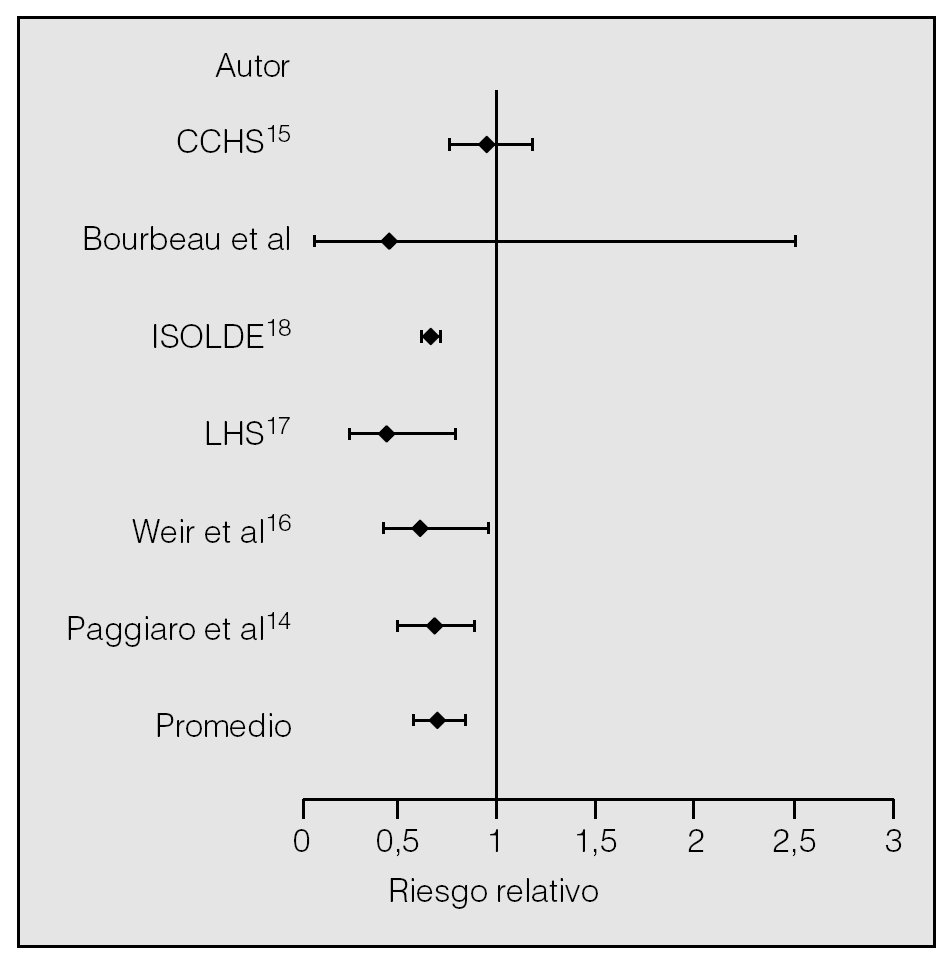
La eficacia de los corticoides inhalados en la disminución de las agudizaciones de la EPOC se ha analizado en una reciente revisión sistemática28 que incluye 9 ensayos clínicos aleatorizados, controlados con placebo, con una duración mínima de 6 meses. En 4 de los ensayos seleccionados se realizó tratamiento previo con corticoides sistémicos. El análisis global demuestra que los corticoides inhalados disminuyen la tasa de exacerbaciones en un 30% (IC del 95%: 0,58-0,84), independientemente del tratamiento previo con corticoides sistémicos (fig. 3). La principal discrepancia entre los ensayos analizados radicaba en la definición de exacerbación. De hecho, la retirada del análisis del CCHS15, que es el estudio con una definición menos rigurosa de exacerbación, incrementa la capacidad de los corticoides inhalados para prevenir exacerbaciones de la EPOC (riesgo relativo [RR]: 0,67).
Fig. 3. Riesgo relativo de exacerbaciones en pacientes con EPOC tratados con corticoides inhalados en comparación con placebo. Las líneas horizontales representan los intervalos de confianza del 95%. (Modificada de Alsaeedi et al28.)
En esta revisión sistemática también se concluye que los corticoides inhalados no tienen efecto sobre la mortalidad, aunque esta variable sólo se evaluó en 5 ensayos. Además, como la mayoría de los estudios incluye a pacientes con EPOC de grados I y IIA, el tamaño muestral global no resulta suficiente para excluir categóricamente esta posibilidad28.
Un nuevo análisis del estudio ISOLDE, en el que se diferencian los pacientes con EPOC leve de los que tienen una enfermedad moderada-grave, demuestra que el tratamiento con fluticasona disminuye la tasa de exacerbaciones en la EPOC moderada-grave (1,47 frente a 1,75/año), pero no en las formas leves de la enfermedad (0,67 frente a 0,92/año)29. Sin embargo, el número de pacientes con una o más exacerbaciones que requieren corticoides sistémicos se reduce tanto a las formas leves (el 8 frente al 16%) como a las moderadas-graves (el 17 frente al 30%). Estos resultados están en concordancia con el estudio de Paggiaro et al14, que refiere una disminución de las exacerbaciones que requieren ingreso hospitalario en pacientes con EPOC de grados IIB y III.
Durante los últimos años, 3 estudios fármaco-epidemiológicos han aportado más información y generado una considerable controversia. Sin y Tu30 realizaron un estudio de cohortes de base poblacional en Ontario, en el que analizaron las altas hospitalarias por EPOC en una muestra de 22.620 ancianos y registraron su evolución durante el año siguiente. Estos autores comprobaron que en los enfermos con EPOC que habían recibido corticoides inhalados, los reingresos se reducían un 24% y la mortalidad al año disminuía un 29%. Estos efectos eran independientes de la comorbilidad, del sexo y de la edad. En definitiva, su análisis sugería que la prescripción de corticoides inhalados al alta se asociaba con un descenso del 26% en el riesgo de muerte o reingreso de ancianos con EPOC. Por primera vez se planteaba que los corticoides inhalados podrían tener un efecto sobre la morbimortalidad de la enfermedad. Sin embargo, y pese a que los autores defienden la ausencia de sesgos y la mejor representación de las situaciones clínicas reales, no debe olvidarse que estos datos provienen de un estudio epidemiológico no controlado ni aleatorizado.
Un estudio de cohortes realizado un año más tarde en el Reino Unido sobre pacientes con EPOC atendidos por médicos generales confirma este hallazgo31. En la misma línea, Sin y Man32 efectuaron otro estudio observacional de seguimiento durante 3 años de las altas hospitalarias por EPOC en sujetos mayores de 65 años residentes en Alberta, y comprobaron que en aquellos en los que se identificó prescripción de corticoides inhalados la mortalidad por cualquier causa disminuía un 25% (RR: 0,75; IC del 95%: 0,68-0,82) y la de origen respiratorio, un 30% (RR: 0,80; IC del 95%: 0,53-0,93). Además, identificaron un efecto dependiente de la dosis de los corticoides inhalados, puesto que la mayor respuesta se producía en pacientes con prescripción de dosis altas-medias de corticoides (beclometasona ≥ 500 μg/día)32.
Estos estudios epidemiológicos tienen el indiscutible mérito de centrar el debate de la eficacia de los corticoides inhalados en la EPOC en torno a la morbimortalidad de la enfermedad. Sin embargo, están sujetos a importantes errores metodológicos23, entre ellos la mala clasificación diagnóstica, puesto que no excluyen a pacientes con asma como diagnóstico secundario, y la insuficiente medición de la exposición al fármaco de interés, realizada a partir de 2 prescripciones siguientes al alta hospitalaria. Recientemente, se ha descrito otro sesgo denominado "tiempo inmortal", en el que existen períodos en los que los pacientes no están expuestos a los riesgos de reingreso o fallecimiento por no estar contabilizados dentro del estudio33. Por todo ello, no existen todavía argumentos suficientes para concluir que los corticoides inhalados influyen en la mortalidad de la EPOC.
En cualquier caso, los datos disponibles señalan que los corticoides inhalados disminuyen las exacerbaciones de la EPOC, y que este efecto es más acusado en enfermos mayores de 65 años así como en las formas más graves de la enfermedad. En la actualidad, está en curso el ensayo clínico TORCH (Towards a Revolution in COPD Health) que probablemente aportará más información sobre esta acción.
Efectos secundarios
Los potenciales beneficios ocasionados por los corticoides inhalados en algunos aspectos de la EPOC no están exentos de efectos adversos. El uso de corticoides inhalados se ha relacionado con efectos secundarios dependientes de la dosis, como cataratas, supresión adrenal u osteoporosis34. Sin embargo, la duración de la mayoría de los ensayos clínicos realizados hasta la fecha podría no resultar suficiente para valorar algunos de sus efectos adversos.
En el estudio EUROSCOP, se describió una frecuencia de hematomas cutáneos del 10% en el grupo tratado con budesonida frente al 4% en el grupo placebo16. Menos del 5% de los pacientes desarrolló hipertensión de reciente diagnóstico, fracturas óseas, cataratas, miopatía o diabetes, y dichos porcentajes no fueron diferentes a los del grupo control16. En el Lung Health Study17 y en su segundo análisis35 se comprobó que la triamcinolona no suprime la función suprarrenal basal ni tras estimulación. Por el contrario, duplica el riesgo de hematomas cutáneos y disminuye la densidad ósea, tanto vertebral como femoral. En una revisión sistemática sobre los efectos secundarios de los corticoides inhalados se llega a algunos resultados diferentes28: que los corticoides inhalados incrementan la candidiasis orofaríngea (RR: 2,1), los hematomas cutáneos (RR: 2,1) y reducen los valores medios de cortisol (RR: 0,84).
Al margen de una mejor definición de los efectos adversos de los corticoides inhalados en la EPOC, se acepta que éstos son leves, relacionados con la dosis y probablemente con el tipo de corticoide utilizado, puesto que en el estudio EUROSCOP no se evidenció pérdida de masa ósea con budesonida16, mientras que en el LHS sí se perdió con triamcinolona17.
Las recomendaciones internacionales vigentes en la actualidad aconsejan el uso de corticoides inhalados en aquellos pacientes sintomáticos con EPOC que muestren una respuesta espirométrica documentada a los mismos y en los enfermos con grados IIB o III con frecuentes exacerbaciones que requieran antibióticos y corticoides orales36. En España, la Conferencia de Consenso sobre la Enfermedad Pulmonar Obstructiva Crónica recomienda utilizar corticoides inhalados en pacientes con enfermedad mal controlada y exacerbaciones frecuentes, en enfermos que presenten una mejoría funcional significativa tras un ensayo esteroideo y en los que tengan una prueba broncodilatadora positiva37.
Tratamiento combinado con broncodilatadores
Desde hace algunos años, se ha propuesto que los corticoides inhalados podrían tener un efecto sinérgico con los broncodilatadores, principalmente agonistas β2 adrenérgicos y teofilinas. De hecho, se han aportado algunos datos que, en estudios de corta duración, demuestran una mayor mejoría funcional y sintomática que con la monoterapia.
Soriano et al38 estudiaron el efecto de la asociación salmeterol y fluticasona frente a la monoterapia con salmeterol en pacientes recién diagnosticados de EPOC. Comprobaron que la supervivencia a los 3 años de seguimiento fue mayor en el grupo tratado con la asociación (78,6%) que en el tratado sólo con salmeterol (63,6%).
En los últimos años, se han publicado varios ensayos clínicos en los que se valora la combinación de un agonista β2 adrenérgico de larga duración con un corticoide inhalado. Szafranski et al39 seleccionaron a 812 pacientes con EPOC de grados IIB y III (FEV1 medio del 36%), que fueron tratados durante un año de forma aleatoria con budesonida y formoterol en el mismo dispositivo o con cualquiera de los fármacos aislados o placebo. Comprobaron que la terapia combinada se asociaba a una reducción de las exacerbaciones graves por paciente y año, tanto con respecto a placebo como a formoterol, así como a un menor uso de corticoides sistémicos. También detectaron un incremento del FEV1 y una disminución de los síntomas y del uso de broncodilatadores de rescate en comparación con el placebo y la budesonida. Además, el tratamiento combinado incrementaba la calidad de vida relacionada con la salud en relación con el placebo. En definitiva, la terapia combinada de budesonida y formoterol resultaba más eficaz que la monoterapia en pacientes con EPOC moderada-grave.
En el estudio TRISTAN se comparó la terapia combinada de salmeterol y fluticasona con la monoterapia y placebo en 1.465 pacientes40. Después de 12 meses, el tratamiento combinado aumentaba el FEV1 con respecto a la monoterapia, tanto el pre (73-99 ml) como el posbroncodilatador (31-48 ml). Incrementaba la calidad de vida relacionada con la salud y reducía la disnea y el uso de medicación de rescate con respecto a la fluticasona. No modificaba, sin embargo, el número total de exacerbaciones ni las agudizaciones graves, en relación con la monoterapia.
La asociación de fluticasona y salmeterol en el mismo disco inhalador también ha sido comparada con la monoterapia durante 24 semanas. Se ha apreciado que aumenta el FEV1, pero que no modifica la disnea ni la calidad de vida41.
Las razones por las que el tratamiento combinado podría ser mejor que la monoterapia todavía son objeto de especulación. En el asma se ha comprobado que los agonistas β2 adrenérgicos de larga duración potencian los efectos antiinflamatorios de los corticoides. Además, es conocido que los corticoides aumentan el número de receptores β2 y que el tratamiento combinado es más eficaz que la monoterapia para disminuir la liberación de IL-8 desde el músculo liso de las vías aéreas41.
Corticoides sistémicos
Los corticoides sistémicos inducen alguna mejoría en pacientes con EPOC e hiperrespuesta bronquial, pero sus importantes efectos secundarios desaconsejan su uso de forma sistemática1,36,42. Además, se asocian a una mayor mortalidad, que no se sabe si es debida al propio tratamiento o a la mayor gravedad de la enfermedad.
La importancia de los corticoides sistémicos en el tratamiento de la exacerbación de la EPOC está mejor definida. Una revisión sistemática Cochrane que incluyó 7 estudios controlados concluye que mejoran la función pulmonar en las primeras 72 h de las reagudizaciones, aunque a costa de considerables efectos secundarios43. Ese mismo año, Sayiner et al44 demostraron que la prolongación del tratamiento hasta los 10 días logra mejorías adicionales con respecto a los 3 días.
Se ha comprobado que el tratamiento de los pacientes con agudizaciones con altas dosis de esteroides sistémicos origina un menor número de fracasos terapéuticos, con una mejoría funcional más rápida y un menor tiempo de hospitalización45. La prolongación del tratamiento durante 8 semanas no ha demostrado un beneficio adicional sobre el tratamiento durante 2 semanas45.
Mucolíticos
Diversos fármacos mucocinéticos y mucorreguladores, como el ambroxol, erdosteína, carbocisteína o glicerol yodado, podrían resultar beneficiosos en algunos pacientes con esputo muy viscoso34. Un metaanálisis sobre el papel de los mucolíticos en el tratamiento de la EPOC, en que se incluyeron 23 ensayos clínicos, demostró una reducción significativa en el número de exacerbaciones de hasta un 29%, una disminución del número de días de incapacidad y un incremento del número de pacientes libres de exacerbación, a costa de escasos o nulos efectos adversos46. No se comprobó que este tipo de fármacos tuvieran efecto alguno sobre la función pulmonar. Sin embargo, la mayoría de los estudios analizados eran de corta duración (2-6 meses) e incluían a pacientes con EPOC grados I o IIA.
Antioxidantes
La N-acetilcisteína es un compuesto que contiene cisteína, agente antioxidante que penetra en las células donde es desacetilado a L-cisteína, que participa en la síntesis de glutatión, uno de los sistemas antioxidantes más importantes de las células. Este sistema protege al pulmón del daño inducido por agentes oxidantes y, en animales, inhibe el engrosamiento epitelial y la hiperplasia de células secretoras originados por el humo del tabaco47. In vitro, la N-acetilcisteína inhibe la quimiotaxis de neutrófilos y monocitos47.
Se han realizado varios ensayos clínicos con un seguimiento cercano a los 6 meses, en los que se demuestra que la N-acetilcisteína mejora los síntomas y reduce un 41% el número de exacerbaciones, de forma dependiente de la dosis. Dos metaanálisis48,49, en los que se analizan 8 ensayos clínicos realizados en pacientes con bronquitis crónica, concluyen que la N-acetilcisteína reduce un 20% las exacerbaciones y que su eficacia es mayor en los pacientes con enfermedad leve-moderada, mientras que resultaba dudosa en la EPOC grave. En pocos meses, se dispondrá de los resultados del estudio BRONCUS, un ensayo clínico aleatorizado a largo plazo que valora el efecto de la N-acetilcisteína sobre el deterioro del FEV1 y la reducción de las exacerbaciones.
El mecanismo por el que la N-acetilcisteína reduce las exacerbaciones podría estar relacionado con la inhibición del crecimiento bacteriano intrabronquial durante el intervalo libre de infección en pacientes con bronquitis crónica. Este mecanismo no es bien conocido, pero probablemente esté relacionado con la inhibición de la adherencia de las bacterias a las células ciliadas epiteliales del tracto respiratorio47.
Se especula que el ambroxol también podría tener un efecto antioxidante, puesto que se ha comprobado que disminuye la producción de oxidantes por las células de lavado broncoalveolar de pacientes con EPOC50.