El síndrome de Birt-Hogg-Dubé (SBHD) es una rara entidad clínico-patológica designada con el nombre de los 3 médicos canadienses que la describieron en 19771. Su prevalencia se estima en 1/200.000 nacimientos. La causa subyacente es una mutación en el gen FCLN —que codifica la foliculina— localizado en el cromosoma 17p11.22. Clínicamente está caracterizado por la presencia de lesiones cutáneas, quistes pulmonares que pueden asociarse a neumotórax de repetición y tumores renales3. Presentamos el caso de un paciente diagnosticado de este síndrome tras presentar múltiples neumotórax de repetición.
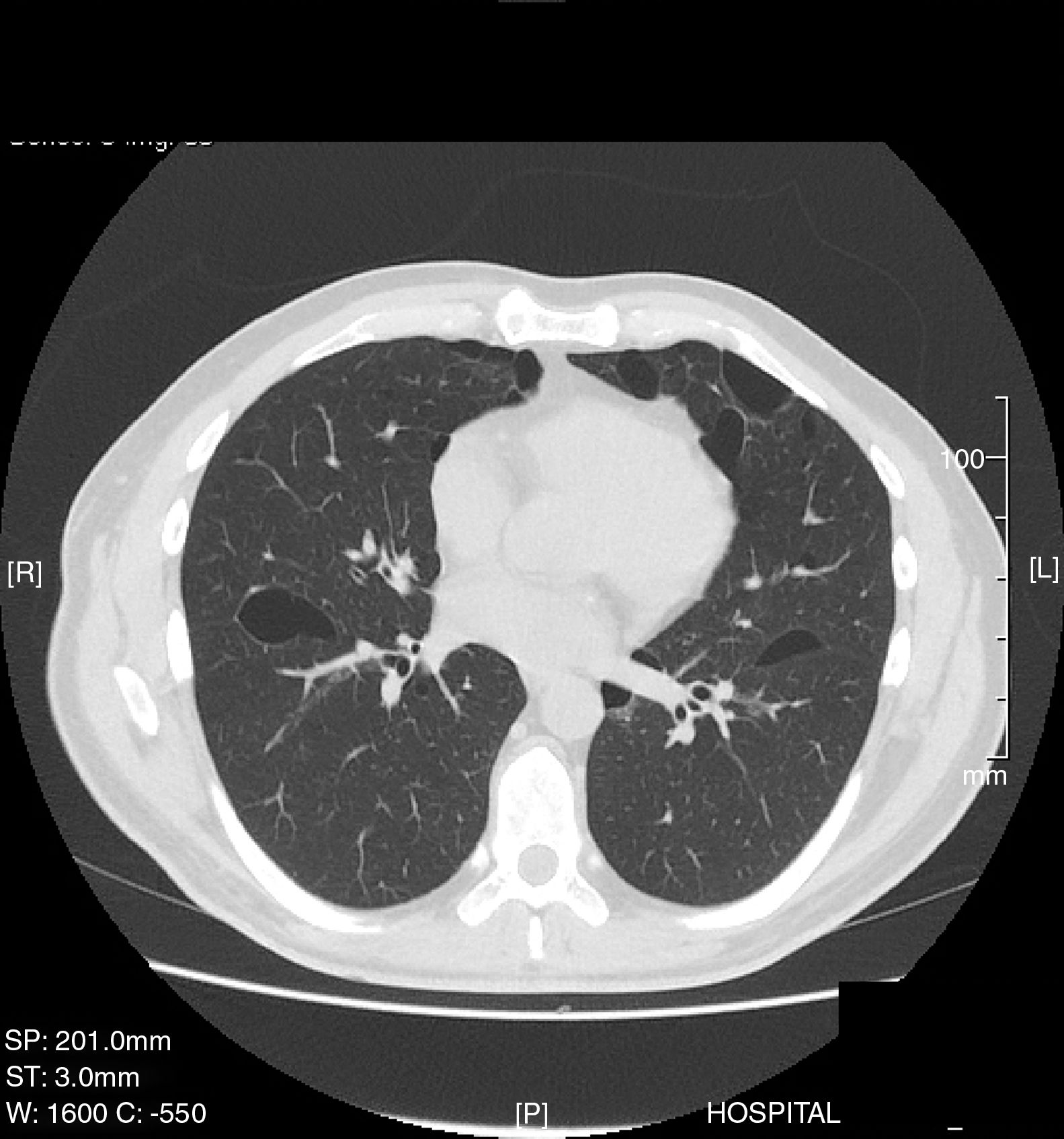
Varón de 35 años, no fumador y con antecedentes patológicos de hipertensión arterial y asma bronquial que ingresa en urgencias por dolor escapular derecho de una semana de evolución. La radiografía de tórax revela un neumotórax derecho completo sin otras alteraciones pulmonares, por lo que se coloca un drenaje torácico y evoluciona favorablemente. A los 30 días presenta un nuevo episodio de neumotórax derecho completo por lo que se indica una videotoracoscopia derecha en la que se observa la presencia de pequeñas bullas apicales que se resecan, más abrasión mecánica pleural del tercio superior del hemitórax. El paciente evoluciona favorablemente y es dado de alta hospitalaria a los 3 días postintervención. El resultado del estudio histológico es compatible con presencia de bullas enfisematosas. Cuatro años más tarde ingresa nuevamente en urgencias por un cuadro de dolor pleurítico izquierdo diagnosticándose de un neumotórax izquierdo completo. Se lleva a cabo una TAC torácica que informa del neumotórax más la presencia de múltiples cavidades quísticas bilaterales de tamaño significativo y predominio basal (fig. 1). Dado el antecedente de un neumotórax contralateral intervenido se realiza una videotoracoscopia izquierda, resecándose la porción apical del ápex más abrasión mecánica pleural del tercio superior del hemitórax. El estudio histológico del ápex pulmonar resecado es compatible con la presencia de bullas enfisematosas, sin otras alteraciones. El paciente evoluciona favorablemente siendo dado de alta a los 3 días. Dos años más tarde reingresa por cuadro de recidiva completa de su neumotórax derecho, por lo que se practica una nueva videotoracoscopia derecha, realizándose una pleurodesis química con 8g de talco. Ante el carácter recidivante y bilateral de los episodios de neumotórax con la presencia en la TAC de quistes bilaterales se realiza un estudio clínico completo, en el que llamaron la atención unas discretas lesiones cutáneas papulosas de aspecto microquístico en la región frontal del paciente las cuales se biopsian con resultado histológico de fibrofoliculomas. La presencia de neumotórax bilaterales de repetición, cavidades quísticas pulmonares bilaterales y fibrofoliculomas cutáneos hace sospechar la posibilidad de un SBHD, por lo que se llevó a cabo estudio en sangre periférica del gen FLCN, cuyas mutaciones se asocian con la aparición de este síndrome, se detectó un cambio en el exón 11 del gen FLCN en la posición 1285 consistente en la deleción de una citosina. Este cambio supone la introducción de un codón de parada prematuro y el consiguiente truncamiento de la proteína. Dada la asociación del síndrome con tumores renales se realiza una TAC abdominal que es normal. El paciente no ha presentado recidiva de sus neumotórax hasta el momento. Se solicitó un análisis histológico más exhaustivo de las muestras de tejido pulmonar obtenido en las 2 primeras intervenciones quirúrgicas. El nuevo informe confirma que las bullas pulmonares tanto del ápex derecho como del izquierdo están rodeadas por paredes alveolares normales y que protruyen en los septos interlobulillares, estas características histológicas se han descrito (junto a la presencia de septos intraquísticos y a la profusión de vénulas en el espacio quístico) como características del SBHD4.
El SBHD es una rara genodermatosis de herencia autosómica dominante caracterizada esencialmente por la presencia de fibrofoliculomas y/o tricodiscomas cutáneos, quistes pulmonares, neumotórax espontáneos y tumores renales. El gen implicado en este síndrome —FLCN—, codifica la foliculina, que se expresa preferentemente a nivel cutáneo, renal y pulmonar5. Los criterios mayores para el diagnóstico del SBHD son las mutaciones del gen FLCN en el estudio genético más la presencia de las lesiones cutáneas (fibrofoliculomas o tricodiscomas)6. Dentro de las manifestaciones extracutáneas las más frecuentes son las neumológicas: hasta un 80% de los pacientes con SBHD presentan quistes pulmonares, que pueden ser asintomáticos durante años7. El número y tamaño de las lesiones varía de un paciente a otro, oscilando desde quistes de pequeño tamaño a bullas de varios centímetros, localizadas sobre todo en las bases pulmonares y a nivel subpleural. Se ha visto una relación entre el mayor tamaño y volumen de los quistes y el mayor riesgo de desarrollar neumotórax. Entre los pacientes que presentan quistes pulmonares, aproximadamente un 20-30% presentan historia de neumotórax, siendo el número medio de 2 episodios. Además, cuando se estudian los pacientes con historia de neumotórax la gran mayoría presentan quistes pulmonares múltiples. El pulmón más afectado suele ser el derecho, aunque pueden afectarse ambos hasta en un 23% de los casos8. Un reciente estudio ha hallado que el 5-10% de los neumotórax espontáneos primarios estarían relacionados con un SBHD9. La fisiopatología de los quistes pulmonares es desconocida, la teoría más actual es la «stretch hypothesis»10 que sugiere que el origen de los quistes podría estar en los defectos de adhesión celular generados por la mutación. Con el tiempo la expansión pulmonar repetida «sobre-expande» el espacio alveolar especialmente en las regiones pulmonares con mayores cambios en el volumen alveolar. La TAC torácica es la exploración óptima para el diagnóstico de la afectación pulmonar11,12.
La prevalencia de tumores renales en estos pacientes varía según los estudios de un 6,5 a un 34%7, con una predilección por el sexo masculino y una edad de presentación comprendida entre los 20-55 años13. Las lesiones renales suelen ser bilaterales y multifocales, con unos determinados tipos histológicos entre los que se incluirían 5: formas híbridas de oncocitoma y carcinoma cromófobo (50%) o formas puras de carcinoma cromófobo (34%), oncocítico (5%), de células claras (3%) o papilar (2%)7,14.
Referente a la asociación, por parte de algunos autores, del SBHD y el cáncer de colon, no se ha descrito una indicación específica de colonoscopia en estos pacientes, siendo la recomendación la misma que para la población general15.
En conclusión, ante la presencia de un paciente con múltiples neumotórax de repetición con una TAC que revela quistes pulmonares bilaterales, cabe plantear una exploración dermatológica en busca de lesiones cutáneas accesibles a biopsia y un estudio genético. Este diagnóstico justifica el estudio abdominal y el seguimiento de estos pacientes para detectar y tratar precozmente posibles tumores renales.