Sr. Director: La proteinosis alveolar pulmonar (PAP) es una rara enfermedad de origen desconocido, descrita por primera vez en 1958, que se origina como consecuencia de una acumulación anormal de fosfolípidos del surfactante en el espacio alveolar por un defecto de aclaramiento del macrófago alveolar. Los pacientes con PAP tienen un riesgo aumentado de presentar infecciones, principalmente debidas a Nocardia, micobacterias y Pneumocystis jiroveci. Presentamos un caso de proteinosis alveolar con infección concurrente por Streptococcus pneumoniae, en el que el tratamiento de la infección, junto con los corticoides, fue suficiente para la resolución del cuadro.
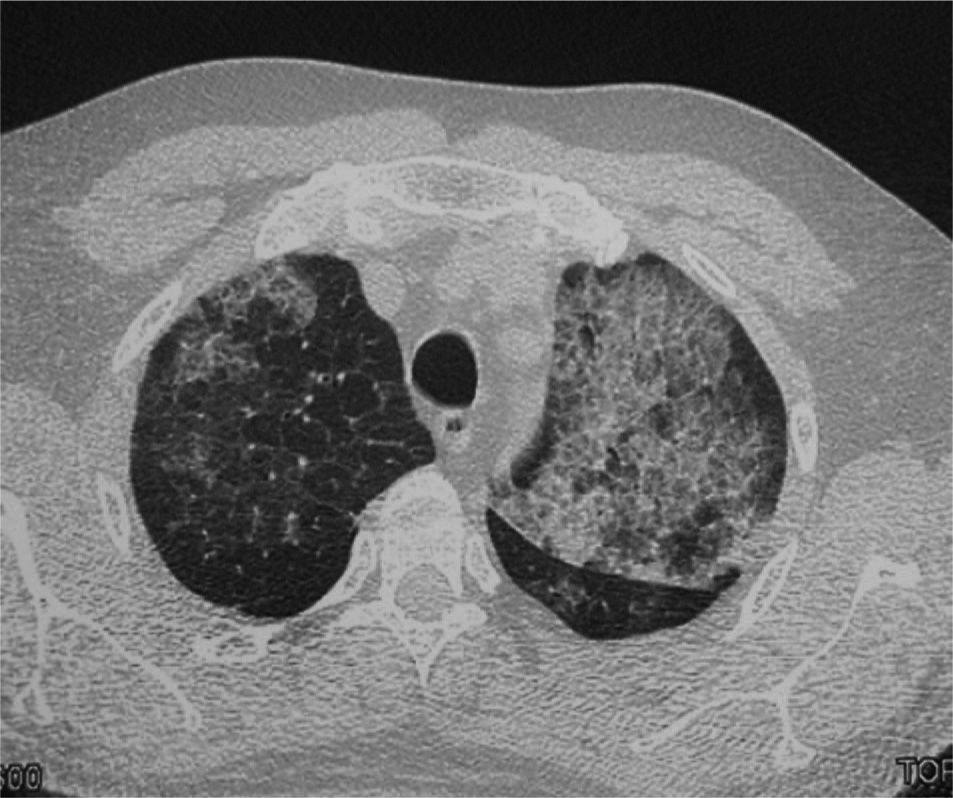
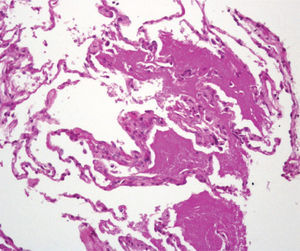
Varón de 47 años, funcionario de profesión, fumador activo con un índice de paquetes-año de 20, una vida basal activa y sin antecedentes médicos ni quirúrgicos de interés. Trasladado al Servicio de Urgencias por un cuadro sincopal, refirió que en los 3 últimos días había presentado tos con expectoración verdosa, dolor de tipo pleurítico en el hemitórax derecho, sensación distérmica (no termometrada), sudación y malestar general. En la exploración física se observaron taquicardia, saturación arterial de oxígeno del 92% y temperatura de 38 °C. En la analítica destacaban: 16.410.000/ml leucocitos con neutrofilia del 85%, creatinina de 1,5 mg/dl, bilirrubina total de 1,8 mg/dl, gammaglutamil transpeptidasa de 90 U/l, ferritina de 952 ng/ml y proteína C reactiva de 20,6 mg/dl. La gasometría arterial basal al ingresar el paciente presentaba los siguientes valores: pH, 7,48; presión arterial de anhídrido carbónico, 26 mmHg; presión arterial de oxígeno, 71 mmHg; HCO3, 19,4 mmol/l, y saturación de oxígeno, del 95%. La radiografía de tórax revelaba infiltrados alveolointersticiales difusos en ambos campos pulmonares. La antigenuria de Legionella fue negativa y en 2 hemocultivos creció S. pneumoniae. La tomografía axial computarizada de alta resolución (TACAR) del tórax mostró múltiples áreas de vidrio deslustrado que se extendían a ambos campos pulmonares, afectaban en mayor medida al lóbulo superior izquierdo y respetaban relativamente ambos senos costofrénicos posteriores y las regiones periféricas posteriores de los campos pulmonares. Alguna de las lesiones presentaba borde geográfico. En muchas localizaciones había un engrosamiento de los septos interlobulillares asociado a vidrio deslustrado (fig. 1). Las pruebas de función respiratoria presentaban los siguientes valores: capacidad vital forzada (FVC), 4.780 ml (100%); volumen espiratorio forzado en el primer segundo (FEV1), 3.360 ml (90%); FEV1/FVC, 73,3%; volumen residual (VR), 1.590 ml (75%); capacidad pulmonar total (TLC), 6.210 ml (89%); VR/TLC, 79%, y capacidad de difusión del monóxido de carbono, 7,30 mmol/min/kPa (70%). La fibrobroncoscopia mostró una mucosa edematosa y friable en ambos árboles bronquiales. La citología del broncoaspirado y del lavado broncoalveolar (LBA) fue negativa para malignidad, y el frotis del LBA mostró el siguiente recuento diferencial: un 73% de macrófagos, un 20% de linfocitos y un 7% de polimorfonucleares. En la biopsia transbronquial se identificó un parénquima pulmonar con macrófagos intraalveolares espumosos y depósitos intraalveolares de un material amorfo, que fue positivo en la reacción del ácido peryódico de Schiff (fig. 1). Durante el ingreso se iniciaron oxigenoterapia y tratamiento antibiótico con levofloxacino, con lo que mejoró de forma parcial el estado del paciente, que presentó fiebre ocasionalmente. Ante la falta de mejoría de las lesiones radiológicas, se indicó tratamiento con deflazacort (60 mg al día) y omeprazol, tras lo cual desapareció por completo la fiebre y el paciente mejoró notablemente, por lo que se le dio de alta. Durante sus revisiones en consulta se observó una mejoría tanto clínica como radiológica y pudo reducirse paulatinamente la dosis de corticoides hasta su retirada. La radiografía de tórax de control realizada al año del ingreso era normal.
Tomografía computarizada de tórax que muestra el típico patrón en empedrado, con opacidad alveolar en vidrio deslustrado y engrosamiento lineal septal de distribución parcheada y difusa. En la parte inferior se muestra un detalle de la biopsia transbronquial, donde se observa que los espacios alveolares están ocupados por un material eosinofílico y acelular que fue positivo en la reacción del ácido periódico de Schiff (PAS). (PAS, ×20.)
Se han descrito 3 formas clínicas de la PAP: congénita, secundaria e idiopática o primaria. La forma secundaria se ha relacionado con enfermedades hematológicas (leucemia, mieloma y algunos linfomas), con la exposición a humos tóxicos, polvos inorgánicos y fármacos (busulfán, clorambucil), y con infecciones (Nocardia, micobacterias y P. jiroveci). La forma idiopática o primaria corresponde al 90% de los casos y es de etiología desconocida. La media de edad en el momento del diagnóstico es de 39 años (rango: 2050 años) y se observa un predominio masculino. La mayoría de los pacientes con PAP presenta disnea de comienzo insidioso y carácter progresivo, acompañada de tos. Es infrecuente la presencia de hemoptisis o dolor torácico. En la radiografía de tórax se observan infiltrados intersticiales bilaterales con un patrón micronodular mal definido, a menudo con predominio en la región perihiliar, indicativo de edema pulmonar, pero sin otros signos radiográficos como insuficiencia cardíaca izquierda. La TACAR muestra una opacidad difusa y parcheada en vidrio deslustrado, asociada a un engrosamiento lineal superpuesto de los septos inter e intralobulares, de distribución central o periférica, patrón que se conoce como crazy-paving o "en empedrado". Aunque este patrón en la TACAR es sumamente indicativo de PAP, también puede observarse en otras enfermedades, como infecciones (P. jiroveci), neoplasias (carcinoma bronquioloalveolar), enfermedades idiopáticas (sarcoidosis, neumonía intersticial no específica), enfermedades inhalatorias, enfermedades sanguíneas (síndrome de hemorragia pulmonar) y en el síndrome de distrés respiratorio1. En las pruebas de función pulmonar se observa por regla general una alteración ventilatoria restrictiva con una desproporcionada y acusada reducción de la capacidad de difusión del monóxido de carbono. En el LBA se encuentra un material opalescente, viscoso y de aspecto lechoso, con macrófagos alveolares espumosos, así como un aumento del número de linfocitos y poca cantidad de otras células inflamatorias2. La biopsia pulmonar, ya sea transbronquial o abierta, es la prueba definitiva para establecer el diagnóstico de la PAP, aunque en muchos casos no es necesaria3.
Los pacientes con PAP tienen un riesgo aumentado de contraer infecciones por patógenos respiratorios4. Nuestro paciente comenzó con una clínica aguda, en el hemocultivo creció S. pneumoniae y el tratamiento con antibiótico y corticoides se siguió de una buena respuesta. Esto nos llevó a preguntarnos si la infección, más que consecuencia de la PAP, fue la causa originaria de ésta, como se ha descrito en un subgrupo de pacientes con proteinosis secundarias. En cuanto a la respuesta favorable a los corticoides en la proteinosis, no hemos encontrado ninguna referencia en la literatura médica. En todo caso, probablemente en nuestro paciente fue determinante la acción antiinflamatoria coadyuvante de estos fármacos, unida a la del propio antibiótico. Aunque algunas formas primarias remiten de manera espontánea, se han descrito resultados favorables con el factor estimulante de colonias granulocíticas y microcíticas5. A pesar de los avances en el tratamiento, el lavado pulmonar total6 sigue siendo el tratamiento de referencia, con una tasa de recurrencia, aunque sea transitoria, del 80%4.
- Home
- All contents
- Publish your article
- About the journal
- Metrics