Presentamos el caso de un varón de 6meses de edad con hipertensión pulmonar (HTP) grave que presentó empeoramiento clínico con edema agudo de pulmón (EAP) tras el inicio del tratamiento vasodilatador convencional. Acudió remitido de otro centro para una segunda opinión y para completar estudio de la HTP. Se obtuvo consentimiento de los padres para la publicación del caso y las imágenes.
Se trataba de un paciente fruto de gestación controlada, con serologías negativas y ecografías normales. Recién nacido a término con peso adecuado para la edad gestacional, sin incidencias perinatales. Como antecedentes familiares destacaba un aborto espontáneo y 2 hermanos vivos sanos de rama materna. A los 3meses de edad comenzó con dificultad para la ingesta, fallo de medro e hipotonía con leve retraso psicomotor.
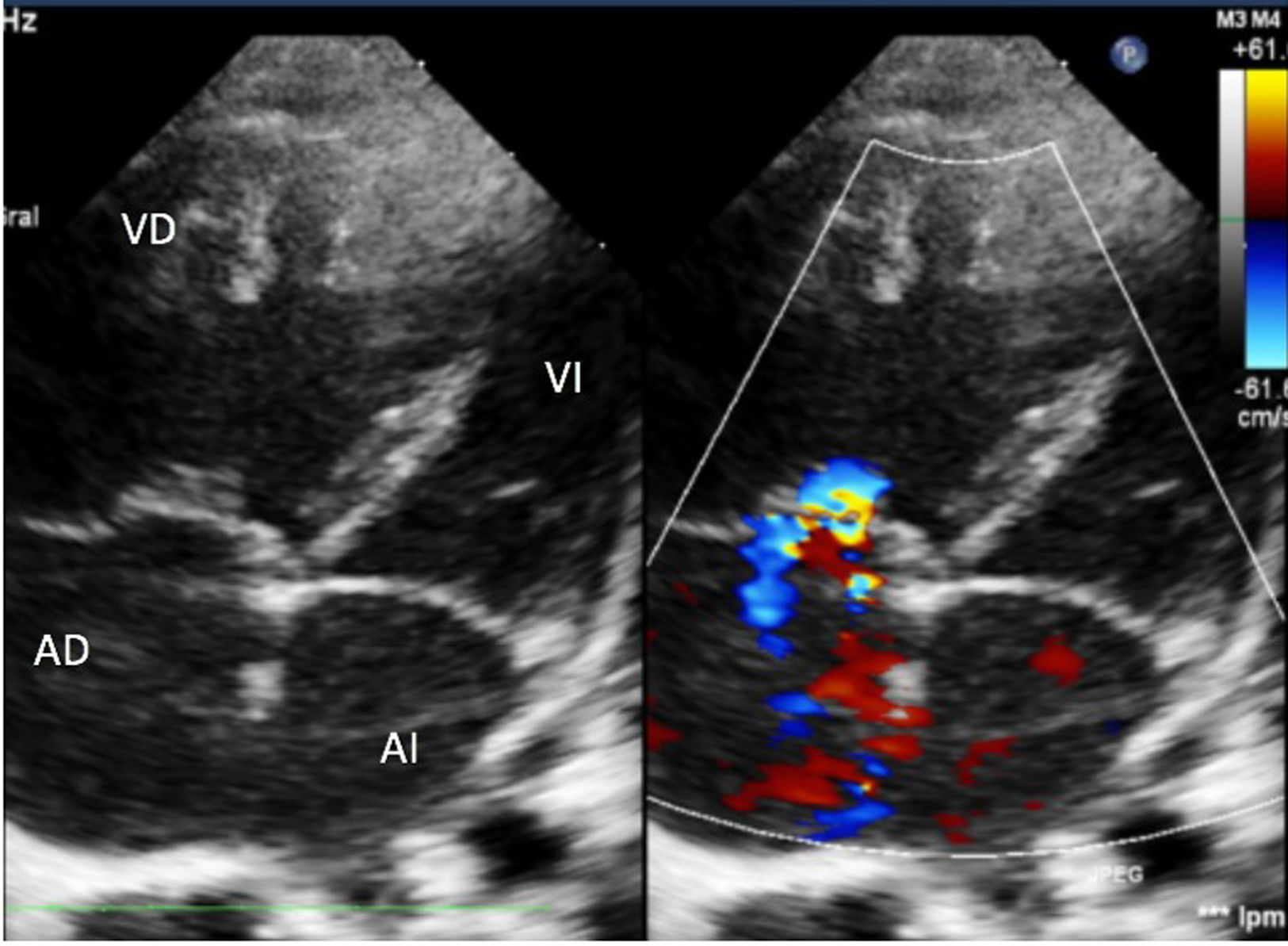
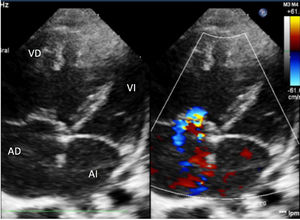
Ingresó en planta de hospitalización con oxigenoterapia, sildenafilo oral y prostaciclinas inhaladas. A los 5días presentó empeoramiento súbito con desaturación y clínica de bajo gasto cardíaco, por lo que se trasladó a la UCI pediátrica. Precisó inicio de ventilación mecánica con FiO2 de 1, tratamiento con óxido nítrico hasta 20ppm y soporte inotrópico con dopamina. En la radiografía se objetivaron líneas B de Kerley e infiltrados moteados perihiliares; en la ecografía torácica se objetivó aumento homogéneo de líneas B, sin condensaciones ni derrame pleural. La ecocardiografía mostró signos de HTP grave (fig. 1) con una estimación de la presión de la arteria pulmonar (PAP) de 70mmHg (VN PAP<20mmHg). Se realizó cateterismo cardíaco que mostró: PAP sistólica/PAP diástolica (PAP media) de 53/24 (38)mmHg (VN PAPs<35mmHg, PAPm<20mmHg)1, resistencias pulmonares de 8,51unidades de Wood/m2 (VN<3UW/m2) y presión de enclavamiento pulmonar (PCP) de 10mmHg (VN<15mmHg)1. Por ello se excluyeron alteraciones del corazón izquierdo como etiología de la HTP.
Ecocardiografía. Eje de 4 cámaras. Cavidades derechas dilatadas con tabique interventricular desviado hacia la izquierda. Insuficiencia tricuspídea moderada con gradiente de 60mmHg que permite estimar una PAP aproximada de 70mmHg. Septo interauricular con foramen oval permeable de 5mm. Válvulas de morfología normal.
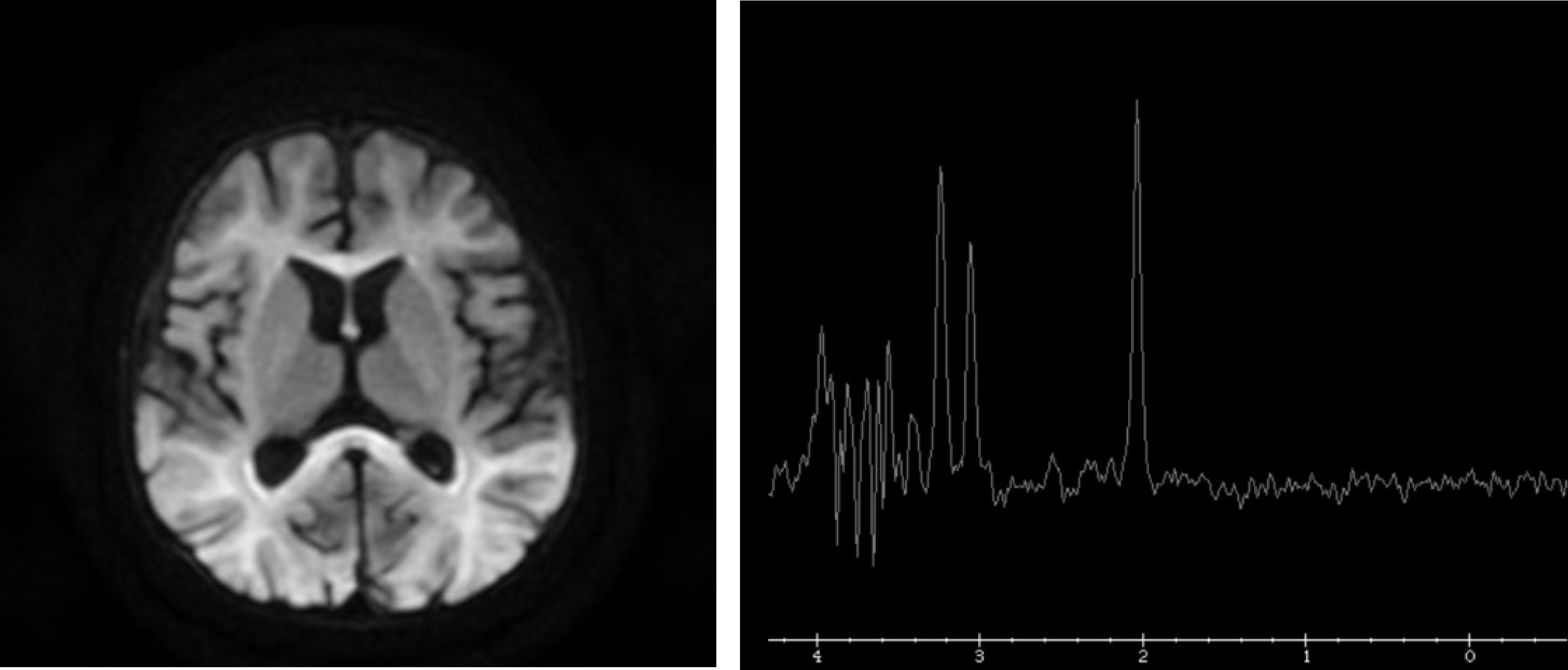
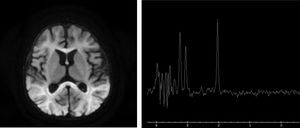
Se amplió el estudio metabólico, en el que destacaba hiperlactacidemia con lactato de 8,1mmol/l (VN<2mmol/l) sin acidosis metabólica ni cetosis, aumento de glicina en sangre de 1.599μmol/l (VN 109-293μmol/l) y en líquido cefalorraquídeo (LCR) de 83,1μmol (VN 3-13μmol). Ante la sospecha de hiperglicinemia no cetósica (HGNC) se inició tratamiento con tiamina, benzoato sódico, ácido lipoico y acetil-cisteína, y se realizó resonancia magnética (RM) cerebral (fig. 2) objetivando reducción de la sustancia blanca subcortical y profunda, así como alteración de la mielinización con pico de glicina en la sustancia blanca parietal derecha en la espectroscopia (fig. 2).
A pesar de todas las medidas instauradas persistió con HTP grave y falleció a los 28días de ingreso. A las 2semanas, se recibió el resultado del estudio genético que confirmó mutación en el gen NFU1 (c.565G>A, p.Gly189Arg), descrito en la literatura como patogénico, causante de disfunción mitocondrial en múltiples órganos.
La HTP es poco frecuente en pediatría y más asociada a errores congénitos del metabolismo. Su pronóstico en estos casos es fatal1,2. En todos los lactantes con HTP se debería descartar la asociación a enfermedad metabólica, ya que puede aparecer antes que las manifestaciones neurológicas3. De forma específica, si el paciente asocia manifestaciones neurológicas, presenta datos de fallo multiorgánico, o bien, si desarrolla EAP con el tratamiento convencional2–7, se aconseja realizar estudio metabólico en busca de elevación de los niveles de glicina en plasma, LCR y orina, como se hizo en el caso que se describe2,4-6. Asimismo, se ha definido el defecto combinado de la actividad del complejo piruvato deshidrogenasa y de diferentes complejos de la cadena respiratoria en músculo esquelético, fibroblastos de piel e hígado2,4-6.
Hasta el momento se han descrito tres fenotipos en relación con la sintomatología neurológica y respiratoria exclusiva, o mixta2. En nuestro caso el paciente presentaba HTP con hipotonía y retraso leve del desarrollo psicomotor, por lo que se podría incluir en el tercer grupo. Al igual que en los casos descritos en la literatura, se objetivó leucoencefalopatía en la RM y pico de glicina en el lóbulo parietal derecho2,4-6.
En las series descritas hasta el momento, el comienzo de la HTP ocurre en los 6 primeros meses de vida, no responde al tratamiento habitual y el pronóstico es desfavorable, falleciendo en los primeros 15meses de vida2,4. Además, el empeoramiento clínico tras el inicio del tratamiento vasodilatador se describe en todos los casos.
Invernizzi et al. y Nizon et al. publicaron el caso de 2 pacientes que fallecieron más tardíamente (a los 30meses de edad)5,6, y ambos se relacionaron con la misma alteración alélica del gen NFU1 (c.565G>A, p.Gly189Arg). El resto de los pacientes descritos fallecen más precozmente y presentan otras mutaciones del gen NFU1.
En el estudio genético del caso que se presenta se detectaron dos mutaciones en el gen NFU1. Una de ellas fue previamente descrita como patogénica (p.Gly208Cys/c.622G>T)2,8–11, sin embargo, la segunda mutación secuenciada (p.Trp130Arg/c.388T>C) se clasificó como variante de significado incierto. Al tratarse de una mutación previamente no descrita en una enfermedad con herencia recesiva, se podría considerar su estudio en futuras investigaciones por si se tratara de una mutación patogénica. Las mutaciones en el gen NFU1 causan una disfunción mitocondrial de múltiples órganos con un patrón de herencia autosómico recesivo.
La alteración genética del gen NFU1 disminuye o elimina la producción de la proteína implicada en la formación de complejos de sulfuro de hierro que se unen a ciertas proteínas para que estas realicen su función, como la producción de energía mitocondrial y la descomposición de la glicina. Este fenómeno explica los hallazgos de laboratorio y la clínica del paciente que se presenta2.
En conclusión, la HTP asociada a errores congénitos del metabolismo es poco frecuente y se asocia a un pronóstico sombrío. Se debe sospechar ante un lactante con HTP grave y sintomatología neurológica en algunas ocasiones, que presenta empeoramiento clínico con EAP tras el inicio del tratamiento convencional, e hiperlactacidemia sin acidosis metabólica. Por lo tanto, en todos los casos de HTP idiopática, se debe realizar estudio metabólico. La importancia de llegar al diagnóstico radica en el ofrecimiento de consejo genético por tratarse de una enfermedad mortal y sin tratamiento curativo descrito hasta el momento.