La enfermedad pulmonar obstructiva crónica (EPOC) presenta una gran heterogeneidad clínica, por lo que su tratamiento se debe individualizar según el nivel de riesgo y el fenotipo. La Guía española de la EPOC (GesEPOC) estableció por primera vez en 2012 unas pautas de tratamiento farmacológico basadas en fenotipos clínicos. Estas pautas han sido adoptadas posteriormente por otras normativas nacionales, y han sido respaldadas por nuevas evidencias publicadas desde entonces. En esta actualización 2017 se ha sustituido la clasificación de gravedad inicial por una clasificación de riesgo mucho más sencilla (bajo o alto riesgo), basándose en la función pulmonar, el grado de disnea y la historia de agudizaciones, y se recomienda la determinación del fenotipo clínico únicamente en pacientes de alto riesgo. Se mantienen los mismos fenotipos clínicos: no agudizador, EPOC-asma (ACO), agudizador con enfisema y agudizador con bronquitis crónica. La base del tratamiento farmacológico de la EPOC es la broncodilatación, y también es el único tratamiento recomendado en pacientes de bajo riesgo. En los pacientes con alto riesgo se añadirán diversos fármacos a los broncodilatadores según el fenotipo clínico. GesEPOC supone una aproximación al tratamiento de la EPOC más individualizado según las características clínicas de los pacientes y su nivel de riesgo o de complejidad.
The clinical presentation of chronic obstructive pulmonary disease (COPD) varies widely, so treatment must be tailored according to the level of risk and phenotype. In 2012, the Spanish COPD Guidelines (GesEPOC) first established pharmacological treatment regimens based on clinical phenotypes. These regimens were subsequently adopted by other national guidelines, and since then, have been backed up by new evidence. In this 2017 update, the original severity classification has been replaced by a much simpler risk classification (low or high risk), on the basis of lung function, dyspnea grade, and history of exacerbations, while determination of clinical phenotype is recommended only in high-risk patients. The same clinical phenotypes have been maintained: non-exacerbator, asthma-COPD overlap (ACO), exacerbator with emphysema, and exacerbator with bronchitis. Pharmacological treatment of COPD is based on bronchodilators, the only treatment recommended in low-risk patients. High-risk patients will receive different drugs in addition to bronchodilators, depending on their clinical phenotype. GesEPOC reflects a more individualized approach to COPD treatment, according to patient clinical characteristics and level of risk or complexity.
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad infradiagnosticada, con una elevada morbimortalidad y supone un problema de salud pública de gran magnitud1.
En el contexto del Plan de calidad del Sistema Nacional de Salud y la estrategia en EPOC del Ministerio de Sanidad, Igualdad y Política Social se desarrolló la primera Guía española de la EPOC (GesEPOC) en el año 2012 a partir de una iniciativa de la Sociedad Española de Neumología y Cirugía Torácica, conjuntamente con las sociedades científicas implicadas en la atención a pacientes con EPOC y el Foro Español de Pacientes2.
GesEPOC fue la primera guía clínica en EPOC en proponer un tratamiento guiado por fenotipos clínicos, un enfoque que posteriormente ha sido adoptado por otras guías nacionales de EPOC3,4. Su implementación ha sido importante, ya que en la auditoría realizada en consultas externas de neumología en España (estudio EPOCONSUL) entre mayo de 2014 y mayo de 2015, un 46,3% de las historias clínicas de pacientes con EPOC ya recogían la clasificación por fenotipos de GesEPOC5.
La continua actividad investigadora en EPOC y la generación de nuevas evidencias hace necesario actualizar las recomendaciones de diagnóstico y tratamiento de forma periódica. En este artículo se presenta el apartado de tratamiento farmacológico de la EPOC estable en la nueva GesEPOC 2017. Para su desarrollo se ha seguido la metodología Grading of Recommendations Assessment, Development and Evaluation6. Los detalles del protocolo que incluyen las preguntas PICO: Paciente, Intervención, Comparación y resultados (Outcomes), la búsqueda bibliográfica y las tablas de evidencia se pueden consultar en la publicación completa de la guía7 y en el anexo 1. La constitución del grupo de trabajo se presenta en el anexo 2.
El proceso de la atención inicial al paciente con EPOCLa EPOC se define como una enfermedad respiratoria caracterizada por síntomas persistentes y limitación crónica al flujo aéreo, causada principalmente por el tabaco.
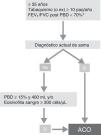
GesEPOC propone una evaluación del paciente en 4 pasos: 1) diagnóstico de la EPOC; 2) estratificación del riesgo en bajo o alto; 3) determinación del fenotipo en pacientes de alto riesgo; y 4) tratamiento guiado por síntomas (bajo riesgo) o por fenotipo (alto riesgo).
DiagnósticoEl proceso se inicia con la sospecha diagnóstica ante un adulto fumador o exfumador de más de 10 años-paquete, que presenta síntomas respiratorios. La realización de una espirometría permitirá confirmar el diagnóstico al demostrar un cociente entre el volumen espiratorio máximo en el primer segundo (FEV1) y la capacidad vital forzada (FVC) tras la prueba broncodilatadora inferior a 0,7, aunque debemos tener en cuenta que este valor puede infraestimar la obstrucción en sujetos jóvenes y sobrediagnosticar a los de edad más avanzada8.
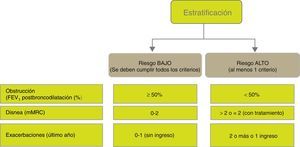
Estratificación del riesgoA continuación se debe evaluar el nivel de riesgo. Como tal se entiende a la probabilidad de que el paciente pueda presentar agudizaciones, progresión de la enfermedad, futuras complicaciones, mayor consumo de recursos sanitarios o mayor mortalidad. Atendiendo a la necesidad de simplificar la estratificación de riesgo y adecuar los niveles de intervención, tanto diagnóstica como terapéutica, GesEPOC propone una nueva clasificación en 2 niveles de riesgo: bajo y alto. Esta clasificación de riesgo no implica derivación entre niveles asistenciales.
Los factores considerados para la evaluación del riesgo son el grado de obstrucción medido por el FEV1(%) posbroncodilatador, el nivel de disnea medido por la escala mMRC y la presencia de agudizaciones (fig. 1). Los puntos de corte establecidos son los recomendados por la Global Initiative for Obstructive Lung Disease9. El punto de corte del 50% del FEV1 es el sugerido para diferenciar la EPOC con obstrucción grave-muy grave de la leve-moderada; el grado de disnea 2 o superior se considera alto nivel de disnea en pacientes en tratamiento para su EPOC, mientras que en pacientes no tratados debe ser superior a 2; y los pacientes con 2 o más agudizaciones moderadas (que requieran tratamiento con corticosteroides sistémicos y/o antibióticos) o con un ingreso hospitalario por agudización son los considerados con mayor riesgo de agudización en el futuro9. Los componentes de esta clasificación de riesgo han demostrado poder predictivo sobre la mortalidad10 y además quedan englobados dentro del cuartil 1 de los índices multidimensionales BODE o BODEx, que sí han demostrado contrastada capacidad predictiva de riesgo11,12. A mayor nivel de riesgo, la necesidad de intervenciones diagnósticas y/o terapéuticas será mayor (tablas 1 y 2).
Adecuación de las pruebas diagnósticas a los niveles de riesgo
| Nivel de riesgo | Pruebas diagnósticas |
|---|---|
| Bajo riesgo | Espirometría forzada |
| Pruebas complementarias básicas | |
| Radiografía de tórax | |
| Analítica básica con alfa-1 antitripsina | |
| Saturación arterial de oxígeno (SpO2) | |
| Alto riesgo | Añadir las siguientes pruebas |
| Volúmenes pulmonares, DLCO | |
| Prueba de esfuerzo: prueba de la marcha durante 6 minutos | |
| TC torácica | |
| Caracterización fenotípica | |
| Identificar fenotipo clínico | |
| Precisar riesgo pronóstico | |
| Índices multidimensionales: BODE o BODEx |
Adecuación del nivel de intervención asistencial a los niveles de riesgo
| Nivel de riesgo | Intervenciones terapéuticas |
|---|---|
| Bajo riesgo | Deshabituación tabáquica |
| Consejo | |
| Tratamiento específico | |
| Educación terapéutica | |
| Programa estructurado de educación terapéutica orientado a: | |
| Fomentar el autocuidado | |
| Adherencia terapéutica | |
| Técnica inhalatoria | |
| Actividad física | |
| Ejercicio regular | |
| Vacunación | |
| Antigripal | |
| Antineumocócica | |
| Tratamiento farmacológico | |
| Broncodilatadores | |
| Comorbilidad | |
| Tratamiento de la comorbilidad | |
| Alto riesgo | Añadir al tratamiento previo: |
| Tratamiento farmacológico | |
| Guiado por fenotipo | |
| Tratamiento no farmacológico | |
| Rehabilitación respiratoria | |
| Valorar oxigenoterapia continua domiciliara | |
| Valorar ventilación no invasiva |
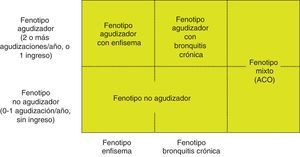
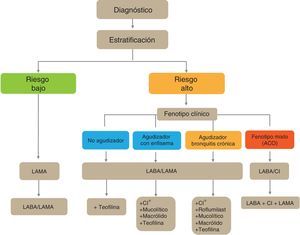
En los pacientes de alto riesgo es preciso conocer su fenotipo, que indica un tratamiento diferente y específico (fig. 2). GesEPOC reconoce 4 fenotipos: 1) no agudizador; 2) EPOC-asma (ACO [del inglés asthma-COPD overlap]); 3) agudizador con enfisema; y 4) agudizador con bronquitis crónica.
Las denominaciones de ACO, enfisema y bronquitis crónica se basan en las manifestaciones clínicas predominantes y el cumplimiento de los criterios diagnósticos. Cualquiera de estos 3 tipos de pacientes puede ser un agudizador, de manera que estas características se combinan para formar los 4 fenotipos clínicos con tratamiento diferenciado: ACO, fenotipo agudizador con bronquitis crónica, fenotipo agudizador con enfisema y fenotipo no agudizador13.
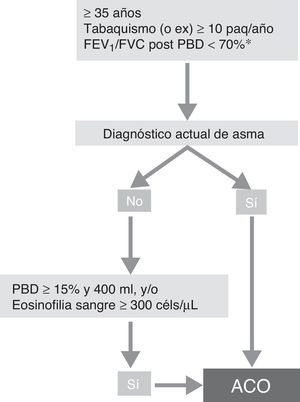
Fenotipo ACOSegún el reciente consenso GesEPOC-GEMA se puede diagnosticar de ACO a un paciente con EPOC que cumpla también los criterios diagnósticos de asma según las guías actuales, o que presente rasgos considerados asmáticos, como tener una prueba broncodilatadora muy positiva (incremento en el FEV1>400ml y 15%) y/o una eosinofília en sangre periférica superior a las 300cél/mm3 (fig. 3)14.
Algoritmo diagnóstico de la EPOC según consenso GesEPOC-GEMA.
ACO: solapamiento asma y EPOC; céls: células; FEV1: volumen espiratorio máximo en el primer segundo; FVC: capacidad vital forzada; paq-año: paquetes-año; PBD: prueba broncodilatadora.
aMantenida tras tratamiento con LABA/CI (6 meses). En algunos casos además tras ciclo de glucocorticoides orales (15 días).
Fuente: Reproducido con permiso de la European Respiratory Society ©: Eur Respir J 2017; 49: 1700068 DOI: 10.1183/13993003.00068-2017.
Se define como fenotipo agudizador a todo paciente con EPOC que presente en el año previo 2 o más agudizaciones moderadas, definidas como aquellas que precisan al menos tratamiento ambulatorio con corticosteroides sistémicos y/o antibióticos, o una grave que precise ingreso hospitalario15. Estas exacerbaciones deben estar separadas al menos 4 semanas desde la resolución de la exacerbación previa, o 6 semanas desde el inicio de la misma en los casos donde no han recibido tratamiento, para diferenciar el nuevo evento de un fracaso terapéutico o una recaída16. Los pacientes con fenotipo agudizador tienen mayor riesgo de hospitalización y de mortalidad; debido a la diferente respuesta a los tratamientos farmacológicos es importante diferenciar los que tienen un fenotipo enfisematoso o bronquítico crónico.
Para caracterizar mejor el enfisema nos podemos ayudar de la medición del atrapamiento aéreo mediante los volúmenes estáticos pulmonares y la prueba de transferencia del monóxido de carbono (DLCO). La realización de una tomografía computarizada de tórax será necesaria cuando se piense en la posibilidad de un tratamiento quirúrgico o si presentan agudizaciones frecuentes17.
Fenotipo agudizador con bronquitis crónicaPara identificar la bronquitis crónica preguntaremos por la presencia de tos con expectoración al menos 3 meses al año en 2 años consecutivos. En el caso del paciente con fenotipo agudizador con bronquitis crónica debemos realizar una tomografía computarizada de alta resolución (TACAR) para comprobar si el paciente tiene bronquiectasias18 y también cultivos de esputo en fase estable, en especial si la expectoración es amarillenta u oscura19. En caso de positividad repetida se considerará que el paciente tiene una infección bronquial crónica20.
Fenotipo no agudizadorEl fenotipo no agudizador se caracteriza por presentar como máximo un episodio de agudización moderada el año previo. Es un paciente de menor riesgo de deterioro de su calidad de vida, de pérdida de función pulmonar o de mortalidad que el agudizador.
Tratamiento de la EPOC estableLos objetivos generales del tratamiento de la EPOC se resumen en 3: reducir los síntomas de la enfermedad, disminuir la frecuencia y gravedad de las agudizaciones y mejorar el pronóstico. Se deben alcanzar tanto los beneficios a corto plazo (control de la enfermedad), como los objetivos a medio y largo plazo (reducción del riesgo).
Existen una serie de medidas generales a tener en cuenta en todo paciente con EPOC que comprenden el abandono del tabaco, la adecuada nutrición, la actividad física regular adaptada a la edad y a las condiciones del paciente, la evaluación y tratamiento de las comorbilidades y la vacunación, que no van a ser abordadas en esta publicación, pero que se describen con mayor detalle en normativas específicas21,22 y en la publicación completa de la guía7. Los puntos clave del tratamiento farmacológico de la EPOC se exponen en la tabla 3.
Puntos clave del tratamiento farmacológico de la EPOC
| La base del tratamiento de la EPOC estable son los broncodilatadores de larga duración (BDLD) |
| Los fármacos que se deben añadir a BDLD dependerán del fenotipo del paciente |
| El tratamiento del fenotipo no agudizador se basa en el uso de los BDLD solos o en combinación |
| El tratamiento del ACO se basa en la utilización de BDLD combinados con corticosteroides inhalados (CI) |
| El tratamiento del fenotipo agudizador con enfisema se basa en BDLD, a los que se pueden añadir los CI o la teofilina según el nivel de gravedad |
| En el tratamiento del fenotipo agudizador con bronquitis crónica a los BDLD se pueden añadir CI, inhibidores de la fosfodiesterasa 4, mucolíticos o antioxidantes según la gravedad o, en casos especiales, antibióticos de forma preventiva |
| Se debe prestar especial atención a las comorbilidades, optimizando su control |
El paciente con EPOC de bajo riesgo es un paciente con obstrucción leve o moderada al flujo aéreo, bajo grado de disnea (mMRC<2 sin tratamiento) y fenotipo no agudizador. En este caso no está indicado ningún tipo de tratamiento antiinflamatorio y el tratamiento farmacológico consistirá en la prescripción de broncodilatadores de larga duración (BDLD). En el caso poco frecuente de una obstrucción leve y con escasos síntomas o síntomas intermitentes puede estar indicada la administración de broncodilatadores de corta duración (BDCD) a demanda, pero los pacientes más sintomáticos deben recibir BDLD de forma continuada.
Broncodilatadores de corta duraciónLos BDCD pueden ser de 2 tipos: anticolinérgicos como el bromuro de ipratropio y beta-2 agonistas de acción corta como salbutamol o terbutalina. En pacientes con síntomas ocasionales el tratamiento con BDCD reduce los síntomas y mejora la tolerancia al esfuerzo23. Estos fármacos, añadidos al tratamiento de base, son de elección para el tratamiento a demanda de los síntomas, sea cual sea el nivel de gravedad de la enfermedad. Cuando el paciente tiene síntomas permanentes o sufre alguna limitación en sus actividades diarias por su problema respiratorio requerirá un tratamiento de base regular con BDLD.
Broncodilatadores de larga duraciónLos BDLD pueden ser beta-2 adrenérgicos (salmeterol, formoterol, olodaterol, vilanterol e indacaterol —su nombre en inglés: long-acting beta-agonists [LABA]—) o anticolinérgicos (tiotropio, aclidinio, glicopirronio, umeclidinio —su nombre en inglés long-acting muscarinic antagonist [LAMA]—). Deben utilizarse como primer escalón en el tratamiento de todos los pacientes con síntomas persistentes que precisan tratamiento de forma regular, porque permiten un mayor control de los síntomas que el conseguido con BDCD y mejoran tanto la calidad de vida como la función pulmonar24–30. Además, los BDLD han demostrado reducir el número de exacerbaciones, tanto los LABA, como LAMA30.
Existen diferencias entre los diversos BDLD; los hay con una duración de acción de 12 horas (aclidinio, salmeterol y formoterol) y de 24 horas (tiotropio, umeclidinio, glicopirronio, indacaterol, olodaterol y vilanterol). En relación con la prevención de agudizaciones tiotropio ha demostrado ser más eficaz que salmeterol en pacientes con EPOC e historia de al menos una agudización el año previo31. También tiotropio ha demostrado ser superior a indacaterol en la prevención de agudizaciones32. Por este motivo ante la elección de un BDLD en monoterapia se recomienda un LAMA de primera elección sobre un LABA.
Pregunta PICO. ¿Qué broncodilatador debemos recomendar en monoterapia?Recomendación débil a favor: en pacientes con EPOC que precisan un broncodilatador de larga duración en monoterapia se recomienda el tratamiento con un LAMA.
Especificaciones: la evidencia analizada se basa en una mayor prevención de agudizaciones en estudios realizados con el LAMA tiotropio. En pacientes sin agudizaciones no hay diferencias en la eficacia clínica entre LAMA y LABA.
En general, los BDLD son bien tolerados y presentan escasos efectos adversos. No obstante, se deben tener en cuenta los siguientes. LABA: temblor fino de las extremidades, calambres musculares, taquicardia, hipertensión arterial, vasodilatación periférica, cefalea, hiperglucemia, hipopotasemia, tos, broncoespasmo, irritación orofaríngea y dispepsia. El tratamiento con LAMA se puede asociar a sequedad de boca, retención urinaria, incremento de la presión ocular e irritación faríngea. Se debe tener en cuenta que los ensayos clínicos excluyen a pacientes con cardiopatía significativa, por lo que se debe estar alerta con el uso de los nuevos broncodilatadores en estos pacientes.
Doble terapia broncodilatadoraEn pacientes sintomáticos o con una limitación al ejercicio evidente, a pesar de la monoterapia broncodilatadora, se debe ensayar la doble terapia broncodilatadora. En estos casos la asociación de LABA y LAMA ofrece un beneficio funcional añadido con reducción de la necesidad de medicación de rescate, mejoría de los síntomas y de la calidad de vida frente a la monoterapia33–35. Por este motivo, en un segundo escalón de tratamiento en los pacientes de bajo riesgo se pueden asociar 2 BDLD para optimizar el efecto broncodilatador. Las combinaciones existentes de BDLD (LABA/LAMA) se presentan en la tabla 4.
Características de los fármacos inhalados para el tratamiento de la EPOC
| Principio activo | Presentación | Dosis recomendada |
|---|---|---|
| Beta-2 adrenérgicos | ||
| Salbutamol | ICP: 100μg/inh | 200μg/4-6h |
| Terbutalina | TH: 500μg/inh | 500μg/6h |
| Salmeterol | ICP: 25μg/inh | |
| AH: 50μg/inh | 50μg/12h | |
| Formoterol | ICP: 12μg/inh | |
| TH: 9μg/inh | 12μg/12h | |
| AL: 12μg/inh | ||
| Indacaterol | BH: 150μg/inh | 150μg/24h |
| BH: 300μg/inh | ||
| Olodaterol | RM: 2,5μg/inh | 5μg/24h |
| Anticolinérgicos | ||
| Ipratropio | ICP: 20μg/inh | 20-40μg/6-8h |
| Tiotropio | HA: 18μg/inh | 18μg/24h |
| RM: 2,5μg/inh | 5μg/24h | |
| Aclidinio | GE: 400μg/inh | 400μg/12h |
| Glicopirronio | BH: 44μg/inh | 44μg/24h |
| Umeclidinio | EL: 62,5μg/inh | 62,5μg/24h |
| LABA/LAMA | ||
| Indacaterol/glicopirronio | BH: 110/50μg/inh | 110/50μg/24h |
| Aclidinio/formoterol | GE: 340/12μg/inh | 340/12μg/12h |
| Umeclidinio/vilanterol | EL: 62,5/25μg/inh | 62,5/25μg/24h |
| Tiotropio/olodaterol | RM: 2,5/2,5μg/inh | 5/5μg/24h |
| LABA/CI | ||
| Beclometasona/formoterol | NH: 100/6μg/inh | 200/12μg/12h |
| ICP Modulite® 100/6μg/inh | ||
| Formoterol/budesonida | TH: 4,5/160 y 9/320μg/inh | 9/320μg/12h |
| SM: 4,5/160 y 9/320μg/inh | ||
| EH: 4,5/160 y 9/320μg/inh | ||
| Salmeterol/propionato de fluticasona | AH: 50/500μg/inh | 50/500μg/12h |
| FP: 50/500μg/inh | ||
| Furoato de fluticasona/vilanterol | EL: 100/25μg/inh | 100/25μg/24h |
AH: Accuhaler®; AL: Aerolizer®; BH: Breezhaler®; CI: cápsulas inhaladas; EH: Easyhaler; EL: Ellipta®; FP: Forspiro®; GE: Genuair®; HA: Handihaler®; ICP: inhalador en cartucho presurizado; inh: inhalación; LABA/CI: beta-2 adrenérgico de larga duración/corticosteroide inhalado; LABA/LAMA: beta-2 adrenérgico de larga duración/antimuscarínico de larga duración; NH: Nexthaler®, p.o.: por vía oral; RM: Respimat®; SM: Spiromax®; TH: Turbuhaler®.
El paciente con EPOC de alto riesgo es el que presenta una limitación al flujo aéreo grave o un elevado grado de disnea (mMRC>2 sin tratamiento o 2 o superior con tratamiento) o al menos 2 agudizaciones moderadas o un ingreso el año previo, o cualquier combinación de estos factores. Se trata de un paciente que precisa una aproximación diagnóstica más detallada con el objetivo de identificar su fenotipo36.
Doble terapia broncodilatadoraEl tratamiento inicial en un paciente con EPOC de alto riesgo no agudizador es la doble broncodilatación. Esta recomendación se basa en la demostración de una mayor eficacia broncodilatadora frente a la monoterapia, que se acompaña de una mejoría significativa de la disnea, de la calidad de vida y una reducción en la utilización de la medicación de rescate. No obstante, los resultados obtenidos en la comparación de la capacidad de ejercicio entre la doble broncodilatación y la monoterapia no son tan consistentes33,34. No existen hasta la fecha comparaciones directas entre las diferentes combinaciones LABA/LAMA, y los análisis comparativos indirectos realizados no permiten identificar claras diferencias entre ellas35,37.
Pregunta PICO. ¿Cuándo utilizar doble broncodilatación (beta adrenérgico de larga duración [LABA]/antimuscarínico de larga duración [LAMA]) frente a monoterapia broncodilatadora?Recomendación débil a favor: la terapia con doble broncodilatación proporciona una mayor eficacia broncodilatadora y es de elección en pacientes sintomáticos (mMRC>2) a pesar de un tratamiento con un solo broncodilatador.
Especificaciones: en pacientes con afectación espirométrica grave o muy grave, la terapia con doble broncodilatación es recomendable de inicio sobre la monoterapia por su mayor efecto sobre la función pulmonar.
TeofilinasLas teofilinas son fármacos broncodilatadores débiles, pero que presentan efectos aditivos a los broncodilatadores habituales. Se ha descrito un efecto positivo de estos fármacos sobre la fuerza del diafragma, un aumento del rendimiento de los músculos respiratorios, una reducción del atrapamiento aéreo y una mejoría del aclaramiento mucociliar38. La dosis habitual es de 200-300mg/12h por vía oral en comprimidos de liberación sostenida. En cualquier caso, su limitada eficacia clínica y su estrecho margen terapéutico las relega a ocupar un lugar de tercera línea, principalmente en pacientes de alto riesgo si persisten disneicos tras la doble terapia broncodilatadora38.
La toxicidad de la teofilina es dosis-dependiente. Cuando se administra de forma prolongada se debe verificar sus concentraciones plasmáticas y se debe tener en cuenta el riesgo de interacciones con otros fármacos como el alopurinol, ciprofloxacino, eritromicina, benzodiacepinas o cimetidina, entre otros.
Tratamiento del paciente de alto riesgo y fenotipo mixto EPOC-asmaSe ha asociado la presencia de ACO con un mayor grado de inflamación eosinofílica bronquial, que sería la responsable de su mayor respuesta clínica y espirométrica a los CI y justifica el uso de los CI asociados a un LABA como primera opción con el objetivo de mejorar su función pulmonar, síntomas respiratorios y reducir las agudizaciones si las hubiere39. En estos casos es necesario un seguimiento para evaluar la respuesta y, al igual que sucede con el asma, seleccionar la mínima dosis necesaria de CI para el tratamiento a largo plazo.
Se ha descrito una asociación entre la inflamación eosinofílica en fase estable y durante las agudizaciones40, y los CI son especialmente eficaces en reducir la frecuencia de agudizaciones en pacientes con EPOC y este tipo de inflamación41. Estas agudizaciones no suelen cursar con expectoración purulenta, sino con síntomas de rinitis, sibilantes y tos con expectoración blanquecina, y son las que se pueden beneficiar más del tratamiento preventivo con CI40,42.
En los casos de mayor gravedad puede ser necesario el tratamiento triple CI/LABA/LAMA. Esta triple combinación ha demostrado su eficacia en pacientes con EPOC que presentaban gran reversibilidad en la obstrucción al flujo aéreo43. Además, tiotropio ha demostrado eficacia en pacientes con asma44.
Tratamiento del paciente de alto riesgo y fenotipo agudizador con enfisemaDoble terapia broncodilatadoraUn ensayo clínico aleatorizado (ECA) comparó indacaterol/glicopirronio frente a glicopirronio con un brazo abierto de tratamiento con tiotropio. La población del estudio fue pacientes con FEV1<50% del teórico y que habían sufrido al menos una agudización el año previo. Los resultados mostraron una reducción significativa de 12% en la tasa de agudizaciones moderadas o graves (p=0,038) frente a glicopirronio. Frente a tiotropio hubo una reducción numérica, pero no llegó a ser significativa45. Este estudio demostró que la doble broncodilatación era superior a la monoterapia en la prevención de agudizaciones en la EPOC.
Posteriormente otro ECA comparó la misma combinación, indacaterol/glicopirronio (LABA/LAMA) frente a salmeterol/fluticasona (LABA/CI) en pacientes con EPOC con FEV1 entre el 25% y el 60% y al menos una agudización el año previo. Los resultados mostraron una diferencia significativa a favor de la combinación indacaterol/glicopirronio en la reducción de agudizaciones de cualquier nivel de gravedad. Además, los pacientes con indacaterol/glicopirronio tuvieron una menor incidencia de neumonías46. Los resultados de ambos estudios justifican que la combinación LABA/LAMA sea de primera elección en el tratamiento inicial de los pacientes con EPOC y fenotipo agudizador, excepto en pacientes con ACO. Cabe recordar que en este último ECA se excluyeron los pacientes con eosinofilia sanguínea superior a 600cél/mm3 y aquellos con antecedentes de asma46.
Corticosteroides inhaladosLos CI están indicados en pacientes que presentan frecuentes agudizaciones pese a realizar un tratamiento broncodilatador óptimo, por cuanto su uso asociado a un LABA produce una disminución significativa del número de agudizaciones y una mejoría en la calidad de vida47,48. En la EPOC los CI se deben utilizar siempre en asociación con un BDLD, generalmente un LABA. Las diversas asociaciones disponibles de LABA/CI se presentan en la tabla 4.
Subanálisis recientes de ECA de las combinaciones LABA/CI para la prevención de agudizaciones de la EPOC han mostrado que el mayor efecto preventivo del CI se obtiene en pacientes con concentraciones elevadas de eosinófilos en sangre49,50. Además, el riesgo de neumonía con el uso de CI en la EPOC parece mayor en pacientes con concentraciones bajas de eosinófilos51. Sin embargo, estos resultados no han sido aún demostrados en estudios prospectivos diseñados específicamente para este fin, y no existe tampoco un punto de corte universalmente aceptado de eosinofilia sanguínea para recomendar o no el uso de CI en la EPOC. Por este motivo, y debido a que los estudios de registro de la combinación LABA/CI no diferenciaban entre pacientes con o sin eosinofilia, no es posible aún dejar de recomendar el uso de los CI en pacientes agudizadores con recuentos bajos eosinófilos en sangre periférica, si bien hay que esperar una escasa eficacia en estos casos42.
Se debe buscar un equilibrio entre los efectos beneficiosos de los CI y sus posibles efectos adversos. Se ha observado en los grandes ECA efectos secundarios tales como aftas orales, disfonía, hematomas, reducción en la densidad mineral ósea y neumonías, aunque sin aumento de la mortalidad52. Aunque el riesgo de neumonía es mayor en pacientes que toman fluticasona a dosis altas, también se ha observado un aumento del riesgo de neumonía, pero de menor magnitud, asociado al uso de budesonida53,54.
Pregunta PICO. ¿Cuál es el tratamiento de elección en pacientes sintomáticos con agudizaciones, LABA/CI o la doble broncodilatación LABA/LAMA?Recomendación débil a favor: en pacientes sintomáticos, a pesar del tratamiento con un broncodilatador de acción prolongada, y en especial si presentan agudizaciones, el tratamiento con doble broncodilatación (LABA/LAMA) es de elección frente al tratamiento con LABA/CI.
Especificaciones: la mayor eficacia de LABA/LAMA frente a LABA/CI en prevención de agudizaciones se ha demostrado con indacaterol/glicopirronio frente a salmeterol/fluticasona.
Triple terapia (LABA/LAMA/CI)En pacientes de alto riesgo y que no presentan un buen control de las agudizaciones con 2 fármacos (sean 2 BDLD o un BDLD más un CI) se puede utilizar la triple terapia LAMA/LABA/CI. Los escasos estudios existentes con triple terapia indican un mayor efecto sobre la función pulmonar43 y una disminución de las agudizaciones y las hospitalizaciones en pacientes graves43,55,56. Estos efectos son evidentes al añadir un LAMA a la combinación LABA/CI57–59, sin embargo no está claro el aumento en la eficacia al añadir un CI a la combinación LABA/LAMA55,56. El aspecto más importante relativo a la triple terapia es conocer su eficacia en comparación con la doble terapia broncodilatadora (LABA/LAMA).
MucolíticosEl uso de carbocisteína a largo plazo, comparado con placebo, reduce de forma significativa el número de exacerbaciones, retrasa el empeoramiento de los síntomas y mejora la calidad de vida de los pacientes con EPOC60. La N-acetilcisteína (NAC) a dosis de 600mg/24h es capaz de reducir el número de exacerbaciones en pacientes no tratados con CI de forma concomitante61. Estudios más recientes con NAC a dosis altas (600mg/12h) han demostrado una reducción significativa de las agudizaciones, especialmente en pacientes de alto riesgo (aquellos con FEV1<50% o con 2 o más agudizaciones al año previo, o ambos)62,63.
El perfil de tolerancia y seguridad de ambos fármacos es excelente. Aunque por su principal mecanismo de acción parecería que el uso de mucolíticos debería quedar reservado a pacientes agudizadores con bronquitis crónica, los ensayos clínicos realizados no han seleccionado a los pacientes por la presencia de expectoración crónica, por lo que no se puede descartar un efecto en la prevención de agudizaciones derivado de su posible acción antioxidante también en pacientes con fenotipo agudizador con enfisema.
Pregunta PICO. ¿Cuándo utilizar mucolíticos en la prevención de agudizaciones?Recomendación débil a favor de la intervención: en pacientes con EPOC y fenotipo agudizador, a pesar de un tratamiento adecuado se sugiere añadir un mucolítico a dosis altas.
Especificaciones: se debe discutir con el paciente los costes asociados al tratamiento con agentes mucolíticos.
Tratamiento del paciente de alto riesgo y fenotipo agudizador con bronquitis crónicaLa presencia de tos y expectoración crónica es un factor reconocido que predispone a las agudizaciones en la EPOC. El primer escalón de tratamiento será la doble terapia broncodilatadora, y el siguiente paso será identificar la mejor opción para cada paciente según sus características64. Estas opciones incluyen fármacos ya descritos con anterioridad como los CI y los mucolíticos, además de los inhibidores de la fosfodiesterasa 4 y los antibióticos a largo plazo.
Inhibidores de la fosfodiesterasa 4Roflumilast es un fármaco antiinflamatorio oral que actúa mediante la inhibición selectiva de la fosfodiesterasa 4 y que ha demostrado prevenir las agudizaciones en pacientes con EPOC grave que presentan tos y expectoración crónica y además sufren agudizaciones frecuentes65. Este efecto se mantiene cuando se añade roflumilast al tratamiento de mantenimiento con un BDLD, sea LABA o LAMA. Además, consigue un incremento significativo del FEV1 valle de entre 50 y 70ml sobre el conseguido con salmeterol o tiotropio65,66. El efecto del roflumilast en la prevención de agudizaciones se ha observado incluso al añadirse a la terapia triple (LABA/LAMA/CI)67. Un estudio reciente ha demostrado que esta medicación es más eficaz en la reducción de agudizaciones en pacientes más graves que requieren ingreso hospitalario68. La dosis habitual es de 500μg por vía oral una vez al día.
Los efectos adversos con roflumilast suelen aparecer al inicio del tratamiento; son rápidamente detectados por el paciente y suelen desaparecer en las 4 primeras semanas, pero en ocasiones condicionan el abandono del fármaco. Los más frecuentes son la pérdida de peso, los efectos gastrointestinales, las náuseas, el dolor de cabeza y la pérdida de apetito. El perfil de seguridad de roflumilast no se modifica en función del tratamiento concomitante que el paciente pueda estar tomando para la EPOC. Se debe evitar la utilización de roflumilast con teofilinas.
Pregunta PICO. ¿Cuándo utilizar roflumilast en la prevención de agudizaciones?Recomendación débil a favor: se sugiere el uso de roflumilast como fármaco de segunda línea para prevenir exacerbaciones en pacientes de fenotipo agudizador con bronquitis crónica y limitación grave al flujo aéreo.
Especificaciones: su perfil de seguridad puede hacer que la tolerancia al fármaco sea escasa. Se debe prestar atención a la posible aparición de efectos adversos.
Utilización de antibióticos en la EPOC estableLa indicación del tratamiento a largo plazo con macrólidos sería en pacientes de alto riesgo con al menos 3 agudizaciones el año previo a pesar de un tratamiento inhalado adecuado69,70.
Los macrólidos administrados de forma prolongada han demostrado en pacientes estables con EPOC grave reducir de forma significativa el número de agudizaciones71. Las pautas utilizadas han sido: eritromicina 250mg/12h durante un año72, azitromicina 500mg/día, 3 días por semana durante un año69,73 y azitromicina 250mg/día durante un año74. Los resultados de todos estos estudios han sido coincidentes en demostrar una reducción significativa de las agudizaciones. Sin embargo, las poblaciones estudiadas fueron distintas y las pautas diferentes, por lo que es difícil hacer una recomendación. Cabe destacar que en el estudio de Albert et al.74 se comprobó un incremento de las resistencias bacterianas a macrólidos y un aumento de problemas auditivos en los pacientes tratados con azitromicina. Por analogía a las pautas utilizadas en pacientes con similares características, y afectados de bronquiectasias, la dosis recomendada sería azitromicina 250 o 500mg/día, 3 días por semana durante un año, con repetición en sucesivos periodos invernales (de noviembre a mayo) en caso de buena respuesta (ausencia de agudizaciones). Este tratamiento debe reservarse a centros de referencia con seguimiento clínico, auditivo y de bioquímica hepática y microbiológico con identificación de microorganismos en esputo y estudio de sensibilidad a los antibióticos70. No existe evidencia de la eficacia de este tratamiento más allá del año de seguimiento, por lo que se recomienda evaluar el posible riesgo-beneficio de forma anual70.
Pregunta PICO. ¿Cuándo utilizar macrólidos a largo plazo en la prevención de agudizaciones?Recomendación débil a favor: en pacientes con EPOC con fenotipo agudizador, con al menos 3 agudizaciones el año previo, a pesar del tratamiento adecuado, se sugiere el tratamiento con macrólidos a largo plazo.
Especificaciones: el grupo elaborador cree que se debe restringir esta indicación a pacientes con frecuentes agudizaciones y grado de obstrucción grave. Una vez seleccionados se debe realizar un control estricto ante los posibles efectos adversos asociados al tratamiento, como la prolongación del intervalo QT, pérdida de la capacidad auditiva o la generación de resistencias.
La utilización de quinolonas durante los períodos de estabilidad ha demostrado erradicar las bacterias presentes en el esputo en la mayoría de pacientes con EPOC grave y agudizaciones frecuentes75. Un ECA evaluó la eficacia de la administración cíclica de moxifloxacino (400mg/día, 5 días cada 2 meses) durante un año en pacientes con EPOC estable76. Los resultados demostraron que el tratamiento redujo de forma significativa, un 45%, las agudizaciones en aquellos pacientes que presentaban esputo purulento o mucopurulento, es decir, aquellos con mayor probabilidad de sufrir una infección bronquial bacteriana crónica.
Debido a que las quinolonas son tratamiento de primera elección en el tratamiento de las agudizaciones de la EPOC en pacientes graves, es importante preservar esta clase de antibióticos, por lo que se desaconseja el uso de quinolonas a largo plazo con finalidad preventiva.
Pregunta PICO. ¿Cuándo utilizar quinolonas a largo plazo en la prevención de agudizaciones?Recomendación fuerte en contra: en pacientes con EPOC en fase estable no se recomienda administrar tratamiento crónico con fluoroquinolonas con el propósito de prevenir exacerbaciones.
Especificaciones: el grupo elaborador de la guía está de acuerdo en racionalizar el uso de fluoroquinolonas, y no indicarlo como pauta preventiva de exacerbaciones debido al riesgo de desarrollo de resistencias bacterianas.
Los pacientes candidatos a tratamiento crónico con antibióticos son pacientes con alta probabilidad de ser portadores de bronquiectasias. Las bronquiectasias pueden contribuir a mantener un círculo vicioso amplificando la inflamación subyacente e induciendo la presencia de agudizaciones frecuentes18,77, e incluso se asocian a una mayor mortalidad78. En pacientes con EPOC y bronquiectasias se debe tratar el componente infeccioso de acuerdo a las normativas de tratamiento de las bronquiectasias79.
Otros tratamientos específicosOxigenoterapia crónica domiciliariaLa oxigenoterapia crónica domiciliaria (OCD) es un tratamiento que consigue aumentar la supervivencia en pacientes con EPOC e insuficiencia respiratoria80. También ha demostrado reducir el número de exacerbaciones y hospitalizaciones y mejorar la capacidad de esfuerzo y la calidad de vida81. Los beneficios conseguidos con la oxigenoterapia dependen de la duración de su administración. La duración diaria de la OCD se recomienda que debe ser al menos de 16horas, con el objetivo de mantener una PaO2≥60mmHg o una saturación de oxígeno≥90% en situación de reposo y al nivel del mar. La indicación debe realizarse cuando la enfermedad está en fase estable y mediante la realización de una gasometría arterial (tabla 5).
Indicaciones de la oxigenoterapia continua domiciliaria
| Paciente con EPOC estable en reposo y al nivel del mar, respirando aire ambiente |
| PaO2<55mmHg |
| PaO2entre 55-60mmHg con repercusión por hipoxemia |
| Hipertensión arterial pulmonar/cor pulmonale |
| Insuficiencia cardiaca congestiva/arritmias |
| Hematocrito>55% |
La utilización de la OCD en pacientes con hipoxemia intermitente, como la que aparece durante el sueño, o en los pacientes con hipoxemia leve a moderada en reposo o durante el ejercicio no se ha demostrado que tenga efectos sobre la supervivencia o el tiempo hasta el primer ingreso hospitalario u otros parámetros clínicos, por lo que no está recomendada82. En ausencia de criterios de OCD, la oxigenoterapia nocturna puede considerarse en pacientes con demostración de desaturación nocturna de oxihemoglobina (<90% durante al menos un 30% del tiempo total de registro) y secuelas relacionadas con la hipoxia (poliglobulia o signos de insuficiencia cardíaca derecha). Se debe considerar la CPAP o la ventilación mecánica, que puede sustituir o complementar la oxigenoterapia83, pero se debe descartar un síndrome de apneas del sueño.
La oxigenoterapia durante la deambulación mejora la capacidad para realizar ejercicio en pacientes con EPOC grave. Se puede utilizar en casos de limitación por disnea y con desaturaciones inferiores al 88% en la prueba de la marcha84. Debe reevaluarse en los primeros 2 meses la mejoría conseguida, tanto en la disnea como en la distancia recorrida84. No obstante, son necesarios más estudios para definir los beneficios.
Tratamiento sustitutivo con alfa-1-antitripsinaEl tratamiento sustitutivo con alfa-1-antitripsina purificada (AAT) se recomienda por las principales sociedades científicas (American Thoracic Society, European Respiratory Society y la Sociedad Española de Neumología y Cirugía Torácica)85,86 en los pacientes con enfisema pulmonar con un déficit de AAT grave y con fenotipo homocigoto PiZZ o variantes raras deficitarias por su efecto en enlentecer la pérdida de densidad pulmonar medida por TACAR. El estudio RAPID es el mayor ECA realizado hasta la fecha para evaluar la eficacia del tratamiento sustitutivo en frenar la evolución del enfisema en pacientes con déficit grave de AAT87. Los resultados demostraron que tras 2 años de seguimiento los pacientes en tratamiento tenían una reducción significativa en la pérdida de densidad pulmonar medida por TACAR, comparados con los pacientes del grupo placebo. Además, el estudio tenía una fase de continuación abierta de 2 años más en la que los pacientes que habían estado en placebo recibieron tratamiento activo, y se observó que enlentecían la progresión de la enfermedad de forma significativa en relación con el periodo anterior de 2 años con placebo. No obstante, el exceso de pérdida de tejido pulmonar que sufrieron durante los 2 años con placebo no se recuperó. Esto indica la importancia de identificar y tratar precozmente a los pacientes en riesgo de una evolución rápida de su enfermedad para prevenir el daño pulmonar88. Sus criterios de inclusión y exclusión están bien definidos en las normativas específicas85,86.
Todo paciente con EPOC debe tener al menos una medición de sus concentraciones de alfa-1 antitripsina sérica. Tras la identificación de un paciente con déficit de AAT se debe realizar un estudio familiar para detectar posibles casos no diagnosticados85,86. Los casos detectados deben ser notificados al Registro español de pacientes con déficit de alfa-1 antitripsina89, y se deben derivar a un centro de referencia para un diagnóstico completo y evaluación del posible tratamiento sustitutivo y estudio familiar
Esquema de tratamiento inicial de la EPOC estableEl esquema de tratamiento inicial de la EPOC estable se presenta en la figura 4. Los pacientes con bajo riesgo recibirán inicialmente un LAMA. En casos de persistencia o empeoramiento de los síntomas o agudizaciones se incrementará el tratamiento a la doble terapia broncodilatadora.
Los pacientes de alto riesgo recibirán de primera elección una combinación LABA/LAMA, excepto en los casos de ACO en que está indicada la combinación LABA/CI. En estos pacientes se debe determinar el fenotipo, y en caso de control insuficiente añadirán nuevos fármacos de acuerdo al fenotipo del paciente. Antes de llevar a cabo un incremento en la medicación es importante investigar el cumplimiento adecuado, una correcta técnica inhalatoria y también comprobar si existen comorbilidades que puedan ser la causa de la sintomatología.
Adecuación del tratamiento durante el seguimientoEstá bien establecido el incremento del tratamiento de acuerdo a la progresión de la enfermedad o a su gravedad, y en particular debido a la persistencia o empeoramiento de los síntomas o a la presencia de agudizaciones. Sin embargo, es muy escasa la evidencia existente sobre la posible reducción o retirada de tratamiento en pacientes que consiguen una mejoría o estabilidad clínica. En función de la evidencia existente se puede recomendar:
- a)
El tratamiento broncodilatador ejerce su efecto solamente durante su administración, por lo que es muy probable que la retirada de un broncodilatador o su sustitución por otro de menor potencia broncodilatadora, o menor duración de acción, produzca un empeoramiento funcional y/o sintomático90.
- b)
En pacientes con ACO se puede ensayar la reducción de dosis de CI hasta conseguir la mínima dosis eficaz, al igual que se realiza en el asma. No se recomienda dejar a estos pacientes en tratamiento con BDLD sin CI.
- c)
En pacientes con fenotipo agudizador no es posible especificar una pauta de reducción de tratamiento en caso de estabilidad. Deberá realizarse según juicio clínico empezando por la retirada de aquellos fármacos que probablemente son menos activos o que presentan mayor probabilidad de efectos adversos a corto o largo plazo.
- d)
El tratamiento a largo plazo con CI está asociado a la posible aparición de efectos adversos54. Por este motivo es esencial evaluar en cada paciente la relación beneficio-riesgo del uso de estos fármacos. Existe un alto grado de consenso en que la retirada de los CI es posible, aunque el acuerdo es menor a la hora de delimitar las características de los pacientes en los que se debe llevar a cabo91.
Existen estudios que indican que la retirada indiscriminada de los CI puede incrementar la inflamación bronquial92 y asociarse a un aumento en el riesgo de agudizaciones93. Sin embargo, trabajos recientes con una gran población de pacientes moderados o graves no han encontrado un mayor riesgo de agudizaciones al retirar los CI, siempre que se sustituyan por una broncodilatación adecuada94,95. Análisis secundarios de estos estudios muestran que la concentración de eosinófilos en sangre puede ser también un buen marcador para identificar aquellos pacientes que pueden interrumpir los CI sin riesgo, incluso con obstrucción al flujo aéreo grave y agudizaciones el año previo, siempre que continúen tratamiento con doble terapia broncodilatadora96. De forma parecida, otros trabajos sugieren que la retirada de CI es segura en pacientes leves-moderados (FEV1>50%) que no presentaron agudizaciones, o incluso con agudizaciones el año previo, siempre que se optimice la broncodilatación97.
A efectos prácticos se recomienda la retirada de CI en todos aquellos pacientes que los están recibiendo sin indicación. Además la retirada se debe considerar en pacientes más graves (FEV1<50%) si tienen riesgo de efectos adversos relacionados con los CI: neumonías previas, osteoporosis, diabetes mal controlada, fragilidad cutánea, etc. Si se mantienen estables, sin agudizaciones en el último año, se debe valorar la concentración de eosinófilos en sangre y aconsejar la retirada si su concentración es inferior a 300cél/mm3, ya que concentraciones superiores constituyen criterio de ACO y de necesidad del uso de CI.
Aunque el mayor estudio clínico realizado hasta la fecha utilizaba una pauta descendente de la dosis de CI94, la evidencia acumulada en otros estudios clínicos sugiere que la retirada puede ensayarse sin reducción de dosis97,98.
El tratamiento farmacológico de los pacientes con EPOC debe reevaluarse periódicamente, pues con la edad, los cambios en las comorbilidades, la estacionalidad de los síntomas y las exacerbaciones, la disponibilidad de nuevos fármacos, las nuevas estrategias de tratamiento, unidos a medidas de higiene y no famarcológicas deben permitir personalizar el tratamiento y mejorar los resultados clínicos.
Conflicto de interesesMarc Miravitlles ha recibido honorarios por asesoría científica y/o por impartir conferencias de AstraZeneca, Boehringer Ingelheim, CSL Behring, Grupo Ferrer, GlaxoSmithKline, Grifols, Laboratorios Esteve, Teva, Cipla, Menarini, Novartis y Gebro Pharma.
Borja G. Cosío ha recibido honorarios por asesoría científica y/o por impartir conferencias de Chiesi, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Laboratorios Esteve, Teva, Menarini y Novartis.
Juan José Soler-Cataluña ha recibido honorarios por asesoría científica y/o por impartir conferencias de Chiesi, AstraZeneca, Boehringer Ingelheim, Gebro, Grupo Ferrer, GlaxoSmithKline, Laboratorios Esteve, Teva, Menarini, Novartis y Pfizer.
Myriam Calle ha recibido honorarios por impartir conferencias de Novartis, AstraZeneca, Glaxo SmithKline y Boehringer-Ingelheim.
Pere Almagro ha recibido honorarios por asesoría científica y/o por impartir conferencias de Chiesi, AstraZeneca, Boehringer-Ingelheim, GlaxoSmithKline, Laboratorios Esteve, Menarini y Novartis.
Ciro Casanova Macario ha recibido en los últimos 3 años honorarios por impartir conferencias y/o asesoría científica de AstraZeneca, Boehringer-Ingelheim, Gebropharma, GlaxoSmithKline, Laboratorios Esteve, Menarini, Novartis y Rovi.
Jesús Molina ha recibido honorarios por asesoría científica y/o por impartir conferencias de AstraZeneca, Boehringer Ingelheim, Chiesi, Gebro, GlaxoSmithKline, Laboratorios Esteve, Menarini, Mundipharma, Novartis, Pfizer, Rovi y Teva.
Pere Simonet ha recibido honorarios por impartir conferencias de Boehringer Ingelheim, Menarini, Mundipharma, GlaxoSmithKline y Teva.
José Antonio Quintano ha recibido honorarios por asesoría científica y/o por impartir conferencias de AstraZeneca, Boehringer-Ingelheim, Esteve, Gebro, Grifols, Menarini, Mundipharma, Pfizer, Rovi y Teva.
Julio Ancochea ha recibido honorarios por asesoría científica y/o por impartir conferencias de Actelion, Air Liquide, Almirall, AstraZeneca, Boehringer Ingelheim, Carburos Médica, Chiesi, Faes Farma, Ferrer, GlaxoSmithKline, InterMune, Linde Healthcare, Menarini, MSD, Mundipharma, Novartis, Pfizer, Roche, Rovi, Sandoz, Takeda y Teva.
Coordinador: Marc Miravitlles, Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Integrantes del grupo de trabajo: Myriam Calle, Borja García-Cosío, Juan Antonio Riesco, Eusebi Chiner, Ciro Casanova y Juan José Soler-Cataluña (SEPAR). Joan B. Soriano (SEPAR-epidemiología). Julio Ancochea, coordinador científico de la estrategia en EPOC del SNS (SEPAR). Pere Almagro, Sociedad Española de Medicina Interna (SEMI). Elena Gimeno (SEPAR-Fisioterapia). Eulogio Pleguezuelos, Sociedad Española de Rehabilitación y Medicina Física y Sociedad de Rehabilitación Cardio-Respiratoria (SERMEF/SORECAR). José Antonio Quintano, Sociedad Española de Médicos de Atención Primaria (SEMERGEN). Juan Antonio Trigueros, Sociedad Española de Médicos Generales y de Familia (SEMG). Jesús Molina y Miguel Ángel Lobo Álvarez, Sociedad Española de Medicina de Familia y Comunitaria (SemFYC). Pere Simonet, Sociedad de Respiratorio en Atención Primaria (GRAP). Pascual Piñera y Adolfo Simón, Sociedad Española de Medicina de Urgencias y Emergencias (SEMES). Carme Hernández y Carmen Mata (SEPAR-Enfermería). Leopoldo Palacios y Carlos Verdejo, Sociedad Española de Geriatría y Gerontología (SEGG). María Emilia Carretero Díaz, Foro Español de Pacientes (FEP). David Rigau y Ena Pery Niño de Guzman Quispe, Centro Cochrane Iberoamericano.