El asma no es una enfermedad homogénea. En el pasado, el asma se clasificaba en 2 grandes categorías: el asma intrínseca, en la que el desencadenante de la enfermedad no es evidente, y el asma extrínseca, en la que se observa una relación obvia con un alérgeno. Se reconoció que la atopia y los antecedentes familiares de asma son más llamativos en los pacientes con asma extrínseca que en aquellos que presentan asma intrínseca. En 1989, Burrows et al. demostraron que la inmunoglobulina E (IgE) disminuye con la edad, aunque, a cualquier edad, las concentraciones de IgE son más altas en sujetos asmáticos que en no asmáticos, y plantearon que el asma siempre es de naturaleza alérgica1. Más adelante, los términos «intrínseca» y «extrínseca» cayeron en desuso. Sin embargo, el interés por diseccionar las diferentes formas de asma se ha recuperado al mismo tiempo que ha crecido el entusiasmo por la medicina personalizada.
En cohortes de pacientes asmáticos se ha observado que existen grupos que se distinguen por características clínicas que no aportan información desde el punto de vista de la etiología de la enfermedad. Durante el Severe Asthma Research Program (Programa de Investigación del Asma Grave) de EE. UU. se identificaron 5 grupos de pacientes en función de los valores de volumen espiratorio forzado en un segundo, este mismo valor posbroncodilatador y la edad de inicio de la enfermedad2. Estos grupos presentaban algunas diferencias entre ellos, pero también se solapaban. En un estudio efectuado en el Reino Unido se identificaron otros grupos que incluían sujetos con mayor o menor grado de eosinofilia en el esputo en concordancia con los síntomas y los grupos en los que el grado de inflamación y los síntomas no concordaban3. Más recientemente, en otro análisis de grupos basado en las citocinas presentes en el esputo, también se identificaron distintos patrones de asma4.
Algunos asmáticos presentan exacerbaciones frecuentes o graves. Debido a que las infecciones víricas son la causa principal de las exacerbaciones que originan visitas a los servicios de urgencias, la susceptibilidad a presentar este tipo de episodios podría estar relacionada con la susceptibilidad a presentar infecciones epiteliales. Se ha demostrado que una respuesta deficiente del interferón epitelial se relaciona con la persistencia de replicación vírica en el interior de las células epiteliales5. Uno de los subgrupos con mayor riesgo relativo de exacerbación es el de los pacientes asmáticos con esputo eosinofílico persistente a pesar de recibir dosis altas de corticoides inhalados.
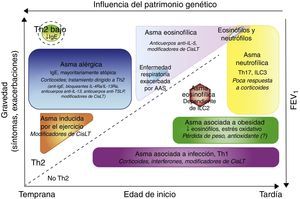
La introducción de fármacos biológicos ha incentivado considerablemente el fenotipado del asma. Un fenotipo es cualquier característica observable de una enfermedad que no implica un mecanismo. Para describir el asma desencadenada por el ejercicio, el asma de las personas intolerantes a la aspirina y el asma de las personas obesas y de las personas de edad avanzada se utiliza una variedad de descriptores clínicos (fig. 1). Los fenotipos no incluyen necesariamente información relativa a la biopatología subyacente y sería preferible clasificar el asma con base en su biopatología. Como se trata de una enfermedad inflamatoria, la mayoría de los intentos de fenotipar el asma se han centrado en factores relacionados con la inflamación. Se ha demostrado que más de 150 genes comportan riesgo de asma, por lo que es probable que existan muchos fenotipos moleculares basados únicamente en rasgos heredados y cuyas características se solapen. Sin embargo, conocer las bases moleculares o endotipar las distintas formas de asma debe continuar siendo un objetivo.
Fenotipos clínicos de asma y de tratamiento. Los fenotipos se representan de acuerdo con la edad de inicio, la gravedad de la enfermedad, la inflamación dependiente o no de Th2 y la influencia de la base genética. Además del tratamiento clásico con agonistas beta, los tratamientos específicos para cada grupo se señalan en cursiva.Ac: anticuerpo; CisLTs: cisteinil-leucotrienos; IL: interleucina; ILC: células linfoides innatas TSLP: linfopoyetina del estroma tímico.
La atopia es una característica frecuente de los sujetos asmáticos y un prerrequisito de la susceptibilidad a padecer asma. La sensibilización y la exposición al alérgeno como causa de asma están bien documentadas en estudios epidemiológicos, en particular en aquellos que abordan el asma ocupacional. La inmunobiología de la inflamación alérgica se ha explorado en modelos murinos que han proporcionado una valiosa perspectiva de las bases del proceso inflamatorio. En el campo de la biología linfocitaria, la identificación de 2 subgrupos de linfocitos T CD4 que dan lugar a perfiles de citocinas diferenciados ha significado un avance importante. Los linfocitos CD4 (Th2), que preferentemente producen interleucina (IL)-4 e IL-5, son fundamentales para la síntesis de inmunoglobulinas y para la diferenciación, la supervivencia y la activación de los eosinófilos, respectivamente. La IL-13 tiene otras propiedades, como la promoción de la diferenciación de las células mucosas o la activación de fibroblastos y de la musculatura lisa6. La inflamación alérgica se desencadena en entornos en los que el medio promueve la diferenciación de CD4 Th2 por influencia de factores como la propia IL-4, la linfopoyetina del estroma tímico y diversos productos de eosinófilos, tales como los cisteinil-leucotrienos o la neurotoxina derivada de eosinófilos.
Una evaluación de los patrones de expresión génica de las células epiteliales de las vías aéreas ha demostrado que los transcriptomas se pueden utilizar para categorizar a los pacientes en asmáticos con Th2 alto, que presentan elevación de IgE, eosinofilia y capacidad de respuesta a los corticoides inhalados, y asmáticos con Th2 bajo, con menor capacidad de respuesta a los corticoides inhalados7. Se han identificado genes epiteliales activados por la IL-13 y, en particular, por la periostina. La periostina, que se utiliza como marcador del asma con Th2 alto, puede participar en la patogenia del asma promoviendo el reclutamiento de eosinófilos en las vías aéreas, activando el factor de crecimiento transformante beta para inducir a los fibroblastos a sintetizar colágeno y a diferenciarse en miofibroblastos8.
En la actualidad, en los pacientes asmáticos con poca respuesta al tratamiento habitual con corticoides inhalados a dosis altas, agonistas beta de acción prolongada en combinación y en algunos casos corticoides orales, se evalúa la posibilidad de que sean atópicos. Los pacientes asmáticos con pruebas intraepidérmicas positivas y elevación de la IgE sérica a menudo obtienen un beneficio del tratamiento con omalizumab, un anticuerpo monoclonal humanizado que se une a la IgE libre. El tratamiento es eficaz, sobre todo para reducir las exacerbaciones, y algunos pacientes también muestran una mejoría del volumen espiratorio forzado en un segundo. El mepolizumab, un fármaco anti-IL-5, ha demostrado su eficacia en asmáticos con eosinofilia resistente al tratamiento con corticoides y, en este pequeño subgrupo, reduce los porcentajes de exacerbaciones9. En breve se comercializarán otros fármacos biológicos anti-IL-5, por ejemplo, un anticuerpo contra el receptor de la IL-5 que presenta la posible ventaja adicional de reducir el número de barorreceptor de la IL-5. La IL-13 aumenta la capacidad de respuesta de la vía aérea y la síntesis de IgE en humanos, y ha sido el objetivo de ensayos clínicos de antagonistas de su receptor (pitrakinra) y de anticuerpos neutralizantes (lebrikizumab)10. Otros nuevos objetivos alternativos son la linfopoyetina del estroma tímico y la IL-33, conocidas con el nombre de alarminas, que reflejan el daño epitelial y en pruebas de provocación con el alérgeno en humanos han demostrado ser eficaces. Estas moléculas activan las células linfoides innatas, que pueden secretar una gama de citocinas similar a la de las células Th2, por lo que pueden originar un patrón de inflamación típico del asma y de la hiperreactividad de las vías aéreas. Estas células proporcionan el fundamento del asma no atópica y podrían explicar algunos casos de asma intrínseca y de asma inducida por irritantes.
Hasta hace poco tiempo, el fenotipado del asma podía parecer un ejercicio estéril. Sin embargo, la introducción de los nuevos tratamientos ha modificado el panorama terapéutico. En estudios realizados en la práctica clínica real, el omalizumab ha sido eficaz en aproximadamente el 60% de los pacientes, al igual que en los ensayos clínicos. Los tratamientos anticitocinas también han probado ser eficaces en pacientes con tipos de asma que se observan con una frecuencia relativamente baja, que precisarán un fenotipado cuidadoso para garantizar que la prescripción de estos nuevos y caros tratamientos es la adecuada.