El término fenotipo aplicado a la EPOC se define como «aquellos atributos de la enfermedad que solos o combinados describen las diferencias entre individuos con EPOC en relación a parámetros que tienen significado clínico». De entre todos los descritos, existen tres que se asocian con factores pronósticos y sobre todo con distinta respuesta a los tratamientos disponibles en la actualidad. Estos fenotipos son: el agudizador, el mixto EPOC-asma y el enfisema-hiperinsuflado.
El agudizador se caracteriza por la presencia de al menos dos agudizaciones el año previo, y además del tratamiento con broncodilatadores de larga duración puede requerir la utilización de fármacos antiinflamatorios. El fenotipo mixto presenta una obstrucción no completamente reversible al flujo aéreo acompañada de una reversibilidad aumentada de la obstrucción. Por su perfil inflamatorio subyacente suele presentar una buena respuesta terapéutica a los corticosteroides inhalados unidos a los broncodilatadores. Por último, el fenotipo enfisema presenta una pobre respuesta a los fármacos antiinflamatorios de que disponemos en la actualidad, y los broncodilatadores de larga duración, junto a la rehabilitación, son la base de su tratamiento.
El reconocimiento de las peculiaridades de los distintos fenotipos de la EPOC nos debe permitir guiar un tratamiento más personalizado en el que las características del paciente se sumen a su gravedad para dirigir la terapia.
The term phenotype in the field of COPD is defined as “a single or combination of disease attributes that describe differences between individuals with COPD as they relate to clinically meaningful outcomes”. Among all phenotypes described, there are three that are associated with prognosis and especially are associated with a different response to currently available therapies. There phenotypes are: the exacerbator, the overlap COPD-asthma and the emphysema-hyperinflation.
The exacerbator is characterised by the presence of, at least, two exacerbations the previous year, and on top of long-acting bronchodilators, may require the use of antiinflammatory drugs. The overlap phenotype presents symptoms of increased variability of airflow and incompletely reversible airflow obstruction. Due to the underlying inflammatory profile, it uses to have a good therapeutic response to inhaled corticosteroids in addition to bronchodilators. Lastly, the emphysema phenotype presents a poor therapeutic response to the existing antiinflammatory drugs and long-acting bronchodilators together with rehabilitation are the treatments of choice.
Identifying the peculiarities of the different phenotypes of COPD will allow us to implement a more personalised treatment, in which the characteristics of the patients, together with their severity will be key to choose the best treatment option.
En los últimos años ha tomado cada vez más relieve la denominación de fenotipo para referirse a formas clínicas de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC)1,2. Esto ha sido motivado por el auge de los estudios que pretenden identificar determinantes genéticos de desarrollo de la enfermedad en sus diferentes manifestaciones. Un grupo de expertos internacional ha definido fenotipo de la EPOC como «aquellos atributos de la enfermedad que solos o combinados describen las diferencias entre individuos con EPOC en relación a parámetros que tienen significado clínico (síntomas, agudizaciones, respuesta al tratamiento, velocidad de progresión de la enfermedad, o muerte)»1. Por tanto, el fenotipo debería ser capaz de clasificar a los pacientes en subgrupos con valor pronóstico y que permitan determinar la terapia más adecuada para lograr mejores resultados clínicos1–3.
En sintonía con la opinión mayoritaria, la denominación fenotipo de la EPOC se reservará a las distintas formas clínicas con repercusión terapéutica identificadas en los pacientes con EPOC. En los últimos años, diversos investigadores han intentado cuantificar las diversas «caras» o fenotipos de la EPOC en lo que se ha llamado el diagrama de Venn no proporcional de la EPOC4, un intento que pone de manifiesto la gran confusión que existe entre las diversas formas etiopatogénicas, clínicas y morfológicas de ese síndrome que llamamos EPOC y que algunos han llegado a postular que se le defina como un conjunto de enfermedades huérfanas5.
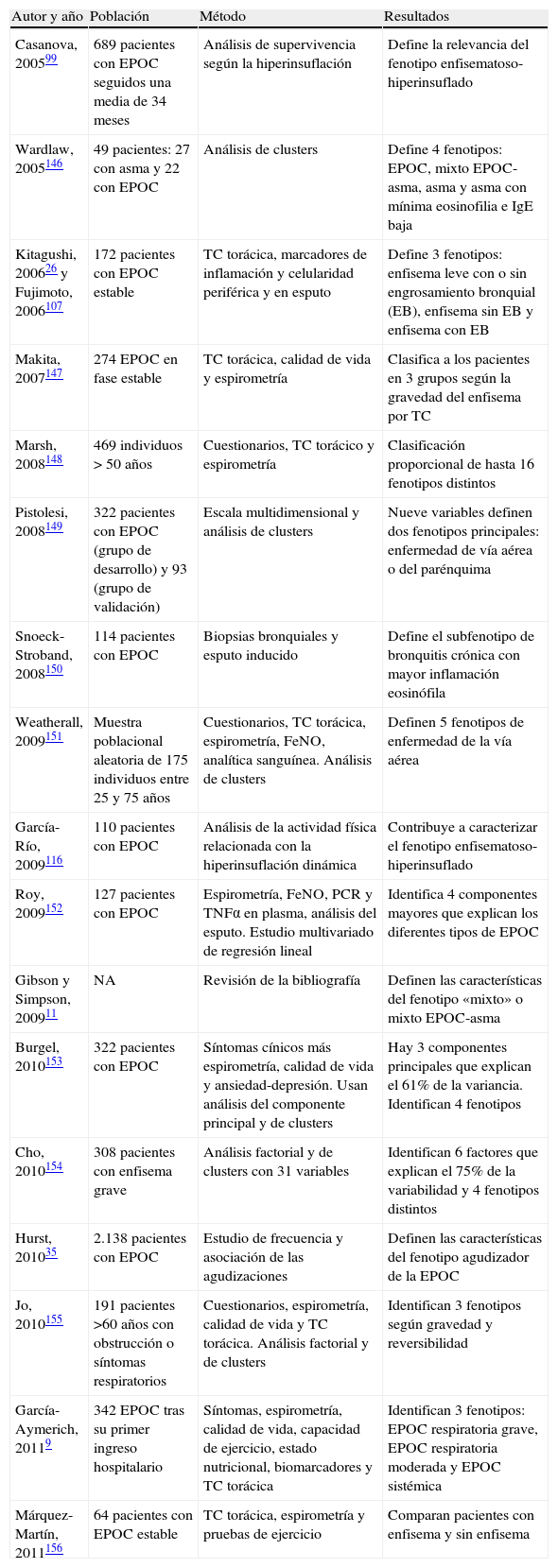
Fenotipos de interés clínico en la EPOCDebemos aceptar que existe un punto intermedio entre la simplificación excesiva del término EPOC, como definición que engloba a todo el espectro de pacientes con obstrucción no completamente reversible al flujo aéreo, y la complejidad de considerar a cada paciente de modo individual como una enfermedad huérfana. Este punto intermedio pasa por la identificación y descripción de algunos fenotipos que tengan interés no solo biológico o epidemiológico, sino también pronóstico y sobre todo terapéutico. En la tabla 1 se muestran algunos estudios que han identificado diversos fenotipos clínicos en la EPOC. Estos estudios parten de poblaciones heterogéneas, utilizan metodologías diversas para analizar variables diferentes, pero todos ellos alcanzan conclusiones similares: es posible distinguir diferentes patrones de expresión clínica de la EPOC, los llamados fenotipos. En su mayoría distinguen entre 3 y 5 fenotipos basados en una serie de factores que se enumeran en la tabla 2.
Estudios que han identificado fenotipos en la EPOC
| Autor y año | Población | Método | Resultados |
| Casanova, 200599 | 689 pacientes con EPOC seguidos una media de 34 meses | Análisis de supervivencia según la hiperinsuflación | Define la relevancia del fenotipo enfisematoso-hiperinsuflado |
| Wardlaw, 2005146 | 49 pacientes: 27 con asma y 22 con EPOC | Análisis de clusters | Define 4 fenotipos: EPOC, mixto EPOC-asma, asma y asma con mínima eosinofilia e IgE baja |
| Kitagushi, 200626 y Fujimoto, 2006107 | 172 pacientes con EPOC estable | TC torácica, marcadores de inflamación y celularidad periférica y en esputo | Define 3 fenotipos: enfisema leve con o sin engrosamiento bronquial (EB), enfisema sin EB y enfisema con EB |
| Makita, 2007147 | 274 EPOC en fase estable | TC torácica, calidad de vida y espirometría | Clasifica a los pacientes en 3 grupos según la gravedad del enfisema por TC |
| Marsh, 2008148 | 469 individuos >50 años | Cuestionarios, TC torácico y espirometría | Clasificación proporcional de hasta 16 fenotipos distintos |
| Pistolesi, 2008149 | 322 pacientes con EPOC (grupo de desarrollo) y 93 (grupo de validación) | Escala multidimensional y análisis de clusters | Nueve variables definen dos fenotipos principales: enfermedad de vía aérea o del parénquima |
| Snoeck-Stroband, 2008150 | 114 pacientes con EPOC | Biopsias bronquiales y esputo inducido | Define el subfenotipo de bronquitis crónica con mayor inflamación eosinófila |
| Weatherall, 2009151 | Muestra poblacional aleatoria de 175 individuos entre 25 y 75 años | Cuestionarios, TC torácica, espirometría, FeNO, analítica sanguínea. Análisis de clusters | Definen 5 fenotipos de enfermedad de la vía aérea |
| García-Río, 2009116 | 110 pacientes con EPOC | Análisis de la actividad física relacionada con la hiperinsuflación dinámica | Contribuye a caracterizar el fenotipo enfisematoso- hiperinsuflado |
| Roy, 2009152 | 127 pacientes con EPOC | Espirometría, FeNO, PCR y TNFα en plasma, análisis del esputo. Estudio multivariado de regresión lineal | Identifica 4 componentes mayores que explican los diferentes tipos de EPOC |
| Gibson y Simpson, 200911 | NA | Revisión de la bibliografía | Definen las características del fenotipo «mixto» o mixto EPOC-asma |
| Burgel, 2010153 | 322 pacientes con EPOC | Síntomas cínicos más espirometría, calidad de vida y ansiedad-depresión. Usan análisis del componente principal y de clusters | Hay 3 componentes principales que explican el 61% de la variancia. Identifican 4 fenotipos |
| Cho, 2010154 | 308 pacientes con enfisema grave | Análisis factorial y de clusters con 31 variables | Identifican 6 factores que explican el 75% de la variabilidad y 4 fenotipos distintos |
| Hurst, 201035 | 2.138 pacientes con EPOC | Estudio de frecuencia y asociación de las agudizaciones | Definen las características del fenotipo agudizador de la EPOC |
| Jo, 2010155 | 191 pacientes >60 años con obstrucción o síntomas respiratorios | Cuestionarios, espirometría, calidad de vida y TC torácica. Análisis factorial y de clusters | Identifican 3 fenotipos según gravedad y reversibilidad |
| García-Aymerich, 20119 | 342 EPOC tras su primer ingreso hospitalario | Síntomas, espirometría, calidad de vida, capacidad de ejercicio, estado nutricional, biomarcadores y TC torácica | Identifican 3 fenotipos: EPOC respiratoria grave, EPOC respiratoria moderada y EPOC sistémica |
| Márquez-Martín, 2011156 | 64 pacientes con EPOC estable | TC torácica, espirometría y pruebas de ejercicio | Comparan pacientes con enfisema y sin enfisema |
IgE: inmunoglobulina E; TC: tomografía computarizada; FeNO: fracción exhalada de ácido nítrico; PCR: proteína C reactiva; TNFα: factor de necrosis tumoral alfa.
Factores o variables identificados como significativos para la clasificación de pacientes con EPOC
| Autor y año | Factores |
| Casanova, 200599 | IC/TLC |
| Wardlaw, 2005146 | Eosinofilia en el esputoReversibilidad de la obstrucciónIgE |
| Kitagushi, 200626 y Fujimoto, 2006107 | Cuantificación del TC para parénquima y vía aéreaReversibilidad en porcentajeEosinofilia en esputo y periféricaSíntomas respiratorios |
| Makita, 2007147 | Enfisema por TCIMCCalidad de vida |
| Pistolesi, 2008149 | Volumen y aspecto del esputoCuantificación del TC para parénquima y vía aéreaRuidos pulmonaresFEV1/VCAtrapamiento aéreo |
| Snoeck-Stroband, 2008150 | Eosinofilia en esputo en bronquitis crónica |
| Weatherall, 2009151 | EdadFEV1 y FEV1/FVCReversibilidad en porcentajeKco en porcentajeFRC en porcentajeIgEFeNOTabaquismo en paquetes-año |
| García-Río, 2009116 | Actividad física relacionada con hiperinsuflación dinámica |
| Roy, 2009152 | Neutrofilia en esputo, IL-8 y TNFαEosinofilia en esputo y FeNOReversibilidad al broncodilatador, FEV1 e ICPCR |
| Gibson y Simpson, 200911 | SíntomasFEV1Hiperreactividad bronquialEosinofilia en esputo |
| Burgel, 2010153 | FEV1EdadSíntomasComorbilidad |
| Cho, 2010154 | FEV1 post-broncodilatadorRespuesta broncodilatadora en porcentajeMedida cuantitativa del enfisema y pared bronquial en la TC |
| Hurst, 201035 | FEV1Frecuencia de las agudizaciones en el pasadoReflujo gastroesofágicoCalidad de vida |
| Jo, 2010155 | EdadReversibilidad en porcentajeFEV1 post-broncodilatador |
| García-Aymerich, 20119 | Gravedad de los síntomas respiratoriosComorbilidad e inflamación sistémica |
| Márquez-Martín, 2011156 | Enfisema por TCFuerza muscular periféricaCapacidad de ejercicioIMC |
TC: tomografía computarizada; FEV1: flujo espiratorio máximo en el primer segundo; IMC: índice de masa corporal; IC/TLC: capacidad inspiratoria/capacidad pulmonar total; IgE: inmunoglobulina E; VC: capacidad vital; FVC: capacidad vital forzada; Kco: coeficiente de transferencia del monóxido de carbono; FRC: capacidad residual funcional; FeNO: fracción exhalada de ácido nítrico; Il: interleucina; TNFα: factor de necrosis tumoral alfa; PCR: proteína C reactiva.
Del análisis de estos estudios podemos concluir que existe evidencia para definir al menos tres fenotipos distintos con repercusión clínica, pronóstica y terapéutica: 1, «overlap» o mixto EPOC-asma; 2, agudizador; 3, enfisema-hiperinsuflado
Se han definido otros posibles fenotipos, pero de escasa trascendencia clínica. Así, el llamado declinador rápido (fast decliner) sería el paciente que sufre una pérdida de función pulmonar, expresada por el FEV1, más rápida que el promedio6. El problema práctico es que es imposible identificar este fenotipo sin un seguimiento estricto de la función pulmonar durante al menos 2 años; por otra parte, tampoco se ha identificado ningún tratamiento específico para este tipo de pacientes. Otro posible fenotipo sería la bronquitis crónica, definida como tos y expectoración durante al menos 3 meses al año en 2 años consecutivos7. Este fenotipo se suele asociar a enfermedad de la vía aérea, que puede ser visualizada por tomografía axial computarizada de alta resolución (TACAR)8. No obstante, la bronquitis crónica puede acompañar a cualquiera de los tres fenotipos señalados anteriormente: «mixto», agudizador y enfisema, por lo que preferimos describirla como un factor modificador en cualquiera de los 3 fenotipos principales. También se ha definido un fenotipo «sistémico» de la EPOC en pacientes que presentan obesidad, enfermedad cardiovascular, diabetes o inflamación sistémica9. Es cierto que estos pacientes presentan un pronóstico distinto, pero no podemos llamar a la EPOC «sistémica» un fenotipo, ya que no cumple con la definición anterior, pues las manifestaciones sistémicas (o comorbilidades) no se ha demostrado que sean una manifestación propia «de» la EPOC. Las comorbilidades o manifestaciones sistémicas son muy importantes pero deben considerarse aparte del fenotipo.
Por último, un fenotipo especial es el enfisema por déficit de alfa-1-antitripsina, que se caracteriza por un enfisema de predominio basal que aparece en edades tempranas de la vida, sobre todo en fumadores, y tiene una base genética10. Por su escasa prevalencia preferimos considerarlo aparte de la clasificación general.
Fenotipo mixto EPOC-asmaCuando un paciente presenta características de más de una enfermedad obstructiva de las vías aéreas decimos que tiene un síndrome de solapamiento o mixto (overlap en inglés). En las normativas de la American Thoracic Society (ATS) de 1995 se definían las enfermedades obstructivas y se identificaron 11 síndromes distintos, 6 de los cuales eran síndromes overlap7. Un estudio que utilizó datos de una población muy amplia observó que el 19% de pacientes con obstrucción al flujo aéreo tenían más de una enfermedad presente4. Los procesos o enfermedades más representativos y frecuentes dentro de estos subgrupos eran la obstrucción crónica al flujo aéreo y el asma. Por tanto, no es de extrañar que exista un buen número de pacientes que comparten características que se atribuyen a la EPOC y al asma. Esta población tiene un especial interés, ya que suele quedar al margen de los ensayos clínicos con medicamentos. Los estudios en asma tienden a excluir a los fumadores, y los estudios en EPOC suelen excluir a los individuos con historia previa de asma, y algunos incluso a los individuos con una prueba broncodilatadora positiva.
Definición de fenotipo mixto (EPOC-asma)El fenotipo mixto en la EPOC se define como una obstrucción no completamente reversible al flujo aéreo acompañada de síntomas o signos de una reversibilidad aumentada de la obstrucción11.
Justificación del fenotipo mixtoPatogénesis y prevalenciaDentro del espectro de la obstrucción crónica al flujo aéreo existen individuos asmáticos fumadores, asmáticos que desarrollan obstrucción no completamente reversible al flujo aéreo y no fumadores que desarrollan obstrucción crónica al flujo aéreo. Los fumadores con asma tienen rasgos que asemejan la EPOC, con una menor respuesta a los corticosteroides y una menor frecuencia de inflamación eosinofílica y una mayor probabilidad de neutrofilia en las vías aéreas12,13. Por otra parte, hay estudios epidemiológicos de incidencia de EPOC en los que se demuestra que los jóvenes asmáticos que desarrollan EPOC tienen una enfermedad de características diferentes a aquellos no asmáticos que también desarrollan la EPOC. En el primer caso es más frecuente la rinitis alérgica, la hiperreactividad bronquial inespecífica y la presencia de sibilantes y son mayores las concentraciones plasmáticas de IgE14, lo que indica que se trata de un síndrome mixto entre asma y EPOC.
La prevalencia del fenotipo mixto es desconocida, pero existen diferentes estimaciones de su importancia en el contexto de la EPOC. Un estudio inicial de pequeño tamaño estimó que el 25% de los pacientes con EPOC tenía una reversibilidad significativa y presentaba respuesta clínica a los corticosteroides inhalados (CI)15. Soriano et al.4 estimaron que aproximadamente el 23% de pacientes con EPOC entre 50 y 59 años podían tener un fenotipo mixto, cifra que aumentaba con la edad hasta el 52% entre los de entre 70 y 79 años4. Otros estudios han cifrado la prevalencia del fenotipo mixto (identificado por eosinofilia en el esputo) en pacientes con EPOC en el 38%, asociada de forma directa con la respuesta terapéutica a los CI16. Si utilizamos como referencia la prueba broncodilatadora, el 31,5% de los pacientes identificados con EPOC en el estudio epidemiológico EPI-SCAN tenían una prueba positiva17. Basados en estos resultados podemos concluir que, en conjunto, entre el 20 y el 40% de pacientes con EPOC pueden ser portadores de un fenotipo mixto.
Tratamiento diferencialLa justificación clínica del fenotipo mixto radica en su demostrada sensibilidad a la acción antiinflamatoria de los CI. El fundamento que explica la respuesta a los corticoides en pacientes con EPOC con mayor reversibilidad hay que buscarlo en la etiopatogenia de la enfermedad. Papi et al.18 demostraron que los pacientes reversibles, incluso los que eran solo parcialmente reversibles (aumento del FEV1 >200ml, pero <12%) tenían una mayor inflamación bronquial eosinófila comparados con los irreversibles, en los que predominaba la inflamación neutrófila. De hecho, diversos estudios han utilizado la mayor reversibilidad al flujo aéreo4,19–21, una elevada concentración de eosinófilos en esputo espontáneo o inducido16,22 o una mayor concentración de NO exhalado23–25 como marcadores de respuesta a los CI en la EPOC, tanto a nivel de función pulmonar15,16,19–23,25 como a nivel de mejoría de síntomas22,24,25. Un estudio más reciente clasificó a un grupo reducido de pacientes en 3 fenotipos distintos según los hallazgos de la tomografía computarizada (TC) de tórax26. Los autores demostraron una relación entre la respuesta a la prueba broncodilatadora, la respuesta al tratamiento con CI y la concentración de eosinófilos en esputo en cada uno de los 3 fenotipos26. Incluso existe un ensayo clínico aleatorizado que comparó el tratamiento con CI en pacientes con EPOC dirigido según las normativas vigentes o según la concentración de eosinófilos en esputo inducido. Los resultados demostraron una reducción significativa de las agudizaciones durante un año en los que tomaron CI de acuerdo a su perfil de inflamación eosinófila27. Todos estos resultados justifican un enfoque personalizado en el tratamiento con CI, basado en las características clínicas, funcionales e inflamatorias de los pacientes con EPOC28,29.
En relación con el tratamiento combinado beta-2 adrenérgico de larga duración (LABA) más CI, es importante recordar que ya los primeros resultados publicados demostraron que el tratamiento combinado con fluticasona/salmeterol (FSC) era eficaz en lograr una broncodilatación importante en pacientes con EPOC, pero se debe recordar que la mitad de los pacientes estudiados tenían una prueba broncodilatadora positiva al inicio del estudio30. Cuando se analizaba los resultados por separado, los pacientes reversibles lograban un efecto broncodilatador máximo de 319ml de FEV1, mientras que los irreversibles se quedaban en 195ml30.
La escasa reducción de mortalidad observada en el estudio Towards a Revolution in COPD Health (TORCH) con FSC puede, al menos en parte, explicarse por la selección de pacientes. Uno de los criterios de inclusión era tener una prueba broncodilatadora negativa, lo que se refleja en una reversibilidad media de los participantes de solo el 3,7%31. Por tanto, TORCH nos explica el efecto a largo plazo de la combinación FSC en aquellos pacientes menos susceptibles de ser respondedores a los CI. Por el contrario, un estudio más reciente ha comparado FSC con salmeterol en el tratamiento de pacientes con EPOC grave (FEV1 <50%)32. Sus resultados mostraron una reducción significativa del 35% durante un año en la tasa de agudizaciones moderadas o graves con FSC comparado con salmeterol solo. Este estudio no tuvo en cuenta la reversibilidad del FEV1 entre sus criterios de inclusión, y de hecho la reversibilidad media de sus pacientes fue del 7%, casi el doble que en TORCH, y el resultado fue una reducción espectacular de la frecuencia de agudizaciones al añadir fluticasona al tratamiento con salmeterol. En el mismo sentido, en un trabajo reciente se demostró que el tratamiento con FSC a dosis de 250/50 cada 12h producía un aumento del área bajo la curva de 6h del FEV1 que era más del doble en pacientes reversibles (1,98l-h en la semana 8) que en irreversibles (0,74l-h), lo que aporta más evidencia de la diferente respuesta a los CI o al tratamiento combinado según la respuesta a la prueba broncodilatadora20. También recientemente se ha demostrado una correlación directa y significativa entre la respuesta a la prueba broncodilatadora con salbutamol en EPOC y la mejoría en función pulmonar tras 3 meses de tratamiento con LABA+CI21. Por el contrario, los pacientes con un fenotipo definido como enfisema-dominante no presentaron ninguna mejoría en su función pulmonar con el mismo tratamiento21. Es de esperar que estos hallazgos descritos en los estudios realizados con salmeterol o con SAL/FLU puedan ser extrapolables a otros CI o combinaciones LABA/CI.
En resumen, las conclusiones que podemos señalar a partir de los estudios existentes son: a) los pacientes con fenotipo mixto, que presentan alguna de las siguientes características: eosinofilia en el esputo y/o periférica, antecedentes de asma y/o atopia, agudizaciones frecuentes, prueba broncodilatadora muy positiva o sibilancias como signo guía, son susceptibles de presentar una buena respuesta a los CI, sea cual sea su función pulmonar; b) pacientes con EPOC que no presentan las anteriores características obtendrán un beneficio clínico marginal con el uso de CI añadidos a broncodilatadores de larga duración.
Diagnóstico del fenotipo mixto (EPOC-asma)Para poder identificar el fenotipo mixto, la historia clínica nos orientará por los antecedentes de asma y atopia en la infancia y juventud, la menor intensidad de la exposición al tabaco, la frecuencia de las agudizaciones y los síntomas guía, como los sibilantes, entre otros. Pero para poder caracterizar un paciente con EPOC como mixto será preciso además realizar una serie de exploraciones. La espirometría, además de diagnosticar la enfermedad, nos dará una medida de su gravedad, y la magnitud de la reversibilidad en la prueba broncodilatadora nos orientará sobre el posible diagnóstico de mixto. La analítica sanguínea nos indicará si existe eosinofilia, y en una situación ideal el análisis citológico del esputo nos podría indicar la intensidad de la inflamación eosinófila, y una concentración elevada de óxido nítrico exhalado también podría ayudar a identificar a pacientes con fenotipo mixto EPOC-asma.
La utilidad de la prueba broncodilatadora como marcador de la respuesta a los CI ha sido puesta en duda tras los resultados reportados por Calverley et al.33. En la fase de cribado del estudio ISOLDE analizaron un total de 660 pacientes, y al realizar 3 pruebas broncodilatadoras en un espacio de 2 meses observaron que un número significativo de pacientes podía ser positivo o negativo para las distintas pruebas, por lo que concluyeron que no era adecuado clasificar a los pacientes en reversibles o irreversibles. Sin embargo, hay que tener en cuenta que ellos excluyeron los pacientes que en la primera prueba tuvieron una reversibilidad del FEV1 >10%, y que el protocolo de la prueba fue distinto en las 3 ocasiones que se realizó. Este estudio no invalida la utilidad de la prueba broncodilatadora, pero nos recuerda que la respuesta es una variable continua y que es más fiable interpretar la magnitud de la respuesta en cada caso que clasificar a un paciente como reversible o irreversible en función de un punto de corte arbitrario.
En resumen, el diagnóstico de fenotipo mixto se establecerá en presencia de una combinación de los siguientes factores: historia de asma y/o atopia, reversibilidad en la prueba broncodilatadora, marcada eosinofilia en las secreciones respiratorias y/o periférica, IgE elevada, pruebas cutáneas a neumoalergenos positivas y concentraciones elevadas de NO exhalado.
Fenotipo agudizadorEl curso clínico de la EPOC se ve salpicado con frecuencia por episodios de inestabilidad clínica a los que denominamos agudizaciones o exacerbaciones. Se estima que los pacientes con EPOC sufren entre 1 y 4 agudizaciones al año34; sin embargo, su aparición no sigue una distribución normal. Algunos pacientes no sufren ninguna agudización, mientras que otros las presentan de forma repetida. En el estudio Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints (ECLIPSE), un estudio prospectivo observacional sobre 2.138 pacientes con EPOC moderada-grave seguidos durante 3 años35, el 23% de los pacientes no sufrieron ninguna agudización, mientras que el 12% de los casos tuvieron 2 o más agudizaciones al año durante los 3 años del estudio. Los agudizadores mantuvieron una notable estabilidad en el tiempo, hasta tal punto que algo más del 60% de los pacientes con 2 o más agudizaciones en el primer año también presentaron frecuentes agudizaciones en el segundo año de seguimiento, y de ellos, más del 70% seguían teniendo repetidas descompensaciones en el tercer año. Dada esta estabilidad temporal se ha sugerido que estos pacientes podrían presentar una susceptibilidad individual a sufrir frecuentes descompensaciones36,37. Este hecho, y también la constancia de que estamos ante un grupo de enfermos con elevado riesgo de morbimortalidad38–45 cuyo tratamiento podría ser diferenciado, constituyen las bases racionales para definir el fenotipo «agudizador». El punto de corte en el número de agudizaciones para considerar a un paciente agudizador ha ido variando a lo largo del tiempo, pero actualmente se considera agudizador el paciente que presenta 2 o más agudizaciones al año35.
Definición de «agudizador»Se define como «agudizador» a todo paciente con EPOC que presente 2 o más agudizaciones al año. Estas exacerbaciones deben estar separadas al menos 4 semanas desde el final del tratamiento de la exacerbación previa o 6 semanas desde el inicio de la misma en los casos que no han recibido tratamiento, para diferenciar el nuevo evento de un fracaso terapéutico previo36.
Justificación del fenotipo agudizadorSusceptibilidad individual a sufrir frecuentes agudizacionesLa tabla 3 recoge los principales factores de riesgo vinculados a la presencia de agudizaciones repetidas38,40,41,43–61. La gravedad de la limitación al flujo aéreo es sin duda uno de los factores más conocidos38,40,46,62,63. Sin embargo, la relación entre FEV1 y número de agudizaciones no es lineal, y de hecho cerca del 40% de los pacientes graves o muy graves no presentan agudizaciones, mientras que algo más del 20% de los moderados las sufren con frecuencia38,46, lo que sugiere la existencia de otros condicionantes. De todos ellos, el historial de exacerbaciones previas es el factor más frecuente referenciado en la literatura38,40,43,49–53, lo que enfatiza la existencia de una cierta susceptibilidad individual que bien puede ser hereditaria o adquirida.
Factores de riesgo asociados a agudizaciones repetidas
| Edad avanzada |
| Gravedad de la EPOC |
| Mayor disnea basal |
| Bajo FEV1 |
| Baja PaO2 |
| Historial de exacerbaciones previas |
| Inflamación |
| Mayor inflamación en la vía aérea |
| Mayor inflamación sistémica |
| Carga bacteriana (fase de estabilidad) |
| Hipersecreción mucosa bronquial crónica |
| Comorbilidad/manifestaciones extrapulmonares |
| Cardiovascular |
| Ansiedad-depresión |
| Miopatía |
| Enfermedad por reflujo |
La presencia de tos y expectoración crónica se asocia a un mayor riesgo de agudizaciones de repetición57. Foreman et al.58 encontraron que la odds ratio (OR) para agudización fue de 3,7 para los pacientes con expectoración crónica, muy superior al riesgo observado en relación al consumo acumulado de tabaco (OR: 1,01, por cada año/paquete) o el FEV1% post-broncodilatador (OR: 0,98). Resultados similares también han sido descritos por Miravitlles et al.34, que observaron una asociación significativa entre hipersecreción mucosa crónica y la presencia de dos o más agudizaciones en el año previo (OR, 1,54), o por Burguel et al.49, que constataron que, entre los pacientes con frecuentes agudizaciones, el 55% de ellos asociaban tos y expectoración crónica, frente al 22% de casos sin hipersecreción bronquial (p<0,001), con un mayor riesgo de hospitalización entre los hipersecretores. La asociación entre agudizaciones frecuentes y la hipersecreción bronquial crónica fue independiente de otros factores de riesgo conocidos para agudizaciones repetidas, como FEV1, edad, comorbilidad cardiovascular o tabaquismo activo, lo que confirma a la expectoración crónica como un marcador destacado de agudización.
La hipersecreción bronquial se ha asociado a una mayor inflamación en la vía aérea y mayor riesgo de infección respiratoria59, y esto podría explicar el nexo con la aparición de agudizaciones de repetición. Lo mismo podría decirse de las bronquiectasias que con elevada frecuencia se aprecian en los pacientes con EPOC moderada-grave, que también se asocian a expectoración aumentada, infección bronquial crónica y agudizaciones de repetición60,61.
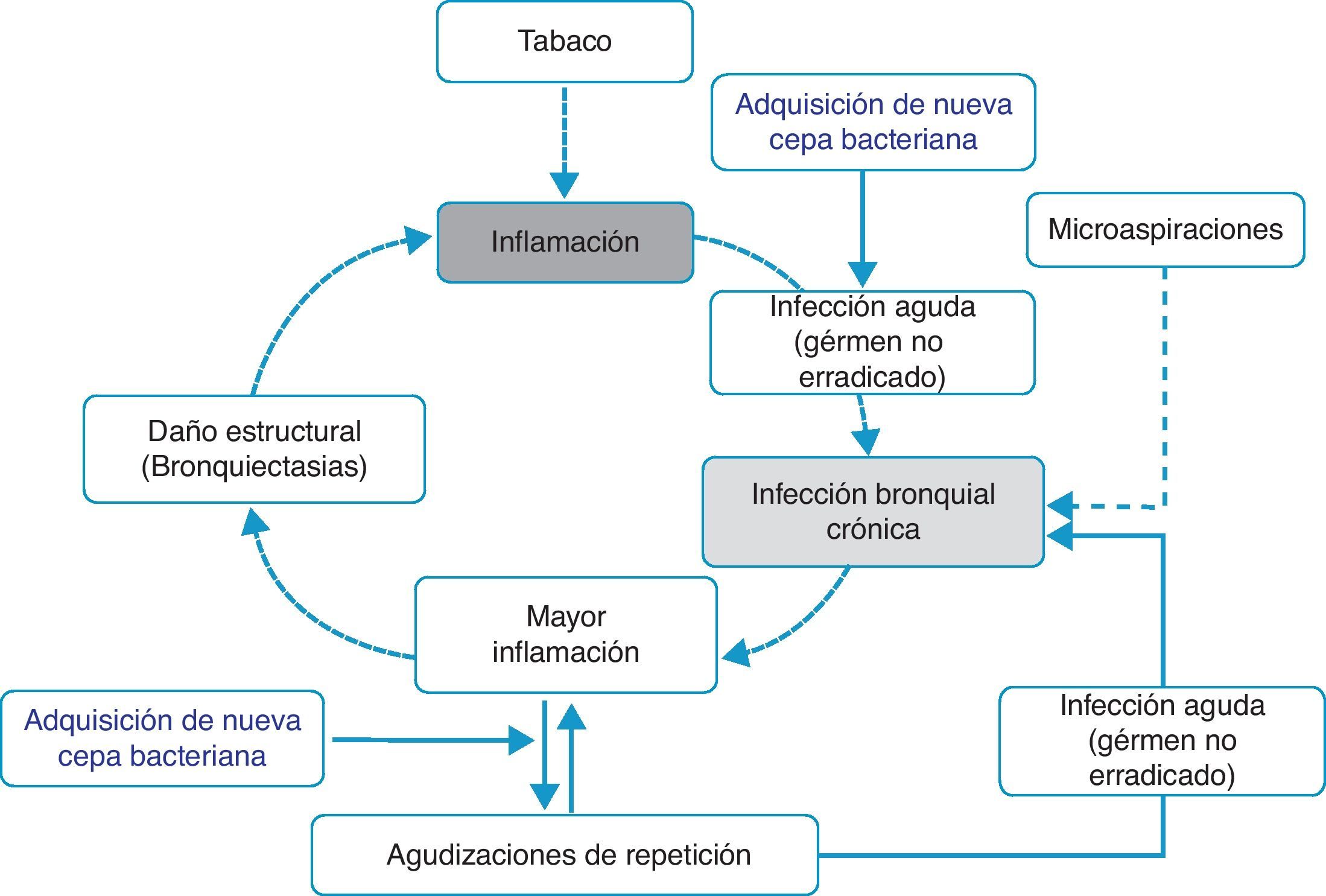
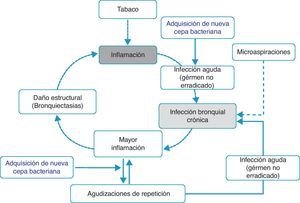
Inflamación-infección bronquial crónica-bronquiectasiasDistintos estudios han demostrado que durante los períodos de estabilidad, los pacientes con frecuentes agudizaciones presentan mayor inflamación en la vía aérea, y que esta es independiente del hábito tabáquico, ya que persiste incluso en los ex fumadores con EPOC50,51,62. La causa de esa mayor inflamación no está establecida; sin embargo, se ha postulado que en algunos pacientes podría ser debida a la presencia de microorganismos potencialmente patógenos (MPP) en la vía aérea. La vía aérea inferior debe ser estéril, pero en cerca del 30% de los pacientes con EPOC clínicamente estables se aíslan MPP63. Estos gérmenes pueden aparecer como consecuencia de una infección aguda no erradicada o bien a partir de la presencia de microaspiraciones. Tradicionalmente, a la presencia de MPP en la vía aérea inferior se la denominaba «colonización». Sin embargo, estos microorganismos no son inocuos sino que producen inflamación, que además aumenta a medida que lo hace la carga bacteriana y la frecuencia de agudizaciones51,62,64. Se ha sugerido que esta carga bacteriana podría ir aumentando con el tiempo y predisponer a la aparición de nuevas agudizaciones, al superar un dintel o umbral clínico65. Sin embargo, estudios recientes indican que la agudización se desencadena también después de la adquisición de nuevas cepas bacterianas66 y que la carga bacteriana no siempre influye directamente en el desarrollo de una exacerbación. En este contexto, la hipótesis más plausible señala que la mayor inflamación, y quizás la existencia de algunas alteraciones estructurales subyacentes asociadas a la misma (por ejemplo, bronquiectasias), sería la que crearía un lecho favorable para el desarrollo de nuevas agudizaciones. Los MPP no erradicados (infección bronquial crónica) contribuirían de esta forma a mantener un círculo vicioso amplificando la inflamación subyacente e induciendo daño estructural67. De hecho, las bronquiectasias, con frecuencia asociadas al binomio infección bronquial-inflamación, también han sido recientemente vinculadas a la existencia de agudizaciones repetidas y más graves60,61. Sobre la base de estos argumentos se proponen algunos modelos teóricos que apoyarían la teoría de la inflamación-infección como eje esencial de la susceptibilidad a la agudización infecciosa (fig. 1). Tanto el tratamiento antibiótico, destinado a erradicar los microorganismos «colonizadores», como la terapia antiinflamatoria e inmunomoduladora han demostrado reducir las agudizaciones, lo que refuerza la hipótesis inflamatoria-infecciosa como factor etiopatogénico que subyace en el fenotipo agudizador.
La infección vírica puede también jugar un papel relevante en modular la respuesta inflamatoria de la vía aérea alterando el frágil balance entre la presencia de bacterias en las vías aéreas y la respuesta del huésped. De hecho, los pacientes con frecuentes resfriados (por ejemplo, infecciones víricas por rinovirus) también experimentan más agudizaciones bacterianas68.
Recientemente se ha sugerido que la enfermedad por reflujo gastroesofágico (ERGE) también predispone a la presencia de frecuentes agudizaciones35,69. El mecanismo íntimo que vincula ERGE y agudización no está claro, pero algunos autores sugieren la existencia de alteraciones en el reflejo de la deglución y la posible existencia de microaspiraciones70, lo que de nuevo refuerza la relación entre la infección y la inflamación causada por las agudizaciones repetidas.
Aunque en la mayoría de las agudizaciones, especialmente si son repetidas, subyace un potencial mecanismo infeccioso, lo cierto es que la mayor inflamación observada en los pacientes agudizadores podría tener otras procedencias. Como se ha mencionado en el apartado anterior, existe un grupo específico de pacientes (fenotipo mixto EPOC-asma) donde subyacen ciertas características asmatiformes. Recientemente se ha presentado un estudio observacional con diseño caso-control en el que se evidencia un mayor riesgo de sufrir agudizaciones frecuentes entre los pacientes que tenían un diagnóstico de asma referido por sus médicos52, lo que podría sugerir un mecanismo alternativo al inflamatorio-infeccioso. Sin embargo, el estudio fue retrospectivo y observacional, por lo que las conclusiones deben ser cautelosas. Además, estos enfermos con diagnóstico referido de asma no presentaron mayor reversibilidad en la prueba broncodilatadora, ni contaron con medidas objetivas que confirmaran el diagnóstico de asma o, en su defecto, el del fenotipo mixto asma-EPOC. Fenómenos de autoinmunidad también podrían estar vinculados a la persistencia de mayor inflamación en la vía aérea. Sin embargo, hasta la fecha apenas existen evidencias que permitan establecer asociación entre dicha autoinmunidad y la presencia de agudizaciones de repetición.
Enfermedad cardiovascular y exacerbaciones repetidasFrente a la hipótesis inflamatoria (infecciosa o no infecciosa), también se ha descrito una asociación significativa entre distintas patologías cardiovasculares y una mayor frecuencia de agudizaciones36,40,46,54. En un estudio prospectivo con diseño caso-control en pacientes con EPOC grave, los agudizadores presentaron mayor número de eventos cardiovasculares que los sujetos con EPOC de similar gravedad pero sin agudizaciones40. La dirección de esta asociación no está claramente delimitada. Mientras algunos estudios sugieren que las agudizaciones provocan o desencadenan las manifestaciones cardiovaculares a través de distintos mecanismos como la inflamación sistémica, la hipoxemia o la disfunción endotelial, no está claro si son los propios eventos cardiovasculares, como algunos trastornos del ritmo (fibrilación auricular, flutter, etc.), episodios de isquemia miocárdica o de fallo ventricular, los que podrían mimetizar una agudización de difícil diagnóstico diferencial, debido entre otras razones a la inespecificidad de los síntomas clínicos. De hecho, casi el 30% de las agudizaciones graves presentan síntomas sugestivos de insuficiencia cardiaca71, y con frecuencia asistimos a elevación de troponinas, un marcador de daño del miocardio, durante las agudizaciones de la EPOC72. Sean causa o consecuencia, lo cierto es que estos episodios cardiovasculares son especialmente relevantes en las agudizaciones graves. En una serie de pacientes fallecidos durante una hospitalización por agudización de la EPOC se identificó la insuficiencia cardíaca como causa de muerte en algo más de un tercio de los pacientes73. La embolia pulmonar, también de difícil diagnóstico, explicó algo más de un 20% de los fallecimientos73.
Susceptibilidad individual genéticaAunque existe muy poca información al respecto, la existencia de una marcada heterogeneidad en los mecanismos de defensa del huésped frente al patógeno podría indicar una cierta susceptibilidad genética. Este hecho ha sido apoyado por el hallazgo de algunos polimorfismos en pacientes con frecuentes agudizaciones. Diferencias en la expresión genotipo-dependiente de la proteína CCL1, un factor quimiotáctico para los monocitos y macrófagos, podría producir alteraciones en la activación del sistema innato inmune frente a las infecciones respiratorias74. Asimismo, también se han descrito polimorfismos en la MBL2 (mannose binding lectin) vinculados a una mayor frecuencia de hospitalizaciones75. La MBL es una proteína del sistema inmunológico innato que inactiva un gran número de microorganismos mediante la activación del complemento. Su deficiencia, debida a polimorfismos MBL2, puede potencialmente incrementar la susceptibilidad a la infección76.
Mayor riesgo de morbimortalidadTradicionalmente las exacerbaciones de la EPOC se han considerado como descompensaciones clínicas más o menos transitorias, cuya repercusión se limitaba a la duración del propio evento. Sin embargo, hoy sabemos que una proporción importante de pacientes no acaban de recuperarse por completo tras sufrir una agudización, y pueden originar consecuencias tardías, tanto pulmonares como sistémicas. En los casos en que se producen exacerbaciones de repetición (fenotipo agudizador), las consecuencias se pueden acumular. Numerosos trabajos han demostrado la existencia de una estrecha relación entre la frecuencia de exacerbaciones y el deterioro de la calidad de vida relacionada con la salud (CVRS)38,40,77–79, y lo mismo sucede con distintas manifestaciones extrapulmonares, como la depresión, la miopatía, el infarto de miocardio o la ERGE39,53,54, mucho más frecuentes entre los pacientes «agudizadores». También se ha documentado un deterioro acelerado de la función pulmonar, que se ha estimado en unos 8ml/año más entre los pacientes con frecuentes agudizaciones62 e incluso un empeoramiento persistente del índice BODE80. Finalmente, y quizás como consecuencia de todo lo anterior, se ha demostrado un peor pronóstico, ya que a medida que aumenta la frecuencia de agudizaciones también lo hace el riesgo de muerte, con independencia de la gravedad basal de la enfermedad40,42. Por todo lo anterior, pensamos que los pacientes «agudizadores» constituyen un grupo especial de enfermos con alto riesgo de morbimortalidad, cuya aproximación terapéutica debería ser distinta e intensa. Estos pacientes también suponen una gran carga asistencial para el sistema sanitario, ya que se ha estimado que son responsables del 60% de las asistencias hospitalarias41.
Tratamiento diferencialLos broncodilatadores de larga duración, que son el primer escalón del tratamiento de la EPOC, han demostrado reducir la frecuencia de agudizaciones81. Cuando persisten las agudizaciones a pesar del tratamiento broncodilatador, está indicada la introducción de los antiinflamatorios. En este sentido, distintas guías de práctica clínica7,82,83 reconocen la utilidad del empleo de CI en pacientes que presentan frecuentes agudizaciones, por cuanto su uso, especialmente asociados a los broncodilatadores, produce una disminución significativa del número de agudizaciones y una mejoría en la CVRS31,32,84. Tradicionalmente este efecto se ha aceptado para los pacientes graves o muy graves (FEV1 <50%) con frecuentes agudizaciones. Sin embargo, algunos estudios en pacientes con menor gravedad funcional también avalan el uso de estos fármacos, por lo que parece que el principal determinante del beneficio sea precisamente la presencia de agudizaciones repetidas31. El roflumilast es un nuevo fármaco antiinflamatorio oral que actúa mediante la inhibición selectiva de la fosfodiesterasa IV y que ha sido aprobado para la prevención de agudizaciones en pacientes con EPOC grave que presentan tos y expectoración crónica y además sufren agudizaciones frecuentes85,86, por lo que está indicado para el fenotipo agudizador con bronquitis crónica. Los macrólidos, administrados de forma prolongada, también podrían tener una indicación específica para algunos de estos pacientes, ya que poseen una actividad antiinflamatoria e inmunomoduladora además de su posible acción antibacteriana87. Algunos ensayos clínicos sugieren que el uso de estos fármacos en pacientes estables con EPOC grave reduce de forma significativa el número de agudizaciones, pero con un posible aumento en el riesgo de aparición de resistencias bacterianas88–91.
Finalmente, y dado el papel potencial de los MPP, también se ha sugerido que el empleo de antibióticos durante los períodos de estabilidad (quimioprofilaxis antibiótica o tratamiento de la infección bronquial crónica) podría ser de utilidad para reducir las agudizaciones92. En esta dirección, el estudio PULSE (Pulsed moxifloxacin Usage and its Long-term impact on the reduction of Subsequent Exacerbation) es un ensayo clínico que estudió la eficacia de la administración de ciclos de 5días de 400mg de moxifloxacino cada 8 semanas en pacientes con EPOC estable93. Los resultados indican que este tratamiento redujo el riesgo de exacerbación en un 20% en el análisis por intención de tratar (ITT), un 25% en el análisis por protocolo (PP) y un 45% en los pacientes que presentaban esputo purulento o mucopurulento, también mediante un análisis PP, sin un incremento significativo de las resistencias bacterianas. En otro estudio realizado en pacientes con EPOC grave colonizados por Pseudomonas aeruginosa, la administración de tobramicina nebulizada redujo un 42% el número de agudizaciones graves, disminuyendo además la inflamación bronquial94. Se necesitan más estudios que ayuden a perfilar adecuadamente el paciente candidato, la duración y el tipo de tratamiento antibiótico necesario. Es muy probable que los pacientes que más se beneficien de esta opción sean los que presenten agudizaciones frecuentes y purulencia en el esputo durante las fases de estabilidad.
Diagnóstico del fenotipo agudizadorEl fenotipo agudizador se identificará cuando se cumplan los siguientes criterios: existencia de dos o más agudizaciones al año; las agudizaciones deben estar separadas al menos 4 semanas desde el final del tratamiento de la exacerbación previa o 6 semanas desde inicio de la misma en los casos que no han recibido tratamiento.
En los casos que finalmente se establezca el fenotipo agudizador será necesario caracterizar adecuadamente al paciente, buscando para ello la existencia de infección bronquial crónica y/o la presencia de bronquiectasias. El uso de fármacos antiinflamatorios y/o antibióticos puede ser de especial utilidad entre estos pacientes.
Fenotipo enfisema-hiperinsufladoEn los últimos años muchos estudios han demostrado que variables como la disnea95,96, la capacidad de ejercicio97,98 y la hiperinsuflación99 predicen la mortalidad de forma independiente de la función pulmonar, e incluso son mejores predictores que el propio FEV1, lo cual justifica definir y establecer el fenotipo enfisema-hiperinsuflado en la EPOC como un grupo de enfermos con un mayor riesgo de mortalidad y que presentan ciertas diferencias respecto a las pautas de tratamiento.
El enfisema pulmonar se define, en términos anatomopatológicos, como la destrucción permanente de los espacios aéreos más allá del bronquiolo terminal3. Conocemos que la pérdida de retracción elástica y el desarrollo de limitación al flujo espiratorio dificultan el vaciamiento alveolar y originan atrapamiento aéreo e hiperinsuflación. Este fenómeno se ha asociado a las limitaciones en la capacidad funcional de los pacientes con EPOC100,101 y guarda una relación más estrecha con la disnea y la tolerancia al ejercicio que la obstrucción al flujo aéreo. Por otra parte, se conoce que la correlación entre la extensión y la gravedad del enfisema macroscópico y el grado de obstrucción por el FEV1 es baja102,103. Sin embargo, la extensión del enfisema medida por TACAR sí explica una gran parte de la variabilidad de la capacidad de difusión del monóxido de carbono (CO)104. Existen estudios que han demostrado una correlación inversa entre el índice de masa corporal (IMC) y el grado de enfisema, evaluado por TACAR8.
La hiperinsuflación en los pacientes con enfisema se suele dividir en estática y dinámica. La hiperinsuflación estática es la más habitual, originada por la pérdida de retracción del parénquima pulmonar en pacientes con enfisema105. Aunque no conocemos su desarrollo en la evolución natural de la EPOC, aparece con mayor frecuencia e intensidad a medida que disminuye el FEV1. La hiperinsuflación dinámica puede ocurrir de forma independiente o asociada a la hiperinsuflación estática, y aparece en enfermos con cualquier nivel de gravedad106. La hiperinsuflación dinámica se produce cuando comienza la inspiración antes de alcanzar una espiración completa, lo que determina que en cada respiración quede atrapada cierta cantidad de aire en los pulmones. En los pacientes con EPOC, la hiperinsuflación dinámica se produce al existir una limitación al flujo aéreo espiratorio por la obstrucción de las vías aéreas, secundaria al incremento del tono colinérgico, la inflamación y los tapones de moco, y a su vez favorecida por el aumento de la colapsabilidad de las vías aéreas, que aumenta su resistencia y prolonga el tiempo necesario para completar la espiración. La hiperinsuflación supone una carga inspiratoria de tipo umbral, dado que en estos pacientes la inspiración comienza cuando aún no se ha producido un vaciamiento pulmonar completo, los músculos inspiratorios deben superar primero la presión de retracción elástica del pulmón que todavía favorece la espiración (auto-PEEP o PEEP intrínseca). La hiperinsuflación tiene un carácter reversible, y por ello constituye una atractiva diana terapéutica.
Definición de fenotipo enfisema-hiperinsufladoEl fenotipo enfisema-hiperinsuflado define a los pacientes con EPOC que presentan disnea e intolerancia al ejercicio como síntomas predominantes, y que con frecuencia se acompañan de signos de hiperinsuflación. Los pacientes con fenotipo enfisema presentan una tendencia a un IMC reducido.
Esta forma clínica de la EPOC se caracteriza por la presencia de datos funcionales de hiperinsuflación, por la existencia de enfisema en el estudio por TACAR, y/o por un test de difusión inferior al valor de referencia, medido mediante el cociente DLCO/VA ajustado para la hemoglobina. La presencia de enfisema no se ha asociado con un mayor riesgo de agudizaciones, excepto si coexiste con bronquitis crónica107; en este caso el paciente se clasificaría como agudizador, ya que el tratamiento debe perseguir de forma prioritaria la reducción de las agudizaciones.
Justificación del fenotipo enfisema-hiperinsufladoSusceptibilidad genéticaLa distinta expresión fenotípica de la enfermedad pulmonar en fumadores viene determinada en parte por factores de tipo genético. En concreto, en estudios familiares utilizando TACAR se ha observado que existe una agregación familiar independiente del fenotipo enfisema, lo que indica la presencia de determinantes genéticos que definen este fenotipo108. Estudios más recientes han identificado polimorfismos de un único nucleótido (single nucleotide polymorphisms, SNP) que están asociados de forma significativa con la extensión de áreas de baja densidad en la TACAR pulmonar109, e incluso determinados loci genéticos se han relacionado de forma significativa con la presencia y extensión del enfisema en amplias poblaciones de pacientes con EPOC110. Estos estudios justifican la diferenciación del fenotipo enfisema como un proceso característico de base genética en fumadores.
Un caso especial es el enfisema congénito por déficit de alfa-1-antitripsina, que se produce por una mutación genética en el gen que codifica esta proteína. Los pacientes homocigotos para la mutación deficitaria tienen un riesgo aumentado de desarrollar enfisema de predominio basal de inicio precoz10. Esta forma de enfisema se ha utilizado como un modelo para entender la fisiopatología del enfisema en fumadores.
Mayor riesgo de morbimortalidadLa importancia clínica de identificar el fenotipo enfisema-hiperinsuflado deriva de que tanto el grado de disnea95,96,111, de tolerancia al ejercicio95,111 y de hiperinsuflación99 son predictores de mortalidad independientes de la gravedad de la obstrucción. En un estudio prospectivo de 5 años de seguimiento Casanova et al.99 observaron una relación inversa entre el grado de hiperinsuflación y la supervivencia y demostraron que los pacientes con EPOC y un índice IC (capacidad inspiratoria)/TLC (capacidad pulmonar total) inferior a 0,25 tenían una probabilidad 3,15 veces mayor de fallecimiento que aquellos con un índice superior. En este estudio, el análisis multivariante demostró que este índice (IC/TLC) se mantenía como un factor de riesgo independiente de otros parámetros, como el FEV1, la edad, la disnea, la capacidad de ejercicio o la comorbilidad.
También se ha demostrado una relación positiva entre la magnitud del enfisema medido por TACAR y la hiperinsuflación y el índice BODE112, si bien no se han observado diferencias en la atenuación pulmonar entre diferentes cuartiles del índice BODE, probablemente debido a la participación de factores extrapulmonares en esta puntuación pronóstica. Sin embargo, la presencia de hiperinsuflación en el TACAR en fumadores con FEV1 normal se asocia a una caída más rápida del FEV1113 y, finalmente, se ha demostrado una asociación significativa entre la magnitud del enfisema evaluado por TACAR con una mayor mortalidad en la EPOC, independientemente de la gravedad medida por el FEV1114. De esta manera se pone de manifiesto la evidencia cada vez mayor de la necesidad de realizar un TACAR en la evaluación del paciente con EPOC, para el estudio del enfisema, además de valorar la posible presencia de bronquiectasias.
El impacto del enfisema en la mortalidad se observó también en el estudio National Emphysema Treatment Trial (NETT)115, en el que los 3 factores —el enfisema, la hiperinsuflación y el índice BODE— fueron predictores de mortalidad de forma independiente, si bien debemos recordar que se trataba de una cohorte de pacientes con EPOC muy grave y, por lo tanto, estos resultados no son extrapolables a todos los pacientes con EPOC. Estos datos se corroboran en estudios como el de Nishimura et al.96 y el de Martínez et al.95, donde los pacientes con volumen residual más alto tenían una mayor mortalidad, con una tendencia similar en los casos donde el índice IC/TLC era más bajo.
De forma indirecta, la hiperinsuflación dinámica puede contribuir a empeorar el pronóstico de la EPOC mediante una reducción significativa de la capacidad de ejercicio de los pacientes que la sufren. Así, se ha demostrado que la actividad física en pacientes con EPOC moderada a grave se correlaciona de forma inversa con el grado de hiperinsuflación dinámica116, y los pacientes con menor actividad física son los que presentan una mayor tasa de ingresos hospitalarios y una mayor mortalidad117.
Enfermedad cardiovascular y enfisemaLa hiperinsuflación pulmonar puede tener un efecto sobre el tamaño del corazón y su función. Diversos trabajos asocian la hiperinsuflación y la presencia de disfunción diastólica. En el estudio de Vassaux et al.118 se pone de manifiesto que el pulso de oxigeno cardiaco, como medida global de la función cardiaca durante una prueba de esfuerzo, es menor en los pacientes con EPOC e hiperinsuflación, medida con un índice IC/TLC ≤0,25. En el estudio de Jorgensen et al.119 se evidencia también que el tamaño de los ventrículos derecho e izquierdo es menor en los pacientes con un enfisema grave y se acompaña de una disminución en el llenado del ventrículo izquierdo, como reflejo de la disminución de la precarga secundaria a la hiperinsuflación pulmonar. Recientemente, en el estudio de Wats et al.120 se analiza la relación entre las alteraciones de la función pulmonar y las mediciones ecocardiográficas de tamaño y función cardiaca en pacientes con EPOC con diferentes grados de gravedad. Los resultados muestran que la hiperinsuflación (IC/TLC) se asocia de forma significativa con el diámetro telediastólico del ventrículo izquierdo, mucho mejor que con el grado de obstrucción al flujo aéreo; así, los pacientes con un índice IC/TLC ≤0,25 tenían una disfunción diastólica del ventrículo izquierdo con afectación global de la función del ventrículo derecho, y esto se asociaba a una menor tolerancia al ejercicio. También en un estudio poblacional se puso de manifiesto que el grado de enfisema, evaluado por TACAR, se relacionaba linealmente con la afectación del llenado del ventrículo izquierdo y una disminución en el gasto cardiaco121. Estos datos sugieren que el tratamiento dirigido a reducir la hiperinsuflación puede tener un impacto directo sobre la función cardiaca y la capacidad de ejercicio, y en último extremo podrían explicar en parte la tendencia a la reducción de la mortalidad con broncodilatadores de larga duración observada en los grandes ensayos clínicos con estos fármacos en la EPOC31,122,123.
Tratamiento diferencial del fenotipo enfisema-hiperinsufladoLa presencia de hiperinsuflación, dado su carácter de reversibilidad, puede ser una diana terapéutica para los broncodilatadores. Conocemos que la hiperinsuflación medida por la IC ha mostrado ser un parámetro fiable en la valoración de la respuesta a algunos tratamientos y más sensible que el FEV1 en capturar el posible efecto beneficioso de algunas opciones terapéuticas de la EPOC. Son varios los estudios que han puesto de manifiesto mejorías en la capacidad vital forzada (FVC) tras la administración de un broncodilatador en pacientes con EPOC moderada o grave e hiperinsuflación, con mejorías en la IC y disminución del atrapamiento aéreo, pero sin mejorías significativas en el FEV1124,125. Esta mejoría en el volumen sin cambios en el flujo es más frecuente a medida que es más grave la obstrucción bronquial. Tampoco en el estudio NETT115 se demostró la superioridad de la intervención quirúrgica frente al tratamiento conservador, pero sí se demostró que en los pacientes que presentaban enfisema en lóbulos superiores y baja capacidad de ejercicio se conseguía una disminución significativa de la mortalidad tras la cirugía de reducción pulmonar. Además, la mejoría en la función pulmonar tras la cirugía se acompañó de una reducción significativa del número de exacerbaciones y prolongó el tiempo libre de exacerbaciones126.
Según las actuales normativas, los broncodilatadores de larga duración son la base del tratamiento farmacológico de la EPOC, ya que consiguen mejorar los síntomas y la capacidad de ejercicio y, por consiguiente, mejoran el estado de salud percibido por el paciente, con cambios estadísticamente significativos y clínicamente relevantes127. Sin embargo, en ocasiones los beneficios conseguidos a nivel clínico no se traducen en una mejoría del grado de obstrucción (cambios en el FEV1), sino en sus efectos a nivel de la hiperinsuflación, al disminuir la hiperinsuflación dinámica con mejorías en la capacidad inspiratoria, el grado de disnea y la tolerancia al ejercicio127–129.
Las actuales directrices recomiendan la asociación de broncodilatadores para intentar conseguir un efecto aditivo, sin aumentar los efectos adversos, en los pacientes con sintomatología mal controlada pese al tratamiento con un solo broncodilatador. En este sentido, la utilización de la doble terapia broncodilatadora —formoterol y tiotropio— frente a la monoterapia broncodilatadora130 o frente a la combinación fluticasona-salmeterol131 ofrece un beneficio funcional añadido con reducción de la necesidad de medicación de rescate, mejoría de los cuestionarios de síntomas y de la calidad de vida. Estos resultados pueden ser aplicados a otras combinaciones LABA/ICS.
El tratamiento antiinflamatorio con corticoides inhalados, cuyo principal objetivo es la prevención de las agudizaciones, no ha demostrado ser tan eficaz en el fenotipo enfisema-hiperinsuflado21. Tampoco el antiinflamatorio oral roflumilast ha ofrecido buenos resultados sobre reducción de agudizaciones en pacientes con enfisema, excepto en aquellos que asociaban síntomas de bronquitis crónica132.
En resumen, los pacientes con un fenotipo enfisema hiperinsuflado podrán beneficiarse en mayor medida de una doble terapia broncodilatadora y, por supuesto, de la rehabilitación respiratoria por sus beneficios sobre la disnea y la tolerancia al ejercicio133.
Diagnóstico del fenotipo enfisema-hiperinsufladoEl parámetro de función pulmonar que mejor evalúa la presencia de enfisema es el test de transferencia para el monóxido de carbono (DLCO), que se correlaciona bien con la gravedad del enfisema pulmonar134. No obstante, una de sus limitaciones es que analiza de forma global todo el pulmón, a diferencia de la TACAR, que es capaz de detectar cambios destructivos localizados, y en el momento actual esta técnica de imagen es muy utilizada para la detección del enfisema pulmonar. Además, estudios recientes señalan que la cuantificación de la magnitud del enfisema pulmonar mediante parámetros densitométricos podría ser una exploración sensible y específica en la evaluación y el seguimiento del enfisema pulmonar135. Así, existen estudios que han demostrado que el análisis de la densidad del parénquima pulmonar en la TACAR está correlacionado con las alteraciones patológicas observadas en muestras tisulares136,137 y con el déficit de la función pulmonar (obstrucción del flujo aéreo y capacidad de difusión)138,139, lo que permitiría una estimación radiológica de la gravedad de la EPOC.
La hiperinsuflación se evalúa mediante la determinación de los volúmenes pulmonares estáticos. Sin embargo, la IC, obtenida de una espirometría lenta, proporciona una estimación indirecta de la magnitud de la hiperinsuflación de forma más sencilla y reproducible140. La IC tiene una buena correlación con la disnea y con la capacidad de ejercicio en los pacientes con EPOC141. Se ha observado que la disminución de la IC se correlaciona con un incremento de la disnea y una disminución de la capacidad de ejercicio142. Este hecho se justifica porque el factor fisiopatológico más importante que determina la disnea de esfuerzo en los pacientes con EPOC es el desarrollo de atrapamiento aéreo e hiperinsuflación dinámica desencadenado por el ejercicio, incluidos los esfuerzos asociados al desarrollo de las actividades de la vida diaria116.
ConclusionesLa EPOC es una enfermedad heterogénea, pero durante muchos años no se han tenido en cuenta las peculiaridades de los pacientes a la hora de recomendar su tratamiento. En gran parte esto se ha debido a que las opciones terapéuticas eran escasas y no existía evidencia de que su eficacia fuera significativamente diferente en diversos tipos de pacientes. El gran desarrollo de diferentes opciones en el tratamiento farmacológico y no farmacológico ha comportado la demostración de que la respuesta clínica puede ser diferente según las características de la enfermedad. El concepto de fenotipo aplicado a la EPOC ha comportado la definición de diversos tipos de pacientes con significado pronóstico y terapéutico. De esta manera podemos acercarnos a un tratamiento más personalizado de acuerdo no solo con la gravedad de la obstrucción del flujo aéreo, sino también condicionado por el fenotipo clínico28,29,143,144. En esta revisión exponemos la justificación para considerar 3 fenotipos fundamentales: agudizador, mixto y enfisema. Es evidente que no todos los pacientes van a cumplir con los criterios que permitan clasificarlos de forma inequívoca en uno de los subgrupos, y siempre va a ser el juicio clínico el que va a acabar de clasificar al paciente en el fenotipo más relevante para su pronóstico. En este sentido, la simple pregunta: ¿Cuántas agudizaciones sufrió el año anterior? va a permitir la clasificación como agudizador si la respuesta es dos o más, sean cuales sean las características clínicas o funcionales del paciente, ya que el tratamiento debe dirigirse de forma prioritaria a la prevención de las agudizaciones. Si la respuesta es una o ninguna, debemos investigar si se trata de un enfisema o un fenotipo mixto. El siguiente paso será el reconocimiento de estos fenotipos clínicos en las nuevas normativas de tratamiento de la EPOC145.
Conflicto de interesesMarc Miravitlles ha recibido honorarios por asesoría científica y/o por impartir conferencias de Almirall, AstraZeneca, Bayer Schering, Boehringer Ingelheim, Grupo Ferrer, GlaxoSmithKline, Laboratorios Esteve, Pfizer, Novartis, Merck Sharp & Dhome y Nycomed. Myriam Calle ha recibido honorarios por impartir conferencias de Almirall, AstraZeneca, Boehringer Ingelheim, GlaxoSmithKline, Pfizer, Novartis, Merck Sharp & Dhome y Nycomed. Juan José Soler Cataluña ha recibido honorarios por asesoría científica y/o por impartir conferencias de Almirall, AstraZeneca, Boehringer Ingelheim, Ferrer, GlaxoSmithKline, Laboratorios Esteve, Pfizer, Novartis, Merck Sharp & Dhome y Nycomed.