El humo de tabaco es la principal causa de la inflamación en la EPOC. Los mecanismos que diferencian a los fumadores que desarrollan EPOC son diversos. En este estudio analizamos la diferente presencia de citocinas en secreciones respiratorias de pacientes fumadores con o sin EPOC y las propiedades secretoras del epitelio bronquial diferenciado, obtenido de los propios individuos tras su exposición al humo de tabaco.
Material y métodosSe estudió a 27 pacientes fumadores, 12 de ellos con EPOC no tratados previamente con esteroides. En 11 se obtuvo la muestra mediante esputo inducido y el resto procedía del aspirado bronquial tras fibrobroncoscopia. Se determinaron las concentraciones de IL8, IL13 y TNFα en el sobrenadante. Se compararon los resultados obtenidos entre individuos con o sin EPOC y se investigó su relación con la gravedad de la EPOC expresada según el grado de obstrucción, disnea, presencia de hipersecreción e intensidad del tabaquismo. Se obtuvieron cultivos de células diferenciadas epiteliales bronquiales, mediante interfase aire-líquido en 4 individuos fumadores. Las muestras fueron expuestas a concentraciones crecientes de humo de tabaco (5-20%) y se determinó la expresión epitelial de ARNm de Muc5AC, IL8 y TNFα.
ResultadosLos pacientes con EPOC tenían valores significativamente más altos de IL8 que los fumadores sanos (41 [22] vs. 21 [12] pM). Los valores de IL8 se correlacionaron de forma significativa con la gravedad de la obstrucción (r=0,6; p<0,05), disnea (r=0,45; p<0,05) y la presencia de hipersecreción. No había relación entre las citocinas y la intensidad o duración del hábito tabáquico. El humo de tabaco produjo un incremento dependiente de la dosis en la expresión de ARNm para Muc5AC, IL8 y TNFα.
ConclusionesExisten diferencias en la producción de citocinas, fundamentalmente IL8, entre individuos fumadores sanos o con EPOC que podrían ser justificadas por la acción directa del humo de tabaco sobre las células epiteliales.
Cigarette smoke is the main cause of inflammation in COPD. The mechanisms that differentiate smokers who develop COPD are diverse. In this study, we analyzed the presence of cytokines in the respiratory secretions of smokers with or without COPD and the secretory properties of the differentiated bronchial epithelium obtained from the individuals themselves after exposure to tobacco smoke.
Material and methodsTwenty-seven smokers were studied, 12 of whom had COPD that had not been previously treated with steroids. In 11, samples were obtained by means of induced sputum, and the remaining samples were collected from bronchial aspiration after bronchoscopy. Concentrations of IL-8, IL-13 and TNFα in the supernatant were determined. The results obtained were compared between individuals with and without COPD, and we studied their relationship with the severity of COPD as expressed by the degree of obstruction, dyspnea, presence of hypersecretion and intensity of smoking. Bronchial epithelial cell cultures were obtained by air-liquid interface in 4 smokers. The samples were exposed to increasing concentrations of cigarette smoke (5-20%) and the epithelial mRNA expressions of MUC5AC, IL8 and TNFα were determined.
ResultsCOPD patients had significantly higher values of IL-8 than healthy smokers (41 [22] vs. 21 [12] pM). The values of IL-8 correlated significantly with the severity of the obstruction (r=0.6; p<0.05), dyspnea (r=0.45; p<0.05) and the presence of hypersecretion. There was no relationship between cytokines and the intensity or duration of the tobacco habit. Cigarette smoke produced a dose-dependent increase in the expression of RNAm for Muc5AC, IL8 and TNFα.
ConclusionsThere are differences in cytokine production (fundamentally IL8) between smokers and smokers with COPD which could be explained by the direct action of cigarette smoke on epithelial cells
El humo de tabaco es la principal causa de inflamación crónica de las vías aéreas respiratorias en individuos fumadores, que persiste incluso tras el cese del hábito tabáquico. La inflamación se caracteriza fundamentalmente por cambios estructurales del epitelio bronquial y un aumento en la infiltración celular por linfocitos CD8, neutrófilos y macrófagos1,2. La intensidad de estas alteraciones es mayor en los individuos que desarrollan enfermedad pulmonar obstructiva crónica (EPOC) frente a los fumadores sanos3,4 y difiere según el fenotipo predominante. La prevalencia de la EPOC entre los sujetos fumadores es, sin embargo, muy variable y los mecanismos que condicionan su aparición no se conocen aún con exactitud.
Estudios recientes que analizan la combinación de factores genéticos, ambientales e inmunológicos señalan que las diferencias en cuanto a la incidencia y expresión fenotípica de la EPOC pueden estar ocasionadas por una respuesta estructural y funcionalmente diferentes según las características del medio inflamatorio local y la variación en la susceptibilidad individual al tabaco5,6. En este sentido, el análisis de biomarcadores inflamatorios obtenidos en secreciones de las vías respiratorias, tanto in vivo en sujetos fumadores con o sin EPOC7 como in vitro a partir de cultivos celulares estimulados con humo de tabaco, han demostrado un aumento en la expresión, producción y liberación de citocinas proinflamatorias entre las que destacan: IL8, IL13 y TNFα8–10, así como otros mediadores de la destrucción celular, como las elastasas, metaloproteasas y radicales libres derivados del estrés oxidativo11,12.
La interacción entre estas sustancias y las estructuras celulares es compleja y variable en cada individuo y puede justificar la distinta susceptibilidad y diversidad de alteraciones observadas en pacientes con EPOC. Entre los fenotipos más frecuentes figuran los pacientes con hipersecreción bronquial. Los mecanismos que conducen a esta producción exagerada son fundamentalmente la sobreexpresión de genes de las mucinas, la hipertrofia o hiperplasia de las células y glándulas secretoras o un incremento en la liberación de moco. Las mucinas detectadas en las vías aéreas son una mezcla de glucoproteínas oligoméricas, fundamentalmente Muc5AC y Muc5B que son sintetizadas y almacenadas en la superficie apical del epitelio bronquial y liberadas13,14 como consecuencia de la acción de citocinas proinflamatorias, exoproductos bacterianos o la propia elastasa neutrofílica. El mecanismo de acción común a todos estos estímulos se produce a través del receptor EGFR (receptor de factor de crecimiento epidérmico)15–17. En otros pacientes con EPOC el fenotipo predominante se debe a los cambios en la destrucción y reparación celular18 que condicionan la aparición de enfisema. En este grupo, también se ha observado la intervención de citocinas como IL8, IL13, TNFα en la apoptosis celular19 y un incremento de los factores de crecimiento o fibrogénicos como son el colágeno o la fibronectina20,21.
El modo en que cada uno de estos mecanismos predomina en respuesta al humo de tabaco es desconocido. En el campo experimental, los estudios son escasos y en su mayoría realizados en cultivo de líneas celulares epiteliales no diferenciadas obtenidas de individuos sanos y no en pacientes fumadores con o sin EPOC. La hipótesis planteada es que en pacientes fumadores con EPOC debe existir una expresión aumentada de estas citocinas y mucinas como consecuencia de la acción directa del tabaco en las células epiteliales.
En el presente estudio, nos planteamos, por tanto, dos objetivos fundamentales. El primero de ellos fue investigar la diferente producción de IL8, IL13 y TNFα en muestras de secreciones respiratorias de pacientes fumadores con o sin EPOC, analizando la correlación existente con los parámetros clínicos y funcionales que caracterizan la EPOC. El segundo de los objetivos fue el estudio de las propiedades secretoras del cultivo de epitelio bronquial diferenciado, obtenido de los propios individuos tras su estimulación mediante exposición al humo de tabaco.
Pacientes y métodosSujetos del estudioEstudiamos a un grupo de individuos adultos, con edades comprendidas entre los 18 y los 70 años, cuyo requisito fundamental era una historia activa de tabaquismo de al menos 10 paquetes-año. Los sujetos fueron reclutados en su mayoría desde la consulta de tabaquismo del hospital. En el caso del grupo que accedió a la realización de biopsia bronquial, se incluyó a pacientes que requerían fibrobroncoscopia por haber presentado esputos hemoptoicos, tras descartar cualquier causa infecciosa o neoplásica.
Para ser incluidos en el estudio, los pacientes debían haber permanecido estables, sin episodios de exacerbación en los 2 meses previos, y no debían haber sido tratados nunca con esteroides y/o anticolinérgicos inhalados, como tampoco con mucolíticos o antioxidantes orales.
Se excluyó a todos aquellos que presentaran cualquier enfermedad pulmonar crónica diferente de la EPOC, enfermedad sistémica grave o neoplasia broncopulmonar localizada.
El estudio fue aprobado por el Comité Ético y de Investigación del hospital.
Diseño del estudioUna vez establecidos los criterios de inclusión y demostrada la ausencia de factores excluyentes, se informó a los pacientes de la naturaleza voluntaria del estudio y su finalidad, obteniéndose su consentimiento por escrito.
De todos ellos, se recogieron datos correspondientes a sus características antropométricas, clínicas, radiológicas y exploración funcional respiratoria. Entre las variables clínicas analizadas se incluyeron los síntomas predominantes, grado de disnea medido según la escala de la Medical Research Council (MRC) y la presencia o no de signos de insuficiencia cardiaca derecha. A todos ellos se les solicitó una radiografía de tórax o una tomografía computarizada torácica (CT) y una exploración funcional respiratoria que incluía una espirometría forzada con prueba broncodilatadora, determinación de volúmenes pulmonares y capacidad de difusión. Asimismo y antes de la espirometría, se procedió a la determinación de la fracción espirada de óxido nítrico (NO) en aire exhalado (FeNO) mediante un analizador de quimioluminiscencia (modelo Logan Research 2000). Se expresó el resultado en partes por billón. La determinación de FeNO ha sido propuesta como medida indirecta de estrés oxidativo en pacientes con EPOC o bronquiectasias.
Cuantificación de citocinas en las secreciones respiratoriasLas muestras de secreciones de las vías respiratorias se obtuvieron mediante esputo inducido o a través del aspirado bronquial de la fibrobroncoscopia. En este último grupo, la exploración sirvió para obtener una biopsia de mucosa en bronquios principales obtenida a partir de una zona macroscópicamente normal. En el primer grupo, la muestra de esputo se obtuvo mediante nebulización ultrasónica de solución salina hipertónica según la metodología ya establecida de inducción de esputo. El procesamiento de las muestras de esputo y aspirado bronquial se realizó de forma inmediata del siguiente modo: mediante pinzas se separaron los acúmulos de moco de la porción salival y se guardaron en dos tubos separados de polipropileno, uno de ellos se utilizó para la determinación celular y el otro para la determinación de concentración de compuestos en la fase sol.
La porción destinada al recuento celular se homogeneizó con solución de ditiotreitol (DTT) al 10% con una concentración cuatro veces igual al volumen de la muestra inicial. Posteriormente, se añadió tampón fosfato en una dilución de volumen 1:1 y se filtró por una malla de 42 μm de poro. De esta muestra filtrada, se obtuvo 0,4 ml con el fin de determinar el recuento celular total y la viabilidad celular. El pellet celular obtenido fue resuspendido en tampón fosfato a un volumen necesario para ajustar la muestra a 106 células, y poder realizar el recuento celular diferencial, mediante tinción de Giemsa. La muestra debía permitir contar al menos 400 células inflamatorias y tener menos de un 50% de células epiteliales. El sobrenadante se congeló a –70°C para la posterior determinación de sus componentes.
La muestra destinada al estudio de marcadores solubles (TNFα, IL13 e IL8), no se homogeneizó con DDT dado que esta sustancia destruye los puentes disulfuro presentes en las interleucinas. La muestra se centrifugó directamente a 60.000 g durante 90 min y la porción sobrenadante se guardó a –70°C para su posterior determinación.
Se envió una muestra, tanto en el caso de esputos como en el aspirado bronquial, para tinción y cultivo cuantificado con el fin de desecharlas en caso de que hubiera infección bronquial.
Las concentraciones de TNFα (eBIOSCIENCES, 88-7346-22), IL8 (DIACLONE 850050096) e IL13 (Cayman Chem, Estados Unidos) en el sobrenadante se determinaron mediante un kit de enzimoinmunoanálisis de acuerdo con las instrucciones del proveedor. En resumen, las muestras se depositaron en microplacas y se incubaron a 40°C durante 24 h con anticuerpos monoclonales; tras el lavado se marcaron a 37°C durante 1 h. La lectura fotométrica se realiza a una longitud de onda de 450 ηm. Los límites de detección y el umbral de sensibilidad de cada medida se establecieron según los datos del proveedor.
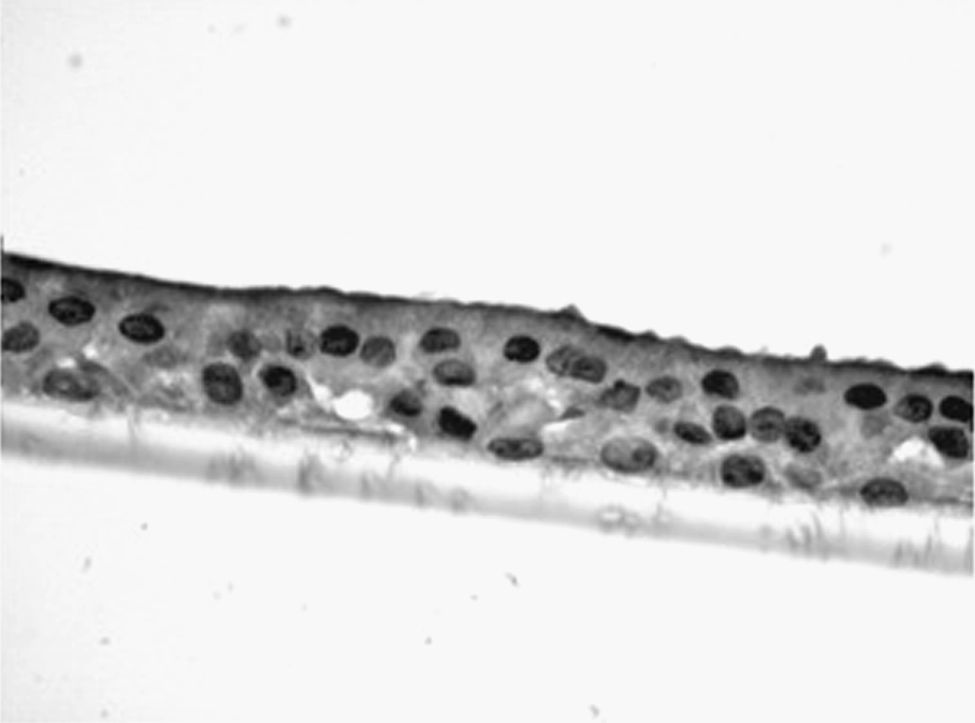
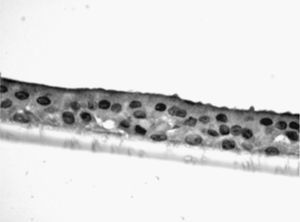
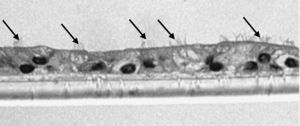
Estudio de la respuesta al humo de tabaco en cultivos de células epiteliales diferenciadasLas muestras de biopsia bronquial fueron depositadas en medio de cultivo celular, donde se mantuvieron, tras varios pases, hasta que formaron placas confluentes de células epiteliales primarias. Una vez obtenidas estas placas celulares, fueron depositadas en inserts de cultivo (8,25×104 células/insert) (Transwell, Corning Costar, Buckinghamshire, Reino Unido) con medio de diferenciación (50% DMEM), medio de crecimiento basal epitelial (Clonetics, Reino Unido) durante 7 días hasta su confluencia. Tras esta, las células fueron tripsinizadas y nuevamente cultivadas hasta su confluencia. Esta maniobra fue repetida en 2 o 3 ocasiones. Tras este periodo, las células fueron cultivadas durante otros 21 días en interfase aire-líquido (técnica ALI), con la superficie apical en contacto con aire y la superficie basal sumergida en medio de crecimiento, hasta lograr su diferenciación en epitelio seudoestratificado con presencia de células ciliadas y caliciformes. Esta característica se demostraba mediante el análisis de las muestras en microscopio invertido. En muestras aleatorias se procedió, tras su inmersión en parafina, a tinción mediante inmunohistoquímica con citoqueratina para demostrar su naturaleza epitelial, y con PAS-Schiff, para el estudio de la secreción de moco.
Una vez diferenciadas, las muestras celulares fueron sometidas de forma separada en cada insert a exposiciones crecientes de extracto de humo de tabaco a diversas concentraciones (5, 10,15 y 20%) durante 6 y 24 horas.
El extracto de humo de tabaco se obtuvo sometiendo unos cigarrillos sin filtro a una combustión en una bomba modifica que permitía burbujear el humo por 25 ml de medio de cultivo que fuera mezcla de RPMI-1640 (Gibco Life Technologies) y LHC-D (Biofluids) en proporción 1:1. El pH de la suspensión resultante se ajustó a 7,4 con NaOH y se filtró por 0,22μm, aplicándose entonces a los cultivos celulares, en los primeros 30 min de preparación. Para ver el efecto de la volatilización, se puede liofilizar el extracto de humo de tabaco y volver después a recomponer en el mismo volumen de agua destilada.
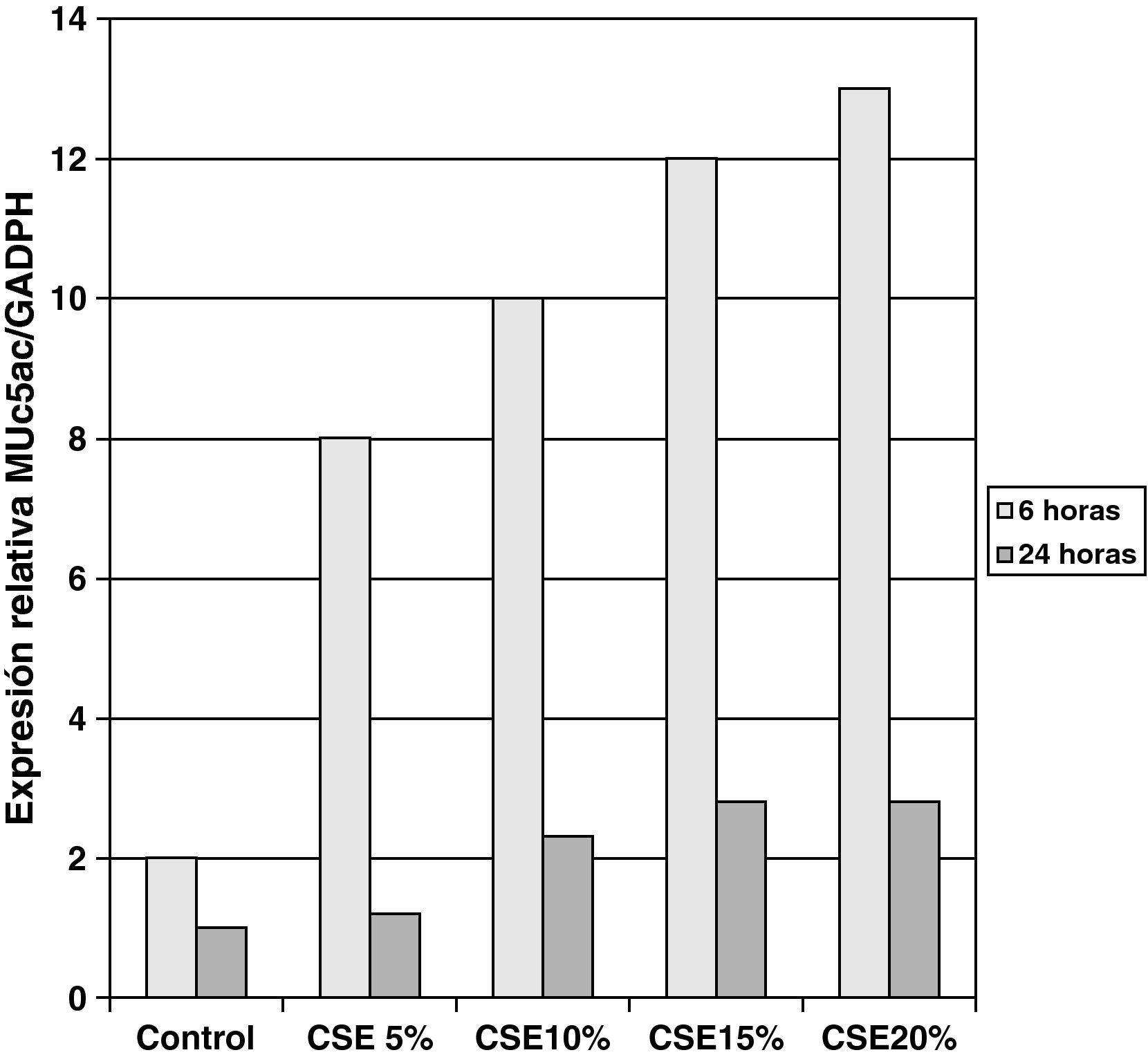
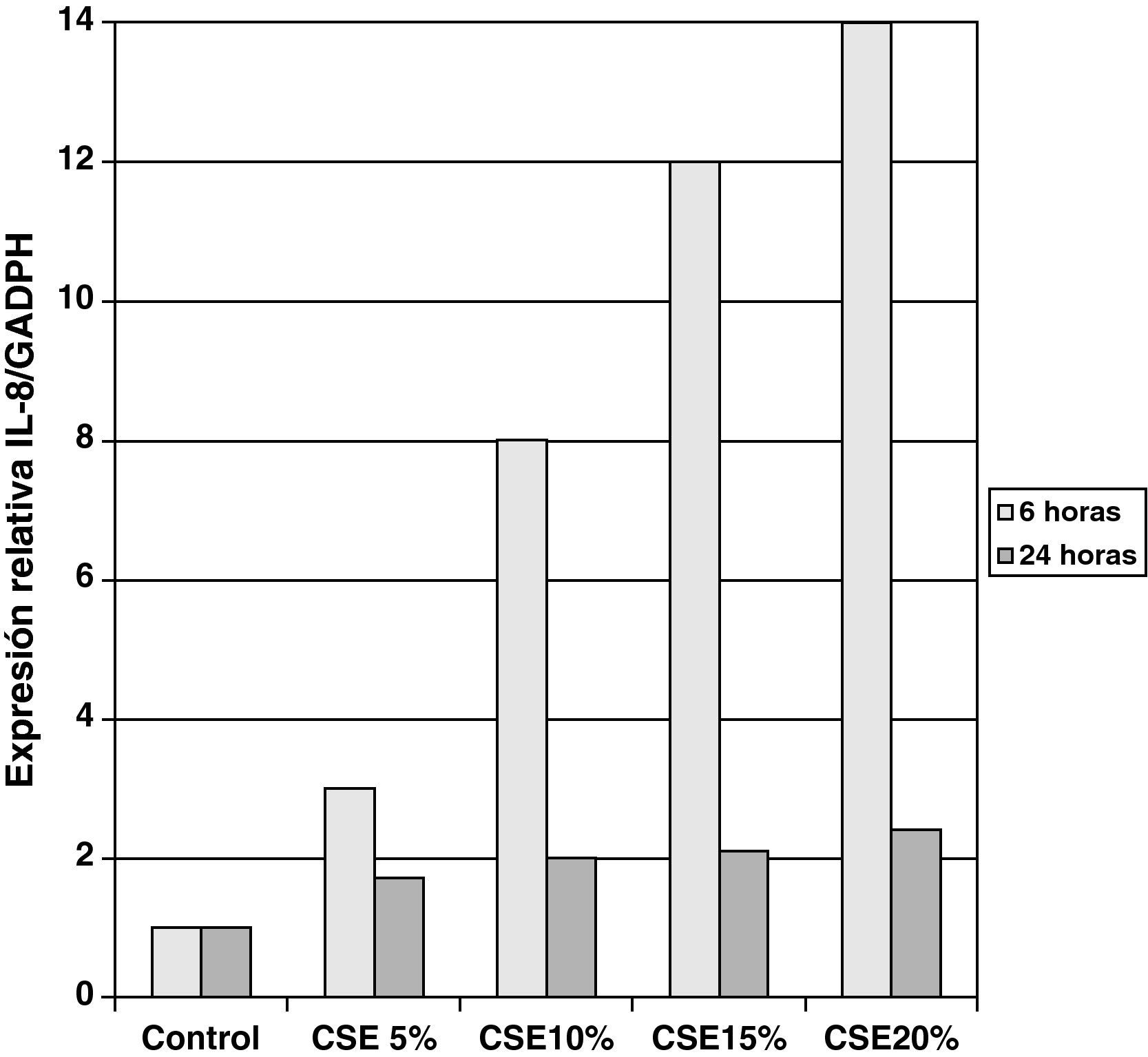
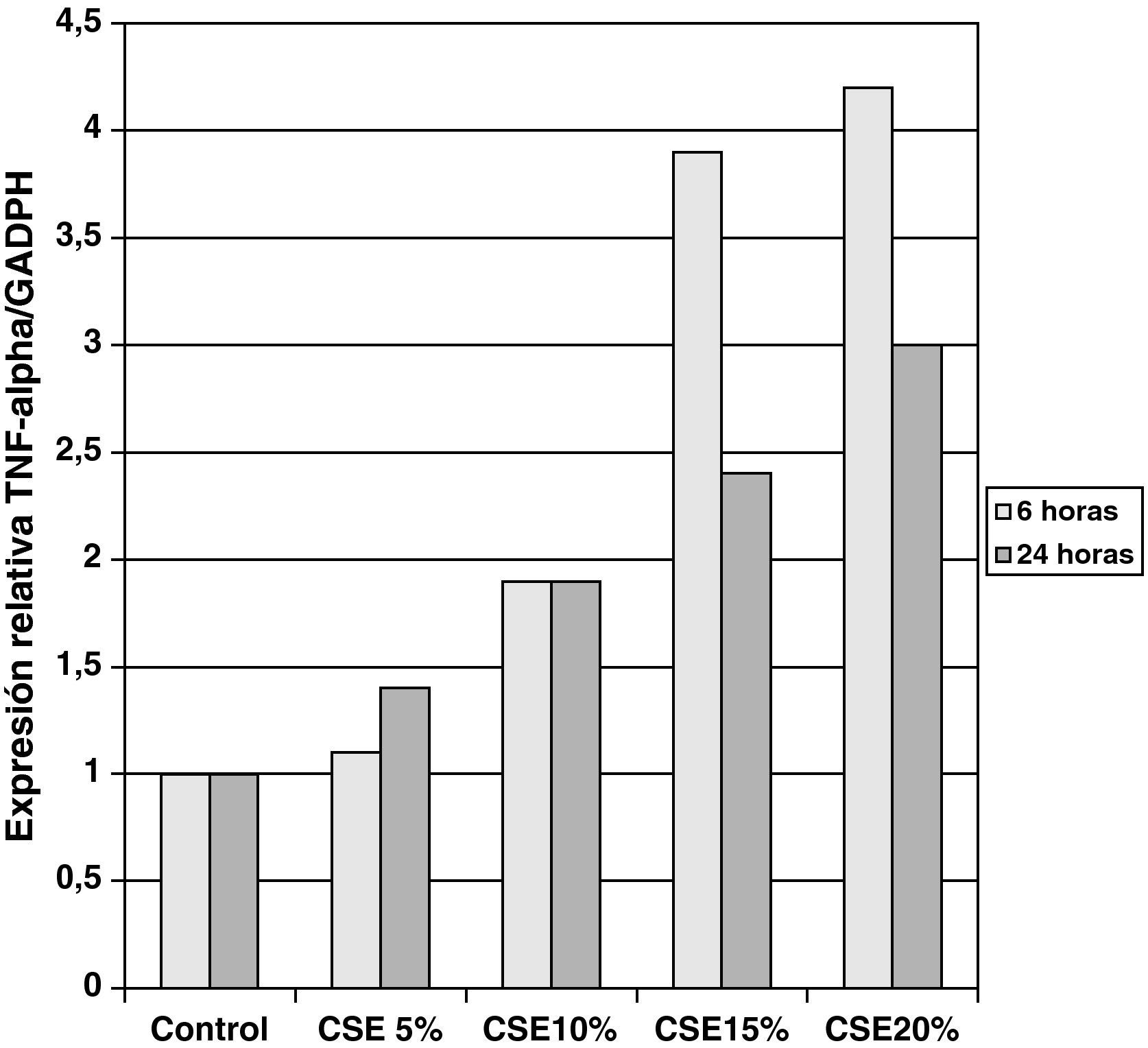
El estudio del humo de tabaco en la producción de mucinas y citocinas de los cultivos celulares se analizó mediante la determinación de ARNm para Muc5AC, IL8 y TNFα, midiendo su concentración en situación basal y tras la estimulación con humo de tabaco durante 6 y 24 h. Al final del tiempo de exposición se procedió a la destrucción celular y extracción del ARN en cada condición experimental.
Como técnica cuantitativa para valorar la cantidad de ARNm se escogió la Real Time-PCR (Applied Biosystem), expresándose los resultados como ratio con respecto al gen control GAPDH. Dicha técnica se basa en convertir el ARN procedente en este caso de células epiteliales en ADNc (ADN complementario) para, una vez obtenido este, realizar una reacción de PCR monitorizada a tiempo real (gracias al incremento de fluorescencia que se genera por la disociación de la sonda debido a la función exonucleasa de la polimerasa de ADN). Una vez obtenida dicha cinética, se escoge un incremento de fluorescencia para el cual la pendiente de la curva es lineal en la totalidad de las reacciones (Ct). La reacción se lleva a cabo en un termociclador ABIPRISM 7700 (Perkin-Helmer). El análisis de las reacciones se realiza con el software SDS (Sequence Detection System) de Perkin-Helmer.
Análisis estadísticoLos datos se expresan como media (DE) en el caso de variables cuantitativas o en porcentaje en el caso de variables cualitativas. El estudio comparativo de valores de citocinas en pacientes fumadores con o sin EPOC se realizó mediante la prueba de Wilcoxon y la relación con los parámetros funcionales o clínicos, mediante el análisis de correlación de Spearman. En el caso del estudio experimental de las diferencias en la proporción de mucinas o citocinas antes y después de la estimulación con distintas concentraciones de humo de tabaco, se utilizó el análisis de la varianza no paramétrico para muestras repetidas. Dadas la naturaleza y dificultad experimental del estudio y la ausencia de valores previos de referencia que permitiesen estimar la muestra necesaria de biopsias, el cálculo del tamaño muestral se realizó con la intención de encontrar diferencias de al menos un 10% en los valores de citocinas en esputo similares al estudio de Keatings7 en pacientes fumadores con o sin EPOC, asumiendo una potencia del 90%, un valor alfa del 5% y unas pérdidas del 25%. Los análisis se realizaron mediante el paquete estadístico SPSS 11.1. El nivel de significación fue de p<0,05.
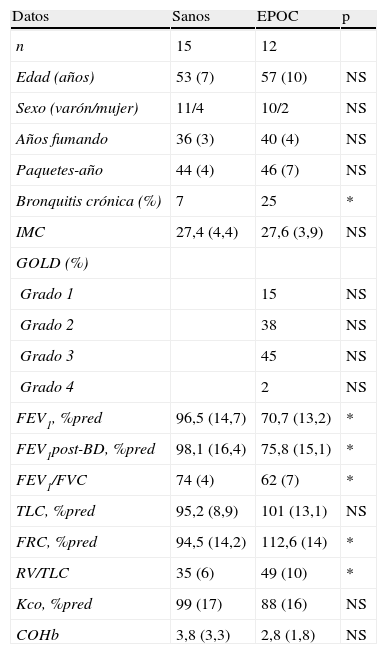
ResultadosSe incluyó a 27 individuos fumadores, 15 de ellos sanos y 12 diagnosticados de EPOC. Las características epidemiológicas, clínicas y funcionales se muestran en la tabla 1. No existían diferencias significativas en ambos grupos con respecto a edad, sexo, intensidad y duración del tabaquismo o índice de masa corporal. La distribución de la gravedad de la EPOC según los criterios GOLD, lógicamente, solo era aplicable al grupo EPOC, y muestra un predominio de obstrucción de grado 2-3. El porcentaje de pacientes que referían tos y/o expectoración con criterios de bronquitis crónica fue también significativamente mayor en el grupo EPOC. Los valores funcionales, por criterio de inclusión, estaban significativamente disminuidos en el segundo grupo.
Diferencias en las características antropométricas, clínicas y funcionales de los pacientes fumadores con o sin EPOC
| Datos | Sanos | EPOC | p |
| n | 15 | 12 | |
| Edad (años) | 53 (7) | 57 (10) | NS |
| Sexo (varón/mujer) | 11/4 | 10/2 | NS |
| Años fumando | 36 (3) | 40 (4) | NS |
| Paquetes-año | 44 (4) | 46 (7) | NS |
| Bronquitis crónica (%) | 7 | 25 | * |
| IMC | 27,4 (4,4) | 27,6 (3,9) | NS |
| GOLD (%) | |||
| Grado 1 | 15 | NS | |
| Grado 2 | 38 | NS | |
| Grado 3 | 45 | NS | |
| Grado 4 | 2 | NS | |
| FEV1, %pred | 96,5 (14,7) | 70,7 (13,2) | * |
| FEV1post-BD, %pred | 98,1 (16,4) | 75,8 (15,1) | * |
| FEV1/FVC | 74 (4) | 62 (7) | * |
| TLC, %pred | 95,2 (8,9) | 101 (13,1) | NS |
| FRC, %pred | 94,5 (14,2) | 112,6 (14) | * |
| RV/TLC | 35 (6) | 49 (10) | * |
| Kco, %pred | 99 (17) | 88 (16) | NS |
| COHb | 3,8 (3,3) | 2,8 (1,8) | NS |
COHb: carboxihemoglobina; GOLD: Iniciativa Global para la Enfermedad Pulmonar Obstructiva Crónica; IC/TLC: ratio entre la capacidad inspiratoria y la capacidad pulmonar total; IMC: índice de masa corporal; NS: no significativo; RV: volumen residual; TLC: capacidad pulmonar total.
Datos expresados como media (DE) en las variables cuantitativas y número de pacientes (frecuencia) en las variables cualitativas.
*p<0,05.
Las muestras de secreciones respiratorias se obtuvieron en 11 pacientes mediante esputo inducido y en los 15 restantes, en el aspirado bronquial obtenido tras la fibrobroncoscopia. No existían diferencias significativas en la distribución de pacientes incluidos en cada grupo en función del lugar de obtención de la muestra.
El recuento diferencial del componente celular del esputo inducido o aspirado bronquial, tanto en valores absolutos como en porcentaje de cada tipo celular, no mostraba diferencias significativas entre ambos grupos. En ninguna de las muestras se observó contaminación bacteriana que pudiera interferir con los resultados.
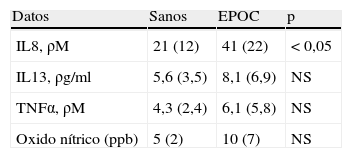
Con respecto al análisis de la diferente producción de IL8, IL13 y TNFα en las muestras obtenidas en ambos grupos de pacientes, los datos obtenidos en el sobrenadante de esputo y aspirado bronquial mostraron que los pacientes fumadores con EPOC tenían valores significativamente más altos de IL-8 que los fumadores sanos (tabla 2), mientras que no existían diferencias en los valores de TNFα o IL13. Dado que algunos estudios han mostrado diferencias en los valores de marcadores inflamatorios en pacientes, fundamentalmente, asmáticos tras la inducción repetida de esputo, comparamos los resultados obtenidos en aspirado bronquial y en esputo inducido sin observar diferencias significativas. Tampoco existían diferencias en los valores de óxido nítrico en aire exhalado.
Los valores de IL8 se correlacionaron de forma significativa en los pacientes con EPOC con el FEV1 antes del broncodilatador (r=0,55; p<0,05), FEV1/FVC (r=0,6; p<0,05), disnea (r=0,45; p<0,05) y la presencia de bronquitis crónica (r=0,56; p<0,05). No existían, sin embargo, relación entre la IL8, IL13 o TNFα con la intensidad o duración del hábito tabáquico, bien sea en los fumadores sanos como en los individuos con EPOC.
De los 15 pacientes a los que se realizó fibrobroncoscopia, solo 7 accedieron a que se les obtuviese una biopsia de mucosa bronquial (4 fumadores sanos y 3 con EPOC).
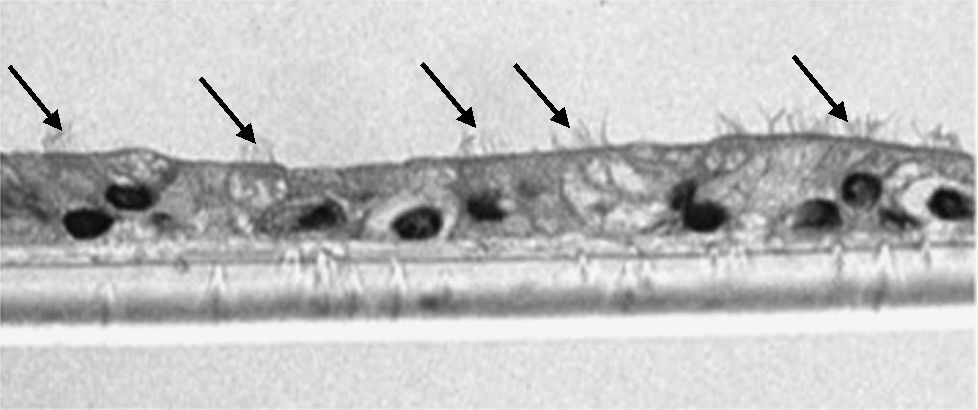
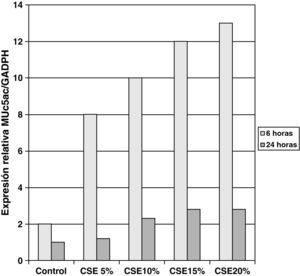
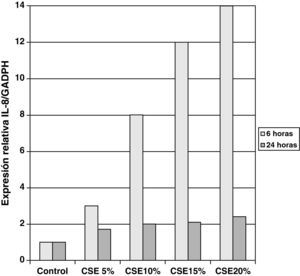
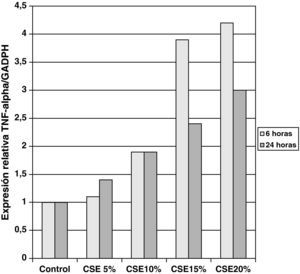
Las muestras obtenidas se cultivaron hasta lograr su diferenciación en epitelio seudoestratificado con presencia de células ciliadas y caliciformes. Debido a la dificultad que entraña la diferenciación en una interfase aire-líquido —se necesitó una media de 40 días para cada cultivo— y la escasez de material que aportaba la biopsia de mucosa, solo fue posible obtener cultivos viables en 4 pacientes, todos ellos del grupo de fumadores sanos. De cada uno de ellos se consiguieron 30 cultivos que fueron utilizados para su análisis experimental. La estimulación de las células epiteliales por exposición a humo de tabaco produjo un aumento dependiente de la dosis en la expresión génica obtenida mediante RT-PCR de Muc5AC (10,3 [1,2]) (fig. 1), IL8 (5,1 [0,3]) (fig. 2) y TNFα (4,3 [0,4] (fig. 3) tanto en el cultivo de 6 h como a las 24 h (2,5 [0,3], 2,4 [0,2] y 2,9 [0,2]) con respecto a sus valores basales. Este efecto en términos proporcionales fue más intenso en los cultivos de 6 h decayendo su expresión progresivamente. En estas condiciones experimentales sí que se observó una correlación significativa entre la concentración del extracto de tabaco y la expresión de IL8 (r=0,42; p<0,05) TNFα (r=0,39; p<0,05) y Muc5AC (r=0,47; p<0,05). Algunos de estos inserts se utilizaron para corroborar la diferenciación epitelial con presencia de células secretoras y epitelio ciliar (figs. 4 y 5).
También existía una correlación significativa entre los valores de ARNm para IL8, TNFα y Muc5AC.
DiscusiónLos resultados del estudio muestran que existen diferencias en la producción y secreción en las vías aéreas respiratorias de IL8 entre fumadores sanos y pacientes con EPOC. Los valores elevados de IL8 son más elevados cuanto mayor es el grado de obstrucción y no aumentan en función de la intensidad o duración del tabaquismo. Por otro lado, también hemos podido demostrar que en cultivos diferenciados de epitelio bronquial de pacientes fumadores existe un aumento en la expresión celular de Muc5AC, IL8 y TNFα; lo que indica que, al menos en el caso de la IL8, su elevación no se debe solo a la inflamación por neutrófilos o macrófagos, sino a un efecto directo de los componentes del humo de tabaco en las células epiteliales.
La relación entre el humo de tabaco y la patogenia de la EPOC es multifactorial: aumento en el reclutamiento de neutrófilos y macrófagos, liberación de mediadores celulares con capacidad oxidativa, inactivación de inhibidores de las proteasas y aumento en la transcripción de citocinas proinflamatorias. La relación entre estos factores y los hallazgos fundamentales que definen la enfermedad, al menos en sus estadios iniciales, como son la hipertrofia-hiperplasia de las células secretoras y glándulas mucosas o la presencia de folículos linfoides de células CD8, han sido motivo de múltiples hipótesis, desarrolladas a partir de estudios tanto in vivo como in vitro.
Desde los estudios de Keating7 en 1996, se sabe que los valores de IL8 y TNFα se encuentran elevados en el esputo de pacientes con EPOC y que este aumento se correlacionaba con la intensidad de la neutrofilia. La diferencia entre fumadores sanos y pacientes con EPOC vendría condicionada, según esta teoría, por un aumento en la actividad quimiotáctica de la IL8 sobre los neutrófilos22,23. Esta acción se vería aumentada en el caso de otros cofactores, como la presencia de infecciones o contaminantes ambientales. Existe, sin embargo, una disociación en los estudios publicados entre los datos obtenidos en muestras obtenidas de secreciones de las vías aéreas24 y los hallazgos histológicos en pacientes con EPOC incipiente en los que no se observa inflamación neutrofílica de la mucosa, sino infiltración por células mononucleares, compuestas por linfocitos CD8+ que se agrupan formando folículos linfoides.
En nuestro estudio, en pacientes con EPOC que no habían sido tratados nunca con antiinflamatorios inhalados, que en conjunto tenían un grado leve-moderado de obstrucción, y estaban libres de infección bacteriana, no encontramos diferencias en la neutrofilia de las secreciones con respecto a los fumadores sanos y sí que observamos un aumento en la producción de IL8 y TNFα, si bien solo la primera alcanzó significación estadística. La ausencia de relación de IL8 con la intensidad del tabaquismo o la neutrofilia del esputo, pero sí con el grado de obstrucción, podría ser debida a diferencias en el patrón de respuesta de otros elementos de la mucosa, como son las células epiteliales, tanto en lo que se refiere a la producción de moco como en su expresión de citocinas. La falta de diferencias significativas en los valores de TNFα entre ambos grupos y la ausencia de correlación con los parámetros clínicos y funcionales contrastan con los datos publicados en la literatura, que señalan este mediador como punto común a las diversas alteraciones inducidas por el tabaco. En este sentido, nuestros resultados en cultivos epiteliales así lo corroboran. Es posible que las diferencias en el tamaño de la muestra o la menor gravedad de la EPOC con respecto a otros estudios justifiquen las diferencias. Con respecto a la IL13, aunque diversos estudios25 en células cultivadas in vitro han demostrado su acción potenciadora en la respuesta al humo de tabaco, no existen estudios comparativos en secreciones de vías respiratorias entre fumadores sanos con o sin EPOC, por lo que la ausencia de diferencias en nuestra muestra no puede ser comparada con otros trabajos.
La ausencia de diferencias en las concentraciones de NO se justifica por la escasez de pacientes con hipersecreción bronquial con respecto a otros estudios.
Los estudios in vitro de cultivos celulares de células epiteliales humanas han permitido conocer mucho las interacciones entre citocinas y mucinas. Hoy sabemos que la exposición a humo de tabaco aumenta, tanto en modelos animales como en células humanas, la expresión del factor del receptor del factor de crecimiento epidérmico (EGFR) que, a su vez, se correlaciona con un aumento en la liberación de TNFα, IL8, IL13 y mucinas.
Las mucinas que constituyen las glucoproteínas más frecuentes en el moco de las vías aéreas son producidas tanto por las células secretoras tipo globet como por las glándulas submucosas. En el primer caso, la mucina más frecuente es la Muc5AC, mientras que en las glándulas la secreción predominante es la Muc5B13. En pacientes con EPOC, en función del fenotipo, se observa un aumento en la Muc5B en pacientes con bronquitis crónica o un aumento en la Muc5AC en los estudios de fumadores sanos o en fases iniciales de la EPOC. Como se explicó en la introducción, la relación entre la producción de mucinas y el humo de tabaco se produce como consecuencia de la acción directa de mediadores inflamatorios, como el TNFα o la IL8, en las células epiteliales, favoreciendo la secreción glandular o la liberación de elastasas neutrofílicas.
En nuestro trabajo, hemos podido observar que la estimulación con dosis incrementales de extracto de tabaco en cultivo de células epiteliales de fumadores sanos produjo un aumento en la expresión de ARNm para TNFα e IL-8, que se correlacionaba con la expresión de Muc5AC.
En estudios previos realizados en muestras obtenidas de biopsia bronquial de fumadores sanos con o sin EPOC26, se han demostrado diferencias en la expresión de Muc5AC en sujetos fumadores frente a no fumadores, pero no se encontraron diferencias con respecto a pacientes con EPOC. Tampoco se observaron correlaciones significativas de la expresión de Muc5AC con la intensidad de la inflamación neutrofílica o la gravedad de la obstrucción. En estudios de cultivos de células epiteliales no diferenciadas el humo de tabaco aumenta de forma sinérgica la producción de Muc5AC inducida por EGFR, lipopolisacáridos bacterianos o TNFα15 y su efecto directo sobre la producción de IL88. Estos estudios, sin embargo, no estaban realizados en cultivos epiteliales diferenciados ni en pacientes con EPOC.
En este último grupo los estudios son más escasos. En un trabajo en cultivos no diferenciados de pacientes con EPOC27, no se observaron diferencias en la expresión basal de ARNm y producción de IL8 frente a fumadores sin EPOC, pero sí tras la estimulación inducida por TNFα. Al igual que antes se vio, estos hechos corroboran que no son los neutrófilos los inductores en la liberación de citocinas, sino otros mecanismos en los que interviene directamente el humo de tabaco o el TNFα sobre las células epiteliales. En un estudio similar, pero en este caso realizado en células epiteliales diferenciadas de ex fumadores sanos y pacientes con EPOC, Patel et al28 observaron que, en condiciones basales, la producción de IL6 e IL8 no solo no era igual, sino que estaba disminuida en los pacientes con EPOC; sin embargo, tras la estimulación con TNFα se observa un aumento mayor en los pacientes con EPOC.
La diferencia entre los valores obtenidos en muestras de secreciones y los resultados en cultivos celulares de pacientes con EPOC no es atribuible, según los autores, a la calidad de los cultivos, ya que demuestran su viabilidad mediante la demostración de células ciliadas, sino al mayor componente inflamatorio que ocurre en los sujetos in vivo.
A nuestro entender, este factor no siempre es así —no todos los estudios demuestran diferencias en el patrón inflamatorio— y sí que es importante la diferenciación epitelial. El método de cultivo de células epiteliales diferenciadas mediante el crecimiento en una interfase aire-líquido (ALI) fue desarrollado en 1996 por Gray29 a partir de líneas celulares epiteliales comerciales. En su estudio, demostraron que las características del medio, el número de pases y la presencia de aire en su segmento apical permiten la diferenciación no sólo de la ciliogénesis, sino también de la célula productoras de moco. La diferenciación apical-basal solo es posible mediante esta interfase aire-líquido. Estudios posteriores30 han demostrado que este método condiciona el perfil de los estudios transcripcionales. Así, el perfil de cluster de ARNm de diversos genes observados directamente de muestras de biopsia es similar al obtenido en cultivos de células epiteliales diferenciadas mediante ALI, tanto si son de origen traqueal como bronquial, mientras que se diferencian de los cultivos realizados sin este método.
Esta técnica de cultivo más fiable es, por el contrario, más laboriosa y no siempre se obtienen los resultados deseados.
En nuestro caso, al utilizar muestras mediante biopsia bronquial y no piezas quirúrgicas, aumentó aún más la dificultad, de ahí que sólo pudiéramos obtener resultados en fumadores sanos. En este grupo, demostramos que con la exposición directa al tabaco y de forma dosis dependiente existe un aumento en la producción de mucinas, secundaria a estimulación de células secretoras ya que no es posible la formación de glándulas, y de IL8 y TNFα. La correlación entre ellas demuestra que el humo de tabaco es capaz per se de inducir respuesta inflamatoria en las células epiteliales de los sujetos sanos fumadores. La disminución en la expresión de ARNm a las 24 h, con respecto a las 6 h, es concordante con los mecanismos transcripcionales de cualquier inductor, que tiene su acción pico en las primeras horas y disminuye al tiempo que aumenta la producción de proteínas, tal y como ha sido demostrado en otros estudios de cultivos epiteliales.
No existen muchos estudios utilizando esta técnica en biopsias de pacientes. En cultivos de líneas celulares comerciales16 la diferenciación mediante ALI ha mostrado que la producción de IL8 y Muc5AC solo se observa tras la estimulación con humo de tabaco a concentraciones altas (30%). El hecho de que en nuestro estudio se observen diferencias significativas con concentraciones inferiores puede indicar una mayor sensibilidad en el epitelio de fumadores.
El hecho de que finalmente solo pudieran obtenerse cultivos viables en pacientes fumadores sin EPOC limita significativamente los resultados y su aplicabilidad generalizada a los distintos fenotipos de la EPOC. La translación de la investigación experimental en la clínica diaria requiere seguramente de muestras más amplias, pero el hallazgo de que, al menos en un número significativo de inserts bien diferenciados, los resultados son concordantes con la hipótesis planteada puede servir de origen de nuevos estudios que corrijan las dificultades de este tipo de estudios en biopsias de mucosa bronquial.
En resumen, nuestro estudio, con las limitaciones inherentes a su dificultad, permite concluir que existen diferencias en la producción de citocinas entre individuos fumadores sanos o con EPOC que podrían estar justificadas por la acción directa del humo de tabaco en las células epiteliales.
Subvencionado con la beca SVN 2004, beca SEPAR 2005, SAF2008-03113 y CIBERES (CB06/06/0027).