Sr. Director: La embolia pulmonar se produce generalmente por la migración de un trombo localizado en el territorio venoso profundo de las extremidades inferiores. Su prevalencia es elevada y su aparición conlleva una elevada morbimortalidad1,2. La enfermedad tromboembólica venosa (ETV) recurrente es un problema complejo que obliga a realizar un estudio exhaustivo por un equipo multidisciplinario. Entre la población caucásica el factor V de Leiden representa el factor de riesgo genético más frecuente asociado a ETV; sin embargo, se van conociendo nuevos factores como desencadenantes de esta entidad3. Seguidamente presentamos un caso clínico de ETV recurrente asociada a hiperhomocisteinemia (HHC), que requirió un estudio hematológico y metabólico complejo.
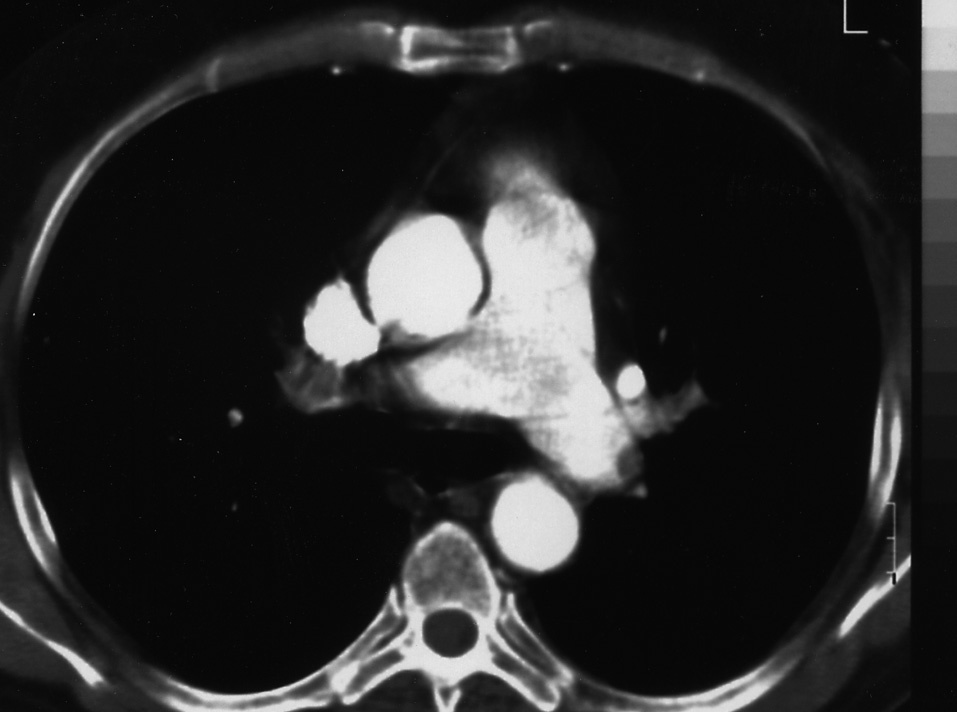
Varón de 57 años de edad, fumador activo, sin criterios clínicos ni funcionales de enfermedad pulmonar obstructiva crónica, que acudió con síntomas de 3 días de evolución consistentes en disnea y dolor torácico pleurítico en el hemitórax izquierdo y, en días posteriores, en el derecho. Entre sus antecedentes figuraban historia recurrente de varios episodios de trombosis venosa profunda y tromboembolia pulmonar en 2003. Había recibido tratamiento con anticoagulantes orales, que había abandonado en los meses previos. En la exploración el paciente se encontraba hemodinámicamente estable, con cianosis, disnea en reposo y frecuencia respiratoria de 30 respiraciones/min. La auscultación cardíaca era normal y la pulmonar revelaba un murmullo disminuido en ambos hemitórax, con estertores crepitantes en la base pulmonar derecha. La exploración abdominal y de las extremidades inferiores era normal. En cuanto a las pruebas de laboratorio, en el hemograma destacaba una cifra de 12.720/μl de leucocitos; la bioquímica, el ionograma y la coagulación basal eran normales. Los datos de la gasometría basal fueron los siguientes: pH de 7,44, presión arterial de oxígeno de 40 mmHg, presión arterial de anhídrido carbónico de 36 mmHg, bicarbonato de 24 mEq/l y saturación de oxígeno en sangre arterial del 70%. El electrocardiograma presentaba un ritmo sinusal, con una frecuencia de 120 lat/min y presencia de S1Q3T3 en las derivaciónes II-III. La radiografía de tórax mostraba escaso grado de inspiración, condensación pulmonar basal izquierda y pequeño derrame pleural. La angiotomografía axial computarizada presentaba múltiples defectos de repleción endovascular en las ramas lobulares de ambos lóbulos inferiores e infarto pulmonar periférico en el lóbulo inferior izquierdo, indicativo de una tromboembolia pulmonar bilateral (fig. 1). La ecografía Doppler de los miembros inferiores fue normal. El estudio de hipercoagulabilidad reveló un cociente internacional normalizado de 0,99, actividad de protrombina del 119%, tiempo de tromboplastina de 27 s, fibrinógeno de 430 mg/ml, plasminógeno del 120%, proteína C del 116%, proteína S del 111%, resistencia a la proteína C activada de 0,6 mg/dl (normal), anticoagulante lúpico de 1,4 (1-1,4) (normal), inmunoglobulina para anticardiolipina de 8,6 UI/ml e IgM inferior a 7,5 UI/ml, antitrombina III del 89%, factor V de Leiden de 0,9 y factor II normal. La concentración sanguínea de homocisteína era de 16,3 μmol/l (normal: 0-15). El estudio genético con determinación del gen C677T de la MTHFR (metalohidrofolato reductasa) fue positivo, siendo el paciente portador heterocigoto. Se administró tratamiento con heparina sódica (48.000 U/día) y se obtuvo una anticoagulación en el intervalo terapéutico. El paciente evolucionó favorablemente y se le dio alta con warfarina oral y suplementos de ácido fólico.
Fig. 1. Angiotomografía axial computarizada con embolia pulmonar en rama lobular inferior izquierda.
El estudio de los factores involucrados en la ETV recurrente constituye un campo apasionante dentro de la medicina. A las causas actualmente conocidas se van uniendo otros procesos a medida que la investigación científica llega a determinarlos. Entre ellas se encuentra la HHC, enfermedad asociada a causas genéticas y a deficiencias de folatos y de vitamina B124. Desde los trabajos de McCully en 1969, mencionados en Fernández Miranda et al5 y Wald et al6 la HHC se considera un factor de riesgo vascular (aterógeno y trombógeno). No obstante, en la actualidad sigue habiendo muchas dudas acerca de esta asociación. La HHC está definida como causa de ETV en pacientes adultos, siendo escasos los estudios realizados en población joven5,6. Se han publicado estudios que han tratado de relacionar la mutación del gen C677T de la MTHFR con el riesgo de desarrollar ETV, sin que por el momento sus resultados hayan sido concordantes1,5,6. En nuestro paciente adulto con historia de ETV recurrente el diagnóstico se estableció al confirmarse una determinación elevada de homocisteína y una mutación positiva de C677T-MTHFR, y tanto la evolución como la respuesta al tratamiento fueron buenas. Sin embargo, en población joven estas alteraciones no están perfectamente establecidas como factor de riesgo de ETV recurrente.
Recientemente se han publicado los resultados de un metaanálisis6 sobre estudios de diferentes poblaciones con ETV (incluidos pacientes jóvenes) que demuestra una asociación entre la HHC y la ETV. Sin embargo, cuando se intentó analizar la asociación entre la ETV y los polimorfismos del gen C677T de la MTHFR, se estableció que era débil, de modo que no puede determinarse que la mutación sea el factor de riesgo para el desarrollo de ETV. Más aclaradores han sido los resultados obtenidos en el estudio prospectivo de Frederiksen et al, citado en Fernández Miranda et al5 y Wald et al6, con 9.238 pacientes y un seguimiento de 23 años, en el que no se comprobó un mayor riesgo de ETV en población homocigota con HHC5,6. Actualmente se están desarrollando nuevas investigaciones que podrían aclarar muchas incógnitas. Se necesitan estudios que confirmen si el descenso de la homocisteína se asocia con una disminución de la morbimortalidad vascular4-6.