El proyecto Pickwick es un estudio prospectivo, aleatorizado, abierto y controlado con grupos en paralelo que intenta dar respuesta a los interrogantes del síndrome de hipoventilación-obesidad (SHO), una enfermedad creciente en los países desarrollados. Para ello, pacientes con SHO fueron divididos en pacientes con índice de apneas-hipoapneas (IAH) ≥30 y <30 mediante polisomnografía. El grupo con IAH≥30 se aleatorizó a tratamiento mediante estilo de vida saludable, ventilación no invasiva (VNI) o presión en la vía aérea positiva continua (CPAP). El grupo con IAH<30, a VNI o estilo de vida saludable.
Su objetivo ha sido evaluar la eficacia del tratamiento con ventilación VNI, CPAP y estilo de vida saludable (control) a medio y largo plazo en el SHO, analizando como variable primaria la PaCO2 y los días de hospitalización, respectivamente, y como variables operativas el porcentaje de abandonos por razones médicas y mortalidad.
Los objetivos secundarios a medio plazo fueron: 1)evaluar la eficacia clínica-funcional, en calidad de vida, en variables polisomnográficas y ecocardiográficas; 2)investigar la importancia de los episodios apneicos y de la leptina en la génesis de la hipoventilación alveolar diurna y el cambio con los diferentes tratamientos; 3)investigar si las alteraciones metabólicas, bioquímicas y disfunción endotelial vascular dependen de la presencia de apneas e hipoapneas, y 4)cambio de marcadores inflamatorios y de daño endotelial con los tratamientos.
Los objetivos secundarios a largo plazo fueron: 1)evaluar la eficacia clínico-funcional y en calidad de vida con VNI y CPAP; 2)cambio de la leptina, marcadores inflamatorios y de daño endotelial con los tratamientos; 3)cambio de la hipertensión pulmonar y otras variables ecocardiográficas, así como en la hipertensión arterial e incidencia de episodios cardiovasculares, y 4)frecuencia de abandonos y mortalidad.
The Pickwick project was a prospective, randomized and controlled study, which addressed the issue of obesity hypoventilation syndrome (OHS), a growing problem in developed countries. OHS patients were divided according to apnea-hypopnea index (AHI) ≥30 and <30 determined by polysomnography. The group with AHI≥30 was randomized to intervention with lifestyle changes, noninvasive ventilation (NIV) or continuous positive airway pressure (CPAP); the group with AHI<30 received NIV or lifestyle changes.
The aim of the study was to evaluate the efficacy of NIV treatment, CPAP and lifestyle changes (control) in the medium and long-term management of patients with OHS. The primary variables were PaCO2 and days of hospitalization, and operating variables were the percentage of dropouts for medical reasons and mortality.
Secondary medium-term objectives were: (i)to evaluate clinical-functional effectiveness on quality of life, echocardiographic and polysomnographic variables; (ii)to investigate the importance of apneic events and leptin in the pathogenesis of daytime alveolar hypoventilation and change according to the different treatments; (ii)to investigate whether metabolic, biochemical and vascular endothelial dysfunction disorders depend on the presence of apneas and hypopneasm and (iv)changes in inflammatory markers and endothelial damage according to treatment.
Secondary long-term objectives were to evaluate: (i)clinical and functional effectiveness and quality of life with NIV and CPAP; (ii)changes in leptin, inflammatory markers and endothelial damage according to treatment; (iii)changes in pulmonary hypertension and other echocardiographic variables, as well as blood pressure and incidence of cardiovascular events, and (iv)dropout rate and mortality.
Hoy día la obesidad es un fenómeno creciente en el mundo desarrollado y afecta a un tercio de la población adulta, por lo que ha sido considerado como «la epidemia del sigloxxi»1. El síndrome de hipoventilación-obesidad (SHO), caracterizado por la presencia de insuficiencia respiratoria crónica hipercápnica no secundaria a otras causas, episodios apneicos e hipoventilación alveolar durante el sueño, es un trastorno dependiente de la obesidad2. Las repercusiones son menos conocidas que en el síndrome de apneas-hipoapneas de sueño (SAHS), pero aparentemente son más frecuentes la hipertensión pulmonar y el síndrome metabólico, y dado el mayor grado de hipoxia nocturna, podrían presentar mayor riesgo de otros episodios cardiovasculares y mortalidad en comparación con obesos sin insuficiencia respiratoria3. El tratamiento ideal es la pérdida de peso4. Restaurar el peso a lo normal revierte la insuficiencia respiratoria, la hipertensión pulmonar y los trastornos durante el sueño5. El problema radica en que en estos pacientes es difícil conseguir y mantener pérdidas importantes de peso y la cirugía bariátrica es una alternativa minoritaria, debido a la mayor mortalidad y rechazo de los propios pacientes. A pesar de que la presión en la vía aérea positiva continua (continuous positive airway pressure [CPAP]) corrige los episodios apneicos nocturnos en pacientes con SHO, no parece normalizar la PaCO2 diurna en todos los casos6. Por tanto, la importancia de las apneas e hipoapneas en el desarrollo de hipercapnia diurna no está claro, y se sospecha que en los respondedores al tratamiento con CPAP pueden predominar los episodios apneicos sobre la hipoventilación alveolar6. La hipercapnia diurna en el SAHS se ha asociado al cociente duración del episodio/duración del interepisodio, lo que indicaría que la hipercapnia nocturna y diurna dependerían de la falta de recuperación de la hipoventilación producida por los episodios apneicos, especialmente durante el periodo REM7. La CPAP y la ventilación no invasiva (VNI) se están usando extensivamente para el tratamiento crónico del SHO. Solamente se ha publicado un estudio aleatorizado8 sobre la eficacia de la CPAP, en comparación con la VNI, en 36 pacientes seleccionados por tener una respuesta favorable a una prueba inicial de tratamiento con CPAP. La conclusión fue que la mejoría clínica, y gasométrica a los 3meses era similar entre los 2 tipos de tratamientos. Otro estudio aleatorizado ha comparado la eficacia de la VNI frente a un «estilo de vida saludable» (es decir, medidas higiénico-dietéticas) en pacientes con SHO seleccionados por tener hipercapnia diurna leve9. No existe ningún estudio aleatorizado en pacientes no seleccionados que demuestre cuál de estos tratamientos es más eficaz entre ellos o frente al control (estilo de vida saludable).
Tampoco existe un estudio con un diseño similar que demuestre si las repercusiones del SHO (hipertensión arterial y pulmonar, episodios cardiovasculares, ingresos hospitalarios y mortalidad) disminuyen más con alguno de estos tratamientos. De lo citado anteriormente se deduce la necesidad de un nuevo estudio que pueda demostrar a medio y largo plazo si el tratamiento con VNI es superior al realizado con CPAP o estilo de vida saludable, dando validez al uso actual extensivo de la VNI en pacientes con SHO.
Nos proponemos realizar un estudio prospectivo, aleatorizado, abierto y controlado con grupos paralelos en el SHO con el objetivo de evaluar la eficacia del tratamiento con ventilación VNI, CPAP y estilo de vida saludable (control), a medio y largo plazo, analizando como variable primaria la PaCO2 y los días de hospitalización, respectivamente, y como variables operativas el porcentaje de abandonos por razones médicas y mortalidad.
Logística del proyectoDesde el Comité Directivo del «Proyecto Integrado de Investigación» (PII) de Sueño de la SEPAR se encargó al Dr. Juan Fernando Masa iniciar el proyecto Pickwick, que agruparía investigación clínica y básica para dar respuesta más integral a los interrogantes que planteaba esta creciente enfermedad (ver también Anexo 2).
En el año 2009 comenzó la inclusión de pacientes en los centros participantes, que se incluyen en el Anexo 3.
Se establecieron a priori las siguientes acciones: a)newsletters mensuales del investigador principal al resto de investigadores con el objetivo de informar sobre la evolución comparativa entre centros y favorecer la inclusión además de informar puntualmente de eventualidades; b)reuniones de investigadores aprovechando los congresos de SEPAR y reunión de invierno, y c)política de publicaciones con una previsión del número de publicaciones y las autorías en función del número de pacientes incluidos (Anexo 4).
Objetivos del estudioLos objetivos primarios y secundarios tanto a corto/medio como a largo plazo están resumidos en la tabla 1.
Objetivos principales y secundarios
| PrimariosEvaluación de la eficacia a largo plazo del tratamiento con VNI frente a CPAP o frente a medidas higiénico-dietéticas (grupo control), siendo la variable principal días de hospitalización por todas las causasEvaluación la eficacia a medio plazo del tratamiento con VNI, CPAP y medidas higiénico-dietéticas (grupo control), siendo la variable principal la PaCO2Secundarios a medio plazoEficacia clínica-funcional, en calidad de vida, en variables polisomnográficas y ecocardiográficasInvestigar la importancia de los episodios apneicos y de la leptina en la génesis de la hipoventilación alveolar diurnaCambio de la leptina con los diferentes tratamientosInvestigar si las alteraciones metabólicas, bioquímicas y disfunción endotelial vascular dependen de la presencia de apneas e hipoapneasCambio de marcadores inflamatorios y de daño endotelial con los tratamientosSecundarios a largo plazoEficacia clínico-funcional y en calidad de vida durante 3añosCambio de la leptina con los diferentes tratamientosCambio de marcadores inflamatorios y de daño endotelial con los tratamientosCambio de la hipertensión arterial pulmonar y otras variables ecocardiográficasIncidencia de hipertensión arterial sanguínea y episodios cardiovasculares con los tratamientosFrecuencia de abandonos y mortalidad |
Se incluyeron en el proyecto los pacientes referidos a las consultas de neumología de los hospitales participantes por presentar insuficiencia respiratoria hipercápnica en fase estable (pH≥7,35 sin síntomas clínicos de agudización en al menos 2meses previos) secundaria a obesidad. Se definió SHO como el conjunto de obesidad (índice de masa corporal [IMC]≥30) e insuficiencia respiratoria hipercápnica estable (PaCO2≥45mmHg) no secundaria a otras causas2. Los pacientes fueron incluidos de forma consecutiva tras comprobar que reunían los criterios de inclusión y la ausencia de criterios de exclusión (tabla 2). Esto incluía una prueba de tratamiento, con una detallada información previa del funcionamiento del equipo y los beneficios esperables con el tratamiento (ver Anexo 5). El estudio fue aprobado por los comités éticos de los 16 centros. Se obtuvo el consentimiento por escrito de todos los pacientes.
Criterios de inclusión y exclusión
| Criterios de inclusión1. Edad comprendida entre 15 y 80años2. Ausencia de enfermedad pulmonar obstructiva crónica de moderada o grave intensidad (FEV1>70% del predicho si FEV1/FVC<70)3. Ausencia de enfermedad neuromuscular, de la pared torácica o metabólica causante de hipercapnia diurna4. Ausencia de narcolepsia o síndrome de las piernas inquietas.5. Superar correctamente una prueba de tratamiento de al menos 30min con CPAP/VNI en vigiliaCriterios de exclusión1. Incapacidad psicofísica para realizar cuestionarios2. Pacientes que no sean susceptibles de ser evaluados mediante cuestionarios de calidad de vida por presentar enfermedad crónica previamente diagnosticada (neoplasia, dolor crónico grave de cualquier origen, insuficiencia renal grave, y cualquier otra enfermedad crónica grave limitante)3. Sujetos con obstrucción nasal crónica importante que impida el uso de CPAP/VNI4. No obtención del consentimiento informado |
Pickwick es un estudio prospectivo, metacéntrico, abierto, aleatorizado, controlado de grupos paralelos que compara la eficacia a medio plazo (variable principal PaCO2) y largo plazo (variable principal días de hospitalización) de tratamiento con VNI, CPAP o recomendaciones para un estilo de vida saludable (medidas higiénico-dietéticas-grupo control) en pacientes con SHO en situación estable, mediante el seguimiento prospectivo y en paralelo de las cohortes.
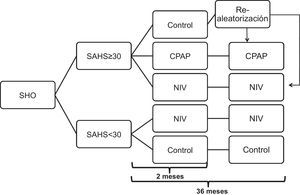
ProtocoloLos pacientes inicialmente seleccionados fueron sometidos a una polisomnografía convencional (PSG) (ver Anexo 6) y posteriormente aleatorizados en 5 grupos (2 aleatorizaciones, una en cada cohorte) mediante lista de números aleatorios generada por ordenador (SPSS, Chicago IL, EE.UU.), de acuerdo con el esquema de la figura 1: a)cohorte de pacientes con índice de apneas e hipoapneas (IAH) ≤30 (grupo de SAHS ausente o leve-moderado) y b)cohorte de pacientes con IAH ≥30 (SAHS grave). En la primera cohorte los pacientes se aleatorizaron a tratamiento con VNI o grupo control, y en la segunda cohorte se aleatorizaron a grupo control, VNI o CPAP durante 2meses (valoración a medio plazo).
Diagrama de flujo del protocolo de estudio. Los pacientes inicialmente seleccionados se dividieron en 2 cohortes: la cohorte de pacientes con índice de apneas e hipoapneas (IAH) ≤30 (grupo de no SAHS o leve-moderado) y la cohorte de pacientes con IAH≥30 (SAHS grave). En la primera cohorte los pacientes se aleatorizaron a tratamiento con VNI o grupo control y en la segunda cohorte se aleatorizaron a grupo control o VNI o CPAP para la valoración a medio plazo (2meses). Después, los pacientes del grupo control se re-aleatorizaron a VNI o CPAP para continuar 36meses, al igual que los 2 grupos de la cohorte no SAHS (valoración a largo plazo).
CPAP: presión positiva continua; SAHS: síndrome de apneas e hipoapneas del sueño; SHO: síndrome de hipoventilación-obesidad; VNI: ventilación no invasiva.
Tras este periodo, los pacientes del grupo control se asignaron en este momento de forma aleatorizada a VNI o CPAP que se mantuvo hasta una nueva evaluación a los 36meses, al igual que los 2 grupos de la cohorte no SAHS (valoración a largo plazo).
La tabla 3 muestra en qué consistía el tratamiento en cada uno de los grupos de aleatorización, control, CPAP y VNI (ver también Anexo 7).
Tratamiento de los grupos tras la aleatorización
| 1. Grupo control: modificación del estilo de vidaConsistió en una dieta de 1.000 calorías y mantener la higiene y los hábitos de sueño adecuados (evitar la posición de decúbito supino, mantener hábitos regulares de sueño y ejercicio, no tomar sedantes, estimulantes, alcohol, tabaco o comidas pesadas dentro de las 4h antes de acostarse). Se añadió oxigenoterapia si estaba indicado con el caudal necesario para mantener en vigilia una SatO2 entre el 88-92% o una PaO2≥55mmHg y durante al menos 17h/día. Después de 20min con el tratamiento con oxígeno se realizó una gasometría arterial basal. Si la PaCO2 aumentó ≥5mmHg o el pH fue <7,35, se suprimió el tratamiento con oxígeno (ver Anexo 8).2. CPAPAdemás de la modificación del estilo de vida y el oxígeno (si necesario), se inició tratamiento con CPAP fija en el domicilio previa a una titulación de CPAP convencional.3. VNIAdemás de la modificación del estilo de vida y el oxígeno (si necesario), se inició tratamiento con VNI. El modo ventilatorio fue soporte de presión binivel con volumen asegurado (ver Anexo 6) |
Los pacientes fueron contactados a los 30días, a los 2meses y después cada 3meses hasta completar los 2años del estudio. Después los contactos fueron cada 6meses hasta completar los 3años. La tabla 4 muestra las variables evaluadas durante el estudio y la tabla 5, el cronograma de las mismas. El cumplimiento con CPAP/VNI u oxígeno se obtuvo dividiendo el número de horas de utilización (obtenido del contador horario) por el número de días de tratamiento. En todos los pacientes se realizó un contacto telefónico mensual para insistir en el cumplimiento del tratamiento dietético. Se consideró abandono en aquellos pacientes que una vez aleatorizados decidieron por voluntad propia o por otro motivo dejar el estudio. También los que por razones médicas no podían continuar con el tratamiento asignado: a)si en las revisiones trimestrales el pH de la gasometría obtenida respirando aire ambiente fue inferior a 7,33; b)si un paciente requirió ingreso hospitalario por insuficiencia respiratoria precisando VNI durante más de 5días o ventilación invasiva durante más de 3días, o si en la gasometría arterial al alta hospitalaria respirando aire ambiente el pH fue inferior a 7,33, o 3)por fallecimiento.
Variables recogidas al inicio del estudio y durante el seguimiento
| 1. Datos antropométricos y sociodemogáficos2. Morbilidad y presión arterial3. Número de ingresos y días de estancia hospitalariaVisitas a urgencias y hospitalización convencional en los 3 años previos al tratamiento y en el seguimientoEn UCI en los 3 años previos al tratamiento y durante el seguimiento4. Número de intubaciones orotraqueales y visitas a urgenciasEn los 3 años previos al tratamiento y seguimiento5. Registro de abandonos del estudio y causas6. Registro de fallecimientos y causas7. CuestionariosSíntomas clínicos y escala de somnolencia de EpworthFunctional Outcomes of Sleep Questionarie (FOSQ)Medical Outcome Survey - Short Form 36 (SF36)Escala visual analógica del estado subjetivo de la enfermedad a estudio8. Pruebas funcionalesGasometríaEspirometríaTest de la marcha9. Polisomnografía10. Ecocardiograma11. Cumplimiento mediante contador horario12. Determinaciones analíticas no experimentalesHemograma, hemoglobina, fibrinógeno, perfil renal, hepático y lipídico, proteína C reactiva13. Determinaciones analíticas experimentales |
Cronograma de las evaluaciones y contenido de las mismas
| 12 Evaluaciones | Clínica y morbilidad | Atención hospitalaria y mortalidad | GA,PA y cumplimiento | PSG | ECO | Analítica |
|---|---|---|---|---|---|---|
| Basal | x | x | x | x | x | x |
| 30 días | x | x | ||||
| 2 meses | x | x | x | x | x | x |
| 6 meses | x | x | ||||
| 9 meses | x | x | ||||
| 12 meses | x | x | x | x | x | |
| 15 meses | x | x | ||||
| 18 meses | x | x | ||||
| 21 meses | x | x | ||||
| 24 meses | x | x | x | x | x | |
| 30 meses | x | x | ||||
| 36 meses | x | x | x | x | x |
ECO: ecocardiograma; GA: gasometría arterial; PA: presión arterial; PSG: polisomnografía.
Clínica: datos antropométricos, sociodemográficos y cuestionarios.
El cálculo del tamaño muestral se realizó para detectar diferencias en la variables primarias del estudio, asumiendo un error alfa=0,05 y un error beta=0,2.
Días de hospitalización. La media de días de hospitalización en pacientes tratados crónicamente con VNI fue de 2,5±1,1días/año10. Estimamos como clínicamente relevante poder detectar diferencias entre grupos a partir de 0,5días/año (20% de diferencia) con una desviación estándar máxima de 1,1. Para una muestra frente a un valor teórico (2 comparaciones) el número de pacientes mínimo estimado sería de 40 pacientes en cada grupo, a lo que hay que añadir una pérdida de un 25%, resultando en 54 por grupo y una muestra total de 216 pacientes.
PaCO2diurna como variable primaria a medio plazo. La media en pacientes tratados con VNI fue 45±5 mmHg11. Estimamos como clínicamente relevante poder detectar diferencias entre grupos a partir de 2,5mmHg con una desviación estándar de 5. Para comparación de 2 medias independientes (triple comparación: cohorte de SAHS) la muestra debería ser de 64 pacientes por grupo. Añadiendo unas pérdidas de un 20%, el tamaño final de la muestra sería de 80 pacientes por grupo, es decir, 240 pacientes en total. Para una muestra frente a un valor teórico (2 comparaciones: cohorte no SAHS) la muestra sería de 34 pacientes en cada grupo. Añadiendo unas pérdidas de un 20% el tamaño final de la muestra sería de 43 pacientes por grupo, es decir, 86 pacientes en total.
En resumen, en la cohorte de pacientes con SAHS el tamaño muestral viene marcado por la estimación sobre la PaCO2, siendo necesario seleccionar 240 pacientes. En cambio, en la cohorte de pacientes sin SAHS el tamaño muestral viene marcado por la estimación sobre los días de hospitalización, siendo, en este caso, necesario seleccionar 108 pacientes. En conjunto, el tamaño muestral sumando las 2 cohortes sería de 348 pacientes
Análisis estadísticoTodas las variables a estudio serán comparadas intragrupo entre la situación pre y postratamiento, aunque el análisis principal de la eficacia serán las comparaciones de las diferencias entre pre y postratamiento en los diferentes grupos (intergrupos) mediante ANOVA inicialmente y posteriormente ANCOVA para los valores estadísticamente significativos (p<0,05). Se analizarán el porcentaje de abandonos, la mortalidad y sus causas, los efectos secundarios y las horas de uso. Los análisis se efectuarán tanto en modo de «intención de tratar» como «por protocolo». Los valores perdidos en la variable principal se sustituirán por valores derivados de una regresión múltiple. Los diferentes análisis mencionados se realizarán en las evaluaciones a los 2 meses y a los 3años.
Aspectos éticos- a)
Consentimiento informado. Se informó al paciente por escrito de la naturaleza y propósitos del estudio. El proyecto fue valorado y aprobado por los comités éticos de los centros participantes teniendo en cuenta la declaración del Helsinki.
- b)
Durante el desarrollo del proyecto una agencia externa autorizada tiene acceso al análisis periódico de la variable primaria (días de ingreso), número de abandonos por razones médicas y de la mortalidad, comparando los grupos para interrumpir el estudio si uno de los tratamientos es significativamente peor. Esto podría ocurrir por separado en las cohortes con o sin SAHS grave.
El estudio se encuentra ahora en su ecuador y ha concluido la inclusión en el grupo de pacientes con SAHS, por lo que se está llevando a cabo el análisis de la eficacia entre los diferentes grupos (VNI, CPAP y control) en esta cohorte de pacientes.
En total hemos incluido hasta el momento 302 pacientes: 221 en el grupo de SAHS y 81 en el grupo de no SAHS. Hemos excluido 49 pacientes12.
Hasta la fecha el número de abandonos ha sido de 70 (23%): 53 (23%) en el grupo de SAHS y 17 (21%) en el grupo de no SAHS. Los abandonos por causa médica han sido 3 (0,01%): uno en el grupo control antes de la segunda aleatorización y 2 en el grupo de SAHS con VNI. Otros 7 pacientes han fallecido (0,02%): 2 en grupo de SAHS con VNI, 4 en el de SAHS con CPAP y uno en el grupo no SAHS control. Por el momento no existen diferencias entre grupos en los abandonos por causa médica o mortalidad.
DiscusiónEste estudio puede demostrar de forma contundente si el tratamiento con VNI es superior al realizado con CPAP o al tratamiento con medidas higiénico-dietéticas, dando validez al uso actual extensivo de la VNI sin base científica sólida. La eficacia podrá demostrarse en variables fisiológicas, clínicas y otras más relevantes, como días de ingreso, episodios cardiovasculares, hipertensión pulmonar o incluso abandonos y mortalidad. Dado que la prevalencia del SHO probablemente esté aumentando, al igual que la de la obesidad, determinar el tratamiento más eficaz tiene una importancia capital.
El proyecto plantea varias líneas para la presentación de resultados y publicaciones:
- 1.
Fase primera a los 2 meses del seguimiento: a)Eficacia comparativa clínica, funcional respiratoria, ecocardiográfica y polisomnográfica de la 3 alternativas de tratamiento. b)Importancia de los episodios apneicos y de la leptina en la génesis de la hipoventilación alveolar diurna. c)Evaluar si las alteraciones metabólicas, bioquímicas y disfunción endotelial vascular dependen de la presencia de apneas e hipoapneas (modelo de hipoxia intermitente) o de la hipoventilación alveolar diurna (modelo de hipoxia mantenida).
- 2.
Fase segunda a los 3 años del seguimiento: a)Eficacia comparativa de la evolución clínica, funcional respiratoria y de las repercusiones (ingresos, episodios cardiovasculares, hipertensión arterial y pulmonar, abandonos y mortalidad). b)Evaluación comparativa de la evolución de las determinaciones biológicas con los tratamientos.
Como se ha comentado, la hipercapnia diurna en el SAHS se ha asociado a la duración del tiempo en apnea, lo que indicaría que la hipercapnia nocturna y diurna dependería de la falta de recuperación de la ventilación alveolar normal producida por los episodios apneicos, especialmente durante el periodo REM13. El presente estudio también permitirá evaluar si las apneas de sueño juegan un papel determinante en el desarrollo de hipercapnia diurna.
Los pacientes con SHO presentan habitualmente aumento del gradiente alveoloarterial de oxígeno debido a las alteraciones mecánicas que sobre el sistema respiratorio tienen la acumulación de grasa en la pared torácica y en el abdomen. Sin embargo, no existen estudios aleatorizados que evalúen el beneficio de la oxigenoterapia crónica en este grupo de pacientes, ni de esta última junto con las medidas higiénico-dietéticas. Igualmente, no se ha comparado el tratamiento con oxígeno frente a CPAP o VNI. Dado que en nuestro estudio la aplicación de oxígeno es a criterio del médico responsable del paciente, podrían analizarse subgrupos con o sin tratamiento con oxígeno adicional en cada grupo de tratamiento.
La leptina es una proteína liberada por el tejido adiposo cuyas funciones son la reducción del apetito y aumentar el gasto energético. En la obesidad parece existir una resistencia central a la leptina que genera una hiperleptinemia. Estudios en animales han demostrado que esta proteína posee un potente estímulo de la ventilación, y su ausencia (o falta de efecto) podría producir hipoventilación. El nivel de leptina sérica disminuye hasta límites normales en pacientes con SAHS tratados con CPAP14, pero se supone que las apneas e hipoapneas pueden ser la causa de la elevación de la leptina más que su consecuencia. La leptinemia parece ser el doble en pacientes con SHO que en pacientes con similar grado de obesidad y número de apneas e hipoapneas pero sin hipercapnia diurna15. Los niveles de leptina pueden reducirse con VNI16 o disminución de peso. Todo lo anterior ha llevado a considerar que la resistencia a la leptina puede ser la causa del SHO. Sin embargo, un estudio más reciente17 encuentra resultados opuestos: los pacientes con SHO sin número de apneas e hipopneas significativo tienen niveles de leptina más bajos que los pacientes con similar número de episodios obstructivos y obesidad sin hipercapnia diurna, y el nivel de leptina se incrementa con VNI. Nuestro estudio permitirá profundizar en este problema, comprobando si los niveles de leptina decrecen o suben a valores normales (para el nivel de obesidad) en pacientes con SHO que reviertan la hipercapnia diurna, especialmente en el grupo sin número de apneas e hipopneas significativo. También podremos conocer si los pacientes con SHO y episodios obstructivos que no revierten la hipercapnia bajo tratamiento con CPAP tienen niveles de leptina más elevados o más bajos que los que revierten con CPAP o VNI. En definitiva, si la hiperleptinemia es causa de la hipoventilación o consecuencia de esta última o de las apneas de sueño.
El SAHS se han asociado con trastornos metabólicos y disfunción del endotelio vascular que pueden ser consecuencia de la hipoxia intermitente o de la mayor actividad simpática propia de estos pacientes. Estos pueden finalmente favorecer el desarrollo de hipertensión arterial y pulmonar, y episodios cardiovasculares. Pocos estudios se han llevado a cabo en este sentido en el SHO, pero parece que los niveles de algunos mediadores inflamatorios, como IL-6, podrían estar más elevados en pacientes con SHO que en pacientes con SAHS sin hipercapnia diurna18. Tampoco se han realizado estudios enfocados a determinar la causalidad: si pacientes con SHO sin número de apneas e hipopneas significativo tienen basalmente niveles elevados de estos marcadores que pueden decrecer con tratamiento o si, por el contrario, la elevación y el descenso de estas sustancias depende de la presencia de apneas e hipoapneas. Nuestro estudio puede aportar luz sobre la mayoría de estos puntos, permitiendo conocer si la inflamación a nivel molecular depende más de la hipoxia intermitente (episodios obstructivos) o de la hipoxia mantenida (hipoventilación) y la evolución con los diferentes tratamientos.
Hasta el momento el porcentaje de abandonos (23%) es inferior al estimado de 30%, aunque todavía no se ha completado el seguimiento de 3años. Este hecho es siempre una pérdida de información en un ensayo clínico, pues los investigadores recopilan información sobre días de hospitalización, tipo de tratamiento CPAP, VNI, oxígeno o medidas generales y mortalidad una vez que se produjo el abandono. Si el porcentaje de abandonos es finalmente superior en un grupo de tratamiento que en otro (p.ej., mayor con CPAP que con VNI), el análisis por protocolo determinará si las pérdidas se relacionan con la eficacia del tratamiento o con otros motivos (p.ej., por incomodidad).
Análisis de riesgoLas dificultades de este estudio son:
- a)
Necesidad de una muestra amplia y, por ende, necesidad de enrolar pacientes de muchos centros diferentes.
- b)
Seguimiento durante 3años, con 2 previos de inclusión.
- c)
No existe información en la literatura del SHO sobre la incidencia de episodios cardiovasculares/año o su modificación con tratamiento.
- d)
El diseño con 2 cohortes en paralelo.
- e)
No existía referencia en la literatura sobre la prevalencia de SAHS grave (IAH>30) en pacientes con SHO (ver Anexo 8).
Financiación: Instituto de Salud Carlos III (Fondo de Investigaciones Sanitarias, Ministerio de Sanidad y Consumo) PI050402, Sociedad Española de Neumología y Cirugía Torácica 2005 (SEPAR) y Air Liquide España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Vanessa Iglesias por su asistencia técnica.
Estefanía García-Ledesma, MD
Maria L. Alonso, MD, PhD
Teresa Gómez-García, MD
Ángeles Martínez, MD
Olga Cantalejo
Elena Ojeda, MD
Santiago J. Carrizo, MD, PhD
Begoña Gallego, MD, PhD
Odile Romero, MD
Mercedes Pallero, MD
Jesús Muñoz-Méndez, MD, PhD
Cristina Senent, MD
José N Sancho-Chust, MD
Erika Miranda
Francisco Rivas, MD
Laura Cancelo, MD
Desde el Comité Directivo del «Proyecto Integrado de Investigación» (PII) de Sueño de la SEPAR se encargó al Dr. Juan Fernando Masa iniciar el proyecto Pickwick, que agruparía investigación clínica y básica para dar respuesta más integral a los interrogantes que planteaba esta creciente enfermedad.
El Dr. Juan Fernando Masa contactó con miembros del área de sueño, ventilación no invasiva y cuidados críticos para proponer la realización del estudio a grupos interesados con el perfil de experiencia de al menos 3años en el tratamiento con VNI y CPAP y la práctica habitual de PSG. Se discutieron versiones sucesivas del protocolo en 3 reuniones consecutivas del PII de sueño aprovechando las reuniones de invierno y SEPAR, y en continuos contactos por email entre investigadores. En 2008 se aprobó la versión definitiva del protocolo. Se solicitaron ayudas para la financiación, obteniéndose finalmente de SEPAR, Fondo de Investigaciones Sanitarias (FIS) y Air Liquide. Se desarrollaron las herramientas necesarias para llevar a cabo el estudio multicéntrico: 1)cuaderno de recogida de datos; 2)base de datos electrónica alojada en una web con dominio específico del proyecto; 3)cuaderno de procedimientos para explicar paso a paso el desarrollo del proyecto así como disponer de todos los cuestionarios y procedimientos para estandarizar el trabajo entre centros, y 4)una auditoría externa para la comparación trimestral de las variables operativas entre grupos (abandonos por causa médica y mortalidad), de las cuales dependería la continuidad del estudio.
En el año 2009 comenzó la inclusión de pacientes en los centros participantes, que se incluyen en el Anexo 3.
Se establecieron a priori las siguientes acciones: 1)newsletters mensuales del investigador principal al resto de investigadores con el objetivo de informar sobre la evolución comparativa entre centros y favorecer la inclusión además de informar puntualmente de eventualidades; 2)reuniones de investigadores aprovechando los congresos de SEPAR y reunión de invierno, y 3)política de publicaciones con una previsión del número de publicaciones y las autorías en función del número de pacientes incluidos (Anexo 4).
- •
Hospital San Pedro de Alcántara, Cáceres (coordinador)
- •
Hospital San Pablo, Barcelona
- •
Hospital General Yagüe, Burgos
- •
Hospital Arnau de Vilanova, Lérida
- •
Hospital Xeral-Calde, Lugo
- •
Hospital 12 de Octubre, Madrid
- •
Hospital La Paz, Madrid
- •
Fundación Jiménez-Díaz, Madrid
- •
Hospital Gregorio Marañón, Madrid
- •
Hospital Valdecilla, Santander
- •
Hospital San Juan, Alicante
- •
Hospital Virgen del Rocío, Sevilla
- •
Hospital Txagorritxu, Vitoria
- •
Hospital Miguel Servet, Zaragoza
- •
Hospital Virgen de la Macarena, Sevilla
La previsión al final del proyecto es de al menos 6 publicaciones, por lo que las autorías se planificaran en función del porcentaje de pacientes incluidos en cada una de ellas, con el siguiente esquema:
- -
Centros que al menos hayan incluido el 10% de la muestra tendrán derecho a 3 autores: 2 en la cabecera y uno en el grupo cooperativo. El orden se establecerá de acuerdo al valor del porcentaje de incluidos.
- -
Centros que al menos hayan incluido el 5% de la muestra tendrán derecho a 3 autores: uno en la cabecera y 2 en el grupo cooperativo. El orden se establecerá de acuerdo al valor del porcentaje de incluidos.
- -
Centros que hayan incluido pacientes con un porcentaje menor de 5 tendrán derecho a un autor en el grupo cooperativo. El orden se establecerá de acuerdo al valor del porcentaje de incluidos.
Previa a la aleatorización se realizaron pruebas de tolerancia con CPAP y VNI. Con el paciente sentado, se ajustó un ventilador en modo CPAP con una presión de 7cmH2O durante 15min. Después el ventilador se cambió a modo BIPAP con respiración espontánea, estableciendo la misma CPAP y con una presión espiratoria positiva de la vía aérea (EPAP) de 16cmH2O durante otros 15min. Se excluyeron los pacientes que no pudieron adaptarse a la ventilación, según criterio del investigador. Una vez aleatorizados, estuvimos el tiempo necesario con el paciente para priorizar la adaptación y explicar lo siguiente: 1)información amplia sobre las características de su enfermedad, el tratamiento con VNI, CPAP o modificaciones en el estilo de vida y la importancia de un seguimiento adecuado; 2)explicación sobre las modificaciones en el estilo de vida, los dispositivos de CPAP o VNI, las características de mascarillas y fijación, y 3)los beneficios a corto y largo plazo de los tratamientos y las consecuencias sobre la vida diaria.
Utilizamos las recomendaciones de la Academia Americana de Sueño (AASM) para la configuración, los filtros y la señal de la muestra a estudio. Las variables neurológicas fueron electroencefalograma, electrooculograma y electromiograma (en barbilla y ambas piernas). El flujo se obtuvo por cánula nasal y termistor para las PSG sin tratamiento mecánico y con flujos de CPAP o ventilador para las PSG con tratamiento de CPAP o VNI. Los movimientos toracoabdominales se midieron por bandas piezoeléctrícas o inductancia. La saturación se midió con pulsioxímetro (el tiempo medio entre centros fue de 2-4s). El electrocardiograma y la posición corporal también se registraron. Los estudios polisomnográficos se analizaron manualmente por cada centro participante de acuerdo a las recomendaciones de la AASM2007, y el análisis del sueño, siguiendo las recomendaciones del grupo español de sueño (GES).
La apnea se definió como la ausencia de flujo de aire (reducción ≥90%) durante ≥10s y la hipoapnea como una reducción de flujo de aire (≥30% y ≤90%) de una duración de al menos 10s con una caída en saturación de oxígeno ≥3% o asociado a un arousal.
Mientras el paciente estaba despierto, se puso presión positiva espiratoria (EPAP) entre 4 y 8cmH2O y presión positiva inspiratoria (IPAP) entre 18 y 22cmH2O (EPAP incluida). Las presiones se ajustaron para obtener una saturación de oxígeno normal, si era posible, medida por pulsioximetría y tolerancia del paciente. La frecuencia respiratoria se ajustó a 12-15 respiraciones por minuto y el volumen se fijó en 5-6ml/kg del peso real, permitiendo que el respirador aumentara la presión máxima sobre la IPAP fija si fuese necesario. Se realizó una verificación de las fases de la ventilación mecánica (inicio, presurización y final) para evitar asincronías y afinar el ajuste. Tras 30min de uso continuo con el paciente adaptado y con una adecuada interacción paciente-ventilador, se realizó una gasometría arterial basal. La PaCO2 se utilizó para ajustar los parámetros del ventilador. El ajuste final se realizó mediante PSG convencional, aumentando la EPAP si aparecían apneas y la EPAP si aparecían hipoapneas, limitación al flujo, ronquidos o hipoventilación no apneica hasta alcanzar la normalización de la saturación de oxígeno o la presión óptima tolerada. No se hicieron cambios en el volumen asegurado durante esta valoración nocturna.
Se añadió terapia de oxígeno si el PaO2 diurna fue <55mm hg18 con el flujo necesario para mantener SaO2 en vigilia entre el 88 y el 92% o PaO2≥55mmHg durante al menos 17h/día. En los pacientes que necesitaron oxígeno se realizó un nuevo análisis gasométrico después de 20min de tratamiento con oxígeno. Se suspendió el tratamiento con oxígeno si aumentó la PaCO2 a ≥5mmHg o si el pH alcanzó <7,35.
Una dificultad es la necesidad de una muestra amplia y, por ende, la necesidad de enrolar a un número alto de centros, lo que dificulta la realización y la coordinación. Sin embargo, la mayoría de centros hemos trabajado juntos en varios estudios multicéntricos y el centro coordinador tiene experiencia en la coordinación de estudios similares.
Otra dificultad radica en el seguimiento de 3años, con 2 previos de inclusión. También el equipo investigador tiene experiencia en estudios de 3años de seguimiento.
Una limitación es que no existe información en la literatura en el SHO sobre la incidencia de episodios cardiovasculares/año o su modificación con tratamiento, así como tampoco sobre un eventual descenso de la presión arterial. En consecuencia, el cálculo muestral no se ha ajustado a estas variables. Pensamos que la muestra puede ser suficiente, pero en caso de no encontrar diferencias estadísticas intergrupos no se podría descartar que estas diferencias puedan existir con un tamaño muestral mayor.
La mortalidad y el porcentaje de abandonos por razones médicas son variables operativas para el desarrollo del estudio. No obstante, se analizarán también en la evaluación final. La muestra permite detectar diferencias intergrupo de ≥12% en la muestra completa y ≥20% con un 30% de la muestra. A nuestro juicio la muestra es suficiente para detectar diferencias clínicamente relevantes.
El diseño es también otra complejidad. Dado que los pacientes son SAHS grave no podrían prescindir de tratamiento (CPAP o VNI) durante un largo plazo, la aleatorización tuvo que hacerse una vez separados los pacientes con SHO en SAHS grave y no grave. Esto lleva a 2 aleatorizaciones separadas pero permite estudiar 2 cohortes en paralelo con análisis independientes.
Otra limitación en el cálculo de la muestra fue que no existía referencia en la literatura sobre la prevalencia de SAHS grave (IAH>30) en pacientes con SHO. Por tanto, el equipo investigador estimó, en base a los otros datos disponibles y a la propia experiencia, que la prevalencia sería cercana al 40%. La realidad ha demostrado que esta es de alrededor del 26%, lo que ha producido que la cohorte con ausencia de SAHS tenga un número de pacientes claramente inferior a la cohorte de SAHS. Por tanto, los investigadores han decidido cerrar la inclusión en la cohorte SAHS y seguir incluyendo pacientes en la cohorte con ausencia de SAHS hasta el final de los 3años de seguimiento.