Se cree que la lesión pulmonar inducida por el oxígeno conduce al desarrollo de una displasia broncopulmonar en los recién nacidos prematuros. Hemos evaluado los efectos favorables del aceite de Nigella sativa (NSO) en ratas con lesión pulmonar inducida por hiperoxia.
MétodosSe utilizaron 30 ratas Sprague-Dawley recién nacidas a las que se dividió aleatoriamente en 3 grupos para aplicarles hiperoxia (O2 al 95%), hiperoxia+NSO o el grupo de control (O2 al 21%). A las crías del grupo de hiperoxia+NSO se les administró NSO a una dosis de 4ml/kg al día por vía intraperitoneal durante el periodo de estudio. Se realizó una evaluación histopatológica, inmunoquímica y bioquímica (superóxido dismutasa [SOD], glutatión peroxidasa [GSH-Px], malonilaldehído [MDA] y mieloperoxidasa [MPO]).
ResultadosEn la evaluación histopatológica e inmunoquímica, la gravedad de la lesión pulmonar fue significativamente inferior en el grupo de hiperoxia+NOS (p<0,05). Los niveles tisulares de GSH-Px y SOD se mantuvieron significativamente preservados, y los niveles de MDA y MPO fueron significativamente inferiores en el grupo de hiperoxia+NSO (p<0,05).
ConclusiónEl NSO redujo significativamente la gravedad de la lesión pulmonar debida a la hiperoxia.
Oxygen-induced lung injury is believed to lead to the development of bronchopulmonary dysplasia in premature infants. We have evaluated the beneficial effects of Nigella sativa oil (NSO) on rats with hyperoxia-induced lung injury.
MethodsThirty newborn Sprague-Dawley rats were randomly divided into 3 groups as hyperoxia (95% O2), hyperoxia+NSO and control (21% O2). Pups in the hyperoxia+NSO group were administered intraperitoneal NSO at a dose of 4ml/kg daily during the study period. Histopathologic, immunochemical, and biochemical evaluations (superoxide dismutase [SOD], glutathione peroxidase [GSH-Px], malonaldehyde [MDA] and myeloperoxidase [MPO]) were performed.
ResultsIn the histopathologic and immunochemical evaluation, severity of lung damage was significantly lower in the hyperoxia+NOS group (P<.05). Tissue GSH-Px and SOD levels were significantly preserved, and MDA, MPO levels were significantly lower in the hyperoxia+NSO group (P<.05).
ConclusionNSO significantly reduced the severity of lung damage due to hyperoxia.
La displasia broncopulmonar (DBP) es una enfermedad pulmonar crónica que se produce en los recién nacidos prematuros que han necesitado ventilación mecánica y oxigenoterapia por un distrés respiratorio agudo1,2. Aunque su etiopatogenia no se conoce por completo, se cree que es multifactorial, con influencia de la prematuridad, la lesión pulmonar oxidativa y la inflamación, como la corioamnionitis, la hiperoxia, la infección, la lesión inducida por respirador y otros muchos estímulos adversos. La lesión altera el crecimiento y la maduración normales del pulmón a causa de un deterioro del crecimiento alveolar y vascular, y da lugar a la estructura pulmonar anormal de la DBP2-4. Esto fue descrito por primera vez hace más de 40 años, pero la naturaleza de la DBP se ha modificado a causa del uso creciente de corticoides prenatales, tratamiento con surfactante, nuevas estrategias ventilatorias y otros tratamientos5,6. No obstante, la DBP continúa siendo una causa importante de morbilidad y mortalidad neonatales, ya que la mejora de la asistencia perinatal ha llevado a un aumento de la supervivencia de recién nacidos con prematuridad extrema (< 28 semanas de gestación)2,4,7. Estos niños tienen, pues, un riesgo elevado de padecer lesiones a largo plazo en el pulmón, debido al deterioro significativo de la función pulmonar que se produce con el empleo prolongado de respiradores durante las estancias en unidades de cuidados intensivos neonatales. Tras el alta, estos niños pueden tener también hospitalizaciones frecuentes, exacerbaciones respiratorias recurrentes, intolerancia al ejercicio y otros signos de enfermedad cardiorrespiratoria tardía, además de una evolución del neurodesarrollo adversa4. Los estudios clínicos y de laboratorio sugieren que las estrategias de intervención temprana que preservan directamente la supervivencia y la función de las células pulmonares debieran prevenir la aparición de la DBP3,7. Sin embargo, continuamos sin disponer de tratamientos que puedan atenuar de manera efectiva la lesión pulmonar y fomentar el crecimiento del pulmón para reducir la incidencia y la gravedad de la DBP. En consecuencia, es necesario identificar nuevas opciones de tratamiento para la prevención de la lesión pulmonar grave en el curso de la DBP.
La planta Nigella sativa (NS), a la que se denomina comúnmente «semilla negra», se emplea como planta medicinal en el tratamiento de muchas enfermedades8. En estudios clínicos y experimentales se han descrito varios efectos terapéuticos de la NS y sus extractos en enfermedades respiratorias9-12. Se ha identificado un enriquecimiento de muchas moléculas bioactivas en los extractos de NS, tanto en aceites fijos como en aceites esenciales. Se ha demostrado que gran parte de la actividad biológica de la NS se debe a la timoquinona, que es el componente principal del aceite esencial y del aceite fijo8. Se ha observado que el aceite volátil contiene un 18,4-24% de timoquinona y también un 46% de monoterpenos (p. ej., p-cimeno, a-pineno)13. Múltiples investigaciones han identificado que el extracto de NS tiene propiedades antiinflamatorias y antimicrobianas (frente a diversos gérmenes) y propiedades antioxidantes debidas a su actividad de eliminación de radicales libres14. Además, se ha podido determinar su acción inhibidora de la elastasa de los neutrófilos humanos15 y sus acciones inmunomoduladoras y citoprotectoras en diversos sistemas corporales con un bajo grado de toxicidad en estudios clínicos y experimentales8,16. Sin embargo, los efectos del aceite de NS (NSO) sobre los pulmones que han sufrido una lesión hiperóxica no han sido investigados hasta el momento. El objetivo de este estudio fue, pues, investigar los efectos favorables del NSO en los pulmones de crías de ratas con una DBP inducida mediante hiperoxia.
Material y métodosDiseño experimentalSe obtuvo la aprobación del Comité Ético de estudios en animales de experimentación de la GATA Military School of Medicine (Ankara, Turquía). Se siguió la guía del National Research Council para el cuidado y uso de animales de laboratorio. Se utilizaron 4 ratas Sprague-Dawley preñadas que dieron a luz espontáneamente. A continuación se juntaron todas las crías, se distribuyeron aleatoriamente y se retornaron a las ratas madres. Se utilizaron 30 crías recién nacidas que se distribuyeron en los 3 grupos siguientes: control, hiperoxia e hiperoxia con tratamiento de NSO. Las crías del grupo de hiperoxia fueron expuestas a O2 al 95%, mientras que las crías del grupo control respiraron aire ambiental con un 21% de O2. En las madres se aplicó una rotación entre las camadas expuestas a hiperoxia y a aire ambiental cada 24h, con objeto de evitar en ellas la toxicidad del oxígeno. Se obtuvo una exposición continua a O2 al 95% en una cámara de plexiglás (70×60×30cm) mediante el empleo de un sistema de flujo continuo. El nivel de oxígeno en el interior de la cámara de plexiglás fue monitorizado de forma continua con un analizador de oxígeno Ceramatec (MAXO2) para mantener una saturación de O2 ≥95%. A las crías experimentales del grupo de control (aire ambiental con 21% de O2 durante 10 días+placebo) y a las de hiperoxia sola (O2 al 95% durante 10 días+placebo) se les administró una solución salina (4ml/kg) por vía intraperitoneal, mientras que a las crías del grupo de hiperoxia+NSO (O2 al 95% durante 10 días+NSO) se les administró NSO (Origo [aceite de semilla de Nigella sativa natural al 100%], Gaziantep, Turquía) a una dosis de 4ml/kg17 una vez al día con una microjeringa por vía intraperitoneal, desde el primero hasta el último día del estudio. Antes de la administración, el NSO se esterilizó mediante filtrado con el empleo de filtros Bexen 0,2μm (Oiarso S. Coop., Gipuzkoa, España). Se ha demostrado que los diferentes compuestos presentes en el NSO actúan de manera sinérgica, y ello sugiere la importancia de utilizar el aceite completo de las semillas en los estudios. Así pues, en este estudio utilizamos el aceite completo8. Se pesaron las crías diariamente con una balanza con sensibilidad de 0,01g y se registraron los pesos obtenidos.
Análisis histopatológico, morfológico e inmunoquímico de los pulmonesTodas las crías fueron sacrificadas al 10.° día del estudio bajo anestesia profunda con quetamina-xilazina (100-10mg/kg) por vía intraperitoneal. Se abrió el tórax, se extrajeron los pulmones y se fijaron mediante perfusión de paraformaldehído (PFA) al 4% tamponado con fosfato 0,1M (PBS). Durante la perfusión se mantuvo una presión de insuflación constante de 5cmH2O mediante un catéter traqueal. Al completar la perfusión se ligó la tráquea con una sutura quirúrgica y se incubaron los pulmones en solución al 4% de PFA-PBS en fresco, con hielo durante 4-5h. Tras esta incubación, la solución de PFA-PBS se reemplazó con dos cambios rápidos de PBS frío para eliminar los restos exteriores. A continuación se transfirieron los pulmones a una solución de PBS/sacarosa al 30% estéril y filtrada, y se mantuvieron a 4°C hasta el equilibrado total. Se incluyeron los pulmones en parafina y se realizaron cortes de 5μm de los bloques de parafina. Se seleccionaron cortes utilizando un procedimiento de muestreo aleatorio sistemático, y se montaron en portaobjetos con recubrimiento de poli-L-lisina (portaobjetos de adhesión Histobond, Marienfeld, Alemania). Se tiñeron los portaobjetos con técnicas estándar de hematoxilina-eosina y tricrómico de Masson para el examen histopatológico y con la técnica ABC para la proteína de membrana de cuerpos laminares.
Para la detección inmunohistoquímica de la proteína de membrana de cuerpos laminares, los cortes se sometieron a una rehidratación, seguida de un tratamiento con peróxido de hidrógeno al 3% durante 30min. A continuación se sometieron los cortes a un bloqueo inespecífico con suero de cabra durante 30min, y luego se incubaron con anticuerpos primarios contra proteína de membrana de cuerpos laminares (1:100, Chemicon, AB3623-rabbit, EE.UU.) durante una noche a 4°C, seguido de un tratamiento con anticuerpo secundario anti-conejo biotinilado (1:200, Vector Laboratories, Peterborough, Reino Unido) durante 30min a temperatura ambiente. Después del tratamiento con el complejo de avidina-biotina, se utilizó 3, 3′-diaminobenzidina (DAB; Vector Laboratories, Peterborough, Reino Unido) para el revelado del color. Se incluyeron también preparaciones de control negativo, en las que se omitió el anticuerpo primario. Los cortes de tejido se examinaron con el empleo de microscopia óptica con acoplamiento de una cámara digital. Las células positivas para cuerpos laminares (células de tipo II) del área alveolar se contaron 5 veces en 10 cortes separados entre sí por 25μm en cada animal. Los datos se presentaron en forma de número de células positivas para cuerpos laminares (células tipo II)/mm2.
El examen histopatológico y la puntuación inmunohistoquímica los llevó a cabo, con un diseño ciego, un anatomopatólogo experimentado que no conocía el grupo de tratamiento al que correspondía cada muestra. La puntuación histopatológica se estableció con los siguientes grados: grado 1, histología normal; grado 2, infiltración leucocitaria moderada; grado 3, infiltración leucocitaria, edema y destrucción parcial; y grado 4, destrucción total del tejido.
Se evaluó también en los cortes el recuento alveolar radial mediante las imágenes digitales, con objeto de evaluar el desarrollo alveolar. De forma resumida, se trazaba una línea superpuesta desde un centro de un bronquiolo respiratorio hasta el tabique de tejido conjuntivo más próximo en ángulos rectos con el epitelio, y se contaba el número de tabiques alveolares que cortaba esa línea en 3-4 cortes de cada animal18. Se obtenían los cocientes de área subepitelial y epitelial, que reflejan la infiltración celular y la fibrosis, mediante una evaluación morfométrica de los tejidos pulmonares con la ayuda de un programa informático (Scion Image, 4.0.3) utilizando un método previo modificado19. Para este fin se seleccionaron vías aéreas transversales (>100μm) de cortes teñidos con tricrómico de Masson y se trazaron los perímetros interiores del epitelio, los perímetros de la membrana basal y los perímetros exteriores de la adventicia, con la ayuda de un programa informático (Scion Image, 4.0.3), y se calcularon las áreas de estos cortes delimitados para evaluar los cocientes de área subepitelial y epitelial.
Análisis bioquímicoSe realizó un análisis bioquímico de la actividad de malonaldehído (MDA), mieloperoxidasa (MPO), superóxido dismutasa (SOD) y glutatión peroxidasa (GSH-Px) en los tejidos del pulmón izquierdo de los grupos de estudio. Los tejidos pulmonares obtenidos se perfundieron con solución salina fisiológica antes de la homogeneización para eliminar la sangre residual. Se homogeneizaron los tejidos en solución salina fisiológica (1g en 5ml) con el empleo de un homogeneizador (IKA T18 basic Ultra-turrax, Alemania) y se centrifugaron a 4.000 × g durante 20min (NF 800 R Nüve). Se separaron los sobrenadantes claros para utilizarlos en el análisis. Las determinaciones se realizaron con un espectrofotómetro (UV Shimadzu 1700, Japón). Las determinaciones de proteína se llevaron a cabo con el método de Lowry20.
Determinación de las actividades de superóxido dismutasaSe determinaron las actividades de SOD total (Cu, Zn, Mn) con el método de Sun et al.21. El principio de este método se basa en la inhibición de la reducción de nitroazul tetrazolio por el sistema de la xantina-xantina oxidasa como generador de superóxido. La actividad de la SOD se expresa en forma de U/mg de proteína.
Determinación de la actividad de glutatión peroxidasaLa actividad de glutatión peroxidasa se determinó con el método de Paglia et al.22. La reacción enzimática en el tubo, con contenido de NADPH, glutatión reducido (GSH), azida sódica y glutatión reductasa, se inició con la adición de H2O2 y se monitorizó el cambio de la absorbancia a 340nm. La actividad de GSH-Px se expresa en U/g de proteína.
Determinación de los niveles de malonilaldehídoLos niveles de MDA en el tejido se determinaron con el método de Draper y Hadley basado en la reacción del MDA con ácido tiobarbitúrico (TBA) a 95°C23. En la reacción de TBA, el MDA y el TBA reaccionan para formar un pigmento rosa con una absorción máxima en 532nm. La reacción se realizó a un pH de 2-3 y a 95°C durante 15min. La muestra se mezcló con 2,5 volúmenes de ácido tricloroacético al 10% (peso/volumen) para precipitar la proteína. El precipitado se separó mediante centrifugación y el sobrenadante se hizo reaccionar con TBA al 0,67% al baño María durante 15min. Tras el enfriamiento, se efectuó la lectura de la absorbancia a 532nm (Shimadzu UV-1700, Japón). Los valores arbitrarios obtenidos se compararon con una serie de soluciones estándar de referencia (1,1,3,3-tetrametoxipropano). Los resultados se expresaron en forma de nmol/mg de tejido.
Determinación de la actividad de mieloperoxidasaLa actividad de mieloperoxidasa se determinó con el método basado en el principio de que un homogeneizado que contenga actividad de MPO reduce el dihidrocloruro de o-dianisidina en presencia de H2O2, y este producto reducido tiene absorción a 460nm. La actividad de MPO se calculó con el empleo del cociente de extinción de o-dianisidina. Los resultados se expresaron en unidades por gramo de tejido húmedo (U/g)24.
Análisis estadísticoPara el análisis estadístico se utilizó el programa SPSS (v15.0, IL, EE.UU.). Se examinaron las distribuciones normales de los datos gráficamente con la prueba de Shapiro-Wilk. Las comparaciones de las variables numéricas se realizaron mediante un ANOVA con corrección de Bonferoni. Las variables discretas se compararon con una prueba de χ2. Se consideraron estadísticamente significativas las diferencias con un valor de p<0,05. Los datos se expresaron en forma de media±desviación estándar (DE). Se realizó un análisis de la potencia estadística. Si se tomaba un valor de magnitud del efecto de 0,60 y un error alfa de 0,05 y un error beta de 0,20, para obtener una potencia estadística del 80% se observó que eran suficientes 10 animales en cada grupo.
ResultadosAl final del experimento, 3 crías de rata del grupo de hiperoxia y una del grupo de hiperoxia+NSO habían muerto. Sin embargo, no hubo diferencias significativas entre los 2 grupos en cuanto a la tasa de supervivencia (p>0,05). Además, la media de peso al nacer de las crías de los grupos de estudio era de 4,9±0,4g en el grupo control, de 5,0±0,3g en el grupo de hiperoxia, y de 5,1±0,2g en el grupo de hiperoxia+NSO. No se observaron diferencias significativas entre los 3 grupos en cuanto al peso al nacer (p>0,05). Al final del estudio, la media de peso corporal de las crías del grupo de control era de 16,9±1,5g, pero la media de peso corporal era de 13,7±1,3g y de 11,1±0,8g en los grupos de hiperoxia+NSO y de hiperoxia, respectivamente, y la media de peso corporal de las crías del grupo de hiperoxia+NSO fue significativamente superior a la de las crías del grupo de hiperoxia (p<0,05).
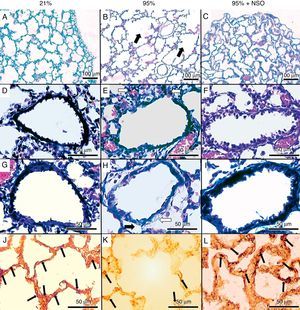
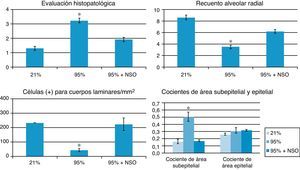
La gravedad de la lesión pulmonar encontrada fue de grado 1 a grado 4 en la evaluación histopatológica (fig. 1A-C y fig. 2). No se observó un engrosamiento de los tabiques alveolares ni un infiltrado celular en los grupos de O2 al 95%+NSO y de O2 al 21%. Se identificaron cambios significativos en el grado histológico y una mejora en el grupo de O2 al 95%+NSO en comparación con el grupo de O2 al 95% solo (p<0,05). Así pues, hubo una lesión pulmonar menos grave en las crías tratadas con NSO (fig. 1A-C). El recuento alveolar radial mostró también una recuperación después del tratamiento con NSO (fig. 2), que se refleja en un mayor número de alvéolos intactos en este grupo, con recuentos alveolares radiales significativamente superiores a los observados en el grupo de O2 al 95% no tratado (p<0,05). Además, observamos también una mejor densidad de proteína de membrana de cuerpos laminares en el grupo de NSO (p<0,05). El cociente de área subepitelial puso de manifiesto la fibrosis y el edema en el grupo de O2 al 95%, y este engrosamiento se recuperó con el tratamiento de NSO (p<0,05). El epitelio de los bronquiolos intactos de los 3 grupos no presentaba diferencias histológicas, y el cociente de área epitelial no mostró cambios significativos (p>0,05).
Tinción de hematoxilina-eosina (A-C, aumento original 100×), tinción de tricrómico de Masson (D-I, aumento original 400×) e inmunohistoquímica para proteína de membrana de cuerpos laminares (J-L, aumento original 400×). Puede observarse una destrucción parcial del tejido pulmonar (panel B, flechas negras), infiltración celular (panel E, flechas blancas), edema (flecha negra) y fibrosis (flecha blanca) (panel H) en el grupo de O2 al 95%, que no se observan de manera apreciable en los grupos de O2 al 21% ni de O2 al 95%+NSO. En los paneles J-L se muestra la inmunohistoquímica para la proteína de membrana de cuerpos laminares en cada grupo.
Histograma de la evaluación histopatológica, recuento alveolar radial, cocientes de área subepitelial/epitelial y recuentos de proteína de membrana de cuerpos laminares (células positivas para cuerpos laminares/mm2) en cada grupo. El asterisco (*) indica cambios significativos (p<0,05) en comparación con los grupos de O2 al 21% y de O2 al 95%+NSO.
El análisis bioquímico se realizó en muestras del tejido pulmonar obtenido de los grupos de estudio. Los niveles de GSH-Px y SOD en los tejidos fueron significativamente mayores en el grupo de hiperoxia+NSO que en el grupo de hiperoxia, y ello determinaba una disminución del estrés oxidativo (p<0,05) (tabla 1). Sin embargo, los niveles de MDA y MPO en los tejidos del grupo de hiperoxia+NSO fueron significativamente inferiores a los del grupo de hiperoxia, lo cual indicaba una disminución de la peroxidación lipídica debida a especies de oxígeno reactivo (ROS) y una reducción de la infiltración de neutrófilos/inflamación con el tratamiento de NSO (tabla 1). Por otro lado, los niveles de MDA y MPO del grupo de control continuaban siendo inferiores a los del grupo de hiperoxia+NSO, además de los niveles más altos de GSH-Px y SOD (p<0,05) (tabla 1).
Niveles tisulares de malonilaldehído (MDA), mieloperoxidasa (MPO), superóxido dismutasa (SOD) y glutatión peroxidasa (GSH-Px) en los grupos de estudio
| Variables | Control(n=10)Media±DE | Hiperoxia(n=7)Media±DE | Hiperoxia+NOS(n=9)Media±DE | p |
| MDA (nmol/g de proteína) | 25,10±2,9 | 86,75±6,2 | 46,06±7,8 | 0,001* |
| SOD (U/mg de proteína) | 107,44±10,4 | 58,67±7,6 | 84,70±7,30 | 0,002* |
| GSH-Px (U/mg de proteína) | 12,72±1,61 | 4,45±0,92 | 9,06±0,97 | 0,001* |
| MPO (U/g de proteína) | 26,17±2,8 | 73,30±9,3 | 52,19±5,9 | < 0,01* |
En el presente estudio hemos evaluado los efectos favorables del NSO sobre crías de rata con una DBP inducida mediante hiperoxia. Nuestros resultados pusieron de relieve que la administración de NSO redujo la lesión histopatológica pulmonar y preservó las células pulmonares, y el análisis bioquímico identificó un aumento de las actividades antioxidantes, una disminución del nivel oxidante y una reducción de la peroxidación lipídica y la infiltración de neutrófilos-inflamación en los tejidos pulmonares dañados por la hiperoxia. Que nosotros sepamos, este es el primer estudio en el que se examinan los efectos del NSO en un modelo experimental de la DBP en la rata.
La DBP tiene una patogenia compleja e insuficientemente conocida. Además de la inmadurez de los pulmones, se ha sugerido que los efectos de la lesión oxidativa que causa la generación de especies moleculares ROS desempeña un papel crucial en la patogenia de la DBP1-4,25-27. Las ROS son producidas por el metabolismo celular del oxígeno molecular y la activación de neutrófilos y macrófagos en el pulmón. Las ROS causan un estrés oxidativo mediante la oxidación de lípidos, proteínas y ADN28. En consecuencia, las ROS pueden producir una lesión del tejido que conduce a las alteraciones anatomopatológicas que se observan en los recién nacidos con DBP25. Además, los recién nacidos pretérmino muestran una vulnerabilidad exclusiva al estrés oxidativo, a causa de las altas concentraciones de oxígeno adicional que se dan con el apoyo respiratorio, como consecuencia del sistema antioxidante inadecuado e inmaduro existente al nacer, así como del deterioro de la regulación de aumento en respuesta al estrés oxidativo. En consecuencia, el recién nacido prematuro presenta un aumento del riesgo de desarrollar una lesión pulmonar inducida por ROS26,29. Las enzimas antioxidantes como SOD y GSH-Px son importantes para la eliminación de las ROS26. Se ha sugerido que los niveles de SOD y GSH-Px en los tejidos pueden reflejar los niveles de ROS30,31. Además, la MDA, que es un indicador fiable de la peroxidación lipídica y el estrés oxidativo en los tejidos, es el producto de degradación originado por la oxidación de los ácidos grasos poliinsaturados por la acción de las ROS32. En consecuencia, las ROS pueden evaluarse indirectamente con la determinación de la MDA y los niveles de algunas enzimas antioxidantes como la SOD o bien GSH-Px en los tejidos30-32.
Nigella sativa y el aceite obtenido de ella son reservorios de diferentes compuestos bioactivos, y se ha demostrado que reducen la lesión tisular gracias a sus actividades antioxidantes, sobre todo al reducir el estrés oxidativo a través de su actividad de eliminación de radicales8,33. Además, se ha observado que el NSO potencia la actividad de enzimas antioxidantes como GSH-PX y SOD, y reduce la peroxidación lipídica de las membranas biológicas gracias a sus propiedades antioxidantes y de eliminación de ROS33. En el presente estudio hemos demostrado que el aumento de los niveles de MDA, además de la reducción de los niveles de GSH-PX y SOD, indicaba y respaldaba la lesión pulmonar y la peroxidación lipídica inducida por ROS en los pulmones de las ratas sometidas a hiperoxia. Sin embargo, el tratamiento con NSO produjo una disminución de los niveles de MDA, además de un aumento de los niveles de GSH-PX y SOD en las crías de rata sometidas a hiperoxia. Estos datos establecen que el tratamiento con NSO reduce el estrés oxidativo y la peroxidación lipídica, y potencia las enzimas antioxidantes endógenas durante el proceso de hiperoxia en el pulmón.
Se cree que la inflamación desempeña un papel central en la patogenia de la DBP. El recién nacido prematuro tiene una prevalencia elevada de trastornos inflamatorios como la corioamnionitis en el periodo neonatal1-4,25. Además, la hiperoxia puede afectar también a la morfogénesis debido a sus efectos quimiotácticos sobre células inflamatorias como neutrófilos y macrófagos. Los neutrófilos y macrófagos producen un aumento de la respuesta inflamatoria frente a la exposición a oxígeno, así como una liberación de ROS en el lugar de inflamación, con la consiguiente lesión del pulmón. Además, la evidencia existente sugiere que la lesión pulmonar de la DBP se asocia a un aumento del contenido de neutrófilos y de quimiocinas procedentes de estos en el pulmón25. Por consiguiente, el número de neutrófilos aumenta de manera persistente tanto en el intersticio como en los espacios aéreos de los pulmones de los recién nacidos con DBP, y la inhibición de la entrada de neutrófilos en el pulmón hiperóxico potencia el crecimiento pulmonar posnatal34,35. Sin embargo, muchos estudios han identificado que el NSO inhibe las respuestas pulmonares inflamatorias, la infiltración celular inflamatoria peribronquial, alveolar y de los tabiques alveolares con neutrófilos y macrófagos, y tiene efectos inmunomoduladores sobre estas células, además de propiedades antimicrobianas frente a diferentes patógenos8,10-12,16,17,33. Otro factor importante que se ha sugerido que puede contribuir a producir el daño pulmonar es la elastasa neutrofílica humana (HNE). Se ha descrito que la HNE desempeña un papel importante en el proceso proteolítico extracelular y es capaz de fragmentar muchas proteínas importantes como la elastina, una proteína crucial de la matriz extracelular en el pulmón. Sin embargo, se han demostrado efectos inhibidores de la NS sobre la actividad de la HNE, que se cree que es un agente antielastasa natural que actúa sobre la HNE15. Además, se ha establecido que la enzima MPO es específica para los lisosomas de los neutrófilos36. Así pues, la evaluación de la migración e infiltración neutrofílica en el pulmón puede efectuarse de manera indirecta determinando la actividad de MPO en esos tejidos34-37. En el presente estudio, el aumento de la actividad de MPO indicó que la entrada de neutrófilos en el pulmón podría desempeñar un papel central en la lesión pulmonar inducida por la hiperoxia. Sin embargo, nuestros datos pusieron de manifiesto que la actividad de MPO en el pulmón se redujo con el tratamiento de NSO durante la lesión hiperóxica. En consecuencia, los resultados obtenidos sugieren que el NSO posee propiedades antiinflamatorias y previno la activación de los neutrófilos además de producir acciones antioxidantes en las crías de rata sometidas a hiperoxia.
En el presente estudio la lesión pulmonar, de manera similar a lo observado en los niños recién nacidos con DBP, fue inducida por la hiperoxia prolongada y mostró alteraciones anatomopatológicas en los tejidos pulmonares en desarrollo, que incluyeron lo siguiente: a) disminución de la alveolarización, evidenciada por una disminución del recuento alveolar radial (RAC) y un engrosamiento de los tabiques alveolares; b) disminución del patrón de expresión de cuerpos laminares, que indica una lesión pulmonar grave a través de la reducción del recuento de células de tipo II que contienen cuerpos laminares, y c) aumento significativo de la fibrosis, que es una de las principales características histopatológicas de la lesión pulmonar en la DBP4,25,37-40. Sin embargo, nuestros resultados indicaron el aumento del RAC y la disminución del grosor de los tabiques alveolares, la reducción de la fibrosis, así como la mejora de la densidad del patrón de tinción de proteína de cuerpos laminares en el grupo de animales con hiperoxia tratados con NSO. Todo ello son evidencias indicativas de la prevención de la lesión pulmonar, con una mejor alveolarización y una disminución de la fibrosis. Por consiguiente, a la vista de estos resultados, sugeriríamos que el tratamiento con NSO protege los pulmones frente a los graves daños causados por la lesión pulmonar inducida por la hiperoxia, que es un importante factor contribuyente en el desarrollo de la DBP. Estos resultados podrían deberse a las propiedades antiinflamatorias, inmunomoduladoras, citoprotectoras y antioxidantes del NSO, además de a su actividad inhibidora de la HNE.
En conclusión, los objetivos terapéuticos en la DBP se centran en reducir al mínimo la lesión persistente, reducir la inflamación, mantener una oxigenación adecuada y facilitar el crecimiento pulmonar en el pulmón en desarrollo. El tratamiento con NSO atenuó significativamente la lesión pulmonar al mantener una mejor alveolarización y reducir la fibrosis, la inflamación y el estrés oxidativo. Así pues, el NSO parece ser un agente prometedor para la protección de los tejidos pulmonares frente a las lesiones graves de la DBP. Sin embargo, serán necesarios nuevos estudios para determinar si el tratamiento con NSO tiene efectos favorables en cuanto a la protección del pulmón frente a los graves daños que se producen en el desarrollo de la DBP.
FinanciaciónEste estudio fue financiado por una subvención de la GATA Military School of Medicine y el Fatih University Faculty of Medicine Scientific Research Committee.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.