Varios protocolos recomiendan la tomografía computerizada para las poblaciones con alto riesgo de cáncer de pulmón. Probablemente aumentará el número de sujetos estudiados por lesiones pulmonares periféricas (LPP) y, por lo tanto, también el número de biopsias no quirúrgicas. Se ha demostrado la importancia de asociar un método guía con una técnica de confirmación de la diana para conseguir los máximos rendimientos diagnósticos. Sin embargo, no hay estudios de broncoscopia mediante ecografía endobronquial con sonda radial mediante fluoroscopia, sin vaina guía.
MétodosRealizamos un análisis retrospectivo de los procedimientos mediante ecografía endobronquial con sonda radial mediante fluoroscopia realizados para estudiar las LPP por broncoscopistas expertos pero sin formación previa en esta técnica concreta. Se evaluaron las curvas de aprendizaje de los operarios y los factores pronósticos radiológicos de todos los pacientes consecutivos estudiados durante el primer año de uso de la técnica.
ResultadosSe estudiaron 51 LPP. El rendimiento diagnóstico y el de visualización fueron 72,5 y 82,3% respectivamente. El rendimiento diagnóstico fue del 64,0% para las LPP ≤20mm, y del 80,8% para las LPP>20mm. No se registraron falsos positivos. La curva de aprendizaje de todas las herramientas diagnósticas mostró un RD del 72,7% para el primer subgrupo de pacientes, 81,8% para el segundo, 72,7% para el tercero, y 81,8% para el último.
ConclusiónLa broncoscopia con ecografía endobronquial con sonda radial mediante fluoroscopia es un método seguro y fácil de usar, incluso sin formación específica previa. Su rendimiento diagnóstico es alto tanto para LPP>20mm como para LPP≤20mm. A partir de estos hallazgos, este método podría presentarse como procedimiento de primera línea para el estudio de las LPP, en especial en centros con recursos limitados.
Several guidelines recommend computed tomography scans for populations with high-risk for lung cancer. The number of individuals evaluated for peripheral pulmonary lesions (PPL) will probably increase, and with it non-surgical biopsies. Associating a guidance method with a target confirmation technique has been shown to achieve the highest diagnostic yield, but the utility of bronchoscopy with radial probe endobronchial ultrasound using fluoroscopy as guidance without a guide sheath has not been reported.
MethodsWe conducted a retrospective analysis of bronchoscopy with radial probe endobronchial ultrasound using fluoroscopy procedures for the investigation of PPL performed by experienced bronchoscopists with no specific previous training in this particular technique. Operator learning curves and radiological predictors were assessed for all consecutive patients examined during the first year of application of the technique.
ResultsFifty-one PPL were investigated. Diagnostic yield and visualization yield were 72.5 and 82.3% respectively. The diagnostic yield was 64.0% for PPL ≤20mm, and 80.8% for PPL>20mm. No false-positive results were recorded. The learning curve of all diagnostic tools showed a DY of 72.7% for the first sub-group of patients, 81.8% for the second, 72.7% for the third, and 81.8% for the last.
ConclusionBronchoscopy with radial probe endobronchial ultrasound using fluoroscopy as guidance is safe and simple to perform, even without specific prior training, and diagnostic yield is high for PPL>and ≤20mm. Based on these findings, this method could be introduced as a first-line procedure for the investigation of PPL, particularly in centers with limited resources.
El cáncer de pulmón sigue siendo la principal causa de fallecimientos relacionados con el cáncer en todo el mundo1–3. La prevención es la piedra angular para controlar el cáncer de pulmón, mientras que las intervenciones que persiguen un diagnóstico precoz y un cambio de estadio podrían ser claves a la hora de reducir significativamente la mortalidad por cáncer de pulmón. A pesar de la actual controversia sobre la utilidad de las pruebas de detección sistemática, algunas asociaciones como la American College of Chest Physicians recomiendan realizar tomografías computerizadas (TAC) de baja dosis en las «poblaciones de alto riesgo»4–7. En consecuencia, cabe esperar que cada vez se estudie a más pacientes por lesiones pulmonares periféricas (LPP), lo que destaca la necesidad de contar con una secuencia de intervención diagnóstica sencilla, eficiente y segura.
En la actualidad, las herramientas de evaluación de probabilidades preprueba integran los factores de riesgo de los pacientes y las características radiológicas de los nódulos para calcular la probabilidad de que se trate de neoplasia maligna y para establecer las pautas de estudio o seguimiento. Estas herramientas, si se combinan con la evaluación del riesgo quirúrgico de los pacientes, permiten identificar a varios pacientes que precisen muestreo no quirúrgico4. Esto último está indicado como procedimiento diagnóstico de primera línea en los casos con baja probabilidad clínica de neoplasia maligna, en pacientes con alto riesgo quirúrgico y en casos con hallazgos clínicos y radiológicos discordantes4. En cuanto al diagnóstico de las LPP >8mm, la broncoscopia con ecografía endobronquial (B-EBUS) compite con la biopsia transtorácica. Ambas técnicas tienen un buen rendimiento diagnóstico (RD), pero la biopsia transtorácica se asoció a más complicaciones en un ensayo prospectivo8. Además, la broncoscopia permite realizar una evaluación general de las vías respiratorias proximales (con lo que se descubrieron cánceres sincrónicos en hasta el 12% de los casos) y evaluar la resecabilidad quirúrgica9.
Se ha demostrado que la combinación de técnicas de guiado (relativas a la navegación por los bronquios) y de técnicas de confirmación de la diana (relativas a la visualización de las lesiones) aumenta el RD de la broncoscopia10,11. En cuanto a la R-EBUS, todos los estudios publicados actualmente combinaron la vaina guía (VG) y la fluoroscopia (F) y registraron un RD del 67-82%12–14. Sin embargo, el uso de VG supone la necesidad de manipulaciones adicionales que aumentarían la duración del procedimiento así como la carga económica (204-276€ en el caso de los productos Olympus). El objetivo del estudio consistió en evaluar la R-EBUS guiada por fluoroscopia (F-R-EBUS) en la toma de muestras de LPP, sin el uso concomitante de una VG y sin mediciones de distancias broncosópicas15,16. A los efectos del presente estudio, se evaluaron la seguridad y eficacia de la F-F-EBUS, se describieron las curvas de aprendizaje y se evaluaron los factores pronósticos radiológicos tanto del rendimiento de visualización (RV) como diagnóstico (RD).
MétodosParticipantes del estudioLos pacientes con LPP estudiados en el Hospital Universitario de Lausana entre noviembre de 2011 y noviembre de 2012 fueron candidatos para participar en este análisis. Se excluyó a los pacientes en los que estaba contraindicada la broncoscopia o la biopsia transbronquial (BTB) o con lesión endobronquial visible macroscópicamente. A los sujetos con linfoadenopatía mediastínica asociada en la TAC o PET/TAC torácica se les examinó primero con EBUS mediastínica. Solo participaron en el estudio los que tuvieron una citología de nódulos linfáticos negativa. Todos los sujetos firmaron un consentimiento informado antes de la broncoscopia. El acceso retrospectivo a los datos clínicos fue aprobado por el Comité ético de investigación en humanos del cantón de Vaud (protocolo 37/14).
Material y técnicasLos procedimientos se realizaron con sedación moderada (propofol o midazolam) de forma ambulatoria. Se encargaron dos broncoscopistas expertos sin formación previa específica en F-R-EBUS. Durante la F-R-EBUS, se utilizó una sonda ecográfica radial ultrafina de 1,7mm a una frecuencia de 20MHz (UM-S20-17S Olympus). La sonda ecográfica se introducía en el canal operativo de 2,1mm de un broncoscopio flexible de 4,9mm (Olympus BFP180) sin VG. Como guía, se usaba un plano de fluoroscopia anteroposterior.
Si se detectaban LPP visibles mediante fluoroscopia, se estudiaban los segmentos bronquiales correspondientes de forma secuencial hasta que el signo ecográfico característico permitía localizar la lesión. Después, se retiraba la sonda y se introducían las herramientas de muestreo en el bronquio identificado. Se metían las pinzas de biopsia mediante guía fluoroscópica hasta el punto en el que se había visualizado previamente el extremo distal de la sonda. Si no había LPP visibles con fluoroscopia, se localizaba la zona sospechosa con lectura cerrada de la TAC. Una vez alcanzado este territorio, se escaneaban con EBUS todos los bronquios accesibles hasta que se detectaba el signo característico que confirmaba la localización. Este punto concreto se visualizaba mediante fluoroscopia. Se introducían las herramientas en el bronquio identificado hasta dicho punto y se tomaban las muestras del siguiente modo: en la mayoría de los casos, se empleó cepillo transbronquial (al menos 3 muestras), BTB (3-5 muestras) solo para lesiones visibles en la ecografía y biopsia aspirativa (BA), (1-3 muestras) para LPP adyacentes al signo de EBUS. Al final del procedimiento, se realizaba un lavado broncoalveolar en función de la probabilidad de atelectasia bronquial. Se hicieron cultivos sistemáticamente de las irrigaciones bronquiales y los lavados broncoalveolares en busca de bacterias, micobacterias y hongos. En caso de BTB o BA, se realizaba una radiografía torácica una hora después del procedimiento para descartar neumotórax. Se diagnosticó neoplasia maligna si había células atípicas, células con sospecha de malignidad o células de CPNM en al menos una de las muestras. A los pacientes con F-R-EBUS no diagnóstica se les realizó una evaluación multidisciplinar y se les remitió bien a otro procedimiento invasivo (p. ej. biopsia aspirativa transtorácica, biopsia quirúrgica) o a un seguimiento clínico y radiológico conforme a las pautas de la Fleischner Society.
Datos de imagenUn radiólogo especializado en imágenes torácicas se encargó de revisar la última TAC torácica disponible e informó acerca de la morfología (opacidades sólidas, en parte sólidas o en vidrio esmerilado puras), el tamaño (eje transverso mayor) y la distancia de las LLP respecto al hilio. La distancia se calculó en imágenes reformateadas oblicuas midiendo la distancia entre el margen interno de la LPP y el origen proximal del bronquio segmentario correspondiente. La presencia de signo bronquial en la TAC se evaluó mediante imágenes axiales y reformateadas17.
Análisis estadísticoSe comprobó si los datos presentaban distribución normal con la prueba de Kolmogorov-Smirnov y se analizaron respecto a RV y RD mediante χ2 y/o prueba t. A no ser que se indique lo contrario, los resultados se muestran como promedio (rango) o número de casos (%), p<0,05 se consideró estadísticamente significativa. Se creó la curva de aprendizaje del operario principal dividiendo todos los casos consecutivos en 4 subgrupos de igual tamaño. Todos los cálculos estadísticos se realizaron con el software R-statistics.
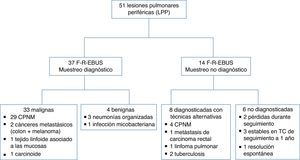
ResultadosSe sometió a 48 pacientes consecutivos (promedio de edad [rango]; 66,1 [39-89] años) a broncoscopia para estudiar LPP y se tomaron muestran de un total de 51 LPP con F-R-EBUS. Se localizaron 35 LPP (68,6%) en los lóbulos superiores, 2 (3,9%) en el central y 14 (27,5%) en los lóbulos inferiores. El tamaño medio de la lesión fue de 25,8mm (rango: 8-67mm), 38 (74,5%) fueron sólidas, 4 (7,8%) en vidrio esmerilado puras y 9 (17,7%) en parte sólidas. Se visualizaron 42 LPP mediante F-R-EBUS, con un resultado del 82,3% de RV. La toma de muestras mediante F-R-EBUS fue diagnóstica para 37 LPP (RD del 72,5%) con 33 (89,2%) LPP malignas. Las aportaciones diagnósticas de las distintas herramientas broncoscópicas se resumen en la tabla 1. En la figura 1 aparece un diagrama de flujo de los procedimientos diagnósticos realizados y los diagnósticos finales de las LPP. No se observaron falsos positivos para las biopsias con F-R-EBUS, como confirmaron las muestras quirúrgicas (26 nódulos) y el seguimiento clínico y radiológico a un año. Tras la exclusión de los 6 casos con diagnóstico inconcluyente, la prevalencia del cáncer de pulmón fue del 66,6% (n=34,33 CPNM y un carcinoide) y la sensibilidad de la F-R-EBUS para las neoplasias pulmonares malignas fue del 88,2% (n=30).
Aportación diagnóstica de la F-R-EBUS en 51 casos
| Método | Frecuencia de uso. Número de casos (%) | Determinación del diagnóstico. Número de casos (%) |
|---|---|---|
| Lavado broncoalveolar | 25 (49%) | 8 (32%) |
| Irrigación bronquial | 51 (100%) | 19 (37%) |
| Cepillado bronquial | 42 (82%) | 20 (48%) |
| Biopsia aspirativa de aguja fina | 19 (37%) | 13 (68%) |
| Biopsia transbronquial | 42 (82%) | 21 (50%) |
Diagrama de flujo de los procedimientos diagnósticos realizados y los diagnósticos finales de las LPP (PPL). NSCLC: non small cell lung carcinoma; CPNM: carcinomas pulmonares no microciticos; F-R-EBUS: fluoroscopic-guided radial probe endoBronchial ultraSound; F-R-EBUS: ecografia endobronquial con sonda radial guida por fluoroscopia; MALT: mucosa-associated lymphoid tissue; MALT: tejodo linfoide asociado a las mucosas.
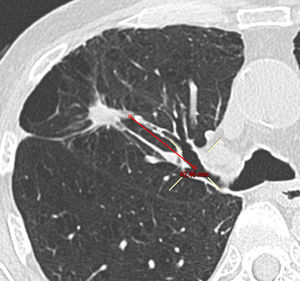
El RD y el RV dependen del tamaño de la lesión: 64,0% y 80,0% respectivamente para LPP ≤20mm (n=25) y 80,8 y 84,6% respectivamente para LPP >20mm (n=26). En cuanto a otras características radiológicas de los nódulos, como distancia de la LPP a la pleura, el RV mejoró significativamente (p=0,021) solo si la distancia al hilio (fig. 2) era <50mm. Por lo que respecta al RD, no se encontró ningún factor pronóstico radiológico (tablas 2 y 3).
Factores pronósticos del rendimiento diagnóstico
| Factores pronósticos | Lesiones diagnosticadas (n=37) | Lesiones no diagnosticadas (n=14) | Prueba | Valor p |
|---|---|---|---|---|
| Aspecto de la LPP en la TAC | ||||
| Sólida | 29 (78%) | 9 (64%) | χ2 | 0,502 |
| No sólida | 8 (22%) | 5 (36%) | ||
| Signo bronquial | ||||
| Sí | 20 (54%) | 5 (36%) | χ2 | 0,392 |
| No | 17 (46%) | 9 (64%) | ||
| LPP visualizada mediante EBUS | ||||
| Sí | 32 (87%) | 10 (71%) | χ2 | 0,397 |
| No | 5 (13%) | 4 (29%) | ||
| Tamaño de la LPP | ||||
| ≤ 20mm | 16 (43%) | 9 (64%) | χ2 | 0,304 |
| > 20mm | 21 (57%) | 5 (36%) | ||
| Promedio (mm) | 27,1 | 22,3 | Prueba t | 0,312 |
| Distancia entre LPP e hilio | ||||
| ≤ 50mm | 27 (73) | 9 (64) | χ2 | 0,792 |
| > 50mm | 10 (27) | 5 (36) | ||
| Promedio (mm) | 37,1 | 44,1 | Prueba t | 0,269 |
EBUS: ecografía endobronquial con sonda radial guiada por fluoroscopia; LPP: lesión pulmonar periférica; TAC: tomografía computerizada.
Factores pronósticos del rendimiento de visualización
| Factores pronósticos | Lesiones visualizadas(n=42) | Lesiones no visualizadas(n=9) | Prueba | Valor p |
|---|---|---|---|---|
| Aspecto de la LPP en la TAC | ||||
| Sólida | 32 (76%) | 6 (67%) | χ2 | 0,862 |
| No sólida | 10 (24%) | 3 (33%) | ||
| Signo bronquial | ||||
| Sí | 21 (50%) | 4 (44%) | χ2 | 1 |
| No | 21 (50%) | 5 (56%) | ||
| LPP diagnosticada | ||||
| Sí | 32 (76%) | 5 (56%) | χ2 | 0,397 |
| No | 10 (24%) | 4 (44%) | ||
| Tamaño de la LPP | ||||
| ≤ 20mm | 20 (48%) | 5 (56%) | χ2 | 0,948 |
| > 20mm | 22 (52%) | 4 (44%) | ||
| Promedio (mm) | 25,8 | 25,9 | Prueba t | 0,988 |
| Distancia entre LPP e hilio | ||||
| ≤ 50mm | 33 (79%) | 3 (33%) | χ2 | 0,021 |
| > 50mm | 9 (21%) | 6 (67%) | ||
| promedio (mm) | 36,6 | 50,2 | Prueba t | 0,053 |
LPP: lesión pulmonar periférica; TAC: tomografía computerizada.
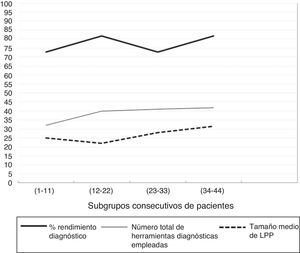
Tal y como ya se ha mencionado, los procedimientos broncoscópicos fueron realizados por dos broncoscopistas expertos sin experiencia previa específica en F-R-EBUS. Un operario realizó 44 intervenciones (86%) y el otro 7 (14%). La curva de aprendizaje (fig. 3) del operario principal obtuvo un RD del 72,7% (n=8) para el primer subgrupo, 81,8% (n=9) para el segundo, 72,7% (n=8) para el tercero y 81,8% (n=9) para el último. El número total de herramientas diagnósticas empleadas y el tamaño medio de las LPP fueron similares en los cuatro grupos de pacientes consecutivos (32, 40, 41 y 42 herramientas diagnósticas y 25,0mm, 22,1mm, 28,1mm y 31,5mm de tamaño medio de las LPP respectivamente). En cuanto a la seguridad de la F-R-EBUS, se produjo un único episodio de hemorragia significativa en el que fue preciso interrumpir el procedimiento, pero sin más complicaciones.
DiscusiónEn el actual estudio, evaluamos el rendimiento diagnóstico y la seguridad de la R-EBUS combinada con guiado por fluoroscopia, sin vaina guía, en el estudio de las LPP. Obtuvimos un RD global del 72,5%: donde el 64% correspondió a LPP ≤20mm y el 81% a LPP >20mm. Aprender la técnica fue sencillo. El perfil de seguridad fue similar al de otras técnicas EBUS (sin neumotórax y solo una hemorragia significativa)18.
Los resultados mencionados más arriba concuerdan con los registrados para todos los métodos de broncoscopia guiada en el metaanálisis de Wang Memoli et al.19 (RD acumulado del 70%, RD ponderado del 60,9% para LPP ≤20mm y del 82,5% para LPP>20mm). Se ha demostrado que estos métodos guiados obtienen mejores resultados que la broncoscopia tradicional o la fluoroscopia20,21. Este buen RD se debe probablemente a la combinación de dos técnicas diagnósticas. Una permite navegar hasta la lesión y la otra, visualizarla. En el ensayo clínico de Eberhardt et al. se resalta la importancia de esta combinación10; los autores emplean la broncoscopia por navegación electromagnética a modo de «GPS» para guiar al broncoscopista por los bronquios y la EBUS para confirmar la localización de la lesión. Consiguieron el RD más alto (88%) registrado hasta el momento en la bibliografía. Además, demostraron que la combinación de los dos métodos es más eficiente que cualquiera de ellos por separado. Aunque el campo electromagnético y el sistema ecográfico son técnicas seguras y no radiantes, combinarlas resulta complejo y consume muchos recursos (en la mayoría de los casos, es preciso repetir la TAC torácica específica compatible con los parámetros de broncoscopia por navegación electromagnética, se necesitan dos operarios y anestesia profunda o general para conseguir la total inmovilización del paciente). Por lo tanto, el procedimiento se aproxima más a una operación que a una simple intervención diagnóstica. Dura más y los costes acumulados son mayores. Todo esto hace que sea difícil utilizarlo en la práctica diaria.
La navegación broncoscópica virtual es otro método con el que se generan imágenes de la ruta bronquial a la lesión y se usan para desplazar el broncoscopio. Ishida et al. también demostraron la importancia de combinar un método de guiado con un método de confirmación de la diana al comparar la técnica EBUS-VG clásica con la combinación de EBUS-VG y navegación broncoscópica virtual11 y observar una mejora significativa del RD en el grupo combinado.
En comparación con las técnicas combinadas altamente efectivas mencionadas más arriba, el punto fuerte de nuestro procedimiento reside en su sencillez, rapidez y coste limitado. De hecho, ya que ambos procesadores radioscópicos y ecográficos están disponibles en la mayoría de las instalaciones endoscópicas (los últimos suelen ser compatibles con EBUS/EUS de mediastino o sistemas ecográficos urológicos/gastroenterológicos), comprar una sonda EBUS pequeña y reutilizabele (50 usos) se convierte en un sistema económico de guiado y visualización en tiempo real de LPP (3.300 euros en el caso de los productos Olympus). El procedimiento es rápido, entre uno y 5 minutos adicionales, y se realiza con sedación suave de forma ambulatoria. El RD es ligeramente inferior al registrado en los estudios de Eberhardt o Ishida et al., pero la sencillez del procedimiento podría justificar su uso de primera línea, con lo que se reservarían los métodos más complejos para casos de resultados negativos y dudosos.
La ventaja de usar guiado por fluoroscopia además de R-EBUS parece ser un mayor RD para LPP <20mm, como registraron Yoshikawa et al., un RD del 76% (n=28) para LPP ≤20mm, en contraste con un RD del 30% (n=11) sin el apoyo de la fluoroscopia22.
La VG no es ni un método de guiado ni un método de visualización de la lesión en tiempo real. Su utilidad consiste en la posibilidad de tomar varias muestras en el mismo punto de interés. Es especialmente útil en los casos de vías bronquiales complejas. Sin embargo, se precisan manipulaciones adicionales para igualar la longitud de las herramientas y es más cara (204-276 euros en el caso de vainas guía desechables). Nuestro estudio confirma la eficiencia de la simple combinación de ecografía endobronquial con sonda radial y fluoroscopia sin VG. Por lo tanto, esta última parece ser más bien un refuerzo para tomar varias muestras que una herramienta que mejore el RD.
Tal y como demuestran las curvas de aprendizaje de la técnica, la F-R-EBUS se asocia a un rendimiento diagnóstico alto de inmediato. Su RD siguió siendo alto durante todo el estudio y no se vio afectado por el tamaño de las LPP ni por el número de intervenciones diagnósticas. Los hallazgos mencionados más arriba reflejan la sencillez del método para el que, como demuestra nuestra experiencia, no fue precisa formación previa específica y se pudo aplicar directamente. Como mostraban Chao et al.23, la BA consigue el mayor RD en comparación con el resto de las herramientas diagnósticas y no se asoció a más complicaciones. Este alto RD se debe probablemente al hecho de que la BA permite tomar muestras tanto en lesiones endobronquiales como extrabronquiales, por lo que esta herramienta diagnóstica es especialmente útil en entornos clínicos.
Los factores pronósticos del RD inherentes a la R-EBUS han sido estudiados en gran medida. En el metaanálisis de Steinfort et al., el RV afectaba a la sensibilidad independientemente del método de guiado18. En dos estudios retrospectivos se analizaron los factores pronósticos radiológicos del RV. Se detectó un efecto significativo tanto de la distancia al hilio24 como del tamaño de las LPP16,24. En el presente estudio, solo parece existir correlación entre la distancia al hilio y el rendimiento de visualización. Esta falta de valor estadísticamente significativo podría reflejar el hecho de que en nuestro análisis se estudió a una población de pacientes más pequeña, en comparación con los estudios anteriores16,24.
En el presente estudio no es posible excluir algunas de las limitaciones inherentes de un análisis retrospectivo, como un posible sesgo de selección en favor de pacientes con alto riesgo de neoplasia maligna o LPP accesibles mediante broncoscopia. No obstante, los rendimientos diagnósticos registrados aquí se ajustan a la regresión lineal entre la prevalencia de neoplasias pulmonares malignas y la sensibilidad de la R-EBUS realizada por Steinfort et al.18. Otra limitación, inherente a la mayoría de los ensayos que estudian el diagnóstico de LPP, afecta a la determinación del diagnóstico y a los criterios histocitológicos empleados para la neoplasia maligna. En nuestro estudio, la combinación de los criterios histopatológicos y el seguimiento clínico en casos dudosos no supuso ningún falso positivo. En último lugar, se utilizó un nuevo método basado en imágenes reformateadas oblicuas para calcular la distancia entre el hilio y las LPP (fig. 2). El estudio de Tay et al. introdujo el uso de la fórmula de Pitágoras para calcular la distancia de las LPP al hilio en 3D24. No obstante, con este método no se tiene en cuenta la distancia real de la ruta bronquial. En el presente estudio, las imágenes reformateadas oblicuas permitieron calcular la distancia entre el margen más interior de la LPP y el origen del bronquio segmentario afectado. De esta forma, se pudo realizar un cálculo más preciso de la ruta bronquial que debía seguirse en la intervención broncoscópica.
En definitiva, la R-EBUS combinada con guía por fluoroscopia es una técnica segura, rápida y sencilla que podría usarse fácilmente en la evaluación de las LPP. El rendimiento diagnóstico de esta técnica ha sido comparable al de otros métodos de broncoscopia guiada19 y fue alto tanto para las LPP <20mm como las LPP >20mm. Estas características combinadas con su coste moderado podrían convertirlo en un procedimiento de primera línea en la secuencia de intervención diagnóstica de las LPP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.