La exposición al humo de biomasa es un factor de riesgo para enfermedad pulmonar obstructiva crónica (EPOC). Se ignora si la EPOC por biomasa y por tabaco tienen características diferentes.
ObjetivoBuscar diferencias clínicas entre ambos tipos de enfermedad.
MétodosEstudio observacional retrospectivo de 499pacientes diagnosticados de EPOC por biomasa o por tabaco. Se compararon ambos grupos respecto a variables clínicas.
ResultadosCiento veintidós sujetos (24,4%) fueron clasificados en el grupo de biomasa y 377 (75,5%) en el de tabaco. El porcentaje de varones fue más alto en el grupo de tabaco (91,2% vs 41,8%, p<0,0001) y la edad resultó inferior en este grupo (70,6 vs 76,2años, p<0,0001). Los valores del índice de masa corporal y del FEV1% fueron superiores en el grupo de biomasa (29,4±5,7 vs 28,0±5,1; p=0,01 y 55,6±15,6 vs 47,1±17,1; p<0,0001, respectivamente). El fenotipo mixto EPOC-asma fue más prevalente en el grupo biomasa (21,3% vs 5%, p<0,0001), aunque esta diferencia desapareció al hacer una corrección por sexo. El fenotipo enfisema fue más frecuente en el grupo tabaco (45,9% vs 31,9%, p=0,009). La prevalencia de los fenotipos bronquitis crónica y exacerbador, el peso de las comorbilidades y la tasa de ingresos hospitalarios fueron equivalentes entre los 2grupos.
ConclusiónExisten diferencias clínicas entre la EPOC por humo de biomasa y por tabaco, aunque podrían ser atribuibles en parte a desigualdades de sexo entre ambos grupos.
Exposure to biomass smoke is a risk factor for chronic obstructive pulmonary disease (COPD). It is unknown whether COPD caused by biomass smoke has different characteristics to COPD caused by tobacco smoke.
ObjectiveTo determine clinical differences between these two types of the disease.
MethodsRetrospective observational study of 499patients with a diagnosis of COPD due to biomass or tobacco smoke. The clinical variables of both groups were compared.
ResultsThere were 122subjects (24.4%) in the biomass smoke group and 377 (75.5%) in the tobacco smoke group. In the tobacco group, the percentage of males was higher (91.2% vs 41.8%, P<.0001) and the age was lower (70.6 vs 76.2 years, P<.0001). Body mass index and FEV1% values were higher in the biomass group (29.4±5.7 vs 28.0±5.1, P=.01, and 55.6±15.6 vs 47.1±17.1, P<.0001, respectively). The mixed COPD-asthma phenotype was more common in the biomass group (21.3% vs 5%, P<.0001), although this difference disappeared when corrected for gender. The emphysema phenotype was more common in the tobacco group (45.9% vs 31.9%, P=.009). The prevalence of the chronic bronchitis and exacerbator phenotypes, the comorbidity burden and the rate of hospital admissions were the same in both groups.
ConclusionDifferences were observed between COPD caused by biomass and COPD caused by tobacco smoke, although these may be attributed in part to uneven gender distribution between the groups.
Aunque el tabaco está ampliamente reconocido como el principal factor de riesgo para la enfermedad pulmonar obstructiva crónica (EPOC), en series internacionales se reconoce la existencia de un porcentaje relativamente alto de pacientes con EPOC que nunca han fumado1,2. Esta proporción es especialmente elevada en países en vías de desarrollo, pero también es significativa en Europa. En España, el estudio IBERPOC reveló que el 24,3% de los pacientes con EPOC nunca habían fumado3. Existen diversos factores de riesgo para desarrollar la enfermedad, no relacionados con el tabaco. Se acepta que la contaminación ambiental de espacios cerrados por el humo de biomasa es uno de los más importantes. De hecho, alrededor de la mitad de la población mundial está expuesta a combustibles de biomasa, lo que sugiere que este podría ser el factor de riesgo más importante para el desarrollo de EPOC, de forma global1. Diversos estudios epidemiológicos, incluyendo uno realizado en España, confirman la asociación entre la exposición al humo de biomasa y la EPOC4-6.
En la actualidad no se sabe con certeza si la EPOC debida al humo de biomasa y la debida al humo del tabaco tienen diferentes características. Se ignora si ambos tipos de enfermedad tienen una presentación clínica similar, si la historia de progresión natural es la misma, si tienen comorbilidades parecidas y si los patrones de inflamación pulmonar y sistémica son similares7.
Actualmente se reconoce que el término EPOC agrupa a una serie de entidades con características diferentes, y se ha puesto énfasis en la importancia de definir fenotipos clínicos que permitan clasificar a los pacientes en subgrupos con implicaciones pronósticas y terapéuticas, y que serían relevantes a efectos de manejo clínico de los enfermos y de la realización de estudios de investigación8,9.
Nuestra hipótesis de trabajo es que el humo de tabaco y el de biomasa podrían producir efectos biológicos diferentes, lo que se traduciría en una presentación clínica distinta entre ambos tipos de enfermedad. Los posibles rasgos clínicos diferenciales entre ambos grupos podrían agruparse en fenotipos, que implicarían un tratamiento diferenciado. Las comorbilidades asociadas a la EPOC también podrían ser distintas en ambos grupos, ya que el humo de biomasa pudiera tener un efecto diferente al humo de tabaco en la aparición de trastornos como enfermedades cardiovasculares o neoplásicas. El principal objetivo de este estudio ha sido buscar diferencias clínicas entre pacientes con EPOC causada por tabaco y por exposición al humo de biomasa. Hemos intentado, concretamente, determinar si existían diferencias en la prevalencia de diversos fenotipos clínicos predefinidos entre ambos grupos y en la existencia de comorbilidades.
MétodosSujetos y diseño del estudioSe ha realizado un estudio descriptivo, retrospectivo. El trabajo se llevó a cabo en el servicio de Neumología de un hospital universitario que da cobertura a una población de 220.000habitantes, muchos de los cuales proceden de zonas rurales, en las cuales los combustibles de biomasa (esencialmente madera) se emplean con frecuencia para cocinar y como sistema de calefacción. Revisamos retrospectivamente las historias clínicas de 529pacientes consecutivos atendidos en una consulta de EPOC localizada en el hospital, entre enero de 2009 y junio de 2013, y diagnosticados de EPOC. Se seleccionaron los sujetos a partir de una base de datos asistencial en la que se incluyen pacientes diagnosticados por un neumólogo de EPOC en relación con tabaco, con humo de biomasa o por déficit de alfa-1-antitripsina. Los criterios para incluir a los sujetos en el estudio actual fueron edad ≥40años, relación FEV1/FVC tras inhalación de broncodilatadores <0,70, presencia de tos crónica, producción de esputo o disnea y, o bien historia de tabaquismo, o antecedente de exposición significativa al humo de biomasa. Los criterios de exclusión fueron el déficit de alfa-1-antitripsina, la existencia de bronquiectasias quísticas o de bronquiectasias cilíndricas atribuidas a una etiología diferente a la EPOC, la infección por el virus de la inmunodeficiencia humana, la coexistencia de enfermedad pulmonar intersticial, el diagnóstico actual de asma, la historia de exposición laboral a polvos inorgánicos o a otros humos diferentes al producido por la combustión de tabaco o biomasa, y la existencia de enfermedad parenquimatosa pulmonar en relación con tuberculosis previa. El estudio fue aprobado por nuestro comité ético (CEIC Galicia, n.° de Registro: 2012/132).
La exposición acumulada al humo de biomasa resultó difícil de calcular, puesto que variaba frecuentemente con el tiempo. Muchos pacientes se encontraron expuestos durante su infancia y juventud al humo liberado al ambiente por las cocinas tradicionales de la región (fuegos abiertos, en una chimenea). Estas chimeneas producen más contaminación ambiental que los hornos y estufas que las han remplazado de forma generalizada en las últimas décadas. Además, la exposición al humo es significativamente más alta durante los meses de invierno que en el resto del año, y varía año a año con las condiciones climáticas. Por ello, y también debido a la naturaleza retrospectiva del estudio, no ha sido posible calcular de forma fiable la exposición en número de horas/año. Sin embargo, un estudio poblacional realizado en más de 5.000sujetos demostró que cocinar 10años o más con una cocina de leña era un factor de riesgo independiente para EPOC10. Teniendo en cuenta que en nuestros pacientes la biomasa se usaba, además de para cocinar, como sistema de calefacción, y que su empleo con este último fin podría producir menor contaminación ambiental, para los propósitos de este estudio hemos adoptado una actitud conservadora y hemos considerado significativa una historia de al menos 20años de exposición al humo de biomasa que comenzase en la juventud. Los pacientes fueron clasificados en 2grupos: 1)grupo de tabaco (historia de consumo de un mínimo de 10paquetes-año), y 2)grupo de biomasa (exposición significativa al humo de biomasa, tal y como se definió previamente, y ausencia de antecedente de tabaquismo). A efectos de análisis, los sujetos con historia de tabaquismo eran clasificados en el grupo1, aunque existiese también una historia de exposición remota al humo de biomasa.
La gravedad de la obstrucción al flujo aéreo se clasificó de acuerdo con los criterios GOLD, basándose en el FEV1 posbroncodilatador, de GOLD1 a GOLD411. Los pacientes fueron catalogados en 4grupos (GOLDA-D) de acuerdo con la clasificación combinada para la valoración de la EPOC recomendada por la iniciativa GOLD11, empleando para estos efectos la escala modificada de disnea del Medical Research Council. Se calculó para cada paciente, según su situación al ser evaluados por primera vez en la consulta de Neumología, el índice multidimensional BODEx, que asigna diferentes puntuaciones según el índice de masa corporal, el grado de obstrucción al flujo aéreo, la gravedad de la disnea y el número de exacerbaciones graves de EPOC12. Las comorbilidades de los pacientes se evaluaron por medio del índice de Charlson no ajustado por edad13 y mediante el índice de comorbilidad específico de la EPOC (COTE)14.
Todos los pacientes fueron clasificados en 3fenotipos clínicos mutuamente excluyentes, usando una modificación de la clasificación propuesta por la guía española de la EPOC (GesEPOC)9: 1)bronquitis crónica: presencia de tos y producción de esputo durante al menos 3meses, en 2años consecutivos15; 2)enfisema: ausencia de tos y expectoración habituales, y 2.1)enfisema pulmonar demostrado por tomografía computarizada (TC) torácica, o bien 2.2)reducción de la difusión de CO (TLCO/VA<80%), o 2.3)radiografía de tórax sugestiva de enfisema16; 3)fenotipo mixto EPOC-asma (FMEA): 2criterios mayores o un criterio mayor y 2criterios menores, tal y como se enumeran en la tabla 1.
Criterios para el diagnóstico del fenotipo mixto EPOC-asma usados en el estudio actual
| Criterios mayores |
| Prueba broncodilatadora positiva, con un aumento del FEV1>15% y>400ml |
| FENO>40 ppb |
| Antecedente personal de asma |
| Criterios menores |
| Niveles de IgE en sangre elevados |
| Antecedente personal de atopia |
| Prueba broncodilatadora positiva, con un aumento del FEV1>12% y>200ml en al menos 2 mediciones diferentes |
FENO: fracción exhalada del óxido nítrico.
Modificado de Soler-Cataluña et al.17.
Los criterios para diagnosticar el FMEA se basan en un consenso de expertos17. Los criterios originales incluían la eosinofilia en esputo en lugar de la elevación de los valores de la fracción exhalada de óxido nítrico (FENO), pero en nuestro centro no está disponible la medición de eosinófilos en esputo, por lo que empleamos los valores elevados de FENO como un marcador sugestivo de inflamación eosinofílica. La medición de FENO se realizó mediante un dispositivo portátil (NIOX MINO, Aerocrine AB, Solna, Suecia) a un flujo en boca de 50ml/s durante 10s. Se consideró significativamente elevado un valor superior a 40ppb.
Además, todos los pacientes fueron clasificados de acuerdo con otro fenotipo clínico no excluyente con los previamente mencionados: el exacerbador frecuente18. Se definió este como el hecho de haber sufrido al menos 2exacerbaciones que requirieron tratamiento con antibióticos o esteroides (o ambos) o que llevaron a un ingreso hospitalario el año precedente a la primera visita en la consulta de EPOC.
Análisis estadísticoSe valoró el ajuste de los datos a una distribución normal mediante el test de D’Agostino-Pearson. Respecto a las variables continuas, las comparaciones entre 2grupos se realizaron con la prueba de la t de Student o con la de Mann-Whitney, según fueran aplicables. Para las comparaciones entre más de 2grupos se usaron las pruebas de ANOVA o de Kruskal-Wallis. El test de Chi-cuadrado se empleó para las variables discretas. Los datos se expresan como porcentajes para las variables discretas y como media±desviación estándar o como mediana (amplitud intercuartil, AIQ) para las variables continuas, dependiendo de que estas siguieran o no una distribución normal, respectivamente. Las pruebas de significación fueron de 2colas y se consideró estadísticamente significativo un valor de p<0,05. Tratándose de un estudio retrospectivo, basado en todos los pacientes atendidos en la consulta de EPOC, no se realizó un cálculo previo del tamaño muestral. Realizamos un cálculo del poder estadístico del estudio para detectar diferencias en la prevalencias de los fenotipos, con un planteamiento bilateral y un error alfa de 0,0519.
ResultadosSe evaluaron 529pacientes que cumplían los criterios de inclusión en el estudio. Treinta fueron excluidos por no disponerse de datos completos sobre todas las variables del estudio. Se obtuvieron datos sobre todos los parámetros para los restantes 499pacientes (94,3%), que fueron incluidos en el análisis. Ciento veintidós sujetos (24,4%) fueron clasificados en el grupo de biomasa y 377 (75,5%) en el grupo de tabaco.
La potencia estadística del estudio para detectar una diferencia del 15% (entre el 30 y el 45%) en la prevalencia de 2fenotipos entre ambos grupos fue del 84,5%. La mediana de edad de los sujetos a estudio fue de 72años (AIQ: 64-78). Trescientos noventa y cinco (79,1%) eran hombres. Los pacientes del grupo de biomasa se habían expuesto a este humo una media de 62,5±9,9años. La carga tabáquica acumulada de los fumadores fue de 60,1±31,4 paquetes/año. La tabla 2 muestra las diferencias entre ambos grupos. Los sujetos del grupo de biomasa tenían una edad más elevada y había más hombres en el grupo de tabaco. El índice de masa corporal y la saturación de O2 medida por pulsioximetría (SpO2) basal fueron significativamente más elevados en el grupo de biomasa. Los pacientes del grupo de biomasa tenían menor obstrucción al flujo aéreo; el valor del FEV1 en valores porcentuales respecto al valor predicho fue significativamente más alto en estos sujetos, y se clasificaron significativamente más pacientes de este grupo en el estadio GOLD2 que en el grupo de tabaco, y en cambio hubo menos sujetos en el estadio GOLD4 en el grupo de biomasa. Además, usando la clasificación combinada de la gravedad de la enfermedad, los casos en el estadio GOLDB fueron más habituales en el grupo de biomasa, mientras que el porcentaje de enfermos con GOLDD fue mayor en el grupo de tabaco. Por otra parte, cuando los pacientes fueron clasificados de acuerdo al índice BODEx, hubo significativamente más casos que recibieron una puntuación menor (0-2) en el grupo de biomasa, mientras que el porcentaje de sujetos con puntuaciones más altas (5-6) fue mayor en el grupo de tabaco. Las tasas de ingresos hospitalarios por exacerbación de EPOC fueron similares en ambos grupos, y el peso de las comorbilidades, valoradas mediante los índices de Charlson y COTE, fue asimismo parecido. La enfermedad vascular periférica y el ulcus péptico fueron comorbilidades más frecuentes en el grupo de tabaco, lo que parece relacionado con desigualdades de sexo entre ambos grupos: todos los casos de ulcus péptico y todos menos uno de los casos con enfermedad vascular periférica eran varones. No encontramos diferencias respecto al resto de las comorbilidades (tabla 2).
Diferencias entre los grupos de biomasa y tabaco
| Parámetro | Biomasa (n=122) | Tabaco (n=377) | p |
| Edad (años) | 76,2 (69,8-80,5) | 70,6 (63,4-77,4) | < 0,0001 |
| Hombres | 51 (41,8%) | 344 (91,2%) | < 0,0001 |
| IMC (kg/m2) | 29,4±5,7 | 28,0±5,1 | 0,01 |
| FEV1% | 55,6±15,6 | 47,1±17,1 | < 0,0001 |
| FVC % | 70,3±15,1 | 71,4±17,4 | 0,55 |
| FEV1/FVC | 55,5±10,7 | 47,4±12,6 | < 0,0001 |
| SpO2 basal | 93,8±3,8 | 92,6±5,1 | 0,004 |
| GOLD 1 (FEV1≥80%) | 2 (1,6%) | 17 (4,4%) | 0,25 |
| GOLD 2 (FEV1: 50-79%) | 74 (60,6%) | 146 (38,4%) | < 0,0001 |
| GOLD 3 (FEV1: 30-49%) | 42 (34,4%) | 146 (38,4%) | 0,49 |
| GOLD 4 (FEV1<30%) | 4 (3,3%) | 68 (17,9%) | 0,0001 |
| GOLD A | 30 (24,6%) | 89 (23,6%) | 0,92 |
| GOLD B | 36 (29,5%) | 51 (13,5%) | 0,0001 |
| GOLD C | 16 (13,1%) | 62 (16,4%) | 0,46 |
| GOLD D | 40 (32,8%) | 175 (46,4%) | 0,01 |
| BODEX 0-2 | 77 (63,1%) | 167 (44,3%) | 0,01 |
| BODEX 3-4 | 34 (27,8%) | 124 (32,9%) | 0,34 |
| BODEX 5-6 | 9 (7,3%) | 60 (15,9%) | 0,02 |
| BODEX ≥7 | 1 (0,8%) | 16 (4,2%) | 0,12 |
| Índice de Charlson | 1 (1-2) | 1 (1-2) | 0,25 |
| Índice de Charlson>1 | 50 (40,9%) | 170 (45,1%) | 0,48 |
| Índice COTE | 0 (0-1) | 0 (0-2) | 0,71 |
| Índice COTE>0 | 40 (32,8%) | 138 (36,6%) | 0,61 |
| Cardiopatía isquémica | 6 (4,9%) | 38 (10,1%) | 0,12 |
| Insuficiencia cardiaca | 16 (13,1%) | 37 (9,8%) | 0,39 |
| Enfermedad vascular periférica | 2 (1,6%) | 29 (7,7%) | 0,03 |
| Enfermedad cerebrovascular | 2 (1,6%) | 19 (5,0%) | 0,17 |
| Ulcus péptico | 0 | 18 (4,7%) | 0,03 |
| Diabetes mellitus | 22 (18,0%) | 49 (13,0%) | 0,22 |
| Insuficiencia renal | 6 (4,9%) | 9 (2,4%) | 0,27 |
| Tumor de órgano sólido | 7 (5,7%) | 33 (8,7%) | 0,38 |
| Neoplasia hematológica | 1 (0,8%) | 7 (1,8%) | 0,72 |
| Fibrilación auricular | 13 (10,6%) | 33 (8,7%) | 0,65 |
| Enfermedad del colágeno | 3 (2,4%) | 6 (1,6%) | 0,86 |
| Hepatopatía | 0 | 5 (1,3%) | 0,46 |
| Ansiedad | 2 (1,6%) | 1 (0,02%) | 0,11 |
| Uno o más ingresos hospitalarios por EPOC los 5años previos | 44 (36,0%) | 144 (38,2%) | 0,74 |
| Número de ingresos hospitalarios por EPOC los 5años previos | 0 (0-1) | 0 (0-1) | 0,15 |
| Bronquitis crónica | 57 (46,7%) | 185 (49,1%) | 0,72 |
| Enfisema | 39 (31,9%) | 173 (45,9%) | 0,009 |
| FMEA | 26 (21,3%) | 19 (5,0%) | < 0,0001 |
| Exacerbador frecuente | 42 (34,4%) | 147 (38,9%) | 0,43 |
FMEA: fenotipo mixto EPOC-asma; IMC: índice de masa corporal.
Los resultados se expresan como número de casos (porcentaje), como media±desviación estándar o como mediana (amplitud intercuartil).
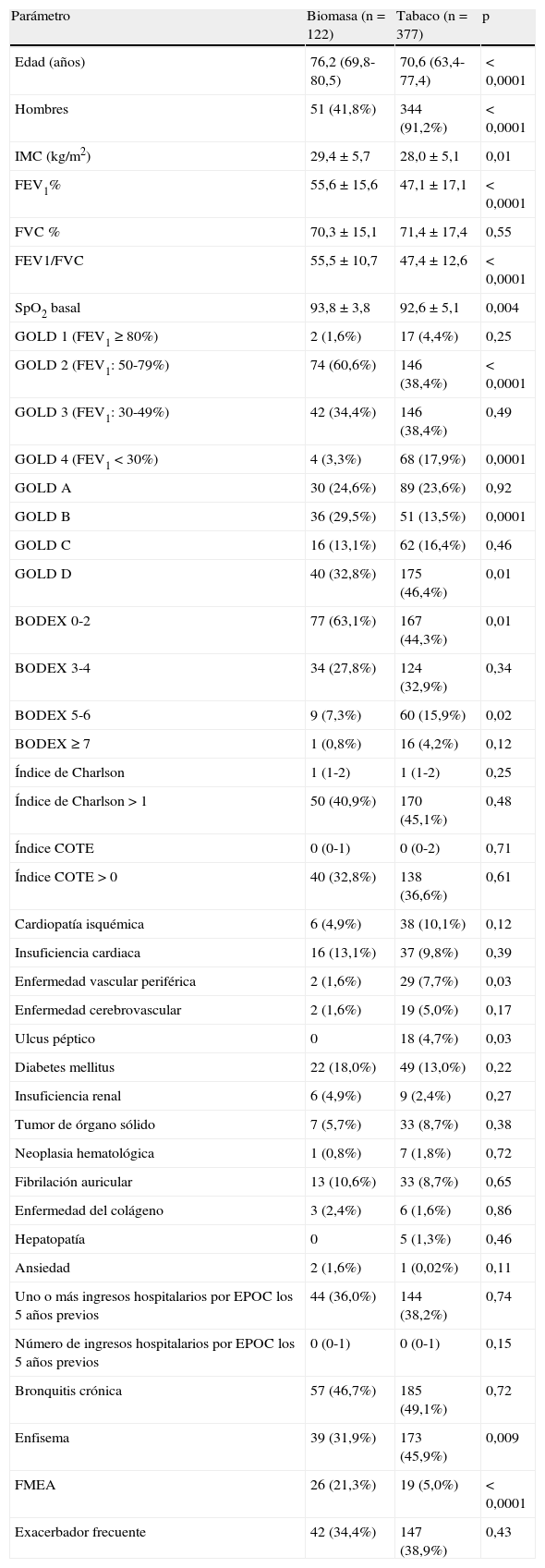
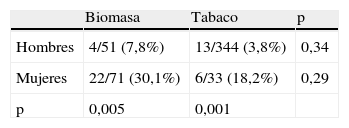
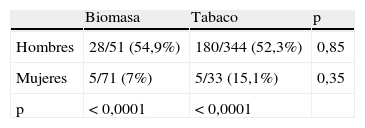
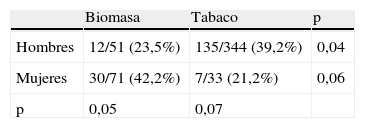
Los fenotipos bronquitis crónica y exacerbador frecuente se distribuyeron de forma similar en ambos grupos. El FMEA fue más frecuente en el grupo de biomasa, mientras que el fenotipo enfisema se diagnosticó en más casos en el grupo de tabaco. El diagnóstico del fenotipo enfisema se apoyó en 120 de 212casos (56,6%) en la realización de una TC torácica, y en la existencia de una difusión de CO reducida en 28casos adicionales. En los 64 restantes nos apoyamos en la ausencia de criterios de bronquitis crónica y una radiografía de tórax compatible. A fin de determinar si las diferencias en la prevalencia de los fenotipos eran atribuibles al sexo, clasificamos a los pacientes dentro de cada fenotipo por sexo, para los grupos de biomasa y tabaco (tablas 3–6). Las diferencias observadas en la distribución del FMEA parecieron claramente relacionadas con el sexo: este fenotipo se diagnosticó más frecuentemente en mujeres, tanto en el grupo de biomasa como en el grupo de tabaco (tabla 3). En cambio, al clasificar a los pacientes por sexo, no hubo diferencias significativas en la frecuencia de presentación de este fenotipo entre ambos tipos de exposición. Para el fenotipo bronquitis crónica encontramos resultados similares: este fenotipo se diagnosticó con más frecuencia en los hombres que en las mujeres, dentro del grupo biomasa y del grupo tabaco, mientras que dentro de cada grupo de sexo no hubo diferencias en la frecuencia de diagnóstico del fenotipo entre ambos tipos de humo (tabla 4).
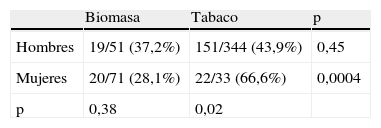
Respecto al fenotipo enfisema, su mayor frecuencia de aparición en el grupo de tabaco pareció relacionada con su presentación más habitual dentro del grupo de mujeres fumadoras (tabla 5). En cuanto al fenotipo exacerbador, este fue más habitual en los pacientes fumadores dentro de los hombres, mientras que no hubo diferencias entre ambos tipos de exposición en el grupo de mujeres (tabla 6). En el conjunto de pacientes expuestos al humo de biomasa hubo una mayor frecuencia del fenotipo exacerbador entre las mujeres, que rozó la significación.
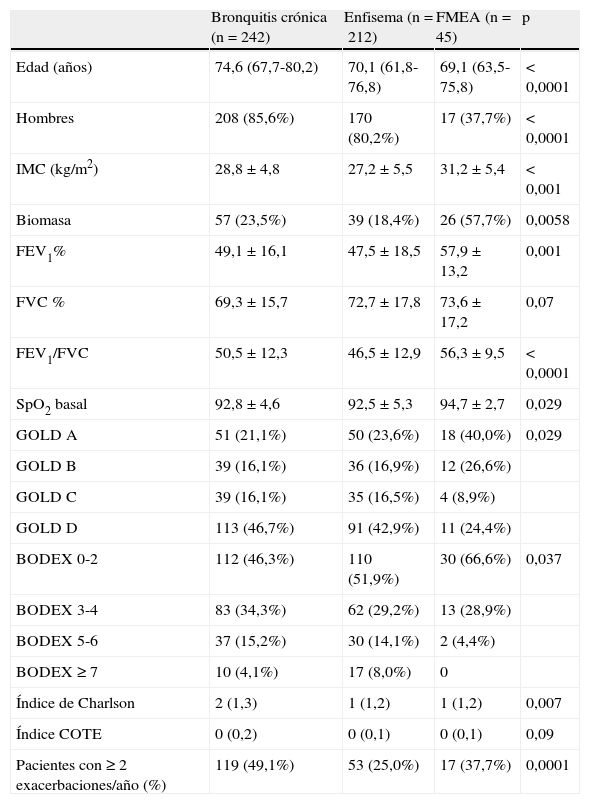
La tabla 7 muestra las características de los pacientes, clasificados según fenotipos. Encontramos numerosas diferencias en las características de los sujetos según esta clasificación. Los pacientes con fenotipo bronquitis crónica tenían mayor edad. Como se indica más arriba, había más mujeres en el fenotipo FMEA. El índice de masa corporal fue más alto en el FMEA, así como el porcentaje de sujetos con exposición al humo de biomasa en este fenotipo. Los valores de FEV1 y de SpO2 basal fueron más elevados en el FMEA. Se clasificaron más pacientes en el grupo GOLDD en los fenotipos bronquitis crónica y enfisema, y más sujetos en el grupo GOLDA en el FMEA. Más pacientes en el FMEA recibieron una puntuación baja (0-2) en el índice BODEX, y más sujetos en los fenotipos bronquitis crónica y enfisema alcanzaron puntuaciones elevadas (5-6) en este índice. El índice de Charlson fue más elevado en el fenotipo bronquitis crónica. Los valores del índice COTE y de la FVC no fueron significativamente diferentes entre los distintos grupos.
Diferencias entre fenotipos clínicos
| Bronquitis crónica (n=242) | Enfisema (n=212) | FMEA (n=45) | p | |
| Edad (años) | 74,6 (67,7-80,2) | 70,1 (61,8-76,8) | 69,1 (63,5-75,8) | < 0,0001 |
| Hombres | 208 (85,6%) | 170 (80,2%) | 17 (37,7%) | < 0,0001 |
| IMC (kg/m2) | 28,8±4,8 | 27,2±5,5 | 31,2±5,4 | < 0,001 |
| Biomasa | 57 (23,5%) | 39 (18,4%) | 26 (57,7%) | 0,0058 |
| FEV1% | 49,1±16,1 | 47,5±18,5 | 57,9±13,2 | 0,001 |
| FVC % | 69,3±15,7 | 72,7±17,8 | 73,6±17,2 | 0,07 |
| FEV1/FVC | 50,5±12,3 | 46,5±12,9 | 56,3±9,5 | < 0,0001 |
| SpO2 basal | 92,8±4,6 | 92,5±5,3 | 94,7±2,7 | 0,029 |
| GOLD A | 51 (21,1%) | 50 (23,6%) | 18 (40,0%) | 0,029 |
| GOLD B | 39 (16,1%) | 36 (16,9%) | 12 (26,6%) | |
| GOLD C | 39 (16,1%) | 35 (16,5%) | 4 (8,9%) | |
| GOLD D | 113 (46,7%) | 91 (42,9%) | 11 (24,4%) | |
| BODEX 0-2 | 112 (46,3%) | 110 (51,9%) | 30 (66,6%) | 0,037 |
| BODEX 3-4 | 83 (34,3%) | 62 (29,2%) | 13 (28,9%) | |
| BODEX 5-6 | 37 (15,2%) | 30 (14,1%) | 2 (4,4%) | |
| BODEX ≥ 7 | 10 (4,1%) | 17 (8,0%) | 0 | |
| Índice de Charlson | 2 (1,3) | 1 (1,2) | 1 (1,2) | 0,007 |
| Índice COTE | 0 (0,2) | 0 (0,1) | 0 (0,1) | 0,09 |
| Pacientes con ≥2exacerbaciones/año (%) | 119 (49,1%) | 53 (25,0%) | 17 (37,7%) | 0,0001 |
IMC: índice de masa corporal.
Los resultados se expresan como mediana (amplitud intercuartil), como número de casos (porcentaje), o como media±desviación estándar.
Considerando la gran profusión de artículos científicos publicados sobre la EPOC, los trabajos centrados en la asociación de esta enfermedad y la exposición al humo de biomasa son relativamente escasos. Algunos estudios previos sugieren que los pacientes con EPOC por humo de biomasa podrían tener características clínicas diferenciadas, aunque por el momento hay poca información sobre el alcance de estas diferencias y sobre su posible implicación terapéutica. Hipotéticamente, el humo de biomasa podría producir efectos biológicos diferentes al humo de tabaco y, en consecuencia, la enfermedad podría manifestarse con un comportamiento diferente en aspectos como la velocidad de progresión de la obstrucción al flujo aéreo, la incidencia y el tipo de exacerbaciones, el grado de afectación de la vía aérea y del parénquima pulmonar, el tipo de comorbilidades asociadas, etc. Nuestro principal objetivo con este estudio era determinar si la EPOC por biomasa podría presentar diferencias en la prevalencia de diversas características, agrupables en fenotipos de fácil reconocimiento en la práctica clínica diaria, y que supondrían un abordaje terapéutico diferenciado. Asimismo, nos interesaba buscar desigualdades en la prevalencia de comorbilidades, ya que estas han demostrado su valor pronóstico en la enfermedad14.
El porcentaje de pacientes con EPOC atribuida al humo de biomasa en este estudio (24,4%) es congruente con la proporción de casos de EPOC que nunca han fumado encontrada en estudios nacionales e internacionales1,3. Hay que destacar que nuestro trabajo intentó excluir casos de obstrucción al flujo aéreo producidos por otras noxas, como la exposición laboral a polvos inorgánicos o a otros humos o vapores. Por esta razón, cabría esperar que el porcentaje de EPOC por biomasa fuese algo más bajo, pero esta observación tiene un valor relativo, ya que nuestra investigación se ciñe a una zona geográfica pequeña, y el estudio IBERPOC mostró importantes variaciones en la prevalencia de la enfermedad según el área geográfica3.
El estudio actual ha hallado algunas diferencias clínicas entre los sujetos con EPOC causada por tabaco y la atribuida al humo de biocombustibles. No resulta sorprendente que la proporción de mujeres sea mucho más alta en el grupo de biomasa, ya que las mujeres han asumido tradicionalmente las labores de cocina y, por lo tanto, el nivel de exposición a los contaminantes presentes en el humo de biomasa es mayor en ellas. La edad de los pacientes del grupo de biomasa fue más elevada, lo que también se ha comunicado en otros estudios20. Este hecho admite varias posibles explicaciones. Aunque la exposición al humo de biomasa comienza generalmente a una edad temprana, es típicamente intermitente, y los niveles más elevados de inhalación de contaminantes solo se alcanzan mientras se cocina. Por lo tanto, es posible que tarde más tiempo en producir lesión al aparato respiratorio que la inhalación de humo de tabaco, que es menos esporádica. Podría ser que diferencias biológicas en la composición de ambos tipos de humo implicasen un efecto nocivo más lento para el humo de biomasa. La menor gravedad de la obstrucción al flujo aéreo en el grupo de biomasa (hallazgo concordante con lo encontrado en otros estudios)20 apoyaría esta posibilidad. También sería posible que se produjese un retraso en el diagnóstico de la EPOC inducida por biomasa, debido a que los clínicos tuviesen menos información respecto a esta asociación que en el caso del tabaquismo. Esta hipótesis parece menos verosímil si consideramos que la gravedad de la enfermedad, determinada con varios marcadores, resultó menor en el grupo de biomasa. Si el diagnóstico se hubiese retrasado, sería esperable que los pacientes se reconociesen en un estadio más avanzado de la enfermedad. Finalmente, las diferencias también podrían estar influidas por un sesgo de supervivencia, aunque esta hipótesis también parece poco probable, ya que estudios previos han mostrado tasas de mortalidad similares en pacientes con EPOC por tabaco y por biomasa, tras corregir para posibles factores de confusión20. Debido al diseño del estudio, todas estas hipótesis entran en el terreno de la mera especulación.
Hasta donde conocemos en el momento de redactar este trabajo, este es el primer estudio que investiga la distribución de fenotipos clínicos en la EPOC relacionada con biomasa. El primer hallazgo del estudio es una mayor prevalencia del FMEA en el grupo de biomasa. Sin embargo, este resultado parece estar relacionado con un mayor porcentaje de mujeres en este grupo, lo que sugiere que esta diferencia no depende de una respuesta biológica diferente a los distintos tipos de humo, sino de variaciones dependientes del sexo en la presentación clínica de la enfermedad. En relación con este hallazgo, es de destacar un artículo reciente, en el que Izquierdo-Alonso et al.21 estudiaron las características de 3fenotipos clínicos en pacientes con EPOC por tabaco. Los autores también encontraron que el FMEA era más frecuente en mujeres.
Otro resultado significativo del estudio actual fue una mayor prevalencia del fenotipo enfisema en el grupo de tabaco, a expensas fundamentalmente de una mayor frecuencia de aparición de este fenotipo en el grupo de mujeres fumadoras. Es interesante destacar que un estudio anatomopatológico realizado en mujeres con EPOC mostró que, en el grupo de tabaco, las fumadoras tenían más enfisema y metaplasia de las células caliciformes que las pertenecientes al grupo de biomasa (en el cual existía más depósito de pigmento en el parénquima pulmonar y más fibrosis de las pequeñas vías aéreas)22. En la misma línea, un trabajo realizado en Colombia, que comparó 12mujeres con EPOC por humo de leña con 10mujeres con EPOC por tabaco, con similar grado de obstrucción al flujo aéreo, encontró valores de puntuación de enfisema —evaluado mediante tomografía computarizada de alta resolución (TCAR)— significativamente más altos en el grupo de tabaco, mientras que en el otro grupo había con más frecuencia engrosamiento peribronquiolar y dilataciones bronquiales23. Un estudio muy reciente, que estudió 43mujeres con EPOC (21 por biomasa y 22 por tabaco), emparejadas por edad y FEV1, demostró asimismo mayores puntuaciones de enfisema por TCAR en el grupo de tabaco y mayores niveles de atrapamiento aéreo en el grupo de biomasa24. En conjunto, todos estos resultados podrían evidenciar un mayor riesgo de sufrir enfisema al exponerse al humo de tabaco que al inhalar el humo de biomasa, riesgo que además podría ser más acentuado en las mujeres.
El fenotipo bronquitis crónica se distribuyó por igual entre los grupos de biomasa y tabaco, aunque fue más frecuente en hombres que en mujeres. En contraste, un trabajo realizado en China encontró que los pacientes con EPOC que nunca habían fumado tenían menos tos y producción de esputo que los fumadores25. Sin embargo, este artículo no se centró específicamente en la EPOC por el humo de biomasa. En el estudio de Ramírez-Venegas et al.20 no se encontraron diferencias en los porcentajes de sujetos con tos y expectoración moderada/grave entre los grupos de EPOC por el humo de biomasa y por tabaco.
El presente estudio no ha encontrado diferencias significativas en el fenotipo exacerbador frecuente entre los 2grupos a estudio. Hay pocos estudios previos que valoren este aspecto. El trabajo de Ramírez-Venegas et al.20 no encontró diferencias entre el número de exacerbaciones en pacientes con EPOC por tabaco o por biomasa. Dicho artículo también comunicó similares incidencias de asistencias a servicios de urgencias e ingresos hospitalarios en ambos grupos. De forma análoga, el estudio actual no ha hallado diferencias significativas en el número de ingresos hospitalarios por exacerbación de la EPOC.
Otro de los aspectos que pretendíamos analizar con el trabajo actual era la prevalencia de diferentes comorbilidades en los 2grupos a estudio. Este aspecto es importante por sus connotaciones pronósticas14. Además, la existencia de diferencias significativas en la frecuencia de aparición de distintas comorbilidades entre ambos grupos podría evidenciar un efecto biológico diferente de ambos tipos de humo. El estudio no ha encontrado variaciones entre ambos grupos que avalen esta hipótesis. El peso de las comorbilidades fue similar, usando 2índices validados con significación pronóstica, y las distintas comorbilidades se distribuyeron de forma similar en ambos grupos. Solo la enfermedad vascular periférica y el ulcus péptico se presentaron con más frecuencia en el grupo de tabaco pero, nuevamente, este aspecto parece relacionado con diferencias de sexo, ya que aparecieron casi exclusivamente en varones.
Es de destacar, aunque este no era el objetivo principal de este estudio, la existencia de diferencias entre los distintos fenotipos definidos, resaltando una menor gravedad, en general, del FMEA, y un menor porcentaje de pacientes exacerbadores en el fenotipo enfisema.
Las definiciones de los fenotipos empleadas en este trabajo deben ser comentadas con cierto detalle. Se reconoce en la actualidad que el FEV1 por sí solo no permite describir la heterogeneidad que existe en la EPOC. Se ha propuesto definir subgrupos de pacientes con similares características de la enfermedad, relacionadas con desenlaces significativos, con fines clínicos y de investigación8. La guía GesEPOC recomienda la clasificación de los enfermos en varios fenotipos predefinidos, que podrían tener implicaciones pronósticas y terapéuticas, pero estos fenotipos todavía no han sido totalmente validados26. El estudio actual ha empleado una definición clásica de bronquitis crónica que ha demostrado en varios estudio ser un predictor de mal pronóstico, incluyendo un mayor riesgo de exacerbaciones27,28. La definición del exacerbador frecuente se basó en la historia de exacerbaciones previas, como se ha empleado en otros trabajos18. Este fenotipo se ha demostrado relativamente estable en el tiempo18. La identificación de este fenotipo es especialmente relevante, ya que las exacerbaciones recurrentes se asocian a mala calidad de vida, pérdida acelerada de función pulmonar y mayores tasas de mortalidad29,30.
Las definiciones usadas para el fenotipo enfisema y FMEA ofrecen más controversia. La TC torácica se empleó en poco más de la mitad de los pacientes, y muchos casos en el fenotipo enfisema se definieron en base a un valor reducido de la TLCO/VA y/o una radiografía de tórax compatible, en ausencia de criterios clínicos de bronquitis crónica. Aunque Miniati et al.16 demostraron que la radiografía de tórax tiene una aceptable sensibilidad y especificidad para detectar enfisema, y que es útil para fenotipar la EPOC, es posible que el fenotipo enfisema haya sido sobrediagnosticado en el presente estudio. La definición de FMEA está basada en un documento de consenso, y todavía no ha sido validada17. Además, hemos empleado una variación de la definición propuesta para este fenotipo, que usaba valores elevados del FENO en vez de la eosinofilia en el esputo. Finalmente, los fenotipos definidos —con la excepción del exacerbador frecuente— eran mutuamente excluyentes, pero Marsh et al.31 encontraron que el 37,5% de los pacientes con EPOC tenían una combinación de más de un fenotipo.
El estudio actual tiene varias limitaciones. Las más obvias son su diseño retrospectivo, su realización en un solo centro, y un tamaño de muestra relativamente pequeño. A este último respecto, el estudio tiene suficiente poder para detectar diferencias en la prevalencia de los distintos fenotipos, de la magnitud observada entre el FMEA y el enfisema, pero podría carecer de potencia para detectar diferencias menores. El carácter retrospectivo del estudio es el principal inconveniente, y puede haber determinado algún error en la clasificación de los fenotipos clínicos. No obstante, todos los pacientes fueron manejados por el mismo equipo, que ha adoptado de forma sistemática la dinámica de clasificar a los pacientes por fenotipos al evaluarlos en la consulta, de modo que no esperamos errores significativos a este respecto. Es más relevante la posibilidad de que se haya producido un cierto grado de solapamiento entre los grupos de tabaco y biomasa, ya que los pacientes con antecedente de exposición remota a humo de biomasa y fumadores eran clasificados dentro del grupo de tabaco. Además, los pacientes fueron reclutados en un servicio de Neumología hospitalario. Por lo tanto, es inevitable un sesgo de selección. Efectivamente, había más pacientes en el grupo GOLDD que en los gruposA al C, y la prevalencia del fenotipo exacerbador frecuente era relativamente alta. Por lo tanto, la población de estudio no puede considerarse representativa de todo el espectro de gravedad de la enfermedad. Por otra parte, como se apunta en el aparatado de métodos, nos resultó difícil estimar el nivel de exposición al humo de biomasa, hecho agravado por el carácter retrospectivo del estudio. En consecuencia, no se ha podido establecer una relación dosis-respuesta entre la exposición al humo y la gravedad de la enfermedad y/o las comorbilidades. Como se discute más arriba, la definición del FMEA empleada en el presente trabajo puede ser controvertida, y la prevalencia de este fenotipo podría variar significativamente si se hubiese empleado otra definición diferente. La ausencia de un consenso general sobre la definición de este fenotipo dificulta el comparar el presente estudio con trabajos realizados por otros autores. Aunque no se incluyeron en el estudio sujetos con exposición ocupacional a polvos minerales y otros humos tóxicos, muchos de los pacientes expuestos al humo de biomasa eran labradores y ganaderos y, por tanto, estuvieron expuestos a polvos orgánicos y gases que se han asociado con la aparición de limitación crónica al flujo aéreo32. Este es un factor de confusión difícil de eliminar, que se reproduce en estudios previos sobre la EPOC por biomasa, desarrollados en su mayoría en el medio rural. La existencia de factores socioeconómicos que podrían asociarse a una peor función pulmonar en esta población es otro posible factor de confusión, difícil de soslayar.
Pese a estas limitaciones, el estudio actual ha encontrado algunas diferencias entre la EPOC por humo de biomasa y por tabaco que podrían evidenciar un efecto biológico diferente de los 2tipos de humo. Es posible que el humo de biomasa tenga un efecto menos lesivo y produzca una limitación al flujo aéreo menos grave y más tardía. La posibilidad de que el humo de tabaco produzca mayor grado de enfisema ha sido sugerida por estudios previos, y debería confirmarse mediante estudios prospectivos más amplios, que deberían, además, intentar aclarar las relaciones, posiblemente complejas, entre el efecto de uno u otro tipo de humo y las posibles diferencias de sexo en la respuesta a distintas noxas inhaladas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en relación con el presente artículo.