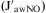La producción de óxido nítrico (NO) se describe mediante un modelo bicompartimental que relaciona la producción y la movilidad de NO desde los alvéolos hacia las vías aéreas. La espiración a múltiples flujos permite deducir la concentración alveolar de NO (CaNO), marcador indirecto del estado inflamatorio de las zonas distales del pulmón. El objetivo fue determinar los valores de referencia de CaNO. En 33 individuos sanos se determinaron la concentración espirada de NO (FeNO) a 50ml/s y la CaNO a 10, 30, 100 y 200ml/s mediante un sensor de quimioluminiscencia (NIOX Aerocrine). El valor medio (± desviación estándar) de FeNO fue de 15±6ppb y de CaNO fue de 3,04±1,30ppb. Los valores de CaNO obtenidos en individuos sanos permitirán analizar el comportamiento inflamatorio alveolar en procesos respiratorios y sistémicos.
Nitric oxide (NO) production has been described using a 2-compartment model for the synthesis and movement of NO in both the alveoli and the airways. The alveolar concentration of NO (CaNO), an indirect marker of the inflammatory state of the distal portions of the lung, can be deduced through exhalation at multiple flow rates. Our objective was to determine reference values for CaNO. The fraction of exhaled NO (FeNO) was measured in 33 healthy individuals at a rate of 50mL/s; the subjects then exhaled at 10, 30, 100, and 200mL/s to calculate CaNO. A chemiluminescence analyzer (NIOX Aerocrine) was used to perform the measurements. The mean (SD) FeNO was 15 (6)ppb. The mean CaNO was 3.04 (1.30)ppb. These values of CaNO measured in healthy individuals will allow us to analyze alveolar inflammatory behavior in respiratory and systemic processes.
El óxido nítrico (NO) es un gas lipofílico y de vida media muy corta, que se sintetiza en el epitelio respiratorio, fundamentalmente por la enzima NO sintetasa inducible o tipo 2 (iNOS), enzima constitutiva que activan citocinas inflamatorias, macrófagos y ciertas moléculas de adherencia. De esta forma el NO interviene en el proceso infamatorio de diferentes enfermedades respiratorias, además de participar como inmunomodulador, inhibidor plaquetario y potente vasodilatador. Se ha demostrado asimismo una sobreactividad de la enzima iNOS en ciertos procesos, lo que se refleja en un incremento de la producción de NO1.
En los últimos años, el desarrollo de un procedimiento no invasivo y sencillo para determinar la concentración de NO en aire espirado (FeNO) ha permitido cuantificar indirectamente y de forma rápida y fiable la magnitud de la inflamación en ciertas enfermedades respiratorias como el asma2. Se han objetivado valores elevados de FeNO en pacientes con asma y una disminución después del tratamiento con corticoides. La sencillez y la fiabilidad de esta técnica la han convertido en una herramienta útil en el diagnóstico del asma, en el control y en el cumplimiento terapéutico, así como en la prevención de agudizaciones, ya permite detectar y tratar de inmediato los incrementos de actividad inflamatoria3,4.
Sin embargo, desde el punto de vista fisiológico, el NO del aire espirado tiene múltiples orígenes en el pulmón y su determinación depende en gran medida del flujo espiratorio, a diferencia de otros gases endógenos como el nitrógeno. Para realizar una mejor aproximación teórica a su determinación, se ha descrito un modelo del pulmón que se basa en la existencia de 2 compartimientos bien diferenciados, el bronquial y el alveolar, y que ayudaría a entender los cambios dinámicos del NO en el aire espirado5–7. De esta forma, frente a la determinación habitual de la FeNO, que se realiza a un determinado flujo aéreo de una manera fija y que “marca” la actividad inflamatoria bronquial, se ha propuesto que la concentración alveolar de NO (CaNO) podría reflejar indirectamente la situación inflamatoria del territorio más distal (membrana alveolocapilar) y ser un indicador de lo que acontece en el ámbito endotelial. Este procedimiento se encuentra aún en una fase preclínica y, por ello, el objetivo de nuestro estudio ha sido desarrollar el modelo bicompartimental de NO, mediante la técnica de espiración constante a múltiples flujos, describir las características del procedimiento de obtención y establecer valores de referencia de CaNO en personas sanas.
Descripción de la técnica y procedimientoDeterminación de la concentración de óxido nítrico en aire espirado: espiración a un flujo constanteLa determinación de FeNO se realizó mediante la técnica de espiración constante a un flujo (50ml/s) con un sensor de quimioluminiscencia (NIOX® Aerocrine AB, Estocolmo, Suecia), según recomendaciones internacionales8. El paciente realizaba una inspiración desde el equipo hasta alcanzar la capacidad pulmonar total y, a continuación, una espiración a un flujo constante de 50ml/s a través de una boquilla con una resistencia de 20cmH2O (para asegurar el cierre del velo del paladar y evitar la contaminación con el NO nasal). El trazador del equipo desestima el pico inicial de espiración y mide el plateau (meseta de 3s y gradiente de variabilidad del 10%) dando como válida la medición. El procedimiento se realizaba en 3 ocasiones y se promediaban las determinaciones válidas8.
Determinación de la concentración de óxido nítrico alveolar: técnica de espiración a múltiples flujosLa técnica de espiración a múltiples flujos se realiza de forma similar que la determinación de FeNO a un solo flujo (50ml/s) y con el mismo sensor de quimioluminiscencia. La diferencia radica en que el paciente, en vez de una sola espiración, efectúa varias espiraciones desde capacidad pulmonar total a 3 o 4 flujos de espiración constante que se encuentran entre 10 y 500ml/s. De esta forma el trazador muestra una concentración de NO para cada flujo espiratorio utilizado (VNO, pl/s)9. En nuestro estudio se realizó la espiración constante a 4 flujos (10; 30; 100, y 200ml/s). Para el cálculo de los parámetros se determinaron los valores correspondientes a 2 de ellos, 100 y 200ml/s, y se utilizaron las ecuaciones de Tsoukias y George6 y Silkoff et al7 para realizar el cálculo matemático de los parámetros independientes del flujo necesarios: la CaNO, el flujo máximo de NO en la vía aérea
y la capacidad de difusión de NO a la luz (DawNO)9.SujetosSe seleccionó a 36 voluntarios sanos (16 varones y 20 mujeres), no fumadores, sin antecedentes de atopia, que presentaban valores espirométricos dentro del margen de referencia, no habían tenido enfermedades intercurrentes en los últimos 6 meses ni recibían tratamiento farmacológico de ningún tipo.
Se les determinó la FeNO a un flujo fijo (50ml/s) utilizando un sensor de quimioluminiscencia. Además se midió la CaNO según la técnica de espiración constante a múltiples flujos (10; 30; 100, y 200ml/s). Todas las determinaciones se efectuaron siempre en la misma franja horaria y 2h después de la última ingesta alimentaria.
Análisis estadísticoPara la descripción de los valores de FeNO, CaNO, J′awNO y DawNO se facilitan los valores medios y su desviación estándar. La comparación entre valores se llevó a cabo mediante la correlación lineal de Pearson. En todos los casos la aproximación fue bilateral y el valor de significación el habitual del 5% (α=0,05). Para el análisis se empleó el paquete estadístico SPSS (versión 11.5; SPSS Inc., Chicago, Illinois, EE.UU.).
ResultadosDe los 36 individuos que iniciaron el estudio, se excluyó a 3 porque no realizaron correctamente la técnica de espiración. Se estudió, pues, a los 33 restantes (17 mujeres y 16 varones), todos ellos no fumadores, con una edad media (± desviación estándar) de 36±11 años, índice de masa corporal medio de 23,8±2,8kg/m2 y función respiratoria dentro del margen de referencia: volumen espiratorio forzado en el primer segundo del 106±11%, capacidad vital forzada del 102±10% y cociente de ambos parámetros del 81±6%).
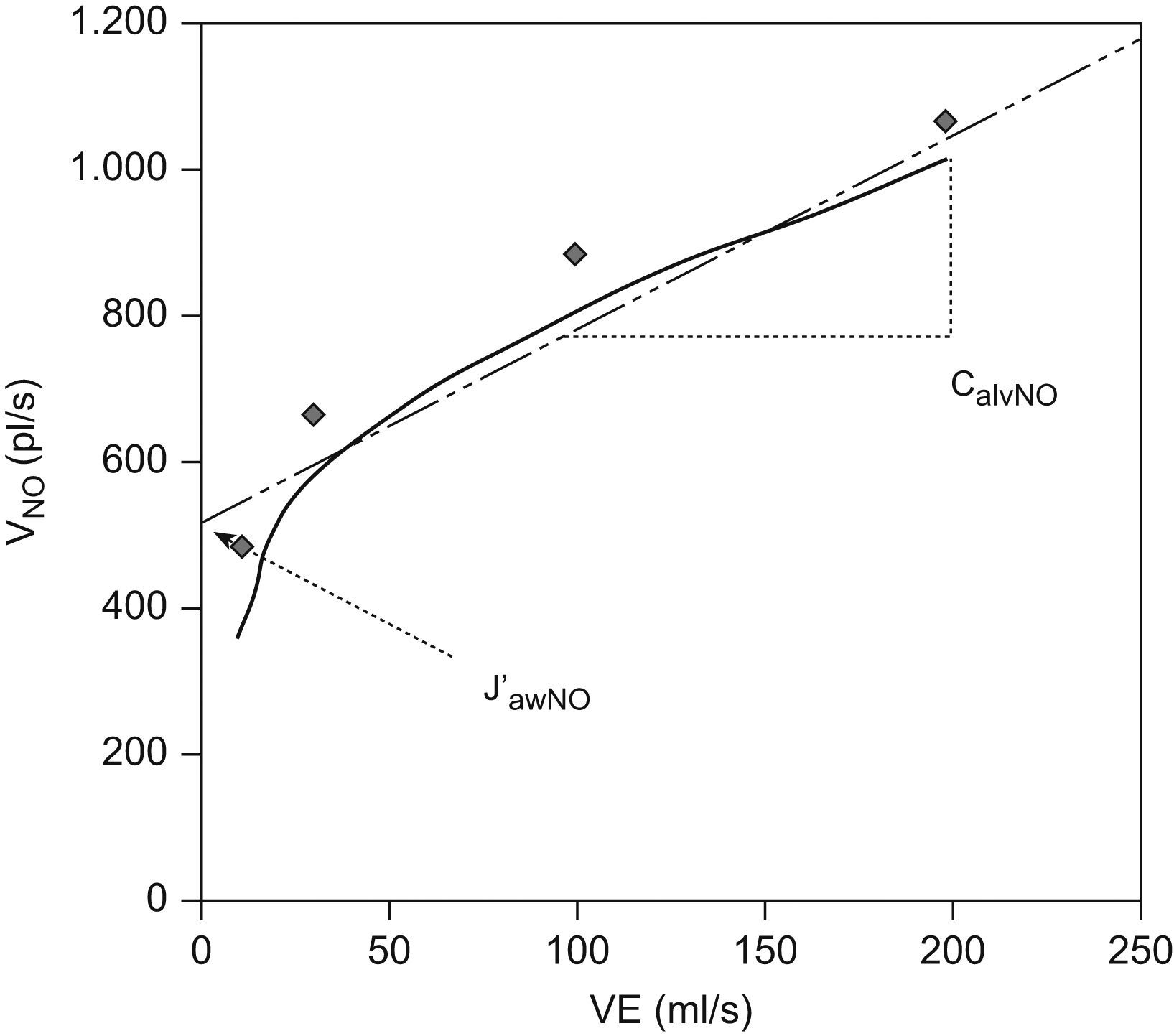
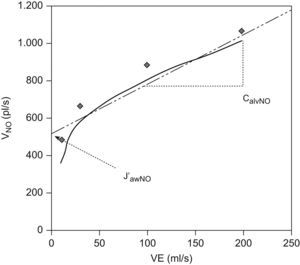
El valor medio de FeNO fue de 15±6ppb (rango: 5,5–27ppb), el de CaNO de 3,04±1, 30ppb (rango: 1,45–6,31ppb), el de J′awNO de 573±145 pl/s (113–1.755) (fig. 1) y el de DawNO de 4,49±3ppb/s. La relación entre los valores de FeNO y CaNO respecto a la edad, el sexo, el índice de masa corporal y los valores espirométricos no fue estadísticamente significativa (p>0,05).
No se encontró una correlación estadísticamente significativa entre la determinación de FeNO y CaNO en este grupo de individuos (p=0,4; r=0,1).
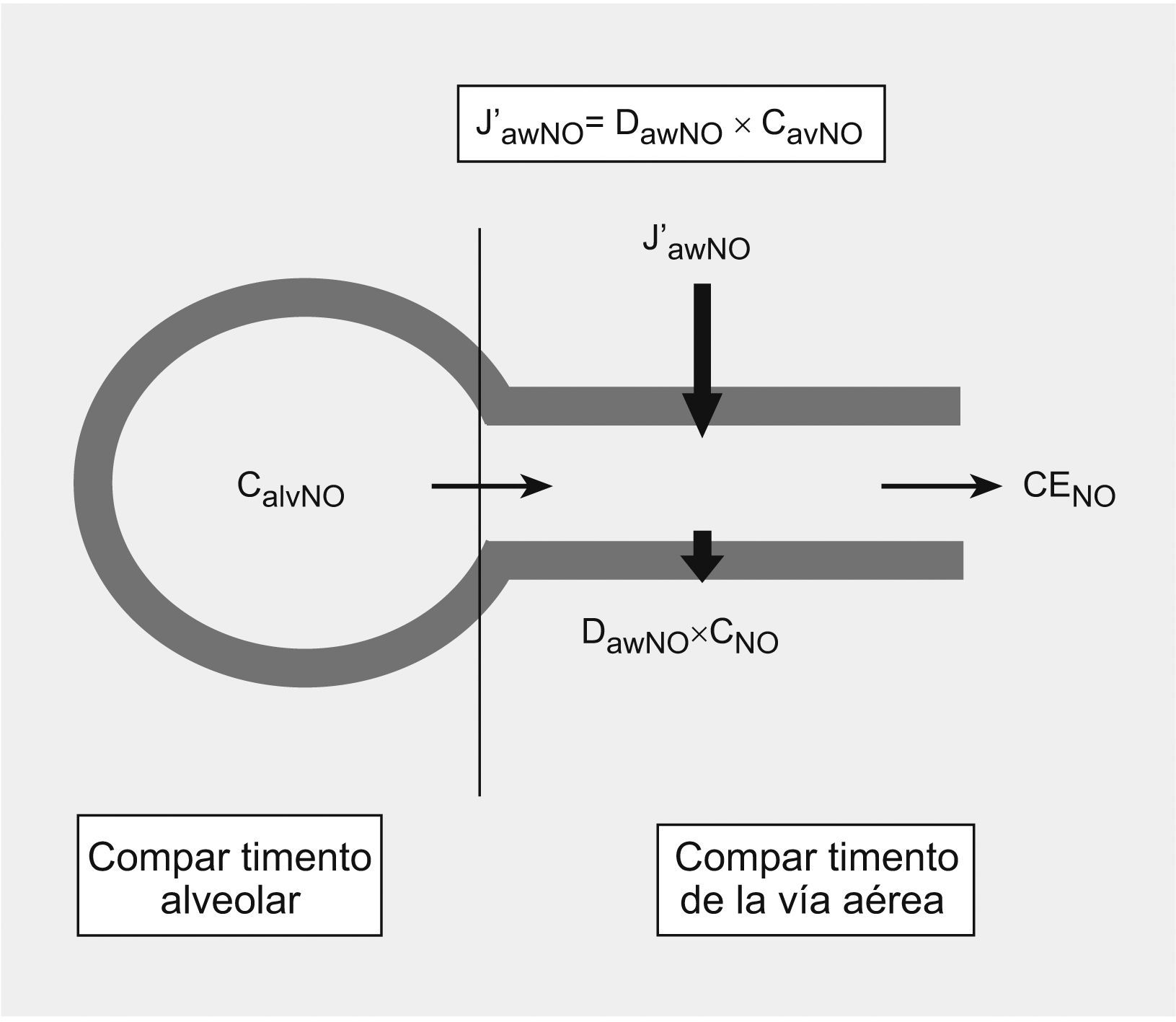
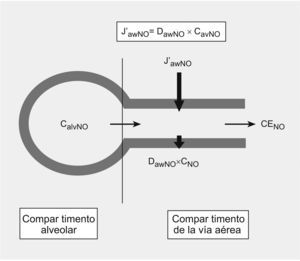
DiscusiónEl modelo bicompartimental utilizado para explicar mejor los cambios dinámicos del NO5–7 se basa en la existencia de 2 zonas teóricamente bien diferenciadas, que definirían la procedencia del NO en el aire espirado, el compartimiento de la vía aérea y el compartimiento alveolar, definidos a su vez por 3 parámetros independientes del flujo. El compartimiento de la vía aérea está determinado por el J′awNO y por DawNO. Según la ley de Fick, la producción de NO en la vía aérea es proporcional a la diferencia entre la concentración existente en la luz y la concentración en la pared bronquial. A su vez, la DawNO dependerá de la concentración de NO en la pared bronquial10. Por otro lado, el compartimiento alveolar está definido por el tercer parámetro independiente del flujo, la CaNO, que sufre modificaciones de forma dinámica y cíclica con la respiración y que refleja el equilibrio existente entre el NO producido localmente y el que se difunde a la vía aérea (fig. 2).
Modelo bicompartimental de óxido nítrico (NO). La concentración de NO en aire espirado (CENO=FeNO) es la suma de las concentraciones de NO en la región alveolar y la vía aérea que viene determinada por 3 parámetros independientes del flujo: flujo máximo de NO en la vía aérea (J′awNO), capacidad de difusión de NO a la luz (DawNO) y concentración alveolar de óxido nítrico (CaNO).
El NO alveolar es conducido por la vía aérea durante la espiración, de tal forma que la concentración final de NO en la vía aérea será la suma del transporte longitudinal desde la luz alveolar y la concentración del transporte transversal de toda la vía aérea9. Con este modelo, y utilizando estos parámetros, se puede predecir la concentración de NO a cualquier flujo espiratorio desestimando el NO procedente de los senos paranasales (fig. 2).
La técnica para determinar los 3 parámetros independientes del flujo descritos con anterioridad se realiza mediante la espiración constante a diferentes flujos, método descrito y estandarizado pero no utilizado en la clínica práctica de forma habitual5–7. Para efectuar esta técnica es necesario disponer del sensor de quimioluminiscencia que se emplea habitualmente para determinar la FeNO y que debe permitir la espiración a diferentes flujos.
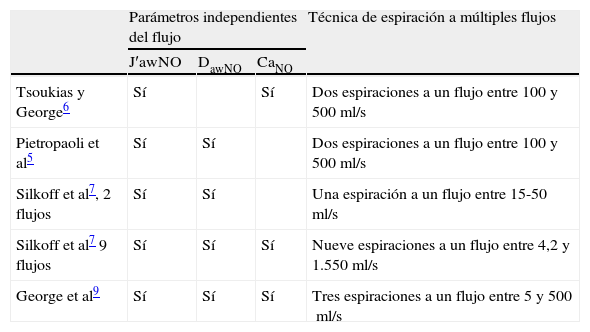
A fin de facilitar el cálculo de los parámetros independientes del flujo que nos facilita el sensor, un grupo de autores desarrolló en la década de los ochenta un modelo matemático mediante técnicas y ecuaciones analíticas que estiman de forma reproducible y fiable los parámetros necesarios para la utilización práctica del modelo bicompartimental9. Tsoukias y George6 utilizaron una técnica de espiración con 2 flujos, entre 100 y 500ml/s. Si se contrasta en una gráfica la concentración de NO para cada flujo espiratorio utilizado (VNO) con el flujo espiratorio de cada espiración (VE, ml/s), nos da una recta de la que matemáticamente pueden obtenerse 2 de los parámetros: la pendiente de la recta será la CaNO y la intersección, el J′awNO (fig. 1). Por otro lado, la ecuación de Silkoff et al7 permite determinar la difusión de NO en la vía aérea (DawNO=J′awNO×CaNO). Como puede observarse en la tabla 1, otros autores realizan operaciones matemáticas más complejos para el cálculo de los parámetros.
Técnicas de espiración constante a múltiples flujos y los modelos matemáticos analíticos*
| Parámetros independientes del flujo | Técnica de espiración a múltiples flujos | |||
| J′awNO | DawNO | CaNO | ||
| Tsoukias y George6 | Sí | Sí | Dos espiraciones a un flujo entre 100 y 500ml/s | |
| Pietropaoli et al5 | Sí | Sí | Dos espiraciones a un flujo entre 100 y 500ml/s | |
| Silkoff et al7, 2 flujos | Sí | Sí | Una espiración a un flujo entre 15-50ml/s | |
| Silkoff et al7 9 flujos | Sí | Sí | Sí | Nueve espiraciones a un flujo entre 4,2 y 1.550ml/s |
| George et al9 | Sí | Sí | Sí | Tres espiraciones a un flujo entre 5 y 500ml/s |
Modificada de George et al9.
CaNO (ppb): concentración media de óxido nítrico (NO) en el tejido alveolar; CawNO: concentración media de NO en la pared bronquial; CENO (ppb)=FeNO: fracción o concentración espirada de NO a un flujo determinado; DawNO: capacidad de difusión del compartimiento de la vía aérea; J′awNO (pl NO/s): flujo máximo total de NO en el compartimiento de la vía aérea; VE (ml/s): flujo de espiración realizado en cada maniobra (10, 30, 100, etc.)8; VNO (pl/s): flujo máximo de óxido nítrico que se consigue al realizar la espiración a un determinado flujo.
Ecuaciones: CENO=(J′awNO×1/VE)+CaNO (de Pietropaoli et al5); VNO=(CANO×VE)+J′awNO (de Tsoukias y George6); DawNO=VE×(CENO−CaNO)/(CawNO−CaNO) (de Hogman citado en George6); and J′awNO=DawNO×CawNO (de Silkoff et al7). Para la determinación del CaNO se utilizan 2 flujos, entre los cuales (100–500) se determina la pendiente de la recta de confrontación entre el VE y VNO. La pendiente será la determinación de CaNO9.
El valor medio de CaNO obtenido en nuestro estudio (3,04±1,30ppb) se encuentra dentro de los valores de referencia descritos en la literatura médica para personas sanas (1,0–5,6ppb)11,12 y muestra correlación con los valores de CaNO medidos en la vía aérea distal mediante lavados broncoalveolares con fibrobroncoscopia en personas sanas12. Asimismo, nuestros resultados de CaNO son equiparables a los obtenidos en individuos sanos incluidos en estudios de casos y controles sobre enfermedades respiratorias inflamatorias como el asma o la enfermedad pulmonar obstructiva crónica (EPOC)10. Por otro lado, los valores de J′awNO (573pl/s) y de DawNO (4,49ppb/s) se encuentran dentro del margen de referencia establecido en la literatura científica5–11 (420–1.280pl/s y 3,1–9,2ppb/s, respectivamente).
La técnica de espiración a múltiples flujos mediante un sensor de quimioluminiscencia adecuado permite determinar de forma sencilla, fiable y precisa los valores de CaNO y establecer valores de referencia en individuos sanos. Como la CaNO refleja un estado inflamatorio periférico y distal, a diferencia de la FeNO, que muestra inflamación bronquial, en los últimos años múltiples estudios han intentado establecer los valores de CaNO en las enfermedades respiratorias con inflamación distal. De esta forma se han objetivado valores patológicos de CaNO en fumadores o en pacientes con asma, EPOC o enfermedad intersticial, asociada o no a esclerodermia13–16. Lehtimäki et al11 realizaron un estudio de casos y controles en el que incluyeron a pacientes asmáticos, pacientes con alveolitis e individuos sanos. En los pacientes con asma los valores de J′awNO fueron superiores a los obtenidos en personas sanas y en los afectados de alveolitis (2,5 frente a 0,1 y 0,7ppb, respectivamente)11. En cambio, la CaNO era superior en los pacientes con alveolitis (4ppb), mientras que los sanos y los pacientes con asma presentaban valores inferiores y similares entre sí (1ppb). La presencia de pacientes asmáticos con escasa afectación de la función pulmonar (asma leve), sin tratamiento y de diagnóstico reciente, que presentaban inflamación bronquial pero poca inflamación periférica, podría explicar la diferencia en los valores de CaNO y el aumento de los de J′awNO en el grupo de pacientes con asma. En consonancia con este estudio, Brindicci et al17 encontraron que los pacientes con asma grave y sin control terapéutico presentaban valores de CaNO superiores a los individuos sanos y a los pacientes con asma leve. Sin embargo, la concentración de NO bronquial era superior en los pacientes con asma leve que en aquéllos con asma grave. Se han obtenido resultados similares en otros estudios14–18. Además, se ha demostrado que existe una correlación negativa y positiva entre la gravedad de los síntomas de los pacientes asmáticos y la determinación de NO bronquial y alveolar, respectivamente18. Estos resultados demuestran que la situación clínica de los pacientes con asma grave y/o resistente al tratamiento está determinada en mayor grado por la inflamación alveolar que por la inflamación bronquial, de tal forma que la determinación de CaNO en estos pacientes podría ser muy útil para el control terapéutico de la enfermedad y tendría mayor precisión que la utilización de FeNO. Por todo ello, la determinación de la CaNO es útil para conocer la situación de inflamación alveolar en enfermedades respiratorias con afectación distal en el pulmón (asma grave, neumopatía intersticial, EPOC), cuantificar el daño alveolar y seguir el curso de la enfermedad.
En cuanto a las limitaciones de la técnica, cabe mencionar que uno de los factores más importantes que modifican las concentraciones de NO en la vía aérea es el tabaco. Respecto a las concentraciones de FENO los estudios publicados muestran resultados variables, dispares e incluso en ocasiones contradictorios. En algunos, los fumadores presentan valores de FeNO menores que los no fumadores, y estos valores aumentan cuando abandonan el hábito tabáquico, aunque no lleguen a alcanzar los valores de referencia13,14. Asimismo, los fumadores presentan valores de CaNO menores que los exfumadores (0,93 frente a 1,41ppb) y que los no fumadores (1,32ppb), resultados que se explican por la asociación entre disfunción endotelial y el efecto tóxico del tabaco19,20. Los cigarrillos contienen un gran número de radicales libres y sustancias pro-oxidantes que generan una disminución de la bioactividad del NO y favorecen un estado de estrés oxidativo. Además, los fumadores presentan un déficit de la síntesis de un cofactor necesario para que la NOS endotelial, la tetrahidrobiopterina, debido a la absorción de aminas aromáticas que inhiben la producción de este cofactor21, favoreciendo así la síntesis de moléculas superóxido que contribuyen al estado de estrés oxidativo19. Por otro lado, el tabaco contiene el aminoácido N-nitrosamina, con poder inhibidor de los macrófagos alveolares para la producción de NO19. Todo ello explicaría que los valores de FeNO y de CaNO en pacientes con EPOC fumadores o exfumadores empedernidos puedan estar disminuidos20. De esta forma su utilidad se verá limitada en pacientes fumadores, pues el resultado estará influido por el hábito tabáquico y no será valorable en el momento de tomar decisiones diagnóstico-terapéuticas. Otras limitaciones de la técnica son las derivadas de la maniobra respiratoria, de la dificultad para realizarlas según el tipo de paciente y de la falta de colaboración. No se han descrito contraindicaciones.
En resumen, el modelo bicompartimental para la determinación de parámetros independientes del flujo permite analizar la procedencia y el intercambio dinámico de NO en la vía aérea y en la región alveolar, 2 partes anatómicamente alejadas en el espacio y responsables de enfermedades respiratorias diferentes. Además, permite describir mejor los cambios metabólicos y estructurales que se producen en enfermedades que afectan a alguno de los 2 compartimientos. El parámetro independiente del flujo más relevante para la descripción del estado de inflamación distal del aparato respiratorio es la CaNO. El método de espiración a múltiples flujos que describe el modelo bicompartimental es una técnica no invasiva y sencilla, que permite determinar la CaNO de forma rápida y fiable. Una vez establecidos los valores de referencia de CaNO, se requiere la determinación de CaNO en pacientes con enfermedades respiratorias que presenten inflamación distal. De esta forma la determinación de CaNO podría ser un marcador del estado inflamatorio y una herramienta útil en el control clínico, terapéutico e incluso pronóstico de pacientes con asma grave, asma refractaria al tratamiento o con enfermedad intersticial.