La gasometría arterial es la medición de elección para el diagnóstico de insuficiencia respiratoria crónica en la enfermedad pulmonar obstructiva crónica (EPOC). Se ha sugerido que el FEV1 se sitúe entre el 30 y el 50% del valor teórico para su indicación, pero estas cifras nunca han sido validadas.
ObjetivoIdentificar los valores de FEV1 post-broncodilatador (BD) y saturación arterial de oxígeno (SaO2) que proporcionen la mejor sensibilidad, especificidad y coeficientes de probabilidad (CP) para el diagnóstico de insuficiencia respiratoria crónica hipoxémica y/o hipercápnica en la EPOC estable.
MétodosSe incluyeron 150 pacientes (39 con PaO2 < 60 mmHg [8 kPa] y 14 de ellos con una PaCO2 ≥ 50 mmHg [6,7 kPa]). Se seleccionaron los mejores puntos de corte de FEV1 post-BD y SaO2 para predecir la insuficiencia respiratoria crónica empleando los CP y las curvas Receiver Operating Characteristic.
ResultadosUn FEV1 post-BD igual al 36% y una SaO2 del 90% fueron los mejores valores predictivos de insuficiencia respiratoria hipoxémica y un FEV1 post-BD igual al 33% para la variante hipercápnica. Un FEV1 ≥ 45% descartó la insuficiencia respiratoria hipoxémica.
ConclusiónUn FEV1 post-BD igual al 36% se erige en el mejor punto de corte para predecir adecuadamente tanto la insuficiencia respiratoria hipoxémica como la hipercápnica en el paciente con EPOC estable. Por su parte, una SaO2 del 90% ofrece el mejor valor para la insuficiencia hipoxémica aislada. Estos valores podrían ser considerados para futuras recomendaciones/guías clínicas de la EPOC.
To diagnose and assess chronic respiratory failure in stable chronic obstructive pulmonary disease (COPD) the measurement of arterial blood gases (ABG) is required. It has been suggested that ABG be determined for this purpose when FEV1 ranges between 50% and 30% predicted, but these thresholds are not evidence-based.
ObjectiveTo identify the post-bronchodilator (BD) FEV1 and arterial oxygen saturation (SaO2) values that provide the best sensitivity, specificity, and likelihood ratio (LR) for the diagnosis of hypoxaemic and/or hypercapnic chronic respiratory failure in stable COPD.
MethodsA total of 150 patients were included (39 with PaO2 < 60 mmHg [8 kPa], 14 of them with a PaCO2 ≥ 50 mmHg [6.7 kPa]). The best post-BD FEV1 and SaO2 cut-off points to predict chronic respiratory failure were selected using the PC and the Receiver Operating Characteristics (ROC) curves.
ResultsA post-BD FEV1 equal to 36% and an SaO2 of 90% were the best predictive values for hypoxaemic respiratory failure and a post-BD FEV1 equal to 33% for the hypercapnic variant. An FEV1 ≥ 45% ruled out hypoxaemic respiratory failure.
ConclusionA post-BD FEV1 of 36% is the best cut-off point to adequately predict both hypoxaemic and hypercapnic respiratory failure in the patient with stable COPD. For its part, an SaO2 of 90% is the best value for isolated hypoxaemic failure. These values could be considered for future clinical recommendations/guidelines for COPD.
La gasometría arterial (GSA) es el procedimiento clínico usual para el diagnóstico y tratamiento de la insuficiencia respiratoria crónica en la enfermedad pulmonar obstructiva crónica (EPOC)1,2. En principio, la GSA practicada mediante punción arterial radial o de otra arteria periférica resulta la práctica más recomendada. La punción del lóbulo de la oreja sólo refleja la presión arterial de dióxido de carbono (PaCO2)3,4 y la pulsioximetría, que es la mejor alternativa no lesiva, sólo es útil para evaluar la evolución de la insuficiencia respiratoria y/o ajustar las pautas de oxigenoterapia5.
La insuficiencia respiratoria crónica se define como un estado o situación en el que los valores de PaO2 son inferiores a 60 mmHg (8 kPa), con o sin hipercapnia (PaCO2 ≥ 50 mmHg [6,7 kPa]) asociada, respirando aire ambiental (en condiciones estándares)6. Sin embargo, no todos los pacientes con EPOC, sobre todo aquellos con un estadio avanzado, presentan insuficiencia respiratoria hipoxémica o hipercápnica7,8. Dado que la GSA es un método diagnóstico lesivo, no siempre indicado en la práctica clínica, sería útil que otras variables funcionales mucho menos lesivas, como el FEV1 y la SaO2, pudieran orientar con la mayor precisión posible la práctica de una GSA para el diagnóstico de dicha insuficiencia respiratoria.
El primer informe de la Global Initiative for Chronic Obstructive Lung Disease (GOLD) recomendó que la GSA fuera practicada en las condiciones estándares habituales en un paciente con EPOC estable cuando el FEV1 post-broncodilatador (BD) fuera inferior al 40% del valor teórico como mejor punto de corte9. Sin embargo, su más reciente actualización recomendó un valor inferior al 50%, consistente con la clasificación espirométrica grave (estadio 3) de la enfermedad10. Hay que destacar que la guía National Institute for Clinical Excellence (NICE) propone efectuar la GSA cuando el FEV1 pre-BD sea inferior al 30% del valor teórico y recomienda su realización en pacientes menos graves cuando el FEV1 pre-BD se sitúe entre el 30 y el 49% del valor teórico o la SaO2 sea igual o inferior al 92%5. Sin embargo, ninguno de estos puntos de corte ha sido validado hasta la actualidad.
Hay que destacar que tan sólo ha habido un trabajo, retrospectivo, que haya propuesto como punto de corte del FEV1 más adecuado para la práctica de la GSA un dintel inferior al 40% del valor teórico11. Es obvio que si el punto de corte es muy alto, todos los pacientes con insuficiencia respiratoria hipoxémica o hipercápnica serán diagnosticados, si bien a muchos otros, cuyas cifras no se sitúen a dicho nivel, se les podría practicar de forma innecesaria una GSA, con sus riesgos y costes habituales12. Sin embargo, si el punto de corte del FEV1 es muy inferior, algunos pacientes con insuficiencia respiratoria quedarán sin diagnóstico, lo que puede comportar la aparición de complicaciones propias de la insuficiencia respiratoria subyacente.
La hipótesis que nos planteamos fue que deberían identificarse unos valores adecuados de FEV1 post-BD y SaO2 para descartar la presencia de insuficiencia respiratoria crónica, que ayudarían a orientar mejor la indicación de la GSA en pacientes con EPOC estable avanzada. El objetivo de nuestro estudio fue, por tanto, investigar los puntos de corte más adecuados para el FEV1 post-BD y la SaO2 evaluando las interrelaciones entre el FEV1 (expresado como porcentaje del valor teórico) y la SaO2 (como porcentaje), por un lado, y los valores de PaO2 y PaCO2 (en mmHg), por otro, en 150 pacientes con EPOC estable que abarcasen el espectro completo de la enfermedad.
MétodosPoblación de estudio y medicionesLos pacientes incluidos (n = 150) correspondieron a todos aquellos en los que se investigaron las distribuciones de las relaciones ventilación-perfusión en nuestro centro mediante la técnica de la eliminación de gases inertes múltiples13. La procedencia de los pacientes fue la siguiente: 21 habían sido hospitalizados por una agudización previa de su EPOC; 59 pacientes habían sido intervenidos para extirpación de un nódulo pulmonar (n = 29), cirugía resectiva de volumen pulmonar (n = 11) o trasplante pulmonar (n = 19); y los 70 pacientes restantes fueron reclutados para diversos estudios, de los cuales tan sólo 10 tenían una EPOC leve (GOLD estadio 1). Estas mediciones fueron realizadas en condiciones experimentales determinadas a lo largo del período comprendido entre 1987 y 2008 usando tres analizadores diferentes de gases sanguíneos (IZASA modelo ILBG 3, IZASA modelo IL1302 y Bayer 800) en 14 estudios distintos, cuyos resultados han sido publicados extensamente14. Las mediciones de GSA se efectuaron en condiciones estables, cuando menos tres meses después de la última exacerbación, por duplicado, respirando aire ambiental, en posición sentada y a nivel del mar. Los valores de SaO2 fueron obtenidos a partir de estas muestras gasométricas14. Se excluyeron pacientes con procesos concomitantes o comorbilidades (insuficiencia cardiaca, diabetes mellitus u otras enfermedades respiratorias crónicas, tales como el síndrome de apneas del sueño)14. Todos los pacientes eran fumadores activos (n = 30) o ex-fumadores (n = 120) y la gran mayoría eran varones (n = 142). La distribución por estadios según el informe GOLD fue: 15 pacientes (10%), estadio 1; 40 (27%), estadio 2; 32 (21%), estadio 3; y 63 (42%), estadio 4. Todos los pacientes aceptaron participar y firmaron los consentimientos informados respectivos tras una descripción detallada de cada estudio y fueron aprobados por el comité ético del Hospital Clínic, Universitat de Barcelona.
Análisis estadísticoLos resultados son expresados como media ± desviación estándar para las variables de distribución normal o como mediana y percentil 5 y 95 (P5-P95) para las de distribución anormal. Teniendo como variable-diana los valores universales de PaO2 y PaCO2 definitorios de insuficiencia respiratoria6, se realizó el análisis de las curvas Receiver Operating Characteristic (ROC) dividiendo dichas variables de manera dicotómica en insuficiencia respiratoria crónica aislada (PaO2 < 60 mmHg [8 kPa] versus PaO2 ≥ 60 mmHg) y/o hipercápnica (PaO2 < 60 mmHg y PaCO2 ≥ 50 mmHg [6,7 kPa] versus PaCO2 < 50 mmHg) y construyendo dichas curvas para determinar el mejor valor del FEV1 (expresado como porcentaje del teórico) y SaO2 (en porcentaje) para predecir ambos tipos de insuficiencia respiratoria (hipoxémica e hipercápnica). Asimismo, se calculó el área bajo la curva (Area Under the curve, AUC) para cada curva ROC, de forma no paramétrica15,16.
También se calcularon los valores predictivos, positivo (VPP) y negativo (VPN), para evaluar los mejores resultados positivos y negativos del procedimiento17. A continuación, se exploraron la capacidad diagnóstica de predicción del FEV1 post-BD, en un intervalo del 30 y el 50% del valor teórico, y de la SaO2, entre el 90 y el 94%, y se seleccionaron los puntos de corte respectivos que incluyeran las mejores sensibilidad y especificidad. Se evaluaron también las medias e intervalos de confianza del 95% (IC 95%) para la sensibilidad, especificidad, VPP y VPN15. Las estimaciones de la sensibilidad son necesarias para el cálculo de los coeficientes de probabilidad (CP), que se definen como la probabilidad de un valor determinado en un paciente afectado de un cuadro clínico en comparación con su probabilidad en otro paciente que no padece dicha condición clínica. Un CP positivo (+), calculado mediante el cociente sensibilidad/(1-especificidad)], por encima de 10 resulta necesario para que la prueba diagnóstica sea considerada con una evidencia confirmatoria potente del cuadro clínico, mientras que un CP negativo (−), calculado con el cociente (1-sensibilidad)/especificidad por debajo de 0,10, es considerado suficiente para descartar la condición. Los CP no se ven modificados por la prevalencia del cuadro clínico subyacente, por lo que son una herramienta robusta para evaluar biomarcadores de enfermedades. En este sentido, los CP fueron utilizados para evaluar los mejores valores predictivos del FEV1 post-BD (como porcentaje del teórico) y de la SaO2 (en porcentaje) usando la PaO2 < 60 mmHg como objetivo primario18, con o sin hipercapnia (PaCO2 ≥ 50 mmHg) asociada. Los cálculos fueron realizados con el empleo de los programas SPSS/PC (versión 15.0, SPSS Inc., Chicago, IL, EE. UU.) y MedCalc (versión 9.3.9.0; MedCalc, Mariakerke, Bélgica).
ResultadosLa tabla 1 muestra las características principales de nuestra población en estudio. Un total de 39 pacientes con EPOC (26%) presentaron insuficiencia respiratoria crónica: 25 tenían hipoxemia arterial severa (PaO2 < 60 mmHg) aislada y 14 asociaban hipercapnia (PaCO2 ≥ 50 mmHg). Tanto los pacientes obesos (índice de masa corporal, 32 ± 2 kg/m2; n = 18; 12%) como no obesos (24± 3 kg/m2; n = 132; 88%) mostraron valores similares de PaCO2 (42 ± 6 y 41 ± 6 mmHg) y pH (7,39 ± 0,90 y 7,40 ± 0,10), respectivamente. La PaO2 en pacientes con insuficiencia respiratoria hipoxémica (54 ± 5 mmHg) y en aquellos con insuficiencia respiratoria hipercápnica (52 ± 5 mmHg) no fue diferente (p = 0,11); por contra, la PaCO2 fue significativamente superior en el grupo de insuficiencia respiratoria hipercápnica (55 ± 5 mmHg) comparada con la de los que sólo tenían la variedad hipoxémica (44 ± 4 mmHg) (p < 0,05).
Características clínicas y funcionales de los pacientes
| Variables | Participantes (n = 150) |
| Género (M:F) | 142:8 |
| Edad (años) | 61 ± 7 |
| IMC (kg/m2) | 25 (19-33) |
| FEV1/FVC Pre-BD | 0,40 (0,23-0,67) |
| FEV1 pre-BD (% teórico) | 35 (16-81) |
| FEV1/FVC Post-BD | 0,41 (0,24-0,56) |
| FEV1 post-BD (% teórico) | 40 (17-86) |
| TLC (% teórico) | 114 ± 22 |
| FRC (% teórico) | 158 ± 46 |
| IC (% teórico) | 65 ± 24 |
| DLCO (% teórico) | 56 ± 23 |
| pH | 7,40 ± 0,4 |
| PaO2 (mmHg) | 69 ± 13 |
| SaO2 (%) | 92 ± 5 |
| PaCO2 (mmHg) | 40 (32-51) |
| AaPO2 (mmHg) | 32 ± 9 |
Los valores son expresados como medias ± DE o medianas (P5-P95).
AaPO2: gradiente alveolo-arterial de oxígeno; DLCO: capacidad de difusión de monóxido de carbono; FRC: capacidad residual funcional; IC: capacidad inspiratoria; IMC: índice de masa corporal; PaCO2: presión arterial de dióxido de carbono; PaO2: presión arterial de oxígeno; SaO2: saturación arterial de oxígeno;
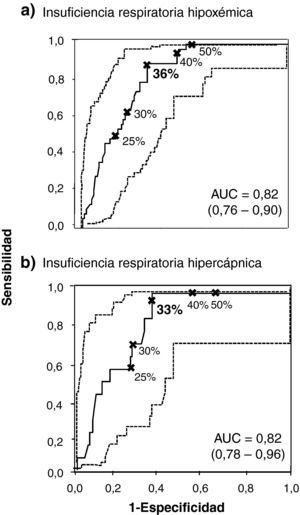
La figura 1 incluye las dos curvas ROC con los mejores puntos de corte del FEV1 post-BD para la evaluación de la insuficiencia respiratoria hipoxémica (fig. 1a) e hipercápnica (fig. 1b), incluyendo las AUC respectivas, todas ellas significativas (intervalo 0,81-0,82; p < 0,01 en todos ellos).
Curvas ROC (línea continua), con sus respectivos IC 95% (línea punteada) para diferentes valores de FEV1 post-BD (expresados como porcentaje del valor teórico) y puntos de corte a considerar para el diagnóstico de insuficiencia respiratoria crónica hipoxémica (a) e hipercápnica (b). Los valores remarcados (en negrita) indican los valores de FEV1 que presentan mayor valor diagnóstico para la práctica de GSA. AUC: area under the curve.
La tabla 2 destaca los valores de sensibilidad, CP+, VPP, especificidad, CP− y VPN para predecir el diagnóstico de insuficiencia respiratoria hipoxémica aislada (PaO2 < 60 mmHg) o hipercápnica (PaO2 < 60 mmHg con PaCO2 ≥ 50mmHg). La tabla 2A indica que un FEV1 post-BD igual al 36% resulta ser el dintel con mayor capacidad de predicción de la insuficiencia respiratoria hipoxémica (sensibilidad: 0,87; CP+: 2,79; VPP: 0,49; especificidad: 0,68; CP−: 0,19; VPN: 0,94). Con el empleo de este punto de corte se encontró un número inferior de falsos positivos (n = 35; 23%) en comparación con un FEV1 post-BD < 50%10 (n = 56; 37%). Este último incluyó un número más reducido de casos falsos negativos (n = 0) que el punto de corte seleccionado (n = 5; 3%). El análisis de la curva ROC para los pacientes obesos con EPOC demostró que el mejor FEV1 post-BD para predecir insuficiencia respiratoria hipoxémica está muy próximo (34%) al de la población estudiada en nuestro trabajo.
Validez de las variables (medias e IC 95%) para varios puntos de corte del FEV1 post-BD para la predicción de insuficiencia respiratoria crónica hipoxémica (A) e hipercápnica (B)
| FEV1 | Sensibilidad | CP + | VPP | Especificidad | CP − | VPN |
| A) | ||||||
| 30% | 0,61 | 2,73 | 0,49 | 0,77 | 0,50 | 0,85 |
| (0,45-0,76) | (1,79-4,18) | (0,35-0,63) | (0,68-0,85) | (0,33-0,70) | (0,76-0,91) | |
| 35% | 0,85 | 2,68 | 0,48 | 0,68 | 0,22 | 0,93 |
| (0,69-0,93) | (1,98-3,64) | (0,36-0,61) | (0,59-0,77) | (0,10-0,43) | (0,84-0,97) | |
| 36% | 0,87 | 2,76 | 0,49 | 0,68 | 0,19 | 0,94 |
| (0,72-0,95) | (2,05-3,73) | (0,37-0,61) | (0,59-0,77) | (0,09-0,39) | (0,85-0,98) | |
| 40% | 0,90 | 2,50 | 0,47 | 0,64 | 0,15 | 0,95 |
| (0,75-0,97) | (1,90-3,26) | (0,35-0,58) | (0,54-0,73) | (0,06-0,36) | (0,86-0,98) | |
| 45% | 0,97 | 2,08 | 0,42 | 0,53 | 0,09 | 0,98 |
| (0,84-1,00) | (1,69-2,55) | (0,32-0,53) | (0,43-0,63) | (0,02-0,32) | (0,90-1,00) | |
| 50% | 1,00 | 2,00 | 0,41 | 0,49 | 0,05 | 1,00 |
| (0,89-1,00) | (1,65-2,38) | (0,31-0,52) | (0,40-0,59) | (0,00-0,26) | (0,92-1,00) | |
| B) | ||||||
| 30% | 0,71 | 2,50 | 0,20 | 0,71 | 0,23 | 0,96 |
| (0,42-0,90) | (1,63-3,81) | (0,11-0,35) | (0,63-0,78) | (0,06-0,63) | (0,89-1,00) | |
| 33% | 0,93 | 2,63 | 0,21 | 0,65 | 0,00 | 0,99 |
| (0,64-1,00) | (2,00-3,45) | (0,12-0,34) | (0,56-0,72) | (0,00-0,43) | (0,93-1,00) | |
| 35% | 1,00 | 2,52 | 0,20 | 0,60 | 0,00 | 1,00 |
| (0,73-1,00) | (2,05-3,10) | (0,12-0,32) | (0,51-0,68) | (0,00-0,47) | (0,94-1,00) | |
| 40% | 1,00 | 2,23 | 0,19 | 0,55 | 0,00 | 1,00 |
| (0,73-1,00) | (1,85-2,70) | (0,11-0,30) | (0,46-0,64) | (0,00-0,51) | (0,94-1,00) | |
| 45% | 1,00 | 1,80 | 0,15 | 0,44 | 0,00 | 1,00 |
| (0,73-1,00) | (1,54-2,08) | (0,10-0,25) | (0,36-0,53) | (0,00-0,65) | (0,92-1,00) | |
| 50% | 1.00 | 1,68 | 0,15 | 0,40 | 0,00 | 1,00 |
| (0,73-1,00) | (1,46-1,93) | (0,10-0,24) | (0,32-0,49) | (0,00-0,71) | (0,92-1,00) | |
Los valores en negrita indican los puntos de corte seleccionados.
CP+: coeficiente de probabilidad positivo; CP−: coeficiente de probabilidad negativo; VPN = valor predictivo negativo; VPP: valor predictivo positivo;
La tabla 2B remarca un FEV1 post -BD igual al 33% como el punto de corte con mayor capacidad de discriminación para la insuficiencia respiratoria hipercápnica, al incluir las mejores cifras de sensibilidad (0,93), CP+ (2,65), VPP (0,21), especificidad (0,65), CP− (0,10) y VPN (0,99). Así, se observaron 30 casos falsos positivos (22%) en comparación con los 56 (37%) cuando se consideraba un FEV1 post-BD < 50%10, si bien no figuraban casos falsos negativos con este último valor. Se debe destacar que un FEV1 post-BD igual al 35% resultó ser un valor adecuado para descartar la insuficiencia respiratoria hipercápnica (CP−: 0).
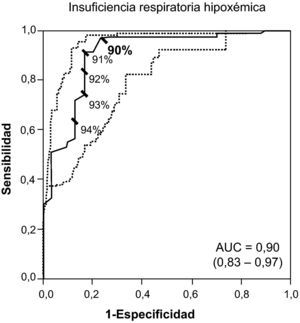
Por último, la figura 2 incluye la curva ROC que identifica la cifra de 90% como el mejor valor de SaO2 para sospechar el diagnóstico de insuficiencia respiratoria hipoxémica (sensibilidad: 0,73; CP+: 24,33; VPP: 0,91; especificidad: 0,97; CP−: 0,27; VPN: 0,91). Asimismo, una SaO2 ≤ 91% (CP+: 15,20) resultó suficiente para sospechar el diagnóstico de insuficiencia respiratoria hipoxémica.
Curvas ROC (línea continua) con sus respectivos IC 95% (línea punteada) para diferentes valores de SaO2 (expresado como porcentaje) y sus puntos de corte para el diagnóstico de insuficiencia respiratoria crónica hipoxémica. En negrita se remarca el punto de corte con valor diagnóstico. AUC: area under the curve.
Nuestro estudio sugiere, como novedad basada en la evidencia, que el 36% del FEV1 post-BD resulta ser el mejor punto de corte para el diagnóstico y la evaluación de la insuficiencia respiratoria crónica en la EPOC estable, cifra considerablemente inferior a la recomendada actualmente por el informe GOLD10. Además, un FEV1 ≥ 45% descarta insuficiencia respiratoria crónica. Más aún, para la insuficiencia respiratoria crónica hipercápnica el mejor punto de corte resulta todavía más bajo (33%) que los valores actualmente recomendados5,10. En cuanto a la SaO2, valores situados entre el 90 y el 91% dan la mayor capacidad de predicción de la insuficiencia respiratoria hipoxémica crónica.
No existen estudios previos que hayan identificado el mejor FEV1 para indicar la práctica de una GSA para el diagnóstico y la evaluación de la insuficiencia respiratoria crónica en pacientes con EPOC estable. En un estudio retrospectivo planteado con el objetivo de investigar la utilidad del FEV1 para determinar la presencia de hipoxemia arterial severa y desarrollar la mejor estrategia de oxigenoterapia continua domiciliaria, Lim et al19 concluyeron que el FEV1 sí resultaba adecuado para el cribado de insuficiencia respiratoria hipoxémica crónica, pero sin estimar el mejor FEV1 para la práctica de una GSA. En una línea más próxima a nuestro estudio, Franciosi et al20 investigaron cuáles podían ser los mejores marcadores clínicos y funcionales de gravedad en la práctica clínica en 145.000 pacientes afectados de EPOC. Concluyeron que la PaO2 era uno de los marcadores más relevantes para diferenciar los diversos estadios espirométricos de la enfermedad; no obstante, el valor más adecuado de FEV1 para practicar una GSA a un paciente con EPOC estable tampoco fue determinado. Mediante un análisis de componentes principales para evaluar el potencial de la estadificación multidimensional del paciente con EPOC estable, Celli et al.11 observaron que el mejor dintel para detectar insuficiencia respiratoria crónica podía corresponder a un FEV1 < 40% del valor teórico, cifra que no se basó en evidencias directas.
Aunque una PaCO2 ≥ 44 mmHg se ha identificado con un número superior de hospitalizaciones por EPOC agudizada21, la hipercapnia nunca se ha invocado como un marcador fiable de progresión de la EPOC20. Nuestros hallazgos confirman que un FEV1 post-BD del 33% es un buen punto de corte para indicar la práctica de una GSA para el diagnóstico de una insuficiencia respiratoria hipercápnica crónica en la EPOC.
El presente trabajo comporta una serie de limitaciones, entre las cuales destacarían la heterogeneidad de su población, el sesgo de género, el diseño transversal y la naturaleza retrospectiva. También se debe resaltar que los valores de SaO2 incluidos fueron derivados de las mediciones realizadas con las muestras de GSA, lo que contrasta con la práctica clínica diaria en la que los clínicos utilizan pulsioxímetros para su medición. Además, los niveles de carboxihemoglobina, que también modulan la SaO222, tampoco fueron medidos. Sin embargo, estas contrapartidas quedaron contrarrestadas por dos fortalezas importantes. Primero, los pacientes incluidos completan todo el espectro espirométrico de la EPOC; segundo, todos nuestros estudios fueron realizados por el mismo laboratorio y, lo que es todavía más importante, mediante una metodología y sistemática comunes para el análisis de GSA14.
Desde 2001, cuando se publicó el primer informe GOLD9, hasta las contribuciones más recientes5,10,23,24 se ha propuesto que un FEV1 igual al 50% se erigiría en la cifra ideal para practicar una GSA con el fin de diagnosticar y manejar la insuficiencia respiratoria crónica en la EPOC estable, cifra nunca validada. De acuerdo con nuestros resultados, se sugiere un valor de FEV1 post-BD igual al 36% como el punto de corte más adecuado para el diagnóstico, evaluación y manejo de la insuficiencia respiratoria crónica hipoxémica e hipercápnica en pacientes con EPOC estable. Asimismo y de forma complementaria, una SaO2 igual al 90% podría también considerarse para el diagnóstico de insuficiencia respiratoria crónica hipoxémica. Hay que destacar, sin embargo, que nuestros datos están poco alejados de las recomendaciones propuestas por el primer informe GOLD9 o la normativa NICE5, que sólo incluye valores de FEV1 pre-BD. De todos modos, nuestros resultados deberían ser replicados con un estudio prospectivo que incluyera una población mayor de pacientes.
En resumen, las guías clínicas o recomendaciones para la EPOC podrían considerar en el futuro los puntos de corte sugeridos para los valores de FEV1 y SaO2 de nuestro trabajo. Ello evitaría la práctica de punciones arteriales innecesarias, lo que siempre puede comportar efectos secundarios y molestias para pacientes y excesos de costes de los sistemas de salud.
FinanciaciónEste estudio ha sido subvencionado en parte por: Generalitat de Catalunya (2005SGR-00822), Marató TV3 (# 040430), Laboratorios Esteve y Almirall. D. A. Rodríguez recibió subvención de ERS-SEPAR 2006 Long-Term Research Fellowship (#191).
Conflictos de interesesRoberto Rodríguez-Roisin preside el Comité Ejecutivo de GOLD. El resto de autores no tiene ningún conflicto de intereses.
Los autores agradecen a Conchi Gistau y Felip Burgos su colaboración durante la realización de este trabajo.