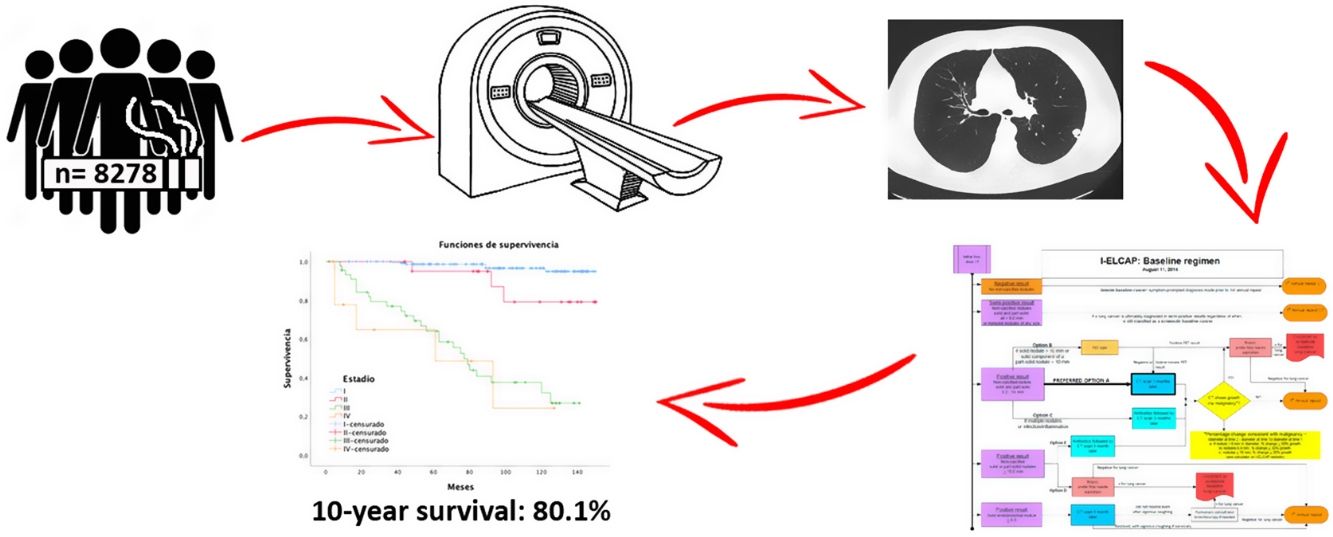
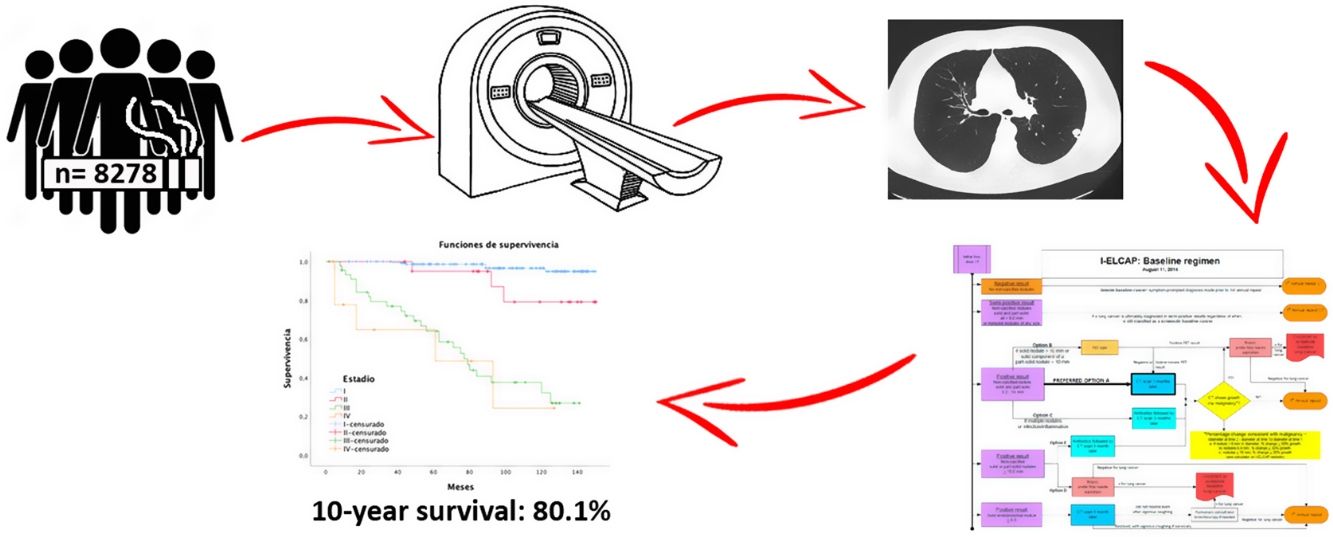
El cáncer de pulmón (CP) se diagnostica habitualmente en estadios avanzados con una supervivencia media a cinco años del 12%. Ensayos como el National Lung Screening Trial (NLST) y el NEderlands Leuvens longkanker Screenings ONderzoek (NELSON) demuestran una reducción de la mortalidad que justifican la implantación del cribado en población de riesgo. Nuestro objetivo es presentar los resultados de supervivencia del programa de cribado de CP más amplio de España con tomografía computarizada de baja dosis (TCBD).
MétodosSe analizaron los datos del programa Internacional de Detección Precoz de CP (IELCAP) en Valencia, España. Este programa reclutó fumadores o exfumadores con una edad entre 40- 80 años. Se comparan los resultados con otros programas de similar tamaño.
ResultadosUn total de 8.278 participantes fueron reclutados con al menos dos rondas de seguimiento, hasta noviembre de 2020 (62,8% varones), realizando una media de seis rondas de cribado por individuo. Diagnosticamos 239 tumores en 12 años de seguimiento. El adenocarcinoma fue el tumor más frecuente con un 61,3% en estadio I. Las tasas de prevalencia e incidencia fueron de 1,5% y 1,4%, respectivamente, con una tasa de detección anual de 0,17. Las tasas de supervivencia cáncer específica a cinco años fueron del 90 y del 80,1% a 10 años. La adherencia fue de 96,84%.
ConclusiónLa experiencia del programa más amplio de España demuestra que la supervivencia se mejora cuando se realiza en equipos multidisciplinares con experiencia en CP y es similar a programas similares.
Lung cancer (LC) is usually diagnosed at advanced stages with only a 12% 5-year survival. Trials as NLST and NELSON show a mortality decrease, which justifies implementation of lung cancer screening in risk population. Our objective was to show survival results of the largest LC screening program in Spain with low dosage computed tomography (LDCT).
MethodsClinical records from International Early Lung Cancer Detection Program (IELCAP) at Valencia, Spain were analysed. This program recruited volunteers, ever-smokers aged 40-80 years, since 2008. Results are compared to those from other similar sizeable programs.
ResultsA total of 8278 participants were screened with at least two-rounds until November 2020. A mean of 6 annual screening rounds were performed. We detected 239 tumours along 12-year follow-up. Adenocarcinoma was the most common histology, being 61.3% at stage I. The lung cancer prevalence and incidence proportion was 1.5% and 1.4%, respectively with an annual detection rate of 0.17. One-year survival and 10-year survival were 90% and 80.1%, respectively. Adherence was 96.84%.
ConclusionLargest lung cancer screening in Spain shows that survival is improved when is performed in multidisciplinary team experienced in management of LC, and is comparable to similar screening programs.
El cáncer de pulmón (CP) es la primera causa de muerte por cáncer, con baja prevalencia y diagnóstico, habitualmente en estadios avanzados1,2, con una supervivencia global a cinco años muy baja (6-18%)2. En Europa hay alrededor de 400.000 casos diagnosticados y 300.000 muertes anuales por CP y una supervivencia media a cinco años del 12% 3. En nuestro país, el CP es el tercer tumor en frecuencia4,5, diagnosticándose alrededor de 29.000 nuevos casos-año. El consumo de tabaco es el factor etiopatogénico más importante (siete cada 10 casos), por lo que las campañas dirigidas a evitar el inicio del hábito, la suspensión del consumo y la implantación de medidas de detección precoz pueden reducir las tasas de morbilidad del CP6.
El principal objetivo de los programas de cribado de cáncer es diagnosticarlo, en estadios iniciales, cuando es curable7. Varias publicaciones mostraron que el CP puede ser detectado en estos estadios iniciales (85% de los casos) con tomografía computarizada de baja dosis (TCBD) y consecuentemente la supervivencia a 10 años alcanza el 88% para estadio I8–10.
Varios son los programas de cribado con TCBD que han demostrado su utilidad en población de riesgo. El National Lung Screening Trial (NLST) muestra una reducción de la mortalidad del 20% frente al cribado con radiografía de tórax después de una media de seguimiento de 6,5 años, por lo que la US Preventive Services Task Force (USPSTF) lo recomienda (grado B) en fumadores de ≥20 paquetes-año con edades de 50-80 años o exfumadores de < 15 años11.
Posteriormente (2015), la European Respiratory Society (ERS) y la European Society of Radiology (ESR) recomendaron el cribado de CP con TCBD12 en programas integrales de calidad, en un entorno de ensayo clínico o asistencial, en centros médicos con equipos multidisciplinares que acrediten unos requisitos mínimos. Existen iniciativas en España reclamando el cribado, aunque el Ministerio de Sanidad, en su estrategia nacional de cáncer, no incluye el mismo13.
En Europa hay varios ensayos aleatorizados en marcha14,15, como la Multicentric Italian Lung Detection (MILD) y NEderlands-Leuvens Longkanker Screenings ONderzoek (NELSON) que, con criterios de inclusión menos restrictivos que el NLST, comunicó una reducción de la mortalidad por CP en varones (24%), y aun mayor (33-59%), en mujeres16, con un 50% de cánceres detectados con TCBD en estadio I, en comparación con un 75% de estadios avanzados en el grupo control. No obstante, la Red de Agencias de Evaluación de Tecnologías Europeas (EUnetHTA) no recomienda dicha implantación17.
El objetivo principal es analizar la supervivencia y mortalidad de los CP diagnosticados mediante el cribado con TCBD en el programa más extenso de España, y como objetivo secundario describir las características de nuestra población incluida y la diagnosticada de CP.
MétodosDesde junio de 2008 a noviembre de 2020, aprovechando la existencia de una unidad de cribado oportunista dependiente de nuestra institución y previa encuesta telefónica, se han incluido 8.546 voluntarios asintomáticos. Los criterios de inclusión de 2008 a 2016 fueron a ≥ 50 años, fumadores de ≥ 10 paquetes-año, y a partir de 2016 a fumadores de ≥ 15 paquetes-año, y a exfumadores de < 15 años de abandono del hábito tabáquico, sin antecedente oncológico personal, salvo el carcinoma basocelular de piel, a los que se recogió el consentimiento informado aprobado por el Comité Ético de nuestro centro.
Tras recoger los datos epidemiológicos y factores de riesgo, se han seleccionado 8.278 voluntarios a los que se les realizó una TCBD basal, y al menos una de control anual, continuando en casos negativos con un tercer control anual y posteriores seguimientos cada 18 meses hasta los 72 meses. Se utilizó el protocolo I-ELCAP (International Early Lung Cancer Action Program)18 para diagnóstico y seguimiento de los hallazgos, disponible online en www.ielcap.org/protocols, realizando un análisis retrospectivo de los datos recogidos en esta cohorte.
Se consideró el estudio basal positivo ante nódulos no calcificados (NNC) sólidos o parcialmente sólidos ≥ 5 mm o nódulos no sólidos ≥ 8 mm en periodo 2008 a 2016, y a partir de esa fecha se consideró a los ≥ 6 mm, por cambios en protocolo I-ELCAP. En dicho caso se optó por control con TCBD en tres meses, tomografía por emisión de positrones-tomografía computarizada (PET-TC) o biopsia, según criterios de tamaño o altamente sugestivos de malignidad. Si hubo sospecha de infección, se recomendó un tratamiento antibiótico y control con TCBD al mes. Si se evidenció una resolución parcial o completa, el siguiente control se realizó al año.
Se consideraron tumores prevalentes aquellos nódulos presentes en el estudio basal e incidentes los de nueva aparición durante el seguimiento con TCBD y diagnosticados de cáncer. Se consideró falso positivo en cribado los hallazgos que llevaron a un procedimiento diagnóstico como son la punción biopsia, cirugía, broncoscopia o la PET con resultado benigno.
La enfermedad pulmonar obstructiva crónica (EPOC) fue clasificada, mediante espirometría, en leve (volumen espiratorio forzado en un segundo [FEV1] ≥ 80% del valor teórico), moderada (50% ≥ FEV1< 80%), grave (30% ≥ FEV1 < 50%) y severa (FEV1 < 30%), según criterios de la Global Initiative for Chronic Obstructive Lung Disease19. Los diagnosticados de CP se estratificaron según la octava clasificación internacional del TNM20, con un seguimiento previsto de 10 años. El enfisema se gradó siguiendo criterios de imagen en TC, según protocolo I-ELCAP18.
Los datos de mortalidad específica por CP se recogieron de la historia clínica de los pacientes y las causas de mortalidad global de la historia clínica electrónica actualizada a noviembre de 2020, considerando como mortalidad global las defunciones ocasionadas por los CP más otras causas como cánceres diferentes al pulmón, accidentes vasculares, sepsis, etc. La tasa de mortalidad global se calculó dividiendo todas las defunciones por la suma de los meses libres de enfermedad.
Análisis estadísticoPara el análisis estadístico utilizamos el programa R (versión 3.6.3) y RStudio (versión 1.2.5033) así como el SPSS Statistics versión 26 (IBM Corp., Armonk, NY), considerando significativo un valor de p < 0,05. Para las variables continuas con distribución normal calculamos la media, mediana y rango, y para las variables sin distribución normal las analizamos usando una prueba de los rangos con signo de Wilcoxon. Para las variables categóricas recogimos la distribución de frecuencias relativas, usamos el análisis de tablas de contingencia con test de Fisher o χ2. Los cálculos de prevalencia e incidencia se realizaron según la ronda diagnóstica.
Para los cálculos de riesgos realizamos una regresión logística bivariada, en la que incluimos las variables edad, sexo, antecedentes familiares, índice de masa corporal (IMC), paquetes-año, EPOC y enfisema.
Con los datos de mortalidad describimos la supervivencia de los pacientes con CP a 5 y 10 años, utilizando curvas de Kaplan-Meier y, para el cálculo de riesgo de muerte, utilizamos el método de Cox de riesgos proporcionales, incluyendo las variables edad, sexo, tratamiento quirúrgico y estadios.
ResultadosLas características de la población estudiada quedan reflejadas en la tabla 1. De los 8.546 voluntarios incluidos, a 8.278 se les realizaron dos o más TCBD, exceptuando aquellos que fueron diagnosticados de CP en el estudio basal que solo tienen un control (tabla 2). El 62,8% fueron varones y el 37,2% mujeres. La tasa de adherencia global fue del 96,84%, con una mediana de seguimiento de 72 meses (media = 67,6, desviación estándar [DS] = 27,03). La media de TCBD realizadas durante el periodo de tiempo del estudio fueron 6 (1 a 15) por persona, de las que el 15,4% tenían enfisema en el TCBD basal, y el parámetro FEV1/capacidad vital forzada (FVC) solo se recogió a 3.387 para valoración de la obstrucción aérea.
Características de la población seleccionada con dos o más controles de TCBD
| Características | Mujeres (n = 3.089) | Hombres(n = 5.189) | Total(n = 8.278) | CP-mujeres(n = 67) | CP-hombres (n = 172) |
|---|---|---|---|---|---|
| Edad | 55 (52-59) | 57 (53-61) | 56 (53-61) | 58 (55-62) | 61 (57-66) |
| < 50 años | 3 | 9 | 12 | 0 | 0 |
| 50-55 años | 1.586 | 1.954 | 3.540 | 16 | 17 |
| 55-60 años | 863 | 1.733 | 2.596 | 23 | 46 |
| 60-65 años | 444 | 897 | 1.341 | 19 | 53 |
| 65-70 años | 157 | 407 | 564 | 7 | 44 |
| > 70 años | 35 | 189 | 224 | 2 | 12 |
| IMC | 24,9 (22,5-29,9) | 27,60 (25,4-30) | 26,70 (24,2-29,4) | 24 (21,7-26,4) | 27,4 (24,3-29,8) |
| Paquetes-año | 26,5 (17-36) | 33 (21-47) | 30,6 (19-42) | 34 (20,4-47,4) | 48 (38,9-69,3) |
| < 15 p-a | 585 (18,9%) | 642 (12,4%) | 1.227 (14,8%) | 7 | 4 |
| 15-30 p-a | 1.184 (38,3%) | 1.539 (29,7%) | 2.723 (32,8%) | 20 | 23 |
| ≥ 30 p-a | 1.319 (42,7%) | 3.008 (57,9%) | 4.327 (52,3%) | 40 | 145 |
| Estatus fumador | |||||
| Fumador | 1.943 (63%) | 2.679 (51,6%) | 4.622 (55,8%) | 42 | 117 |
| Exfumador | 1.142 (37%) | 2.513 (48,4%) | 3.655 (44,2%) | 25 | 55 |
| Meses de seguimiento | 72 (44-85) | 73 (49-90) | 72 (48-87,5) | 89 (66-126,5) | 92,5 (52-130,1) |
| Controles de TCBD | 6 (4-7) | 6 (5-7) | 6 (5-7) | 4 (2-6) | 4 (3-6) |
| Antecedentes familiares CP | 707 (8,5%) | 978 (11,8%) | 1.685 (20,4%) | 21 (31,3%) | 41 (23,8%) |
| Enfisema en TCBD basal | p <0,0001 | p=0,071 | |||
| no | 2.690 | 4.280 | 6.970 | 45 | 100 |
| mínimo | 307 | 672 | 979 | 20 | 46 |
| moderado | 67 | 185 | 252 | 2 | 21 |
| severo | 4 | 31 | 35 | 0 | 5 |
| EPOC | p=0,0084 | p=0,76 | |||
| normal | 325 | 438 | 763 | 1 | 3 |
| leve | 950 | 1.465 | 2.415 | 11 | 33 |
| moderado | 58 | 137 | 195 | 53 | 134 |
| severo | 2 | 12 | 14 | 2 | 2 |
Se recogen mediana y rango intercuartílico o porcentaje entre paréntesis.
CP: cáncer de pulmón; TCBD: tomografía computarizada de baja dosis; EPOC: enfermedad pulmonar obstructiva crónica.
Tabla de número de TCBD por individuo de estudio
| Núm. TCBD | Núm. individuos | % |
|---|---|---|
| 1 | 8.278 | 16,61 |
| 2 | 8.237 | 16,53 |
| 3 | 7.819 | 15,69 |
| 4 | 7.223 | 14,49 |
| 5 | 6.255 | 12,55 |
| 6 | 5.225 | 10,48 |
| 7 | 3.294 | 6,61 |
| 8 | 1.896 | 3,80 |
| 9 | 931 | 1,87 |
| 10 | 401 | 0,80 |
| 11 | 176 | 0,35 |
| 12 | 76 | 0,15 |
| 13 | 25 | 0,05 |
| 14 | 7 | 0,01 |
| 15 | 3 | 0,01 |
%: Corresponde a porcentaje total de TCBD realizadas.
TCBD: tomografía computarizada de baja dosis.
En 223 personas se diagnosticaron 239 tumores, ya que dos presentaban tres tumores y 12 dos tumores. Prevalentes hubieron 124 (proporción de prevalencia por sexo = 1,5%), mientras que 115 fueron incidentes (proporción de incidencia por sexo = 1,4%), no existiendo diferencias significativas en los diagnósticos realizados por sexos en ambas categorías (p = 0,131). Dentro de los pacientes con tumores múltiples, 12 fueron metacrónicos y tres fueron sincrónicos, de los que uno rehusó la cirugía y los otros dos no fueron quirúrgicos.
Existieron 113 pacientes (1,35%) con falsos positivos, tanto en el momento basal como en TCBD en seguimiento. De los cuales, 43 fueron punciones, no realizándose en 10 por resolución de la lesión pulmonar o renuncia; 10 broncoscopias, 37 PET y 23 biopsias quirúrgicas con resultado de benignidad.
Los casos diagnosticados de CP eran significativamente más fumadores (> 13 paquetes-año) que el resto de la población incluida (43,75 vs. 30, p < 0,001), de más edad (59 vs. 56 años, p < 0,001), así como con más gravedad de la EPOC (p = 0,021), mientras que no había diferencias en el IMC (26,55 vs. 26,70, p = 0,1919). En un análisis de regresión logística, solo las variables edad (p < 0,0001), paquetes-año (p < 0,0001) e IMC (p < 0,001) tenían significación estadística.
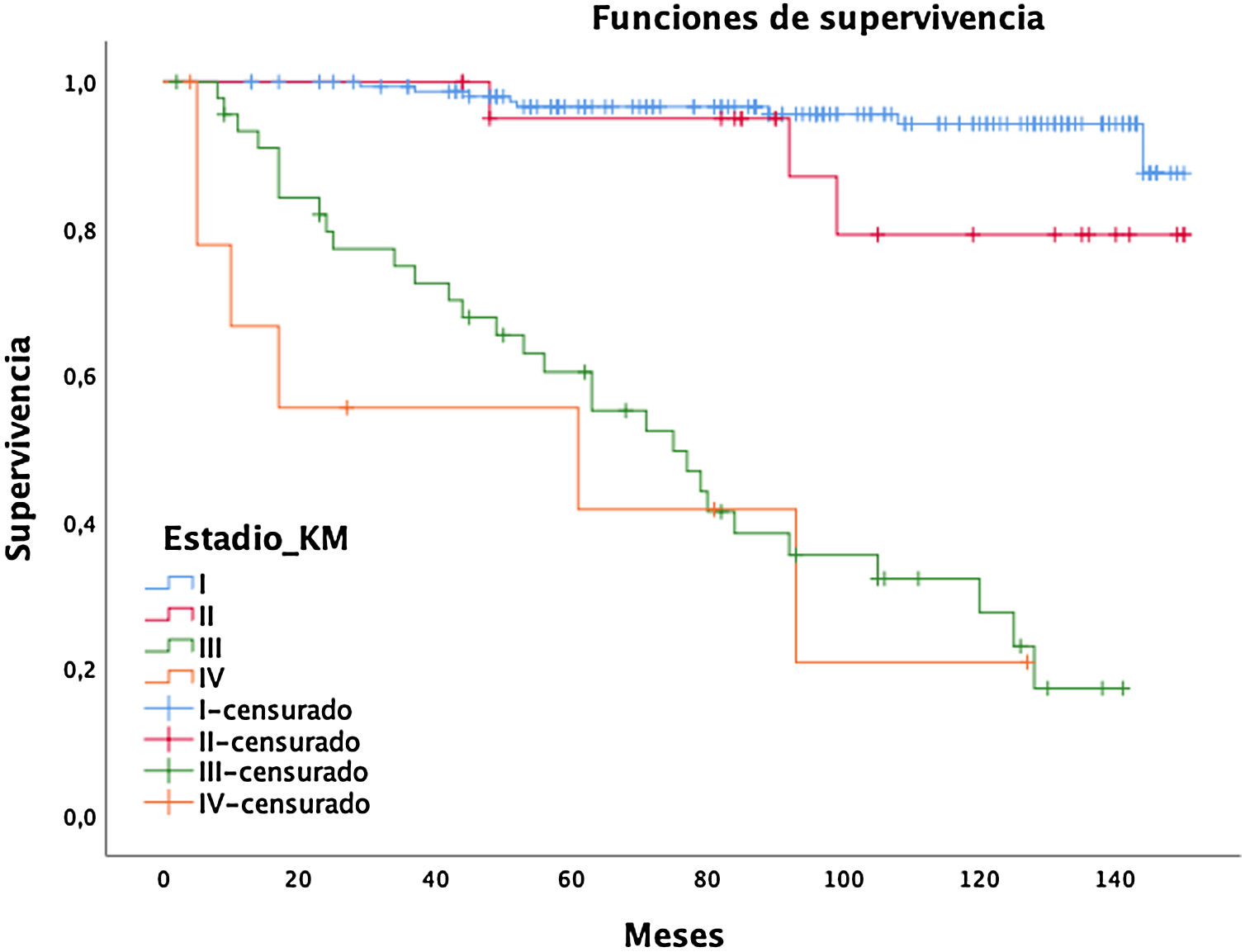
El tipo histológico predominante fue el adenocarcinoma (75,3%), de ellos mínimamente invasivos 21 casos e in situ 10 casos, seguido del escamoso (11,3%) y neuroendocrino (11,3%), de los que ocho fueron tumores carcinoides y 18 fueron neuroendocrinos de células pequeñas. En estadios iniciales (I y II) hubo un total de 76,6%, y un 4,2% en estadio IV, tal como se recoge en la tabla 3. La tasa anual de incidencia fue de 0,17 y el número de inclusiones necesarias para detectar un CP en un año fue de 416.
Incidencia, estadios e histología de los CP diagnosticados y tratados,
| Total | Estudio TCBD prevalente | Estudio TCBD incidente | ||
|---|---|---|---|---|
| Incidencia CP | 239 | 124 | 115 | |
| Tasa CP/100.000 | 433,6 | nc | nc | |
| Incidencia personas/año | ||||
| CP estadio | χ2 = 58.911p=0,117Fisher (p=0,1214) | |||
| I | 161 (67,4%) | 76 (61,3%) | 85 (73,9%) | |
| II | 22 (9,2%) | 13 (10,5%) | 9 (7,8%) | |
| III | 46 (19,2%) | 27 (21,8%) | 19 (16,5%) | |
| IV | 10 (4,2%) | 8 (6,5%) | 2 (1,7%) | |
| Cirugía | p=0,4575 | |||
| No quirúrgico | 44 (18,5%) | 25 (10,5%) | 19 (8%) | |
| Segmentectomía/Lobectomía | 188 (79,2%) | 94 (39,5%) | 96 (39,9%) | |
| Neumectomía | 3 (1,3%) | 3 (1,3%) | 0 | |
| Rehúsa cirugía | 2 (0,8%) | 1 (0,4%) | 1 (0,4%) | |
| Histología | p=0,076 | |||
| ADC | 180(75,3%) | 100(41,8%) | 80(33,5%) | |
| Adenoescamoso | 1(0,4%) | 1(0,4%) | 0 | |
| Escamoso | 27(11,3%) | 8(3,3%) | 19(7,9%) | |
| Células grandes | 2 (0,8%) | 2 (0,8%) | 0 | |
| Neuroendocrino de célula pequeña | 18 (7,5%) | 6 (2,5%) | 12 (5,0%) | |
| Carcinoide | 8 (3,4%) | 7 (2,9%) | 1 (0,4%) | |
| NOS* | 2 (0,8) | 0 | 2 (0,8%) | |
| Muertes por CP | 37 (16,6%) | 25 (11,2%) | 12 (5,38%) | |
| Tasa mortalidad por CP (por 1.000) | 0,77 | 0,52 | 0,25 |
El porcentaje total de fallecimientos fue de 1,4%, de los que 0,5% correspondieron a mortalidad por CP y 0,9% por otras causas. Nuestra tasa de mortalidad global se situó en 1,99 por 1.000. La mortalidad específica por CP fue de 16,6% (37 personas), de los que cuatro estaban en estadio I (1,83%), tres en estadio II (1,38%), 25 en estadio III (1,46%) y cinco en estadio IV (2,29%). La mayoría de los fallecimientos se debió a progresión de enfermedad (34 casos) o complicaciones respiratorias (tres casos).
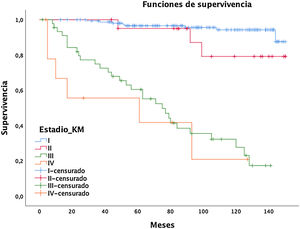
Las mujeres tuvieron un menor riesgo relativo (RR) de muerte a cinco años (RR mujeres = 0,73 vs. RR hombres = 1,37), pero sin diferencias significativas (p = 0,1711, intervalo de confianza [IC] = 0,47-1,15). Por el contrario, las variables edad (RR = 0,95; IC = 0,95-0,96), paquetes-año (RR = 1,01, IC = 1,01-1,02), y el tratamiento quirúrgico (RR = 0,75; IC = 0,57-0,99) mostraron significación estadística (p < 0,05). En esta serie, 44 tumores no fueron quirúrgicos (12 estadios I-II y 32 estadios III-IV), con supervivencia a los cinco y 10 años de 70,7 y 40,5%, significativamente menor que los operados con un 94 y 87,9%, respectivamente (fig. 1).
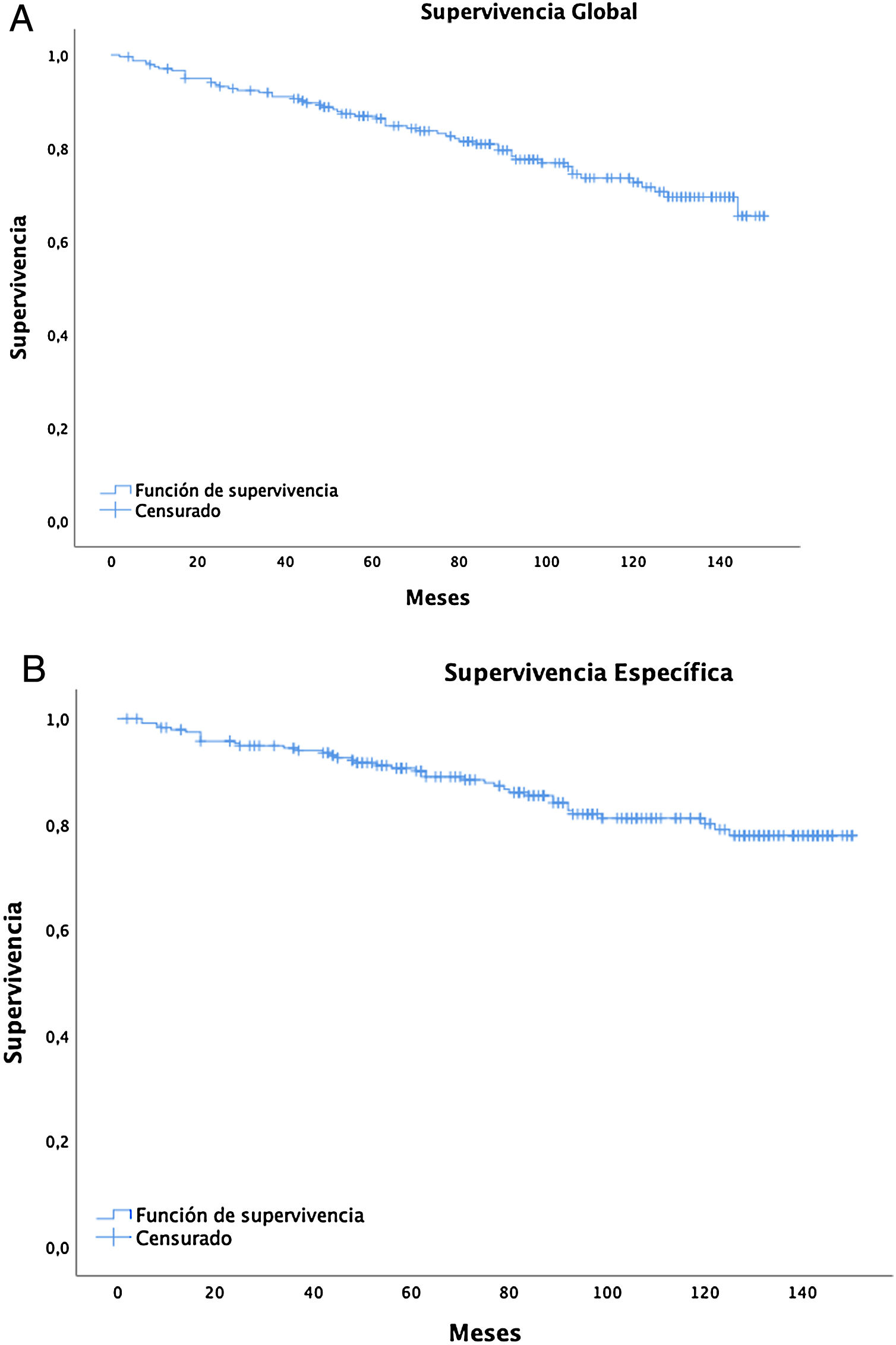
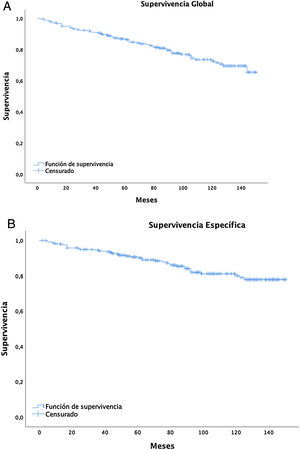
La supervivencia global a cinco años fue del 86% (IC: 81,4-90,8) y a 10 años del 72,2% (IC: 65,6-79,4), con una mediana de 91 meses (media 89; rango = 2-150, IC:83,64-94,75), mientras que para estadios I-II es de 98,5 y de 61 para estadios III-IV (fig. 2A).
La supervivencia cáncer específica (fig. 2B) a cinco años fue del 90% (IC: 86-94,1) y a 10 años del 80,1% (IC: 74,1-86,5), siendo de 98,5% (IC: 96,6-100) y 97,4% (IC: 94,5-100) para el estadio I, respectivamente.
DiscusiónNuestros resultados son comprables con lo publicado respecto a prevalencia, incidencia, histología y estadificación. Atendiendo a la ronda basal, nuestra proporción de prevalencia de CP fue de 1,5%, similar al ITALUNG, algo mayor que NELSON (0,9%) y Pamplona International Early Lung Cancer Detection Program (P-IELCAP) (1%)21, pero inferior al UK Lung Cancer Screening Trial (UKLS) (2,1%). Este estudio presenta la experiencia del programa de cribado de CP con TCBD más amplio y el segundo con mayor seguimiento de España.
En nuestro entorno, el proyecto I-ELCAP fue iniciado el año 2000 en la Clínica Universitaria de Navarra, obteniendo un rendimiento similar al resto de programas europeos con diagnósticos de CP en estadio I del 85%21. Posteriormente, en junio 2008, se adhiere nuestro centro con un 52,08% de tumores en estadio I y resultados preliminares de supervivencia global de 58,5% a cinco años y supervivencia específica de CP de 67,1% y en los casos quirúrgicos del 75,8%22. Respecto a la proporción de incidentes, nuestros resultados se situaron en 1,4%, igual que P-IELCAP y similar al NLST (1,5%)21 (tabla 4). La tasa de supervivencia cáncer específica a 10 años fue del 97% para el estadio I. Esta mejoría del resultado, podría justificarse por el mayor número de controles ya que los criterios de inclusión y los algoritmos de diagnóstico son muy similares18, con tasas de resecabilidad quirúrgica similar a otras series23. Es de resaltar nuestra baja tasa de falsos positivos 1,36% sólo comparable al 1,2% del NELSON, que utilizó los criterios volumétricos más estrictos16. En todos los demás programas muestran tasas superiores desde el 5,2% del Danish Lung Cancer Screening Trial (DLCST) al 24,2% del NLST24.
Cribados europeos y NLST
| ProyectoInclusiones | Edad y Controles | Seguimiento (años) | % cáncer en control basal | % cánceres en control de seguimiento | Mortalidad específica | Mortalidad global |
|---|---|---|---|---|---|---|
| NELSON15.422 | 50-75 a4 controles: basal, 1- 2 y 2,5 años | 10 a | 0,9 | 0,9 | Mujeres: 0,61 (0,35-1,06)Hombres: 0,74 (0,60-0,91) | No publicado |
| DLCST4.104 | 50-70 aAnual (5 años) | 10 a | 0,8 | 0,7 | 1,03 (0,66-1,60) | 1,01 (0,82-1,25) |
| MILD4.099 | 49-75 aAnual (10 controles) o Bienal (5 controles) | 10 a | Anual: 1Bienal: 0,5 | Anual: 0,5Bienal: 1 | 0,73 (0,47-1,112) | 0,94 (0,73-1,20) |
| LUSI4.052 | 50-69 aAnual (5 controles) | 8,8 a | 1,1 | 0,5 | 0,72 (0,45-1,116)Mujeres: 0,31 (0,1-0,94)Hombres: 0,92 (0,54-1,58) | 0,98 (0,79-1,22)Mujeres: 0,82 (0,47-1,42)Hombres: 1,02 (0,80-1,29) |
| DANTE1.264 | 60-74 a. anual. 5 controles | 8,35 a | 2,3 | 5,85 | 0,54 (0,41-0,7) | 1,65 (1,42-1,91) |
| NLST5.3454 | 55-74 aAnual (3 controles) | 7,4 a | 1 | 0,85 (0,75-0,96) | 0,94 (0,88-1,00) | |
| P-IELCAP2.989 | ≥ 40 a.Anual (3 controles) | 3,5 a | 1 | 1,4 | nd | nd |
nd: no disponible.
El adenocarcinoma fue el tipo histológico más frecuente, sin diferencias de sexo, similar a otros programas de cribado16,25. Respecto al estadio I encontramos un 61,3% de CP, inferior a P-IELCAP (85%) y a Lung cancer Screening Intervention (LUSI) (82%), pero similar a NELSON (64%) y ligeramente mejor que NLST que refieren un total de 39,6% en estadio I 26 y al MILD con un total del 50% en estadio I25.
La tasa de supervivencia a 10 años del estadio I del 97,5% es superior a la de P-IELCAP (80%) y 88% en I-ELCAP, respectivamente. Probablemente se debe a nuestra tasa de ADC mínimamente invasivos (8,8%), los ADCis (4,2%) y los tumores carcinoides (3,3%) de nuestra serie. El porcentaje de estadios avanzados fue bajo, con un 8% de incidentes y 2% de prevalentes para estadio IV.
Este trabajo reitera la importancia tanto la EPOC como el enfisema en TC de forma significativa como factores de riesgo. Estos parámetros ya han demostrado la importancia que juegan para la selección de voluntarios a incluir21, pues a mayor severidad de enfisema centrolobulillar mayor riesgo de CP27, así como el número de paquetes-año28.
La edad es la variable independiente que es tomada en consideración en todos los programas de cribado, con rangos de inclusión de 50 a 80 años, ya que más allá de este límite aumenta el riesgo de comorbilidades por sobrediagnóstico e ineficiencia. En nuestra serie, se incluyeron personas de edades de 50 a 80 años (a excepción de 12 menores de 50 años) con el pico de mayor inclusión en el rango de 50 a 60 años (74,12%). Mientras que con CP el rango fue de 60 a 65 años, muy similar al de otras publicaciones21.
La tasa específica de mortalidad a los 12 años de seguimiento fue del 16,6%, algo menor que en NELSON16, posiblemente condicionada por tratarse de un programa de cribado con intervalos de seguimientos más cortos y con mayor duración.
Nuestra población mostró una alta tasa de adherencia 96,8%, por encima de NELSON (90%), y sensiblemente superior al 56% de P-IELCAP. Probablemente por las diferencias de cobertura sanitaria con este último, ya que nuestra fundación tiene convenio con el servicio nacional de salud con ausencia de pago directo por el usuario. La mejora de la adherencia es un problema multifactorial en el que múltiples estrategias son necesarias, incluido el trabajo de enfermería29.
Se ha observado que ganan mayor peso específico las mujeres, las cuales presentan un incremento del 6,5% de muertes en el último lustro30. En nuestra serie, las mujeres representaron el 37,32% del total de las inclusiones y el 28,03% de los CP diagnosticados, con una mortalidad específica de los diagnósticos de CP del 19,4%, sin diferencias significativas respecto a varones (p = 0,46).
Nuestro estudio tiene algunas limitaciones. En primer lugar, es un ensayo de cribado monocéntrico con un único grupo de estudio, no comparable completamente a los ensayos aleatorizados mencionados. Segundo, reclutamos participantes más jóvenes que otros cercanos con menor umbral de historial de tabaquismo que los empleados en otros estudios. Para la inclusión, en los programas de cribado se selecciona según el hábito tabáquico, existiendo cierta uniformidad en cuanto al número de paquetes-año, con variaciones de > 15 paquetes-año en NELSON16 y > 30 paquetes-año en NLST26. En nuestro caso, dado que se comenzó en 2008 con evidencia limitada, se incluyeron fumadores de < 15 paquetes-año, pero con otras condiciones, como los antecedentes familiares de CP, la exposición laboral, las enfermedades respiratorias previas, la predisposición genética o el estatus socioeconómico, ya que son factores que aumentan significativamente el riesgo de CP3,27,29.
Tercero, unido a lo anterior, es la posible existencia de un sesgo de selección, sobre todo un efecto de voluntario sano. Esto se ha descrito en P-IELCAP21 donde los casos de EPOC más leve fueron los que más adherencia presentaban.
En conclusión, nuestros resultados son similares a lo publicado en cuanto a la prevalencia, incidencia, histología y estadios. La supervivencia y mortalidad específica por CP se mejora con el cribado de TBD cuando se realiza en equipos multidisciplinares con experiencia en el diagnóstico y manejo del CP.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.