El tratamiento con terapias biológicas aumenta la incidencia de enfermedad tuberculosa. La implementación sistemática del cribado de la infección tuberculosa latente en pacientes que van a recibir estas terapias ha conseguido reducir el riesgo de desarrollarla. En 2016 se publicó en España el Documento de consenso sobre la prevención y el tratamiento de la tuberculosis en pacientes candidatos a tratamiento biológico. El objetivo principal del estudio fue evaluar la adherencia al mismo.
MétodosEstudio multicéntrico, descriptivo, observacional en forma de encuesta anónima online, difundida entre las diferentes sociedades médicas que trabajan con biológicos.
ResultadosSe recibieron 747 respuestas. La mayoría de los encuestados realizaba el cribado en el momento adecuado y con la indicación correcta (93,7%). Solo un 36,6% de los encuestados solicitaba las pruebas diagnósticas adecuadas, mientras que el 56,3% acertaron las indicaciones de quimioprofilaxis. Hasta el 96% conocía las pautas de quimioprofilaxis recomendadas, mientras que solo el 63,9% las iniciaba en el momento adecuado. La especialidad con más participación y que más realizaba el cribado de infección tuberculosa latente fue reumatología (54%). En la mayoría de los casos, los neumólogos participaban como consultores.
ConclusionesEste estudio pone de manifiesto un bajo grado de adherencia a las recomendaciones, realizando un cumplimiento aceptable el 56% de los encuestados. Enfatizando en las pruebas diagnósticas adecuadas y en el algoritmo diagnóstico de infección tuberculosa latente, se podría reducir aún más la incidencia de enfermedad tuberculosa en los pacientes que van a recibir terapias biológicas.
Treatment with biological therapies increases the incidence of tuberculous disease. The introduction of systematic screening for latent tuberculosis infection in patients who are to receive these therapies has reduced this risk. In 2016, the consensus document on the prevention and treatment of tuberculosis in patients who are candidates for biological treatment was published in Spain. The main objective of this study was to evaluate adherence to these guidelines.
MethodsMulticenter, descriptive, observational study via an anonymous online survey sent to medical societies involved in biologics.
ResultsWe received 747 responses. Most respondents performed screening at the right time in the right patients (93.7%). Only 36.6% of respondents requested the appropriate diagnostic test, while 56.3% correctly recommended chemoprophylaxis. Up to 96% were familiar with the recommended chemoprophylaxis regimens, while only 63.9% initiated them at the right time. The specialist area that participated most and screened most patients for latent tuberculosis infection was rheumatology (54%). In most cases, pulmonologists were involved in an advisory capacity.
ConclusionsThis study shows poor overall adherence to recommendations, with only 56% of respondents reporting appropriate compliance. The incidence of tuberculous disease in patients who are to receive biological therapies could be reduced further by emphasizing the importance of the right diagnostic test and use of the diagnostic algorithm for latent tuberculosis infection.
La aparición de casos de tuberculosis en pacientes que comenzaron con agentes biológicos para el tratamiento de enfermedades inflamatorias mediadas inmunológicamente alertó sobre el riesgo de reactivación tuberculosa asociado a estas terapias1,2. El riesgo relativo de enfermedad tuberculosa (ET) con estos tratamientos se ha incrementado 1,6-25 veces en las últimas décadas2–7, siendo los anti factor de necrosis tumoral alfa, concretamente infliximab y adalimumab, los que asocian un mayor riesgo. Dos estudios estadounidenses objetivaron mayores incidencias de ET en pacientes con artritis reumatoide tratados con infliximab (52,2-54 casos/100.000 pacientes/año) en comparación a aquellos sin terapias biológicas (6,2 casos/100.000 pacientes/año)4,8–10. En el registro francés RATIO, la incidencia de ET en pacientes con infliximab fue de 116,7 casos/100.000 pacientes/año, 12,2 veces mayor que en la población general11. En España, Carmona et al. describieron un incremento del riesgo de ET de 4 veces en pacientes con artritis reumatoide y terapias biológicas en comparación con la población general12. Teniendo en cuenta que en España más del 10% de los pacientes candidatos a fármacos biológicos tienen infección tuberculosa latente (ITL), nos encontramos ante una numerosa población en riesgo de reactivación tuberculosa13.
A raíz de esta evidencia, las sociedades médicas internacionales introdujeron el cribado de la ITL en sus protocolos, como una medida obligatoria previa al inicio de los agentes biológicos14. A raíz de su implementación, se ha evidenciado una disminución de la ET del 78-90%, aunque no existen estudios que hayan evaluado la adherencia a estas recomendaciones. En España, en el año 2016 se publicó el Documento de consenso sobre la prevención y el tratamiento de la tuberculosis en pacientes candidatos a tratamiento biológico15-17.
Desde el Grupo Emergente del Área de trabajo de tuberculosis e infecciones respiratorias de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR), con la colaboración de diferentes sociedades médicas, se llevó a cabo el presente estudio con el fin de valorar el grado de adherencia a las recomendaciones del documento de consenso nacional.
Material y métodosDiseño del estudioEstudio multicéntrico, descriptivo, observacional basado en una encuesta anónima online en formato surveymonkey®. Se invitó a participar a seis sociedades científicas (Dermatología, Reumatología, Patología Digestiva, Medicina Interna, Enfermedades Infecciosas y Neumología). Se contactó directamente con las sociedades médicas vía mail a través de su página web. La invitación a participar en la encuesta fue realizada a través de un correo electrónico abierto enviado desde cada sociedad médica a sus respectivos socios con el link de la encuesta online.
Objetivos del estudioEl objetivo principal fue conocer la adherencia a las recomendaciones del consenso. Los objetivos secundarios fueron identificar qué especialidades realizan el cribado de ITL, valorar si se realiza el cribado en el centro del encuestado, identificar la heterogeneidad en el manejo de la ITL, recomendaciones con menor porcentaje de acierto, pautas de quimioprofilaxis más empleadas y el papel del servicio de neumología en el proceso.
Recogida de datosLa encuesta constaba de 10 preguntas con cinco posibles respuestas y un apartado de respuesta abierta en algunas (tabla 1). No era un requisito indispensable ser el responsable de la toma de decisiones en este tipo de paciente, para poder participar en la encuesta. Precisamente, como en cada centro varía qué especialistas participan en el estudio y de qué forma, nos interesaba saber si los especialistas que potencialmente podrían estar involucrados en algún punto del proceso (ya fuera por pautar terapias biológicas, ver pacientes con estos tratamientos, o manejar la tuberculosis) sabrían qué hacer. No era obligatorio responder a todas las preguntas y en algunos casos había dos posibles respuestas verdaderas. Las cuatro primeras preguntas recogían datos generales y las preguntas entre la quinta y la décima hacían referencia a las recomendaciones del consenso sobre el cribado de ITL y la quimioprofilaxis.
Modelo de la encuesta realizada sobre «Cribado de infección tuberculosa latente en paciente candidatos a terapias biológicas en España»
| Pregunta 1. ¿A qué especialidad pertenece? |
| 1. Neumología. 2. Medicina interna / Infecciosas 3. Reumatología 4. Dermatología 5. Digestivo |
| Pregunta 2. ¿Realizan cribado de infección tuberculosa latente a los pacientes candidatos a terapias biológicas en su centro de trabajo? |
| 1. Sí 2. No 3. No sé |
| Pregunta 3. ¿Qué servicio/s en su hospital realiza/n el cribado de infección tuberculosa latente a los pacientes candidatos a terapias biológicas? |
| 1. Neumología 2. Reumatología 3. Dermatología 4. Medicina Interna / Infecciosas 5. Digestivo |
| Pregunta 4. ¿Qué papel desempeña el servicio de Neumología de su hospital en el cribado de infección tuberculosa latente en pacientes candidatos a terapias biológicas? |
| 1. Ninguno. 2. Supervisor del proceso 3. Consultor en caso de dudas 4. Es el encargado de la realización completa del estudio 5. Solo en caso de estudio de cribado positivo, se deriva al servicio de Neumología |
| Pregunta 5. ¿A quién realiza el estudio de infección tuberculosa latente entre los pacientes candidatos a terapias biológicas? |
| 1. Inicialmente no realizó el estudio de infección tuberculosa latente 2. Solo realizó el estudio en pacientes con antecedentes de exposición previa a tuberculosis 3. Solo realizó el estudio en pacientes que, una vez iniciada la terapia biológica, comienzan con síntomas sugestivos de enfermedad tuberculosa 4. Realizó el estudio de infección tuberculosa latente a todos los pacientes candidatos a terapias biológicas, siempre antes de iniciar el tratamiento 5. Realizó el estudio de infección tuberculosa latente a todos los pacientes candidatos a terapias biológicas, pero no siempre antes de iniciar el tratamiento |
| Pregunta 6. ¿Qué pruebas solicita para el cribado de infección tuberculosa latente? |
| 1. Radiografía de tórax + prueba de la tuberculina 2. Radiografía de tórax + IGRA 3. Radiografía de tórax + prueba de la tuberculina + IGRA 4. Radiografía de tórax + prueba de la tuberculina o IGRA indistintamente 5. Radiografía de tórax + prueba de la tuberculina, si es negativo, pido IGRA |
| Pregunta 7. En el caso de que la prueba de la tuberculina sea negativa, ¿qué actitud toma a continuación? |
| 1. No hay que hacer nada más, se podría iniciar el tratamiento con terapias biológicas 2. Repetir la prueba de la tuberculina en 2 semanas por el efecto Booster 3. Solicitar un IGRA antes de iniciar el tratamiento con terapias biológicas 4. Iniciaría el tratamiento con terapias biológicas, pero haría seguimiento con pruebas de la tuberculina anuales mientras esté con el tratamiento 5. Solo si se trata de un paciente inmunodeprimido o que ha recibido corticoides recientemente, solicitaría un IGRA antes de iniciar el tratamiento con terapias biológicas |
| Pregunta 8. En caso de que la prueba de la tuberculina sea positiva, ¿qué actitud toma a continuación? |
| 1. Repetirlo en dos semanas, por si se tratara de un falso positivo 2. Solicitar un IGRA, para confirmar el resultado 3. Iniciaría quimioprofilaxis durante mínimo 2 semanas antes de iniciar el tratamiento con terapias biológicas, tras descartar enfermedad tuberculosa activa 4. Iniciaría quimioprofilaxis y tratamiento con terapias biológicas, tras descartar enfermedad tuberculosa activa 5. Iniciaría quimioprofilaxis durante mínimo 4 semanas antes de iniciar el tratamiento con terapias biológicas, tras descartar enfermedad tuberculosa activa |
| Pregunta 9. ¿Hay algún caso en el que iniciaría quimioprofilaxis en un paciente candidato a terapias biológicas, con prueba de la tuberculina e IGRA negativos? |
| 1. No, no hay indicación 2. Sí, en pacientes inmunodeprimidos o que han recibido recientemente corticoides 3. Sí, si hay evidencia de enfermedad tuberculosa no tratada en la radiografía de tórax 4. Sí, si hay constancia epidemiológica de exposición reciente a TB 5. Sí, si se cumplen cualquiera de las dos opciones previas |
| Pregunta 10. En caso de pautar quimioprofilaxis, ¿qué pauta suele emplear más frecuentemente? Escriba en comentarios la duración del tratamiento |
| 1. Isoniacida sola 2. Isoniacida con rifapentina 3. Rifampicina sola 4. Isoniacida con rifampicina 5. Yo no pauto la quimioprofilaxis, en estos casos derivo al paciente |
Se han marcado en negrita la/s respuesta/s correcta/s.
Se consideró como adherencia aceptable a las recomendaciones haber respondido acertadamente a cuatro o más de las preguntas 5 a 10 (acierto igual o mayor al 60%). Por el contrario, se consideró una baja adherencia haber respondido incorrectamente a tres o más de estas preguntas (menos del 50% de acierto). Los baremos se establecieron de acuerdo con los «Estándares de calidad asistencial en la enfermedad pulmonar obstructiva crónica»18 publicados recientemente, que proponen una metodología para cuantificar su aplicación.
Análisis estadísticoSe empleó el programa estadístico SAS 9.3 (SAS Institute, Cary, NC, EE. UU.). La descripción de los datos cualitativos se realizó en forma de frecuencias absolutas y porcentajes y los datos cuantitativos mediante media, mediana y desviación típica (mínimo, máximo). Se calculó el número de preguntas (desde la 5 a la 10) con respuesta acertada. Las comparaciones entre dos grupos se realizaron usando el test de la U de Mann-Whitney y aquellas entre más de dos grupos mediante el test de Kruskal-Wallis. La comparación con otras variables cualitativas se realizó mediante el test de chi cuadrado o el test exacto de Fisher. Todos las pruebas estadísticas se han considerado bilaterales y como valores significativos aquellos con p<0,05.
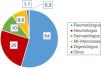
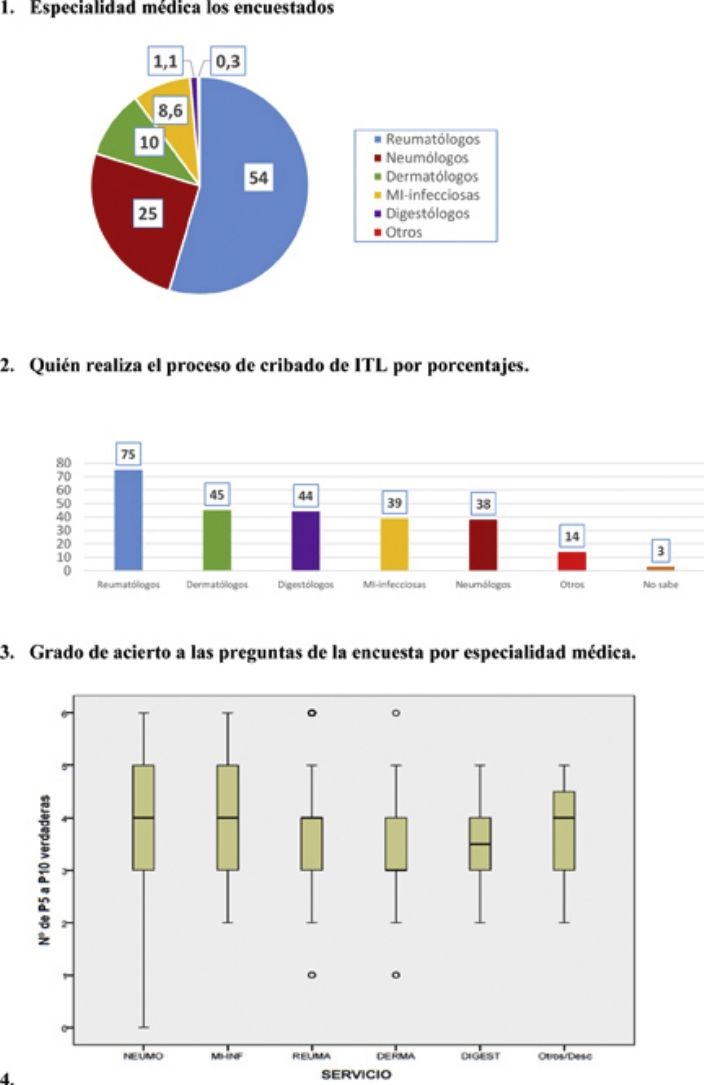
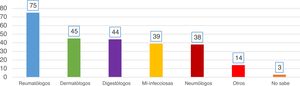
ResultadosPreguntas 1-4Se recibieron un total de 747 encuestas. El 62% de los encuestados eran mujeres, con una edad media de 46 (±10,6) años (25-81 años). En el 98,1% de los casos se realiza el cribado de ITL en los centros de trabajo de los encuestados. La participación por especialidades se muestra en la figura 1. La especialidad de reumatología fue la mayoritaria (54%) y la que más realiza el cribado de ITL. La figura 2 muestra qué especialidades realizan el cribado en cada centro.
El papel del servicio de neumología en el cribado de ITL es el de consultor en un 43% de los casos, en un 38% no participa, en un 8% realiza el estudio completo, en un 3% supervisa el proceso y en un 18% solo se le derivan pacientes con cribado positivo.
Preguntas 5-10Con respecto a quién y cuándo realizar el cribado de ITL entre los pacientes candidatos a terapias biológicas, el 93,7% de los encuestados respondió que a todos (respuesta acertada). Un 2,8% lo realiza, pero no siempre antes de iniciar el tratamiento; un 1,6% no lo realiza en ningún caso; un 0,4% lo realiza únicamente si una vez iniciada la terapia biológica, el paciente presenta clínica sugestiva de ET; un 1,2% solo si los pacientes presentan antecedente de contactos con enfermos tuberculosos.
En cuanto a qué pruebas se deben solicitar para el cribado de ITL, un 36,6% de los encuestados respondió que una radiografía (Rx) de tórax, una determinación de liberación de interferón gamma (IGRA) y una prueba de la tuberculina (PT) de forma simultánea (respuesta acertada). El 45,6% respondió que únicamente Rx de tórax y PT y el 11,4% que Rx de tórax e IGRA. El 9% restante que Rx de tórax y, o PT o IGRA indistintamente, pero no ambas aunque sean negativas.
Respecto a qué actitud tomar en el caso de que la PT fuera negativa, solo el 26,1% de los encuestados respondió que solicita un IGRA antes de iniciar el tratamiento biológico (respuesta acertada); el 57,6% repetiría la PT en dos semanas por el «efecto booster»; el 9,4% solo solicitaría el IGRA en pacientes inmunodeprimidos o que hubieran recibido corticoterapia. Un 6,9% no realizaría más pruebas e iniciaría la terapia biológica en ese momento, aunque casi la mitad de estos, el 3,7%, haría seguimiento posterior con PT anuales mientras durase el tratamiento biológico.
En la pregunta sobre qué hacer en el caso de una PT positiva, el 63,9% de los encuestados contestó que pautarían 4 semanas de quimioprofilaxis antes de iniciar el tratamiento biológico (respuesta acertada); un 15,4% administraría la quimioprofilaxis durante solo dos semanas antes de iniciar el tratamiento biológico; un 8,7% iniciaría la quimioprofilaxis y las terapias biológicas simultáneamente, tras descartar enfermedad tuberculosa activa; un 0,8% repetiría la PT en dos semanas, por si se tratara de un falso positivo y el 11,2% solicitaría un IGRA para confirmar el resultado.
Respecto a la pregunta de si en algún caso iniciaría quimioprofilaxis con PT e IGRA negativos, el 56,3% de los encuestados respondió que harían quimioprofilaxis si hay evidencia de enfermedad tuberculosa no tratada en la Rx de tórax o si hay constancia epidemiológica de exposición reciente a tuberculosis (respuesta acertada). El 19,1% iniciaría quimioprofilaxis solo si hubiera evidencia de ET no tratada en la Rx de tórax; el 13,6% si hubiera constancia de exposición reciente a TB; el 3,6% en pacientes inmunodeprimidos o que hubieran recibido recientemente corticoides; mientras el 17,4% no iniciaría quimioprofilaxis en ningún caso, considerando que no hay indicación.
Por último, acerca de las pautas de quimioprofilaxis un 96% respondieron acertadamente, o monoterapia con isoniazida (H), pauta mayoritaria (83%), o en casos especiales terapia combinada de H y rifampicina (R). La duración de los tratamientos propuesta por la mayoría de los encuestados (9 y 3 meses, respectivamente) sigue las recomendaciones del consenso nacional. Del resto de los encuestados, un 1,5% emplean monoterapia con R, el 1,9% H con pirazinamida, y el mismo porcentaje H con rifapentina.
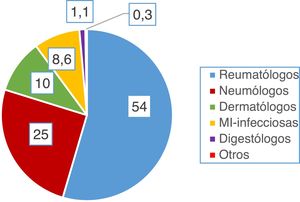
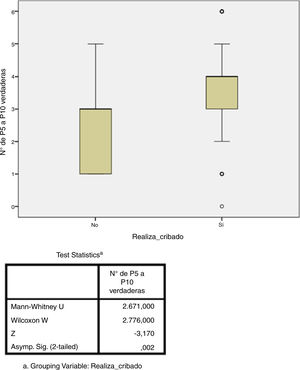
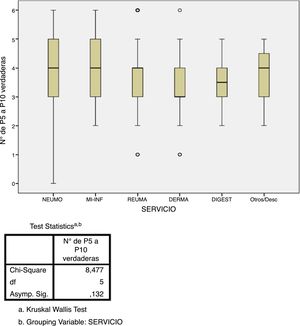
Estudio de adherenciaEl 56% de los encuestados contestó con una adherencia igual o mayor al 60% a las recomendaciones del consenso nacional (acertar 4 o más de las 6 preguntas), aunque solo el 5,6% acertó el 100% de las preguntas. Por contra, el 43% de los encuestados tuvo un bajo porcentaje de acierto (acertar 3 o menos de las 6 preguntas). El único factor que se relacionó de forma estadísticamente significativa con una mayor adherencia fue el hecho de que el cribado de ITL sí se realice en el centro de trabajo (p=0,002, fig. 3). No hubo diferencias significativas en el grado de adherencia según la especialidad médica (p=0,132, figura 4). El porcentaje de acierto por especialidad se recoge en la figura 4.
Las respuestas con mayor grado de acierto fueron a quién y cuándo realizar el estudio de ITL, y las pautas y duración de la quimioprofilaxis, con un 93 y 94% de acierto respectivamente. Al contrario, las respuestas con menor grado de acierto fueron qué actitud tomar en caso de PT negativa y qué pruebas solicitar para realizar el cribado, con un 25 y 36% de acierto respectivamente.
DiscusiónEl presente estudio pone de manifiesto, mediante una encuesta realizada en una amplia muestra de médicos especialistas relacionados con las terapias biológicas, un bajo grado de adherencia a las recomendaciones del Documento de consenso nacional sobre la prevención y el tratamiento de la tuberculosis en pacientes candidatos a tratamiento biológico16. Solo un 56% de los encuestados mostró una adherencia aceptable a las mismas. El 98% de los encuestados realizan el cribado de ITL en sus respectivos centros de trabajo, siendo esta la única variable que se asocia con una mayor adherencia al consenso. Se desconoce qué porcentaje de los encuestados realiza en primera persona el cribado o de qué forma participan en el proceso. Por lo tanto, se podría asumir que los especialistas que contestaron voluntariamente a la encuesta participan directa o indirectamente en el proceso o que, como mínimo, deberían conocerlo como parte de su formación y de su práctica clínica como especialista relacionado, o bien con la tuberculosis, o bien con las terapias biológicas. La mayoría sigue de forma adecuada las indicaciones de a quién y cuándo realizar el cribado. Sin embargo, solo un 36% solicita las pruebas diagnósticas adecuadas, no incluyendo la determinación de IGRA en su práctica habitual. Cuándo iniciar la quimioprofilaxis y qué pautas emplear fueron las preguntas con mayor porcentaje de acierto. Aunque llama la atención que casi un 24% de los encuestados no iniciaría quimioprofilaxis con una PT positiva y cerca de un 20% no la indicaría en ningún caso con PT o IGRA negativos, a pesar de exposición reciente a ET y/o inmunosupresión.
Estos datos se asemejan a los del registro español de tratamientos sistémicos en psoriasis (BIOBADADERM), publicados recientemente por Sánchez Moya et al.17. En él se incluyen más de 1.400 pacientes con psoriasis moderada grave, con una prevalencia de ITL estimada del 20,5%. El cribado se realizó al 83% de los pacientes, pero solo en el 51% se llevó acabo según las recomendaciones del documento de consenso. No existen más estudios que hayan publicado datos evaluando la adhesión a las recomendaciones sobre ITL.
Si bien existe unanimidad sobre que la incidencia de ET es mayor al inicio del tratamiento con biológicos, existen discrepancias respecto a la duración mínima de la quimioprofilaxis antes de iniciar el tratamiento biológico de forma segura. Las recomendaciones iniciales establecieron un mínimo de un mes, pero este intervalo se redujo a tres semanas tras el estudio de Carmona et al.11. Varios estudios recientes, incluyendo las recomendaciones americanas del Centers of Disease Control and Prevention, incluso sugieren que no es necesario esperar y que es seguro iniciar ambos tratamientos de forma simultánea19,20. No obstante, en España el documento de consenso mantiene la recomendación de tres semanas, tiempo que permite comprobar la adecuada adherencia y tolerancia a la quimioprofilaxis15. Según los resultados de nuestro estudio, la mayoría de los encuestados (63,9%) siguen esta recomendación.
De lo que sí existe evidencia es de la efectividad de las recomendaciones, tras haber sido integradas en la práctica habitual15,20,21. En España, los datos publicados por el registro español de acontecimientos adversos de terapias biológicas en enfermedades reumáticas (BIOBADASER), muestran una reducción del 74% de casos de ET desde el 2002, fecha en que se implementó el cribado de ITL. Sin embargo, se estima que hasta en un 20% de los casos no se siguieron las recomendaciones adecuadamente, fundamentalmente por la no repetición de la PT para el «efecto booster», lo que condicionaba 7 veces mayor riesgo de ET15,17,22. Antes de que se generalizara el cribado de ITL, la tasa de ET en el BIOBADASER era 20 veces superior a la de la población general, reduciéndose un 78% tras su puesta en marcha. De esta forma, la tasa de ET en pacientes con AR y tratamiento biológico se ha reducido un 86%, hasta equipararse a la de los pacientes sin terapia biológica15.
Profundizando sobre las pruebas que se solicitan para el cribado de ITL, según el documento de consenso, se recomienda la búsqueda activa de antecedentes personales de tuberculosis, de contacto con pacientes con tuberculosis activa, de posibles lesiones tuberculosas antiguas en la Rx de tórax y en la realización simultánea de las pruebas IGRA y PT. La alta tasa de falsos positivos en la PT, muchos debido a la vacunación previa, así como su baja sensibilidad en pacientes en tratamiento inmunodepresor (hasta el 40% de falsos negativos en algunas series)21,23–27, apoyan la recomendación de realizar las dos pruebas diagnósticas de forma habitual en estos pacientes. Sin embargo, los resultados de nuestra encuesta revelan que la determinación del IGRA no está completamente integrada en la práctica clínica habitual. La repetición de la PT para aumentar su sensibilidad debido al «efecto booster», es otro de los errores más frecuentes en las respuestas de la encuesta, ya que el documento de consenso no lo recomienda, puesto que disminuye la especificidad de la prueba y aumenta los falsos positivos28. Esta falta de adherencia a las recomendaciones del documento de consenso con respecto a las pruebas diagnósticas objetivada en la encuesta, podría estar influenciada por la disparidad de criterios entre las diferentes sociedades médicas internacionales.
Según los resultados de la encuesta, el papel de los neumólogos es en la mayoría de los casos el de consultor (43% de las respuestas) o para el manejo de la ET. La neumología es uno de los servicios que realiza el cribado en solo un 38% de las encuestas. De estos datos podría suponerse que, como el servicio de Neumología no pauta fármacos biológicos, recibe una pequeña cantidad de pacientes candidatos a terapias biológicas, siendo los especialistas que los prescriben quienes hacen el cribado de ITL de sus pacientes. Por lo tanto, menos de la mitad de los pacientes con indicación de cribado serán valorados por Neumología. Esto podría haber contribuido a que un 20% de los encuestados refirieran que no iniciarían quimioprofilaxis en casos en los que estaría indicada, al tratarse de especialidades con menor experiencia en el manejo de esta patología.
El estudio presenta algunas limitaciones, debido fundamentalmente al formato de encuesta anónima online, lo que conlleva implicaciones metodológicas a la hora de poder extraer conclusiones. No se investigó acerca de los medios disponibles en cada centro participante (acceso a determinación de IGRA, presencia de neumólogos, etc.), lo que puede haber influido en algunos resultados. Tampoco conocemos el número total de especialistas contactados y, por lo tanto, qué proporción ha contestado globalmente. Por otra parte, la sobrerrepresentación de reumatólogos (54% de los encuestas) en comparación con la escasa representación de especialidades como Neumología, Medicina Interna o Enfermedades Infecciosas, puede haber sesgado los resultados del manejo de la ITL, ya que son estas tres las especialidades que de forma habitual más manejan este tipo de pacientes. Además, en este estudio, el 98% de los encuestados respondieron que sí se realiza el cribado de ITL en sus centros de trabajo, lo que aún destaca más el bajo grado de cumplimiento global.
Nuestro estudio también tiene una serie de fortalezas, como el hecho de recoger las opiniones de una amplia muestra de médicos que reflejan su práctica clínica habitual, lo que confiere representatividad a los resultados. En este mismo sentido, la forma en que se diseñaron las preguntas permitía un cierto grado de variabilidad, evitando respuestas categóricas o con una única respuesta posible, lo que también refleja la realidad asistencial en nuestro medio.
ConclusionesTras 15 años desde la introducción de los tratamientos biológicos y un año desde la publicación del documento de consenso nacional sobre el cribado de ITL en pacientes candidatos a terapias biológicas, todavía un 43% de los médicos encuestados no sigue las recomendaciones con un aceptable grado de adherencia.
La mayoría de los encuestados, independientemente de su especialidad, identifican correctamente a los candidatos y el momento correcto para realizar el cribado de ITL previo al tratamiento biológico, así como las pautas y duración de la quimioprofilaxis. Sin embargo, solo un 36% solicita las pruebas diagnósticas adecuadas y la mayoría actúa erróneamente ante la actitud tras una PT negativa, una de las cuestiones con menor porcentaje de acierto. Esto podría reflejar una infrautilización de la determinación del IGRA en la práctica clínica diaria, tal vez por un escaso acceso a la misma en algunos centros, tal vez por desconocimiento. El hecho de que algunas sociedades médicas hagan recomendaciones diferentes a las del consenso nacional también puede haber influido. Probablemente, enfatizando en la implementación del algoritmo diagnóstico recomendado se podría llegar a reducir aún más la incidencia de ET observada desde que se inició el cribado sistemático de ITL.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
- -
Servicio de Estadística del HGU La Paz de Madrid.
- -
Sociedades Españolas de Reumatología (SER), Academia Española de Dermatología y Venereología (AEDV), de Patología Digestiva (SEPD), de Medicina Interna (SEMI), de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), y de Neumología y Cirugía Torácica (SEPAR).
- -
Grupo de Trabajo de Tuberculosis de SEPAR.
- -
Grupo de Estudio de Infecciones por Micobacterias de SEIMC.
- -
Coordinador del Área de Tuberculosis e Infecciones Respiratorias (TIR) de SEPAR.
- -
Coordinador del PII de Tuberculosis de SEPAR.