Las bronquiectasias (BQ) son la tercera enfermedad inflamatoria crónica más frecuente de la vía aérea tras la EPOC y el asma. El importante incremento en el interés por esta enfermedad en las dos últimas décadas ha llevado a un aumento en el número de diagnósticos. Sin embargo, desafortunadamente, el grado de evidencia científica terapéutica no ha aumentado de forma paralela. Esta situación supone un importante obstáculo para el desarrollo de normativas que se basen de forma estricta, aunque necesaria, en la información científica disponible con la utilización de sistemas como el actual GRADE. Es por ello por lo que en muchas ocasiones son imprescindibles las recomendaciones realizadas por los expertos autores de las diferentes normativas a la hora de dar respuesta a las muchas situaciones clínicas que se plantean en la práctica diaria. Aun con todo ello, es alentador pensar que, a pesar de este precario grado de evidencia en BQ, la gran mayoría de las normativas nacionales e internacionales existentes coinciden plenamente en los aspectos fundamentales del manejo de estos pacientes.
Las normativas españolas de BQ de la SEPAR (2008)1 fueron las primeras realizadas en el mundo y ya contaban con profesionales con más de 20 años de experiencia tanto en fibrosis quística (FQ) como en BQ que propusieron tratamientos que han demostrado una mejoría de los pacientes. Una década después, las nuevas normativas españolas (2018)2,3 han incorporado el estricto sistema metodológico impuesto por el Comité Científico de la SEPAR (con asesoramiento de un especialista en metodología), pero a la vez han seguido contando con un experimentado grupo multidisciplinar de profesionales que pudiera establecer un buen balance entre la (escasa) evidencia científica y una larga experiencia clínica.
Uno de los aspectos clínicos clave en los que más divergen las diferentes normativas en BQ es en el manejo de la infección bronquial crónica (IBC) por Pseudomonas aeruginosa (PA), circunstancia que, como es conocido, triplica la mortalidad en pacientes con BQ según los resultados de un metaanálisis de 21 estudios4. La normativa española, desde su primera versión, aboga por un tratamiento antibiótico a largo plazo intensivo en esta situación en todos los pacientes, mientras que otras normativas, como la europea o la británica, consideran que, según la evidencia existente derivada de los ensayos clínicos (EC) con macrólidos y algún antibiótico inhalado, tan solo deberían ser subsidiarios de tratamiento aquellos pacientes con, al menos, 3 exacerbaciones anuales. En nuestra opinión existen algunas circunstancias que podrían explicar esta divergencia, y que no las hacen incompatibles5,6.
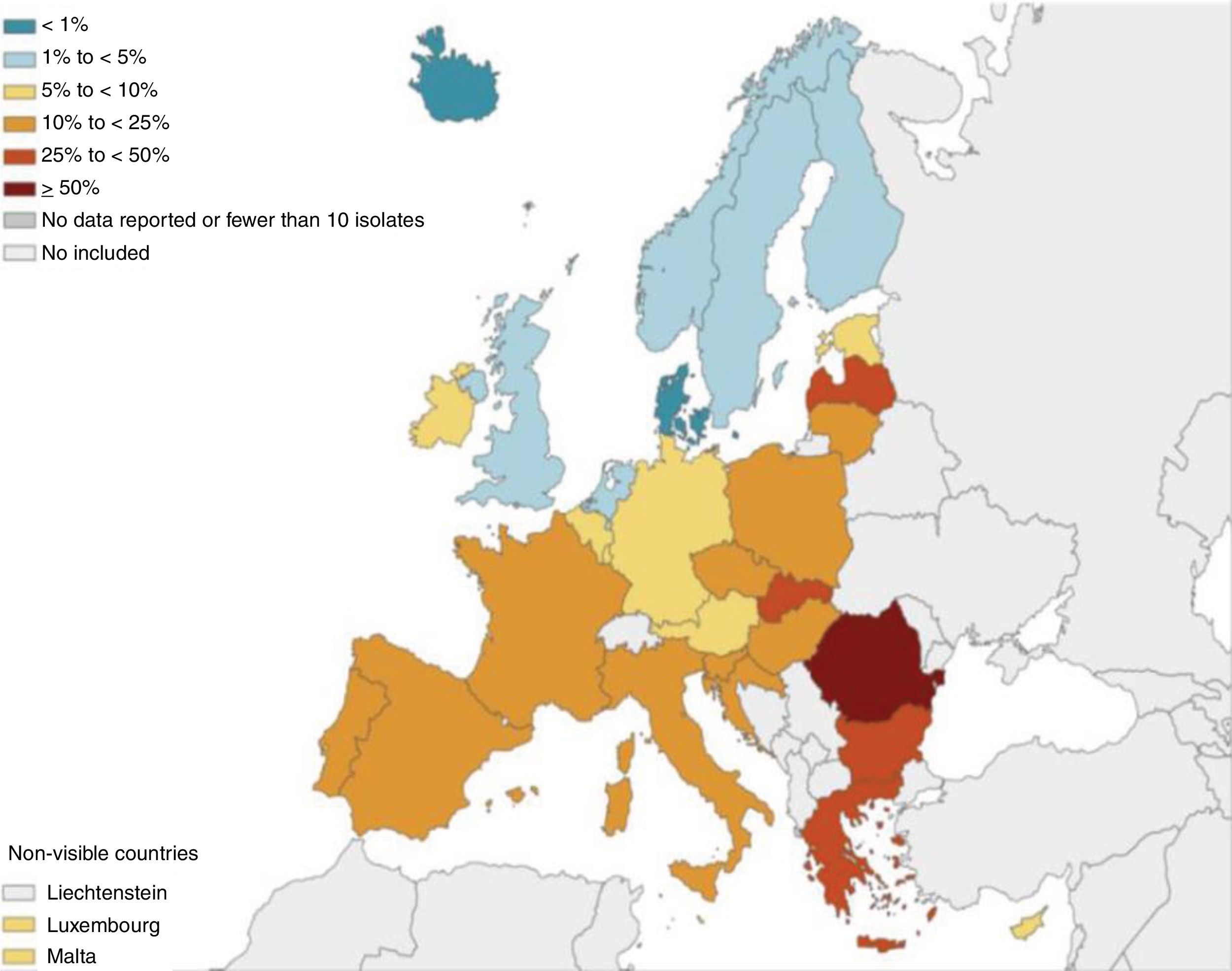
Por un lado, datos procedentes de registros internacionales demuestran con claridad como la prevalencia de aislamientos de PA en pacientes con BQ presenta un gradiente creciente en su incidencia desde el norte al sur de Europa, pudiendo llegar a ser más del doble en la zona mediterránea, incluida España, que en países centroeuropeos o nórdicos7. Estos datos han sido corroborados (también para la IBC) en los registros y estudios nacionales españoles8, latinoamericanos9 y asiáticos10. Además, y lo que parece más preocupante, el porcentaje de resistencia y multirresistencia de PA a los antibióticos más utilizados en la infección respiratoria y sistémica por este microorganismo parece seguir un patrón geográfico semejante (fig. 1)11, situación que puede limitar la eficacia de los tratamientos por vía oral y sistémica. ¿Deberían ser tratados todos los pacientes con IBC por PA de la misma forma independientemente de la situación de presión microbiológica del país de origen? Según los autores del presente editorial, la respuesta es que no. Un tratamiento intensivo temprano favorecería una menor progresión de PA y por tanto un menor efecto lesivo en el paciente. Esperar a una situación clínica menos favorable en un ambiente epidemiológico de mayor resistencia a los antibióticos reduciría enormemente la probabilidad de controlar la cronicidad de la infección.
Porcentaje (%) de aislamientos de Pseudomonas aeruginosa con resistencia combinada a al menos 3 grupos de antimicrobianos: piperacilina-tazobactam, ceftazidima, fluoroquinolonas, aminoglucósidos y carbapenemes, por país de la Unión Europea, 2017.Fuente: European Centre for Disease Prevention and Control11.
Por otro lado, diferentes normativas internacionales han establecido, basándose en la evidencia científica, la necesidad de un tratamiento intensivo ante una situación de IBC por PA en BQ debidas a FQ12. Si bien es cierto que la efectividad y seguridad de algunos fármacos no ha resultado ser superponible en ambas enfermedades ¿sería razonable que, ante una falta de evidencia científica disponible específica para el tratamiento de la IBC por PA en BQ no debidas a FQ, se adopten medidas terapéuticas semejantes a la FQ habida cuenta de la gran agresividad de este microorganismo en BQ de cualquier etiología? Nuestra respuesta es que sí.
Por último, algunos autores han puesto de manifiesto que es al menos discutible que la reducción en el número de agudizaciones deba ser el objetivo principal de los EC para evaluar la efectividad de la antibioterapia a largo plazo en situación de IBC por PA en BQ. Ello es debido a varias circunstancias: por un lado, a la existencia habitual de una selección previa de los pacientes más agudizadores para ser incluidos en estos estudios. Por otro lado, a la existencia de otras variables que también han demostrado gran importancia pronóstica más allá de las agudizaciones, como el deterioro de la calidad de vida (parámetro clave para las agencias reguladoras) en pacientes ancianos, frágiles, con múltiples comorbilidades o inmunodepresión, el declive de la función pulmonar o la gravedad de los síntomas o de las propias BQ. Es necesaria, por lo tanto, una reflexión sobre cuál debería ser el mejor objetivo en estos EC4,12 (quizá se debería valorar un objetivo ponderado compuesto por diferentes variables). En este sentido, según el registro en España, más del 95% de los pacientes con BQ e IBC por PA cumplirían con algunos de los criterios clínicos anteriormente descritos. Conclusiones semejantes aportan Aliberti et al. en un estudio de clústeres en BQ que incluyó 5 centros europeos y en el que el clúster formado por aquellos pacientes con IBC por PA presentó un 93-95% de pacientes con tos y/o expectoración diaria, y una mediana de 3 exacerbaciones en el año previo13. ¿Parece razonable, por lo tanto, el tratamiento en todos estos casos anteriormente expuestos en un país tanto con elevada prevalencia de IBC por PA como de resistencia de PA a los antibióticos? Nuestra respuesta, nuevamente, debe ser que sí.
Por todo ello, nuestra recomendación es que todos los pacientes con IBC por PA y BQ sean tratados con antibióticos inhalados independientemente del número de agudizaciones que presenten (que serán habitualmente frecuentes, en cualquier caso). Recomendamos, además, que este tratamiento sea seguido en aquellos países con una situación de presión microbiológica semejante a la de España. Sin embargo, somos conscientes de que estos tratamientos no están exentos de costes y efectos adversos y que, en ocasiones, no son del todo accesibles y, por lo tanto, parece sensato pensar que en aquellas zonas en las que la presión microbiológica no sea excesiva, se pueda ser más selectivo y menos agresivo en el tratamiento ante una potencial mejor respuesta con otras opciones.
En resumen, dada la escasa información terapéutica disponible en BQ es necesario buscar un buen balance entre la evidencia científica, la experiencia y los aspectos locales geográficos de esta enfermedad. Ello añade valor a la coexistencia lógica y necesaria de normativas internacionales y nacionales, o de normativas más basadas en la evidencia científica y otras que además plantean modificaciones terapéuticas acordes a las diferentes circunstancias locales, para que entre ambas se dé respuesta a las necesidades reales de todos los pacientes en la práctica clínica. Es una excelente noticia que, al menos, un amplio grupo de colaboración mundial en BQ se reúna periódicamente para establecer las bases de las definiciones más básicas pero importantes de esta enfermedad, entre ellas, la propia definición de agudización o de IBC14. Sin duda, son necesarios estudios bien diseñados que incluyan diferentes fenotipos de pacientes dependiendo de sus características clínicas y microbiológicas, con la medición de objetivos clínicamente relevantes que vayan más allá de la simple tasa de agudizaciones, que aporten más luz sobre qué pacientes deben ser tratados y quiénes no. Como siempre, parece que, en un futuro, la esperada medicina personalizada de precisión tendrá la respuesta: «cada paciente, un tratamiento, en un momento dado».
FinanciaciónSEPAR a través del grupo de trabajo de RIBRON.
Conflicto de interesesTodos los autores firmantes del presente manuscrito son autores de las Normativas para el diagnóstico y tratamiento de las bronquiectasias 2108 de SEPAR.