Los fármacos inhalados se depositan directamente en el tracto respiratorio, con lo que se alcanzan altas concentraciones, con un inicio de acción más rápido y con menores efectos secundarios que si se emplea la vía sistémica. Los fármacos nebulizados se recomiendan fundamentalmente en pacientes que requieren dosis altas de broncodilatadores, cuando precisan inhalar fármacos que solo pueden administrarse nebulizados (como los antibióticos o la dornasa alfa) y si no son capaces de utilizar otros dispositivos de inhalación. El desarrollo tecnológico de los últimos años ha permitido contar con dispositivos que optimizan el depósito pulmonar y disminuyen el tiempo necesario para realizar el tratamiento. En esta revisión nos ceñiremos únicamente a aquellos fármacos que se administran —o están en investigación— en nebulización en pacientes adultos; fundamentalmente a los broncodilatadores, corticoides inhalados, antibióticos, antifúngicos, mucolíticos y otros como los prostanoides, los anticoagulantes o la lidocaína.
Inhaled drugs are deposited directly in the respiratory tract. They therefore achieve higher concentrations with faster onset of action and fewer side effects than when used systemically. Nebulized drugs are mainly recommended for patients that require high doses of bronchodilators, when they need to inhale drugs that only exist in this form (antibiotics or dornase alfa) or when they are unable to use other inhalation devices. Technological development in recent years has led to new devices that optimize pulmonary deposits and reduce the time needed for treatment. In this review we focus solely on drugs currently used, or under investigation, for nebulization in adult patients; basically bronchodilators, inhaled steroids, antibiotics, antifungals, mucolytics and others such as anticoagulants, prostanoids and lidocaine.
La vía inhalada se ha utilizado desde hace siglos para administrar diferentes sustancias y fármacos. Los fármacos inhalados se depositan directamente en el tracto respiratorio, con lo que se alcanzan altas concentraciones, con un inicio de acción más rápido y con menores efectos secundarios que si se emplea la vía sistémica. Las 3 modalidades habitualmente utilizadas son los cartuchos presurizados dosificados, los inhaladores de polvo seco y los nebulizadores. Como norma general, no se recomienda utilizar nebulizadores si el fármaco puede administrarse con otros dispositivos1-4. La European Respiratory Society2 los recomienda en pacientes que requieren dosis altas de broncodilatadores, cuando precisan inhalar fármacos (como los antibióticos o la dornasa-alfa) que solo pueden administrarse nebulizados, y si no son capaces de utilizar otros dispositivos de inhalación2.
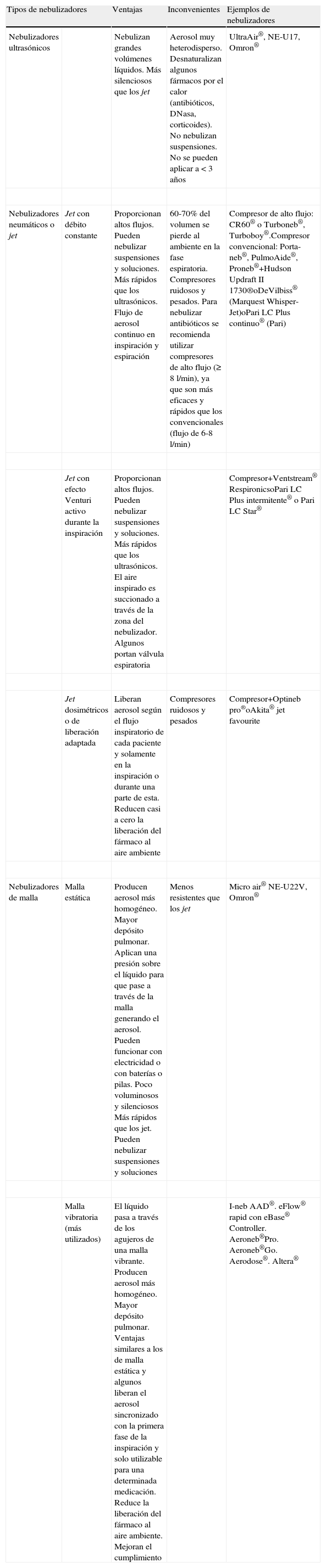
Los medicamentos para inhalación son desarrollados con características específicas y diferentes a sus análogos de administración sistémica. La eficacia de la nebulización depende de muchos factores, entre otros, de las características del medicamento (tamaño, forma, densidad y tensión superficial de la partícula), de la anatomía de las vías aéreas, de la técnica de inhalación del paciente y del sistema de nebulización1. El tamaño de las partículas producidas por un nebulizador depende de las características de la solución y de la velocidad de flujo. Cuanto mayor sea la velocidad de flujo, menor será el tamaño de las partículas del aerosol. Las partículas de un tamaño comprendido entre 1 y 5μm son las que más probabilidades tienen de llegar a los lugares adecuados del árbol bronquial y de conseguir el efecto terapéutico buscado1–4. Los equipos o sistemas de nebulización se componen de una cámara de nebulización donde se introduce el líquido a nebulizar y se genera el aerosol, y de una fuente de energía necesaria para hacerlos funcionar. Hay 3 tipos de nebulizadores de uso clínico: ultrasónicos, neumáticos o tipo jet y de malla. En la tabla 1 se resumen sus principales características. Los fármacos nebulizados deben administrarse, preferiblemente, con los nebulizadores con los que se hayan realizado los ensayos clínicos. Se debe entrenar a los pacientes en su utilización, limpieza y mantenimiento. El desarrollo tecnológico de los últimos años ha permitido contar con dispositivos que optimizan el depósito pulmonar y disminuyen el tiempo necesario para realizar el tratamiento1,4,5.
Tipos de nebulizadores, características y ventajas e inconvenientes
| Tipos de nebulizadores | Ventajas | Inconvenientes | Ejemplos de nebulizadores | |
| Nebulizadores ultrasónicos | Nebulizan grandes volúmenes líquidos. Más silenciosos que los jet | Aerosol muy heterodisperso. Desnaturalizan algunos fármacos por el calor (antibióticos, DNasa, corticoides). No nebulizan suspensiones. No se pueden aplicar a<3 años | UltraAir®, NE-U17, Omron® | |
| Nebulizadores neumáticos o jet | Jet con débito constante | Proporcionan altos flujos. Pueden nebulizar suspensiones y soluciones. Más rápidos que los ultrasónicos. Flujo de aerosol continuo en inspiración y espiración | 60-70% del volumen se pierde al ambiente en la fase espiratoria. Compresores ruidosos y pesados. Para nebulizar antibióticos se recomienda utilizar compresores de alto flujo (≥8l/min), ya que son más eficaces y rápidos que los convencionales (flujo de 6-8l/min) | Compresor de alto flujo: CR60® o Turboneb®, Turboboy®.Compresor convencional: Porta-neb®, PulmoAide®, Proneb®+Hudson Updraft II 1730®oDeVilbiss® (Marquest Whisper-Jet)oPari LC Plus continuo® (Pari) |
| Jet con efecto Venturi activo durante la inspiración | Proporcionan altos flujos. Pueden nebulizar suspensiones y soluciones. Más rápidos que los ultrasónicos. El aire inspirado es succionado a través de la zona del nebulizador. Algunos portan válvula espiratoria | Compresor+Ventstream® RespironicsoPari LC Plus intermitente® o Pari LC Star® | ||
| Jet dosimétricos o de liberación adaptada | Liberan aerosol según el flujo inspiratorio de cada paciente y solamente en la inspiración o durante una parte de esta. Reducen casi a cero la liberación del fármaco al aire ambiente | Compresores ruidosos y pesados | Compresor+Optineb pro®oAkita® jet favourite | |
| Nebulizadores de malla | Malla estática | Producen aerosol más homogéneo. Mayor depósito pulmonar. Aplican una presión sobre el líquido para que pase a través de la malla generando el aerosol. Pueden funcionar con electricidad o con baterías o pilas. Poco voluminosos y silenciosos Más rápidos que los jet. Pueden nebulizar suspensiones y soluciones | Menos resistentes que los jet | Micro air® NE-U22V, Omron® |
| Malla vibratoria (más utilizados) | El líquido pasa a través de los agujeros de una malla vibrante. Producen aerosol más homogéneo. Mayor depósito pulmonar. Ventajas similares a los de malla estática y algunos liberan el aerosol sincronizado con la primera fase de la inspiración y solo utilizable para una determinada medicación. Reduce la liberación del fármaco al aire ambiente. Mejoran el cumplimiento | I-neb AAD®. eFlow® rapid con eBase® Controller. Aeroneb®Pro. Aeroneb®Go. Aerodose®. Altera® | ||
En esta revisión nos ceñiremos a aquellos medicamentos que se utilizan, o están en investigación, para uso en nebulización en pacientes adultos.
Broncodilatadores y corticoides nebulizadosDiferentes revisiones sistemáticas han demostrado que los 3 tipos de dispositivos habitualmente utilizados para la administración de broncodilatadores y corticoides inhalados (cartuchos presurizados, inhaladores de polvo seco y nebulizadores) tienen una eficacia similar cuando se utilizan de forma adecuada2–4,6,7. Sin embargo, la práctica clínica nos demuestra que algunos pacientes, particularmente los de edad avanzada, con limitaciones físicas, mentales, o con enfermedad grave, son incapaces de utilizar correctamente los dispositivos de polvo seco o los cartuchos presurizados8. Estos pacientes podrían beneficiarse de la administración de estos fármacos por vía nebulizada, así como aquellos que los prefieran frente a otros inhaladores2,3,9–13.
Los broncodilatadores de acción corta son los que más frecuentemente se utilizan en nebulización, estando disponibles el salbutamol y el bromuro de ipratropio. Con su utilización conjunta se obtiene una mejoría del 24% en el FEV1 si se compara con el salbutamol solo y del 37% con respecto al bromuro de ipratropio, en pacientes con EPOC14. Este tratamiento puede mejorar la calidad de vida incluso cuando se combina con la utilización de otro inhalador15. El formoterol es el único broncodilatador de acción larga disponible (como fumarato de formoterol o como arformoterol), aunque no están disponibles en España. Diferentes estudios han demostrado su efectividad en el tratamiento de pacientes con EPOC16–18.
Los corticoides nebulizados19–28, fundamentalmente la budesonida20–23, aunque también la flunisolida24, la fluticasona25 y la beclometasona26,27, pueden considerarse una alternativa eficaz en los pacientes asmáticos o con EPOC que no quieren o son incapaces de utilizar otros dispositivos de inhalación (tabla 2). Marcus et al.28, en pacientes mayores con asma o EPOC y con dificultad para utilizar otros dispositivos, observaron menor uso de corticoides sistémicos y menos visitas a urgencias al mantener tratamiento crónico con corticoides nebulizados. Maltais et al.22 compararon la eficacia de budesonida nebulizada y corticoides sistémicos en pacientes con exacerbaciones de EPOC, sin encontrar diferencias en la mejoría del FEV1, duración de la hospitalización o efectos adversos. La utilización de dosis más altas, o con una mayor frecuencia, podría ser una alternativa segura a los corticoides sistémicos, sin los efectos secundarios de estos23.
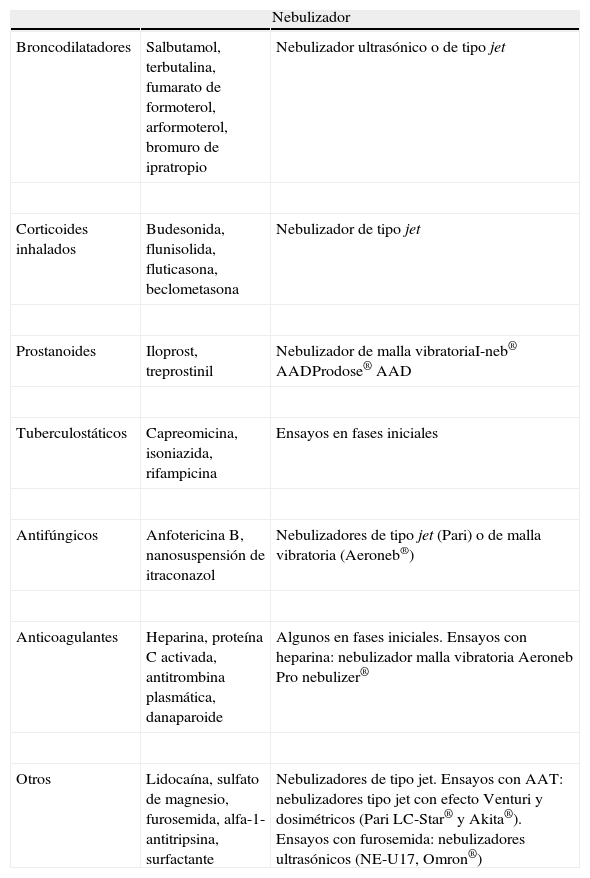
Diferentes tipos de fármacos para nebulización
| Nebulizador | ||
| Broncodilatadores | Salbutamol, terbutalina, fumarato de formoterol, arformoterol, bromuro de ipratropio | Nebulizador ultrasónico o de tipo jet |
| Corticoides inhalados | Budesonida, flunisolida, fluticasona, beclometasona | Nebulizador de tipo jet |
| Prostanoides | Iloprost, treprostinil | Nebulizador de malla vibratoriaI-neb® AADProdose® AAD |
| Tuberculostáticos | Capreomicina, isoniazida, rifampicina | Ensayos en fases iniciales |
| Antifúngicos | Anfotericina B, nanosuspensión de itraconazol | Nebulizadores de tipo jet (Pari) o de malla vibratoria (Aeroneb®) |
| Anticoagulantes | Heparina, proteína C activada, antitrombina plasmática, danaparoide | Algunos en fases iniciales. Ensayos con heparina: nebulizador malla vibratoria Aeroneb Pro nebulizer® |
| Otros | Lidocaína, sulfato de magnesio, furosemida, alfa-1- antitripsina, surfactante | Nebulizadores de tipo jet. Ensayos con AAT: nebulizadores tipo jet con efecto Venturi y dosimétricos (Pari LC-Star® y Akita®). Ensayos con furosemida: nebulizadores ultrasónicos (NE-U17, Omron®) |
En la década de los cincuenta del siglo pasado se utilizaron por primera vez antibióticos nebulizados (ATN) (penicilina y estreptomicina) para el tratamiento de la infección bronquial29,30. Estos primeros intentos dieron paso a la utilización de una mayor gama de ATN, acondicionados desde su preparación intravenosa, fundamentalmente en pacientes con fibrosis quística (FQ) con infección crónica por Pseudomonas aeruginosa (PA). También se han utilizado para el tratamiento de la infección bronquial en bronquiectasias (BQ) no FQ, en la EPOC y en las neumonías asociadas al ventilador (NAV). Todo ello impulsó la comercialización de preparados antibióticos específicos para nebulización (tabla 3) y la puesta en marcha de ensayos clínicos con distintos antibióticos para inhalación (algunos en polvo seco a los que no nos referiremos) y en distintas patologías29–33. Los ATN deben administrarse preferiblemente con los nebulizadores con los que se hayan realizado los ensayos clínicos1–4,33,34.
Antibióticos comercializados en España para uso nebulizado
| Antibiótico | Nombre comercial | Dosis | Nebulizadores |
| Colistina, solución para inhalación (COL) | Colistina GES® | 0,5-2 millones UI, 2 o 3 veces al día continuo | Compresor de alto flujo tipo CR60®+pipeta tipo Ventstream®o +Pari LC Plus® (Pari)oE flow® |
| Promixin® | 0,5-1 millón UI, 2 o 3 veces al día continuo | I-neb AAD®: activado por la inspiración | |
| Tobramicina, solución para inhalación (TNS) | TOBI® | 300mg/5ml, 2 veces al día, 8 días sí/28 días no | Compresor de alto flujo tipo CR60®+Pipeta tipo Ventstream®o+Pari-LC Plus®oE flow® |
| Tobramicina Combino Pharm® | |||
| Tobramicina Teva® | |||
| Bramitob® | 300mg/4ml, 2 veces al día, 28 días sí/28 días no | ||
| Tobrineb® | |||
| Aztreonam lisina, solución para inhalación (AZLI) | Cayston® | 75mg, 3 veces al día, 28 días sí/28 días no | Eflow®+dispositivo Altera® |
En pacientes con FQ, con primoinfección por PA, está demostrado el beneficio del tratamiento precoz con ATN35–44 (tobramicina [TIS]35–38,40–42, colistina39,40,43 o aztreonam-lisina [AZLI]44), ya que se consiguen altas tasas de erradicación y se retrasa la infección bronquial crónica35–44.
La administración prolongada de ATN ha demostrado su eficacia en el tratamiento de la infección bronquial crónica por PA en pacientes con FQ31,35–39,45–59. Las opciones son diversas35–38 e incluyen la terapia antibiótica inhalada intermitente, con periodos de 28 días de tratamiento y 28 de descanso, con TIS31,45–49 o AZLI38,55–59, o el tratamiento continuo con colistina36,39,50–52. Disponemos ya de estudios con otros ATN, aun no comercializados en España32, que han demostrado ser eficaces y bien tolerados en pacientes con FQ, como el levofloxacino60,61, la amikacina liposomal (Arikace®)32,62 y la combinación de fosfomicina y tobramicina63. En la tabla 4 se resumen los principales estudios con ATN en pacientes con FQ e infección crónica por PA.
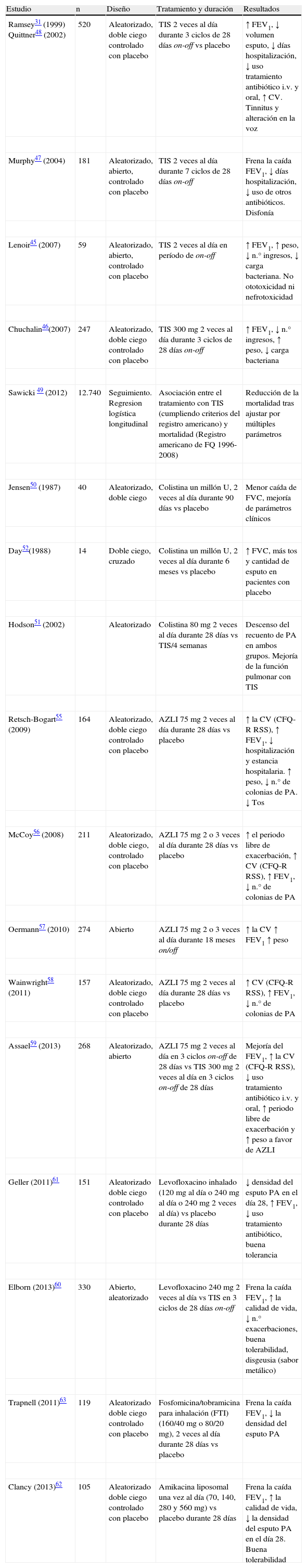
Estudios sobre terapia antibiótica nebulizada en pacientes con bronquiectasias debidas a fibrosis quística con infección crónica por Pseudomonas aeruginosa
| Estudio | n | Diseño | Tratamiento y duración | Resultados |
| Ramsey31 (1999) Quittner48 (2002) | 520 | Aleatorizado, doble ciego controlado con placebo | TIS 2 veces al día durante 3 ciclos de 28 días on-off vs placebo | ↑ FEV1, ↓ volumen esputo, ↓ días hospitalización, ↓ uso tratamiento antibiótico i.v. y oral, ↑ CV. Tinnitus y alteración en la voz |
| Murphy47 (2004) | 181 | Aleatorizado, abierto, controlado con placebo | TIS 2 veces al día durante 7 ciclos de 28 días on-off | Frena la caída FEV1, ↓ días hospitalización, ↓ uso de otros antibióticos. Disfonía |
| Lenoir45 (2007) | 59 | Aleatorizado, abierto, controlado con placebo | TIS 2 veces al día en período de on-off | ↑ FEV1, ↑ peso, ↓ n.° ingresos, ↓ carga bacteriana. No ototoxicidad ni nefrotoxicidad |
| Chuchalin46(2007) | 247 | Aleatorizado, doble ciego controlado con placebo | TIS 300mg 2 veces al día durante 3 ciclos de 28 días on-off | ↑ FEV1, ↓ n.° ingresos, ↑ peso, ↓ carga bacteriana |
| Sawicki 49 (2012) | 12.740 | Seguimiento. Regresion logística longitudinal | Asociación entre el tratamiento con TIS (cumpliendo criterios del registro americano) y mortalidad (Registro americano de FQ 1996-2008) | Reducción de la mortalidad tras ajustar por múltiples parámetros |
| Jensen50 (1987) | 40 | Aleatorizado, doble ciego | Colistina un millón U, 2 veces al día durante 90 días vs placebo | Menor caída de FVC, mejoría de parámetros clínicos |
| Day52(1988) | 14 | Doble ciego, cruzado | Colistina un millón U, 2 veces al día durante 6 meses vs placebo | ↑ FVC, más tos y cantidad de esputo en pacientes con placebo |
| Hodson51 (2002) | Aleatorizado | Colistina 80mg 2 veces al día durante 28 días vs TIS/4 semanas | Descenso del recuento de PA en ambos grupos. Mejoría de la función pulmonar con TIS | |
| Retsch-Bogart55 (2009) | 164 | Aleatorizado, doble ciego controlado con placebo | AZLI 75mg 2 veces al día durante 28 días vs placebo | ↑ la CV (CFQ-R RSS), ↑ FEV1, ↓ hospitalización y estancia hospitalaria. ↑ peso, ↓ n.° de colonias de PA. ↓ Tos |
| McCoy56 (2008) | 211 | Aleatorizado, doble ciego, controlado con placebo | AZLI 75mg 2 o 3 veces al día durante 28 días vs placebo | ↑ el periodo libre de exacerbación, ↑ CV (CFQ-R RSS), ↑ FEV1, ↓ n.° de colonias de PA |
| Oermann57 (2010) | 274 | Abierto | AZLI 75mg 2 o 3 veces al día durante 18 meses on/off | ↑ la CV ↑ FEV1 ↑ peso |
| Wainwright58 (2011) | 157 | Aleatorizado, doble ciego controlado con placebo | AZLI 75mg 2 veces al día durante 28 días vs placebo | ↑ CV (CFQ-R RSS), ↑ FEV1, ↓ n.° de colonias de PA |
| Assael59 (2013) | 268 | Aleatorizado, abierto | AZLI 75mg 2 veces al día en 3 ciclos on-off de 28 días vs TIS 300mg 2 veces al día en 3 ciclos on-off de 28 días | Mejoría del FEV1, ↑ la CV (CFQ-R RSS), ↓ uso tratamiento antibiótico i.v. y oral, ↑ periodo libre de exacerbación y ↑ peso a favor de AZLI |
| Geller (2011)61 | 151 | Aleatorizado doble ciego controlado con placebo | Levofloxacino inhalado (120mg al día o 240mg al día o 240mg 2 veces al día) vs placebo durante 28 días | ↓ densidad del esputo PA en el día 28, ↑ FEV1, ↓ uso tratamiento antibiótico, buena tolerancia |
| Elborn (2013)60 | 330 | Abierto, aleatorizado | Levofloxacino 240mg 2 veces al día vs TIS en 3 ciclos de 28 días on-off | Frena la caída FEV1, ↑ la calidad de vida, ↓ n.° exacerbaciones, buena tolerabilidad, disgeusia (sabor metálico) |
| Trapnell (2011)63 | 119 | Aleatorizado doble ciego controlado con placebo | Fosfomicina/tobramicina para inhalación (FTI) (160/40mg o 80/20mg), 2 veces al día durante 28 días vs placebo | Frena la caída FEV1, ↓ la densidad del esputo PA |
| Clancy (2013)62 | 105 | Aleatorizado doble ciego controlado con placebo | Amikacina liposomal una vez al día (70, 140, 280 y 560mg) vs placebo durante 28 días | Frena la caída FEV1, ↑ la calidad de vida, ↓ la densidad del esputo PA en el día 28. Buena tolerabilidad |
AZLI: aztreonam lisina; CFQ-R RSS: Cystic Fibrosis Questionnaire-Revised; CV: calidad de vida; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; PA: Pseudomonas aeruginosa;TIS: tobramicina solución para inhalación.
Excepcionalmente se utilizan en FQ otros ATN (acondicionados desde su preparación intravenosa) como la vancomicina para la infección bronquial por Staphylococcus aureus resistente a la meticilina (SARM)64 o la amikacina para tratamiento de micobacterias atípicas de «crecimiento rápido» como Mycobacterium abscessus65 o Mycobacterium avium complex66 como terapia coadyuvante y en combinación con antibióticos sistémicos.
Antibióticos nebulizados en bronquiectasias no fibrosis quísticaEn BQ no FQ la evidencia es menor, pero los estudios disponibles con distintos ATN observan mejoría de la calidad de vida y de los síntomas, con reducción del volumen y purulencia del esputo y de las agudizaciones; disminución de la inflamación bronquial y sistémica y de la densidad de colonias de PA o de otros microorganismos, con tasas de erradicación variables29,33,67–84. En la tabla 5 se resumen los principales estudios con ATN en pacientes con BQ no FQ.
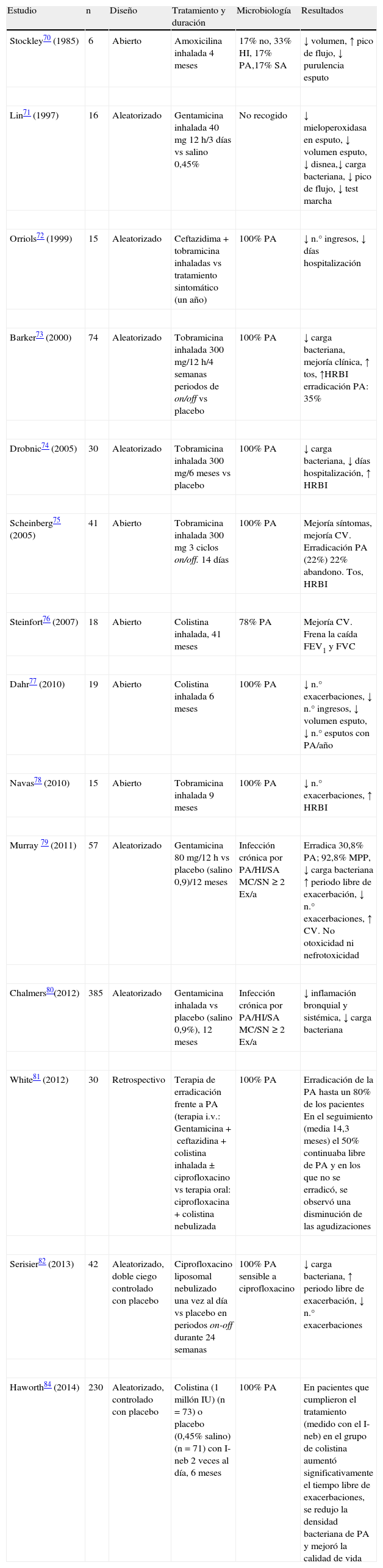
Estudios sobre terapia antibiótica nebulizada en bronquiectasias no fibrosis quística
| Estudio | n | Diseño | Tratamiento y duración | Microbiología | Resultados |
| Stockley70 (1985) | 6 | Abierto | Amoxicilina inhalada 4 meses | 17% no, 33% HI, 17% PA,17% SA | ↓ volumen, ↑ pico de flujo, ↓ purulencia esputo |
| Lin71 (1997) | 16 | Aleatorizado | Gentamicina inhalada 40mg 12h/3 días vs salino 0,45% | No recogido | ↓ mieloperoxidasa en esputo, ↓ volumen esputo, ↓ disnea,↓ carga bacteriana, ↓ pico de flujo, ↓ test marcha |
| Orriols72 (1999) | 15 | Aleatorizado | Ceftazidima+tobramicina inhaladas vs tratamiento sintomático (un año) | 100% PA | ↓ n.° ingresos, ↓ días hospitalización |
| Barker73 (2000) | 74 | Aleatorizado | Tobramicina inhalada 300mg/12h/4 semanas periodos de on/off vs placebo | 100% PA | ↓ carga bacteriana, mejoría clínica, ↑ tos, ↑HRBI erradicación PA: 35% |
| Drobnic74 (2005) | 30 | Aleatorizado | Tobramicina inhalada 300mg/6 meses vs placebo | 100% PA | ↓ carga bacteriana, ↓ días hospitalización, ↑ HRBI |
| Scheinberg75 (2005) | 41 | Abierto | Tobramicina inhalada 300mg 3 ciclos on/off. 14 días | 100% PA | Mejoría síntomas, mejoría CV. Erradicación PA (22%) 22% abandono. Tos, HRBI |
| Steinfort76 (2007) | 18 | Abierto | Colistina inhalada, 41 meses | 78% PA | Mejoría CV. Frena la caída FEV1 y FVC |
| Dahr77 (2010) | 19 | Abierto | Colistina inhalada 6 meses | 100% PA | ↓ n.° exacerbaciones, ↓ n.° ingresos, ↓ volumen esputo, ↓ n.° esputos con PA/año |
| Navas78 (2010) | 15 | Abierto | Tobramicina inhalada 9 meses | 100% PA | ↓ n.° exacerbaciones, ↑ HRBI |
| Murray 79 (2011) | 57 | Aleatorizado | Gentamicina 80mg/12h vs placebo (salino 0,9)/12 meses | Infección crónica por PA/HI/SA MC/SN ≥2 Ex/a | Erradica 30,8% PA; 92,8% MPP, ↓ carga bacteriana ↑ periodo libre de exacerbación, ↓ n.° exacerbaciones, ↑ CV. No otoxicidad ni nefrotoxicidad |
| Chalmers80(2012) | 385 | Aleatorizado | Gentamicina inhalada vs placebo (salino 0,9%), 12 meses | Infección crónica por PA/HI/SA MC/SN ≥2 Ex/a | ↓ inflamación bronquial y sistémica, ↓ carga bacteriana |
| White81 (2012) | 30 | Retrospectivo | Terapia de erradicación frente a PA (terapia i.v.: Gentamicina+ceftazidina+colistina inhalada±ciprofloxacino vs terapia oral: ciprofloxacina+colistina nebulizada | 100% PA | Erradicación de la PA hasta un 80% de los pacientes En el seguimiento (media 14,3 meses) el 50% continuaba libre de PA y en los que no se erradicó, se observó una disminución de las agudizaciones |
| Serisier82 (2013) | 42 | Aleatorizado, doble ciego controlado con placebo | Ciprofloxacino liposomal nebulizado una vez al día vs placebo en periodos on-off durante 24 semanas | 100% PA sensible a ciprofloxacino | ↓ carga bacteriana, ↑ periodo libre de exacerbación, ↓ n.° exacerbaciones |
| Haworth84 (2014) | 230 | Aleatorizado, controlado con placebo | Colistina (1 millón IU) (n=73) o placebo (0,45% salino) (n=71) con I-neb 2 veces al día, 6 meses | 100% PA | En pacientes que cumplieron el tratamiento (medido con el I-neb) en el grupo de colistina aumentó significativamente el tiempo libre de exacerbaciones, se redujo la densidad bacteriana de PA y mejoró la calidad de vida |
CV: calidad de vida; Ex/a: exacerbaciones/año; FEV1: volumen espiratorio forzado en el primer segundo; FVC: capacidad vital forzada; HI: Haemophilus influenzae; HRBI: hiperreactividad bronquial; I-Neb: nebulizador de malla; MC: Moraxella catarrhalis; MPP: microorganismos potencialmente patógenos; PA: Pseudomonas aeruginosa; SA: Staphylococcus aureus; SN: Streptococcus pneumoniae.
Actualmente hay 2 normativas publicadas que coinciden en lo sustancial sobre las indicaciones del tratamiento con ATN en pacientes con BQ no FQ. La Normativa SEPAR33 los recomienda en la primocolonización por PA (si no se ha conseguido erradicación con ciprofloxacino oral), en la infección bronquial crónica por PA y en la infección bronquial crónica por otros microorganismos, ante la presencia de efectos adversos, resistencias o ineficacia del tratamiento antibiótico prolongado por vía oral. La normativa británica67 los recomienda en la infección crónica por PA cuando presenten más de 2 agudizaciones en el año previo, o si los pacientes presentan importante morbilidad.
Antibióticos nebulizados en pacientes con enfermedad pulmonar obstructiva crónicaLos pacientes con EPOC pueden presentar infección bronquial crónica persistente y se ha observado, también, una alta prevalencia de BQ asociadas en aquellos con enfermedad moderada-grave, lo que condiciona mayor morbilidad y peor pronóstico85–88. Según la guía GesEPOC89, los pacientes con EPOC y fenotipo agudizador con BQ asociadas e infección bronquial crónica son candidatos a tratamiento crónico o cíclico con antibióticos y se les puede aplicar la Normativa SEPAR de BQ33 para control de la infección bronquial crónica. Recientemente se han puesto en marcha diversos ensayos clínicos con formulaciones para uso inhalado32 de levofloxacino90,91 y ciprofloxacino92 en pacientes con EPOC para evaluar su seguridad, su tolerancia y su farmacocinética, así como su efecto en la prevención de las exacerbaciones. Dal Negro et al.93, en un estudio no controlado, investigan el efecto de la tobramicina nebulizada (300mg/14días) sobre los marcadores inflamatorios en las secreciones bronquiales en 13 pacientes con EPOC severa colonizados por PA multirresistentes, consiguiendo una reducción significativa de los marcadores de inflamación y, durante el período de seguimiento de 6meses, de la densidad bacteriológica y de las exacerbaciones graves. En el estudio de Steinfort y Steinfort76 con colistina nebulizada también se incluyeron 4 pacientes con EPOC severa infectados crónicamente por bacterias gramnegativas multirresistentes, observándose mejoría de la calidad de vida y una disminución en el declinar de la función pulmonar.
Antibióticos nebulizados en las neumonías asociadas al ventiladorAlgunos estudios han demostrado resultados clínicos positivos cuando se utilizan los ATN como terapia adyuvante para la neumonía asociada al ventilador (NAV), con mejoría en la puntuación de severidad clínica, disminución de las resistencias microbianas, reducción en el uso de antibióticos sistémicos y/o disminución de los días de intubación94–102. Los estudios abarcan desde la prevención de la NAV96 a la terapia adyuvante del tratamiento intravenoso de la neumonía por bacterias gramnegativas94 y al tratamiento de la neumonía por PA o Acinetobacter multirresistente97–101. La colistina inhalada se ha mostrado eficaz como terapia adyuvante para la NAV fundamentalmente producida por patógenos multirresistentes (Acinetobacter y PA), observando una buena respuesta bacteriológica97–99 y clínica100,101.
Palmer et al.102, en un ensayo aleatorizado doble ciego y controlado con placebo incluyeron pacientes intubados que recibieron tratamiento con ATN en función de la tinción de Gram (gentamicina 80mg cada 8h para gramnegativos y vancomicina 120mg cada 8h para grampositivos) o placebo. El tratamiento con ATN demostró mejoría de los signos clínicos de neumonía, menor número de episodios de NAV, menos resistencias bacterianas, facilitó el destete y redujo el uso de antibióticos sistémicos. En otro estudio aleatorizado y controlado con placebo95, 4 de 5 pacientes con SARM como agente causal de NAV consiguieron la erradicación del microorganismo con el uso de la vancomicina en aerosol. Aunque estos números son pequeños, y necesitan ser confirmados en ensayos mayores, sugieren que la terapia en aerosol frente al SARM puede ser útil.
La adición de antibióticos en aerosol a los antibióticos sistémicos puede ser considerada en pacientes con microorganismos multirresistentes, en los que no responden a los antibióticos sistémicos o en la NAV94–102.
Neumonía por Pneumocystis jiroveciLa pentamidina en aerosol es una alternativa relativamente bien tolerada a los agentes orales en la prevención primaria y secundaria de la neumonía por Pneumocystis jiroveci en pacientes con infección por el VIH y otros pacientes con enfermedades inmunosupresoras, como los receptores de trasplante de células madre hematopoyéticas103.
AntifúngicosLa infección por Aspergillus fumigatus es la infección fúngica más frecuente en pacientes receptores de trasplante pulmonar. La anfotericina inhalada es la estrategia preventiva más habitual104. Tiene buena distribución a nivel pulmonar105 sin modificación de los lípidos a nivel del surfactante106 y con muy escasa absorción sistémica. Existen 3 presentaciones: la anfotericina B desoxicolato, la lipídica y la liposomal. Estas 2 últimas son las más utilizadas por su mejor distribución pulmonar y buena tolerancia105.
La anfotericina inhalada ha sido utilizada con buenos resultados en pacientes con enfermedades hematológicas en los que se presuponía una neutropenia inducida por la quimioterapia como prevención de la aspergilosis pulmonar invasiva107. También podría representar una alternativa al tratamiento con itraconazol o voriconazol en pacientes con FQ y aspergilosis broncopulmonar alérgica (ABPA). Proesmans et al.108 trataron a 7 pacientes con FQ, ABPA y dificultad para reducir los esteroides con anfotericina desoxicolato o lipídica, demostrándose su eficacia y seguridad, con solo un fallo en el tratamiento y la mejoría de la función pulmonar108.
Recientemente se han publicado los resultados de la farmacocinética de una nanosuspensión acuosa de itraconazol para pacientes con ABPA, observando unas concentraciones altas y duraderas en el tejido pulmonar, que permiten la administración una vez al día con una exposición sistémica mínima109.
Mucolíticos nebulizadosLa N-acetilcisteína nebulizada no ha demostrado efectividad en la EPOC10,89,110, en la FQ33,36,37,111, en la BQ33,67,68 ni tampoco, de forma concluyente, en la fibrosis pulmonar idiopática112. Un estudio reciente, aleatorizado, de Homma et al.113 encuentra que la N-acetilcisteína nebulizada en monoterapia podría ser útil en pacientes con estadios tempranos de fibrosis pulmonar idiopática ya que, aunque no encuentra mejoría en la función pulmonar, sí parece que podría frenar el deterioro.
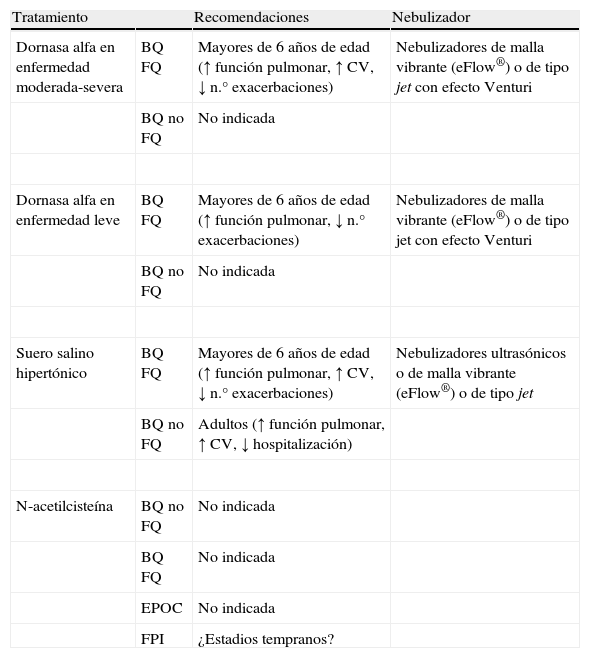
La inhalación de dornasa alfa (DNasa) se ha demostrado claramente efectiva en FQ33,36,37,114, pero en las BQ debidas a otras etiologías puede ser ineficaz o incluso perjudicial115,116, por lo que no se recomienda su empleo33,67,68,116 (tabla 6).
Mucolíticos nebulizados
| Tratamiento | Recomendaciones | Nebulizador | |
| Dornasa alfa en enfermedad moderada-severa | BQ FQ | Mayores de 6 años de edad (↑ función pulmonar, ↑ CV, ↓ n.° exacerbaciones) | Nebulizadores de malla vibrante (eFlow®) o de tipo jet con efecto Venturi |
| BQ no FQ | No indicada | ||
| Dornasa alfa en enfermedad leve | BQ FQ | Mayores de 6 años de edad (↑ función pulmonar, ↓ n.° exacerbaciones) | Nebulizadores de malla vibrante (eFlow®) o de tipo jet con efecto Venturi |
| BQ no FQ | No indicada | ||
| Suero salino hipertónico | BQ FQ | Mayores de 6 años de edad (↑ función pulmonar, ↑ CV, ↓ n.° exacerbaciones) | Nebulizadores ultrasónicos o de malla vibrante (eFlow®) o de tipo jet |
| BQ no FQ | Adultos (↑ función pulmonar, ↑ CV, ↓ hospitalización) | ||
| N-acetilcisteína | BQ no FQ | No indicada | |
| BQ FQ | No indicada | ||
| EPOC | No indicada | ||
| FPI | ¿Estadios tempranos? |
BQ FQ: bronquiectasias debidas a fibrosis quística; BQ no FQ: bronquiectasias no debidas a fibrosis quística; CV: calidad de vida; FPI: fibrosis pulmonar idiopática.
La inhalación de la solución salina hipertónica (SSH) en pacientes con FQ es eficaz, ya que reduce las exacerbaciones, mejora la calidad de vida y mejora levemente la función pulmonar33,36,37,117.
En pacientes con BQ no FQ se ha demostrado que la SSH puede reducir la viscosidad del esputo y las agudizaciones, y mejora la calidad de vida y la función pulmonar33,67,68. Nicolson et al.118 comparan salino al 6% frente al 0,9% y encuentran que ambos reducen las colonizaciones por microorganismos y las exacerbaciones, mejoran la calidad de vida y la función pulmonar, pero sin diferencias significativas ente ellos118. La SSH podría tener también efectos inmunomoduladores y se ha observado que puede reducir las concentraciones de interleucina-8 en esputo y en lavado broncoalveolar119.
Hay ensayos clínicos en marcha en EPOC con SSH120 y de la solución de inhalación BIO-11006 que podría tener efectos antiinflamatorios e inhibir la secreción de moco121.
Otras terapias nebulizadas (tabla 2)Alfa1 antitripsina (AAT). Se está investigando el papel de la AAT nebulizada como tratamiento antiinflamatorio en la FQ. En un estudio aleatorizado, doble ciego, de 39 pacientes tratados 4 semanas con AAT humana recombinante inhalada, el fármaco fue bien tolerado pero tuvo un efecto limitado sobre los marcadores de inflamación122,123. Sin embargo, Griese et al.124 sí observan, con la inhalación de AAT, una disminución en la carga total de PA y de los marcadores de inflamación en el esputo inducido. Recientemente se ha utilizado la L-arginina nebulizada125 en pacientes con FQ, siendo segura y bien tolerada, aumentando la producción de óxido nítrico y sin evidencia de cambios en la inflamación bronquial.
Sulfato de magnesio. Diferentes estudios han valorado el papel del sulfato de magnesio en la agudización del asma. La última revisión Cochrane no encontró mejorías significativas cuando el sulfato de magnesio se añadía al tratamiento beta-agonista126. En un metaanálisis posterior el sulfato de magnesio se añadió al tratamiento habitual con corticoides y agonistas beta-2; en los adultos, este tratamiento nebulizado estaba asociado con un efecto significativo sobre la función pulmonar y la reducción de ingresos hospitalarios127. Goodacre et al.128 compararon el efecto del sulfato de magnesio intravenoso frente al nebulizado y a placebo en 1.084 adultos, no encontrando ningún beneficio, ni en la disnea ni en la tasa de hospitalizaciones, al añadirlo al tratamiento estándar. No hay evidencia actualmente, en pacientes adultos, de que el sulfato de magnesio nebulizado tenga efecto sobre la agudización asmática126,129.
Lidocaína. La lidocaína es un fármaco utilizado como anestésico local y antiarrítmico. Como una extensión de su uso tópico para prevenir la tos durante las fibrobroncoscopias, la lidocaína nebulizada ha sido utilizada como tratamiento de la tos de difícil control y el asma. Aunque para nebulización no está comercialmente disponible, la solución de hidrocloruro de lidocaína inyectable satisface los requerimientos para su utilización nebulizada130.
Su uso como tratamiento de la tos refractaria ha sido analizado en varios estudios descriptivos. Sin embargo, la diversidad de los datos en cuanto a dosis, fracción inhalada según el nebulizador utilizado, las comorbilidades responsables de la tos y el tratamiento previo, hacen difícil establecer la dosis ideal e identificar los pacientes que se podrían beneficiar de este tratamiento130,131. Un reciente estudio de 99 pacientes con tos de difícil control, utilizando entre 3 y 5ml de lidocaína al 4% 2 o 3 veces al día, obtenía un control sintomático en el 49% de los casos sin que se observaran efectos adversos graves131. Por tanto, aunque la lidocaína no es un tratamiento de primera elección para la tos persistente, podría constituir una opción alternativa en pacientes que no toleran o no responden a otros tratamientos.
Los estudios con lidocaína nebulizada en pacientes con asma no muestran resultados claros; algunos encuentran mejoría en la función pulmonar y una reducción de los corticoides para el control de síntomas130,132, aunque otros no han logrado reproducir estos datos130,133, por lo que son necesarios más estudios para considerar esta opción en pacientes que precisan dosis altas de corticoides orales para el control de los síntomas.
Furosemida. También ha sido utilizada para aliviar la disnea por vía nebulizada. Ha sido eficaz en pacientes con cáncer avanzado y disnea importante que no responde a los opiáceos. Diferentes revisiones de los efectos de la furosemida nebulizada en los pacientes con obstrucción de la vía aérea han encontrado que tiene un leve efecto broncodilatador, o al menos es capaz de detener la broncoconstricción134. Un reciente ensayo clínico aleatorizado de 100 pacientes con exacerbación de EPOC, comparando con añadir furosemida inhalada al tratamiento convencional, encuentra una mejoría significativa del FEV1, la disnea, el pH, la presión arterial y la frecuencia cardiaca en el grupo de la furosemida135.
Prostanoides. En la hipertensión arterial pulmonar (HAP), dentro del grupo de los prostanoides existen 2 fármacos para su utilización por vía inhalada: iloprost y treprostinil136. El iloprost es un análogo de la prostaciclina autorizado en España como tratamiento inhalado en pacientes adultos con HAP y clase funcionaliii. Aunque inicialmente ha demostrado una mejoría en el grado funcional, a largo plazo solo una minoría de pacientes permanece estable con iloprost en monoterapia137. Existen estudios que avalan su eficacia en combinación con bosentán y sildenafilo y también como tratamiento de transición para la retirada de prostanoides intravenosos o subcutáneos.132 Existen datos recientes sobre la utilidad del iloprost en pacientes con síndrome de dificultad respiratoria aguda (SDRA) e HAP con mejoría del intercambio de gases sin detrimento de los parámetros respiratorios ni hemodinámicos138,139.
El treprostinil inhalado fue aprobado en 2009 por la FDA para pacientes con HAP y clase funcionaliii. Inicialmente se demostró su efectividad en pacientes que continuaban sintomáticos a pesar de realizar tratamiento con bosentán y sildenafilo140 y también ha sido utilizado como medida de transición para la retirada de prostanoides intravenosos o subcutáneos141.
Tuberculostáticos. Existen algunos intentos de tratamiento de la tuberculosis multirresistente por vía inhalada, como la capreomicina en polvo seco142, o formulaciones de diversos tuberculostáticos como la capreomicina liposomal, la isoniazida o la rifampicina que alcanzan niveles adecuados por vía aerosolizada en animales de experimentación143. Sin embargo, algunas características de las lesiones tuberculosas, como la existencia de zonas poco aireadas o el crecimiento de los microorganismos en biofilms, dificultan la eficacia de la terapia nebulizada143.
Anticoagulantes. La alteración del intercambio de la fibrina alveolar es un hecho fundamental en las neumonías graves. Estudios clínicos sugieren que los inhibidores naturales de la coagulación ejercen un efecto protector sobre el pulmón por vía anticoagulante y posiblemente antiinflamatoria. En animales de experimentación, la administración aerosolizada de proteínaC activada, antitrombina plasmática y heparina, reducen significativamente la coagulopatía pulmonar, sin cambios en la coagulación sistémica. El tratamiento con antitrombina plasmática reduce el crecimiento del S.pneumoniae y el daño histopatológico en el pulmón. Este efecto no ha podido ser confirmado en la neumonía por PA. En una revisión sistemática144 de las investigaciones preclínicas y clínicas sobre anticoagulantes nebulizados solo se identificaron 3 ensayos clínicos con heparina nebulizada145–147, observándose una mejoría de la supervivencia en pacientes con lesión pulmonar aguda relacionada con la inhalación de humos y también una reducción en los días de ventilación mecánica.
Surfactante. Un metaanálisis148 que analiza la administración de surfactante exógeno en el SDRA encuentra que puede mejorar la oxigenación sin mejorar la mortalidad. Sin embargo, existe gran diversidad en las vías de administración utilizadas en este metaanálisis, concluyendo que la vía broncoscópica es la que posiblemente tenga más futuro, ya que las tasas de depósito pulmonar usando la vía nebulizada solo alcanza el 4-5%149.
ConclusiónLos fármacos nebulizados son una alternativa terapéutica eficaz en múltiples patologías respiratorias. Actualmente disponemos de dispositivos de nebulización eficaces y rápidos para su administración. Probablemente en un futuro contemos con nuevos fármacos y nuevas evidencias que nos permitan resolver las incertidumbres que aún existen.
Conflicto de interesesCasilda Olveira ha participado en comités de expertos y actividades de formación promovidas y financiadas por Chiesi, Gilead, Novartis y Praxis.
Adolfo Domenech ha participado en actividades de formación promovidas y financiadas por Astra, Boehringer, Esteve, Glaxo, Novartis y Menarini.
Ana Muñoz ha participado en actividades de formación promovidas y financiadas por Astra.