La afectación pulmonar es la causa más importante de morbimortalidad en la fibrosis quística (FQ) y la inflamación-infección bronquial crónica condiciona el deterioro progresivo de la función pulmonar. Los tratamientos destinados a reducir la respuesta inflamatoria podrían ser beneficiosos.
ObjetivosValorar el efecto de la suplementación oral durante un año en pacientes adultos con FQ, de una combinación de ácidos grasos sobre parámetros respiratorios, antropométricos, inflamatorios, de calidad de vida y sobre el perfil de AG de los fosfolípidos séricos (AGFS).
Pacientes y métodoDiecisiete pacientes recibieron diariamente durante un año: 324mg de ácido eicosapentaenoico, 216mg de ácido docosahexaenoico, 480mg de ácido linoleico y 258mg de ácido gammalinolénico. Se valoraron marcadores inflamatorios, parámetros espirométricos, reagudizaciones respiratorias, consumo de antibióticos, calidad de vida (St. George), antropometría y los AGFS.
ResultadosAl final del tratamiento se observó, de forma significativa, una disminución de reagudizaciones y del consumo de antibióticos con mejoría de los parámetros espirométricos, de la masa magra y la dinamometría. Concomitantemente, se observó una reducción significativa de los anticuerpos anti-LDL oxidada (inmunoglobulina [Ig] G e IgM) y de los niveles séricos del factor de necrosis tumoral α, así como un incremento de sus receptores solubles. Los niveles de AGFS mejoraron con un aumento significativo de DHA, AG-omega-3 y ácido linoleico, y un descenso de monoinsaturados y del cociente araquidónico/DHA.
ConclusionesLa suplementación con una mezcla definida de AG durante un año parece mejorar los parámetros respiratorios (espirométricos, reagudizaciones y consumo de antibióticos), inflamatorios y antropométricos en pacientes adultos con FQ.
Chronic inflammation plays a major role in lung deterioration in cystic fibrosis (CF) patients and anti-inflammatory strategies have beneficial effects. To study the changes seen after a one-year course of low-dose dietary supplements with a mixture of fatty acids in adult patients with CF in chronic inflammation, pulmonary status (lung function, respiratory exacerbations and antibiotic consumption), quality of life and anthropometric parameters.
Patients and methodSeventeen adult subjects with CF received 324mg of eicosapentaenoic, 216mg of docosahexaenoic, 480mg of linoleic and 258mg of gammalinolenic acid daily. We assessed inflammation markers, spirometry parameters, number and severity of respiratory exacerbations, antibiotic consumption, quality of life (St George's QoL), anthropometric parameters and serum phospholipid fatty acid composition.
ResultsAt the end of the treatment period TNF alpha levels fell significantly and its soluble receptors (60 and 80) rose significantly. Levels of IgG and IgM anti-oxidized LDL antibodies fell significantly. Spirometry improved significantly. Annual respiratory exacerbations and days of antibiotic treatment fell significantly. The improvement in QoL was not significant. Serum levels of docosahexaenoic, total omega-3 and linoleic acid rose significantly and more favourable profiles were seen in monoenoic acids, arachidonic acid and the arachidonic/docosahexaenoic ratio. The fat-free mass and hand grip dynamometry improved significantly.
ConclusionsLow-dose supplements of n-3 and gammalinolenic fatty acids over a long period (one year) appears to improve pulmonary status (lung function, respiratory exacerbations and antibiotic consumption), inflammatory and anthropometric parameters in adults with CF.
La mayor parte de la morbimortalidad asociada a la fibrosis quística (FQ) está relacionada con la afectación pulmonar, que se caracteriza por infecciones bronquiales de repetición y una respuesta inflamatoria exagerada. La vía aérea de las personas con FQ presenta un importante aumento de la inflamación, con elevación de neutrófilos activados y de citoquinas proinflamatorias y descenso de citoquinas antiinflamatorias. El tratamiento de la obstrucción de la vía aérea y de las infecciones respiratorias, el control de la inflamación y un adecuado soporte nutricional son claves para retrasar el daño pulmonar.
La inflamación crónica desempeña un papel fundamental en el deterioro pulmonar en los pacientes con FQ y, en este sentido, estudios previos han demostrado que estos pacientes presentan con frecuencia niveles anormales de ácidos grasos (AG) esenciales (AGE) en suero, plasma y membranas de células sanguíneas, así como en muestras histológicas, y que la normalización o modificación de este patrón de AG podría reducir la inflamación crónica1–6. Comparado con la población general, la característica más importante de los sujetos con FQ es encontrar niveles descendidos de ácido linoleico (LIN) y de ácido docosahexaenoico (DHA) con un incremento relativo en el porcentaje de AG monoinsaturados y de ácidos eicosatrienoicos2–6. Nuestro grupo ha observado estas mismas alteraciones en suero en un grupo de adultos con FQ respecto a controles de similar edad, sexo y composición corporal, a pesar de tener un buen estado nutricional, ausencia de déficit de vitamina E y una adecuada ingesta3. Estos hallazgos apoyarían la hipótesis de que este perfil anómalo podría ser secundario a la mutación del gen regulador de la conductancia transmembrana de la FQ (RTFQ) y que una dieta de tipo mediterránea, aunque sea un buen punto de partida en estos pacientes, no es capaz de normalizar el perfil de los AG en plasma3.
El descenso observado en la biodisponibilidad de estos AGE podría inducir cambios importantes en la composición de los AG de las membranas celulares con detrimento de su funcionalidad. Estas alteraciones podrían favorecer, en parte, el deterioro de los órganos específicamente afectados en la FQ (como es el caso del pulmón)3,7. Pese a conocer la existencia de estas alteraciones desde hace más de 40 años, el tema cobró de nuevo interés cuando Freedman et al describieron una restitución de la morfología pancreática tras la suplementación con altas dosis de DHA en modelos de ratones con FQ5.
Durante los últimos años se han realizado otros intentos de normalizar o modificar el patrón de AG en pacientes con FQ mediante la suplementación de la dieta con varios AG, con el objetivo de reducir la inflamación crónica. Se han utilizado AG poliinsaturados, de la familia omega-6 (como el ácido gammalinolénico [GLN])8 y otros de la familia omega-3 (n-3) (aceite de pescado, ácido eicosapentaenoico [EPA] y DHA)2,4,9–19. Estos estudios han mostrado que es posible modificar el perfil de AG en plasma y membranas celulares mediante la suplementación oral2,4,8–10,12,16–19. Algunos trabajos han mostrado también mejoría en algunos parámetros nutricionales, clínicos, espirométricos2,8,10,13 e inflamatorios10,13,14,18, al menos a corto y a medio plazo. No obstante, sus efectos a largo plazo sobre la evolución de la enfermedad o sobre la calidad de vida no son conocidos. Además, se desconoce en la actualidad cuál debería ser la composición más adecuada de la suplementación en cuanto al contenido de AG (tipo de estos y dosis óptima), así como la duración apropiada de ésta, y es necesaria mayor investigación al respecto.
Algunos autores han propuesto utilizar, en lugar de un suplemento con altas dosis de un único AG-n-3, combinaciones de n-3 y GLN que podrían actuar sinérgicamente1,20 a diversos niveles de la cascada de producción de los eicosanoides proinflamatorios. Nuestra hipótesis de trabajo es que la ingesta de una combinación de AGE podría modular la inflamación, reducir el número o gravedad de las exacerbaciones y enlentecer el deterioro de la función pulmonar. Por esto, el objetivo de este estudio fue valorar el efecto a largo plazo (un año) de la suplementación oral con una combinación de varios AG en bajas dosis en pacientes adultos con FQ sobre: a) el número y la gravedad de las exacerbaciones infecciosas respiratorias y los parámetros espirométricos; b) la calidad de vida; c) los parámetros nutricionales; d) el perfil de AG de los fosfolípidos del suero, y e) los diversos marcadores de oxidación e inflamación.
Pacientes y métodosPacientesEl estudio incluyó a pacientes que presentaban criterios diagnósticos de FQ y que seguían controles periódicos (cada 2 o 3 meses) en las consultas de la Unidad de adultos de FQ del Complejo Hospitalario Universitario Carlos Haya (Málaga) según las directrices del consenso europeo de FQ21. Se seleccionaron pacientes (de forma secuencial y prospectiva), durante un período de inclusión de 7 meses, que acudían a la consulta de FQ para la valoración anual (respiratoria y nutricional). El Comité de Ética e Investigación Clínica del Hospital Carlos Haya aprobó el estudio y todos los participantes dieron su consentimiento informado por escrito.
Criterios de inclusiónSujetos con FQ con 16 años de edad o más que hubieran completado el desarrollo puberal (Tanner V), con 2 o más años de seguimiento en la unidad y que hubieran acudido a consulta al menos 4 veces durante el año previo al inicio de la suplementación. Los pacientes se excluyeron si habían recibido previamente suplementación oral con AG-n-3, si tenían insuficiencia renal, si estaban tomando anticonceptivos orales, glucocorticoides orales o fármacos antiinflamatorios no esteroideos, si tenían tiempo de protrombina <90%, si el recuento plaquetario era <50.000/mm3, si presentaban fallo hepático grave (por criterio ultrasonográfico: cirrosis/fibrosis grave o hipertensión portal o elevación persistente de los niveles de aminotransferasas en suero) o hubieran tenido un episodio de hemoptisis masiva o amenazante, si tenían un forced expiratory volume in one second (FEV1, ‘volumen espiratorio en el primer segundo’) expresado en porcentaje con respecto a su valor teórico esperado menor del 20%, o si hubieran recibido trasplante de órganos o estuviesen en lista de espera de trasplante (pulmón, hígado, corazón o combinado).
Diseño del estudio: se estableció un período de observación de un año, en el que se recogieron prospectivamente las mismas variables que posteriormente se analizaron durante el año de suplementación. Se realizó un estudio prospectivo de intervención suministrando 6 cápsulas diarias de synerbiol (Nutergia S. A.), 2 con cada comida principal, durante 12 meses. El synerbiol tiene la siguiente composición por perla: EPA (54mg), DHA (36mg), LIN (80mg), GLN (43mg) y vitamina E (10mg). El período de seguimiento fue de 12 meses. El cumplimiento terapéutico y los posibles efectos adversos (diarrea, esteatorrea, dolor abdominal, náuseas, vómitos, reflujo gastroesofágico, sabor a pescado o hemorragia) se evaluaron cada 3 meses con visitas programadas y mensualmente mediante llamadas telefónicas, y se revisaron los envases del producto suministrado y los posibles efectos secundarios. Durante los 12 meses de suplementación dietética ningún paciente inició tratamiento con macrólidos, aunque 6 de ellos recibían tratamiento con azitromicina desde antes de comenzar el período de observación. Para comparar la concentración de AG de los fosfolípidos del suero y los marcadores de inflamación y oxidación (ver más adelante), se seleccionó un grupo control con el mismo número de personas —sanas y de similares características en cuanto a edad, sexo y estado nutricional— procedente del estudio nutricional Pizarra de la provincia de Málaga22.
Variables neumológicasSe realizó una espirometría simple basal a los 6 meses del inicio de la suplementación y tras finalizar el año de suplementación. Los valores espirométricos también se recogieron de las historias clínicas de los seguimientos anuales realizados 12 y 24 meses antes del comienzo de la suplementación (en situación de estabilidad clínica). La forzed vital capacity (FVC, ‘capacidad vital forzada’) y el FEV1 se midieron en ml y como porcentaje del valor teórico esperado para personas del mismo sexo, edad, peso y altura de una población de referencia23. La gravedad de la enfermedad se evaluó basalmente y tras 12 meses de suplementación con el sistema de valoración NIH modificado24 y con el sistema de puntuación Bhalla (basado en la tomografía computarizada de tórax)25.
En cada visita se recogió una muestra de esputo para estudio microbiológico, que incluía siembra en medio general y selectivo para patógenos habituales en FQ, y recuentos bacterianos. Hemos analizado la colonización inicial por microorganismos habituales en la FQ, y se consideró la primera aparición en el esputo (al menos 3 muestras de esputos positivas) independientemente de su persistencia en el momento del estudio. Las exacerbaciones respiratorias se registraron de manera prospectiva, tanto durante el año previo a la suplementación (período de observación) como durante el año de ésta. Las exacerbaciones se consideraron como: a) leve-moderada: aumento del volumen y de la purulencia del esputo o incremento de la disnea no debido a otras causas, acompañado o no de otros síntomas (tos, febrícula, astenia, mal estado general, anorexia con pérdida de peso, dolor torácico pleurítico, cambios en la exploración respiratoria, cambios en la radiografía de tórax indicativos de infección o un aumento en los marcadores de inflamación sistémica —proteína C reactiva (PCR) o VSG— y tratado con antibiótico oral, o presencia de un cultivo positivo a un microorganismo a una dilución ≥10−5 y tratado con antibiótico oral); b) grave: si, además, se asocia a un empeoramiento clínico significativo (fiebre mayor o igual que 38°C, taquipnea, disminución significativa de la saturación de oxígeno o de la función respiratoria, hipercapnia o aparición de complicaciones, como neumonía, insuficiencia respiratoria aguda, hemoptisis, neumotórax, inestabilidad hemodinámica o empeoramiento del estado cognitivo) y está tratado con antibiótico intravenoso26. Se recogió también el número de días con tratamiento antibiótico oral y parenteral en el año previo a la suplementación y durante éste.
Evaluación nutricionalSe midieron al inicio y al final de la suplementación (basales y a los 12 meses) los siguientes parámetros antropométricos: peso y talla (y a partir de éstos se calculó el índice de masa corporal); pliegues cutáneos (tricipital, abdominal, bicipital y subescapular) usando un lipocalibrador de presión constante tipo Holtain; circunferencia braquial, medida con una cinta métrica inextensible y estimación de la circunferencia muscular del brazo. El mismo investigador realizó todas las medidas antropométricas, por triplicado, en la extremidad dominante y consignó la media. Los percentiles se estimaron a partir de los valores de referencia para la población española27. Los porcentajes de masa magra y la masa grasa se estimaron según las fórmulas de Durnin28 y Siri29. La dinamometría de mano se realizó con un dinamómetro de adultos (Medizintechnik AS, Tuttlingen, Alemania), y se obtuvieron 3 medidas con el dinamómetro en la extremidad dominante y se calculó la media. Se realizó un registro dietético prospectivo de 4 días (incluyendo al menos un sábado o un domingo) de acuerdo con un protocolo previamente descrito3,30. Un dietista experimentado dio a los pacientes instrucciones precisas para rellenarlos. El mismo dietista revisó los cuestionarios con los pacientes para resolver posibles dudas o errores u omisiones. La ingesta de los pacientes se comparó con el gasto energético total teórico estimado mediante la fórmula propuesta por la Cystic Fibrosis Foundation31.
Parámetros de laboratorioEn la visita basal y tras finalizar la suplementación se realizaron determinaciones analíticas (que coinciden con el estudio anual de seguimiento de rutina) en las que se incluía un hemograma, parámetros bioquímicos (mediante un autoanalizador), albúmina, vitaminas liposolubles A, D y E (mediante high performance liquid chromatography), y las inmunoglobulinas (Ig) totales (IgA, IgG, IgM e IgE). Se recogió una muestra de heces de 72h para la determinación cuantitativa de grasa y nitrógeno fecales por técnica de espectrofotometría (near infrared reflectance analysis). También se realizó una curva de glucemia (tras sobrecarga oral de 75g de glucosa) siguiendo los criterios de la OMS de 1998 con medición de glucosa, insulina y péptido C en el momento basal y a las 2h. En la extracción de sangre del momento basal, y también a los 3, a los 6 y a los 12 meses del inicio de la suplementación, parte del suero y del plasma de las muestras inmediatamente se separaron y se congelaron a -70°C, hasta que se descongelaron para realizar: a) la determinación de la composición de los AGFS, según metodología descrita previamente3; b) tumor necrosis factor alpha (TNF-α, ‘factor de necrosis tumoral α’) y sus α soluble receptors 60 and 80 (TNF-60 y TNF-80, ‘receptores solubles del factor de necrosis tumoral α 60 y 80’)(BLK Diagnostics International, Barcelona, España), y c) los anticuerpos anti-LDL oxidada con malonil-dialdehido de IgG e IgM (mediante ELISA descrito en trabajos previos)32.
Estudio de calidad de vidaSe evaluó antes de la suplementación y al final de ésta mediante el cuestionario respiratorio de St. George, validado por nuestro grupo en adultos con FQ33.
Estudio estadísticoEl análisis de los datos se realizó con SPPS para Windows, versión 12 (SPSS Inc., Chicago, Illinois). Los resultados se han expresado como valores de media y desviación estándar. La normalidad de la distribución de las variables cuantitativas se examinó mediante la prueba de Shapiro-Wilks. Las comparaciones entre variables pareadas (basales y a los 12 meses) se realizaron mediante el t-test o el test de Wilcoxon, en función de la normalidad y de la prueba de la Ji al cuadrado para variables cualitativas. Para la comparación entre grupos (FQ vs. control) se usó el t-test o la prueba de Mann-Whitney, en función de la normalidad, para las variables cuantitativas y se usó la prueba de la Ji al cuadrado para las variables cualitativas. Para valorar los efectos del tratamiento de la suplementación con una mezcla de AGE sobre los AG de los fosfolípidos del suero, los parámetros espirométricos y los marcadores de inflamación y oxidación se realizaron las comparaciones (teniendo en cuenta el valor basal) mediante el uso de la prueba de ANOVA de medidas repetidas. Sólo se analizaron los datos de los 17 pacientes que completaron el estudio. Se consideró que existían diferencias estadísticamente significativas para una p<0,05 para 2 colas.
ResultadosEn la fase de selección se valoraron 38 pacientes con FQ. De ellos, 19 no cumplían todos los criterios de inclusión o presentaban algún criterio de exclusión. De los 19 pacientes restantes, 2 abandonaron el estudio en la primera semana de tratamiento debido a la aparición de efectos secundarios (eructos, epigastralgias y reflujo gastroesofágico). Las características de los 17 pacientes que completaron el estudio se incluyen en la tabla 1. Al comienzo de la suplementación, todos los pacientes presentaban niveles normales de vitamina A (retinol) y de vitamina E (tocoferol). Sólo un paciente tenía niveles de 25 hidroxivitamina D (25-OH-D) por debajo de 20ng/ml. Doce pacientes tenían alteraciones del metabolismo de los hidratos de carbono: 3 pacientes tenían diabetes relacionada con la FQ, 8 tenían intolerancia a los hidratos de carbono y uno tenía glucemia basal alterada. Los pacientes con FQ tenían las siguientes combinaciones de genotipos: ΔF508/ΔF508 (n=6), G542X/G542X (n=1), ΔF508/Q890X (n=1), ΔF508/R1066C (n=1), R334W/R334W (n=1), G551D/712-IG>T1890 (n=1), ΔF508/G85E (n=1), ΔF508/R709X (n=1), R334W/621+1G->T (n=1), N1303k/V232D (n=1), N1303K/F508del (n=1) y N1303K/N1303k (n=1).
Características clínicas
| n=17 | |||||
| Media | DE | ||||
| Edad (años) | 26,4 | 10,6 | |||
| Edad al diagnóstico | 8,5 | 3,4 | |||
| Hombres, n (%) | 8 (47) | ||||
| Mujeres, n (%) | 9 (53) | ||||
| Genética, % | |||||
| ΔF508/ΔF508 | 35% | ||||
| ΔF508/no ΔF508 | 35% | ||||
| no ΔF508/no ΔF508 | 30% | ||||
| Afectación predominante al diagnóstico: | |||||
| Digestiva, n (%) | 7 (41) | ||||
| Respiratoria, n (%) | 8 (47) | ||||
| Golpe de calor, n (%) | 1 (6) | ||||
| Fallo de medro, n (%) | 1 (6) | ||||
| Insuficiencia pancreática, n (%) | 13 (77) | ||||
| Alteraciones del metabolismo hidrocarbonado, n (%) | 12 (70) | ||||
| Primera colonización por patógenos, n (%) | |||||
| Pseudomonas | 14 (82) | ||||
| Staphylococcus aureus | 10 (59 ) | ||||
| Haemophilus influenzae | 14 (82) | ||||
| Tratamiento con antibióticos en aerosol, n (%) | |||||
| Tobramicina | 10 (59) | ||||
| Colistimetato de sodio | 6 (35) | ||||
| Ninguno | 1 (6) | ||||
DE: desviación estándar.
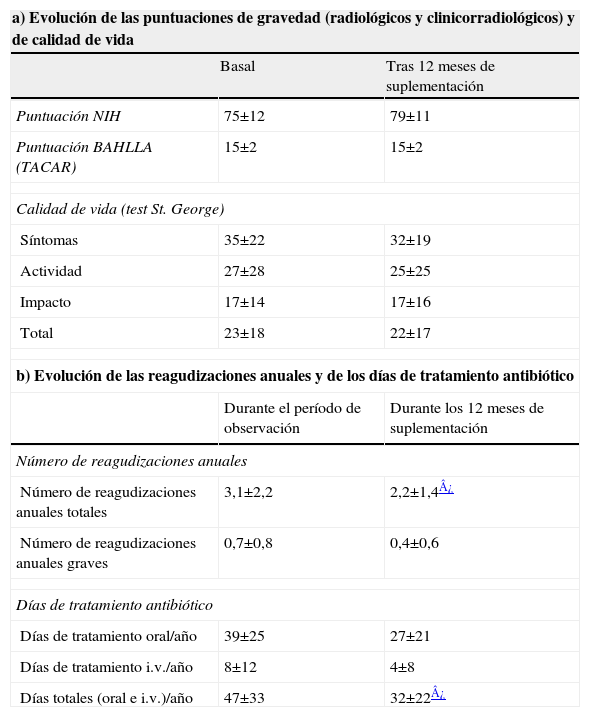
Durante el año de suplementación se redujeron significativamente el número de reagudizaciones totales, así como el número de tandas y días de consumo de antibióticos, en comparación con el año previo. Nueve pacientes tuvieron alguna reagudización grave durante el año de observación (53%) frente a sólo 5 (23%) durante el año de la suplementación (p<0,05; Ji al cuadrado) (tabla 2).
Parámetros neumológicos (clínicos y radiológicos) y de calidad de vida
| a) Evolución de las puntuaciones de gravedad (radiológicos y clinicorradiológicos) y de calidad de vida | ||
| Basal | Tras 12 meses de suplementación | |
| Puntuación NIH | 75±12 | 79±11 |
| Puntuación BAHLLA (TACAR) | 15±2 | 15±2 |
| Calidad de vida (test St. George) | ||
| Síntomas | 35±22 | 32±19 |
| Actividad | 27±28 | 25±25 |
| Impacto | 17±14 | 17±16 |
| Total | 23±18 | 22±17 |
| b) Evolución de las reagudizaciones anuales y de los días de tratamiento antibiótico | ||
| Durante el período de observación | Durante los 12 meses de suplementación | |
| Número de reagudizaciones anuales | ||
| Número de reagudizaciones anuales totales | 3,1±2,2 | 2,2±1,4¿ |
| Número de reagudizaciones anuales graves | 0,7±0,8 | 0,4±0,6 |
| Días de tratamiento antibiótico | ||
| Días de tratamiento oral/año | 39±25 | 27±21 |
| Días de tratamiento i.v./año | 8±12 | 4±8 |
| Días totales (oral e i.v.)/año | 47±33 | 32±22¿ |
BAHLLA (TACAR): sistema de puntuación de Bhalla (basado en la tomografia computarizada del tórax de alta resolución); i.v.: intravenoso; NIH: National Institutes of Health.
Se expresan los valores como media±desviación estándar.
Wilcoxon o test de la t de Student.
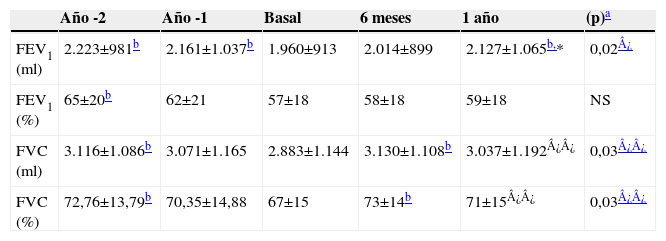
Las puntuaciones de Bahlla y NIH no se modificaron (tabla 2). Respecto al momento basal, se observó un incremento estadísticamente significativo del FEV1 (ml), así como del FVC (ml) y el FVC (%) al final del año de suplementación. El FEV1 (%) también mejoró, aunque sin alcanzar significación estadística. Cuando comparamos con los datos registrados de las espirometrías de años previos, no existieron diferencias significativas del FEV1 (ml y %) y del FVC (ml y %) al final del año de suplementación, con respecto a los valores registrados 24 meses antes del inicio de la suplementación con AGE (año -2). Sin embargo, tanto el FEV1 (ml y %) como el FVC (ml y %) en el momento basal fueron significativamente menores que los valores registrados 24 meses antes (tabla 3).
Evolución de los parámetros espirométricos
| Año -2 | Año -1 | Basal | 6 meses | 1 año | (p)a | |
| FEV1 (ml) | 2.223±981b | 2.161±1.037b | 1.960±913 | 2.014±899 | 2.127±1.065b,* | 0,02¿ |
| FEV1 (%) | 65±20b | 62±21 | 57±18 | 58±18 | 59±18 | NS |
| FVC (ml) | 3.116±1.086b | 3.071±1.165 | 2.883±1.144 | 3.130±1.108b | 3.037±1.192¿¿ | 0,03¿¿ |
| FVC (%) | 72,76±13,79b | 70,35±14,88 | 67±15 | 73±14b | 71±15¿¿ | 0,03¿¿ |
FEV1: forced expiratory volume in one second, ‘volumen espiratorio forzado en el primer segundo’ (expresado en ml y en porcentaje con respecto al predicho [%]); FVC: forced volume capacity, ‘capacidad vital forzada’; NS: no significativo.
Se expresan los valores como media±desviación estándar.
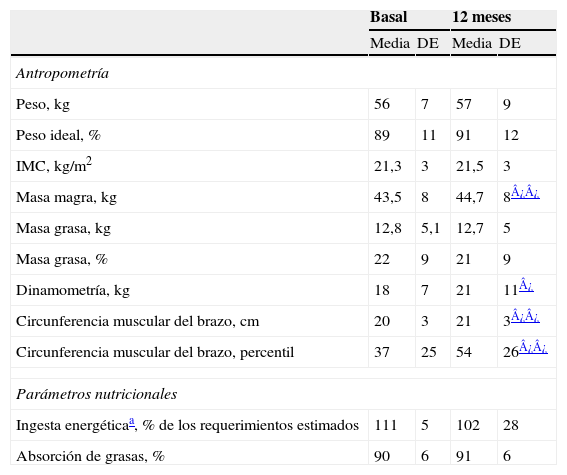
Tras el año de suplementación se encontraron diferencias estadísticamente significativas en la masa magra (kg), la dinamometría y el perímetro muscular del brazo (tabla 4). Aunque descendieron ligeramente las calorías totales de la dieta, no se observaron diferencias significativas en el porcentaje, respecto al contenido calórico total, de hidratos de carbono, lípidos, proteínas o ingesta de AG monoinsaturados, saturados o poliinsaturados (totales, n-3 y n-6) (basal vs. 12 meses).
Parámetros antropométricos y nutricionales
| Basal | 12 meses | |||
| Media | DE | Media | DE | |
| Antropometría | ||||
| Peso, kg | 56 | 7 | 57 | 9 |
| Peso ideal, % | 89 | 11 | 91 | 12 |
| IMC, kg/m2 | 21,3 | 3 | 21,5 | 3 |
| Masa magra, kg | 43,5 | 8 | 44,7 | 8¿¿ |
| Masa grasa, kg | 12,8 | 5,1 | 12,7 | 5 |
| Masa grasa, % | 22 | 9 | 21 | 9 |
| Dinamometría, kg | 18 | 7 | 21 | 11¿ |
| Circunferencia muscular del brazo, cm | 20 | 3 | 21 | 3¿¿ |
| Circunferencia muscular del brazo, percentil | 37 | 25 | 54 | 26¿¿ |
| Parámetros nutricionales | ||||
| Ingesta energéticaa, % de los requerimientos estimados | 111 | 5 | 102 | 28 |
| Absorción de grasas, % | 90 | 6 | 91 | 6 |
DE: desviación estándar; IMC: índice de masa corporal.
Prueba de Wilcoxon para datos pareados o test de la t de Student.
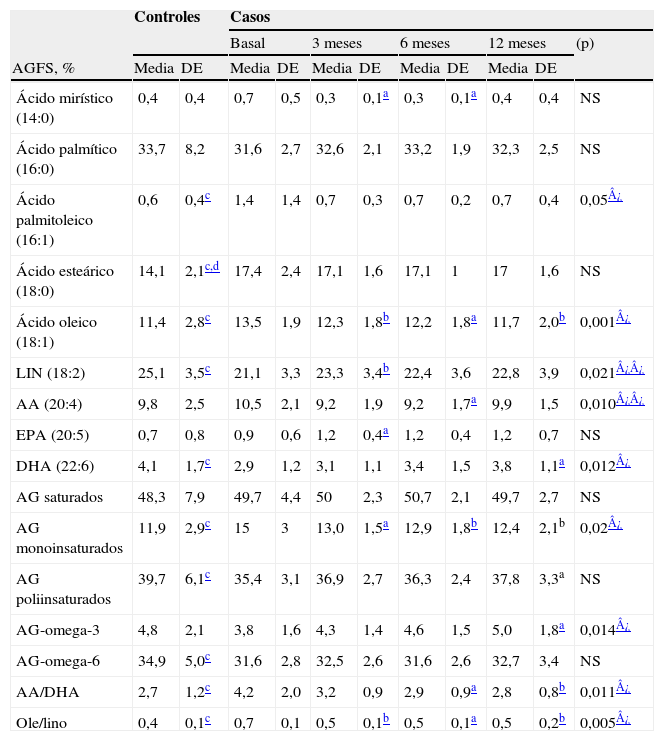
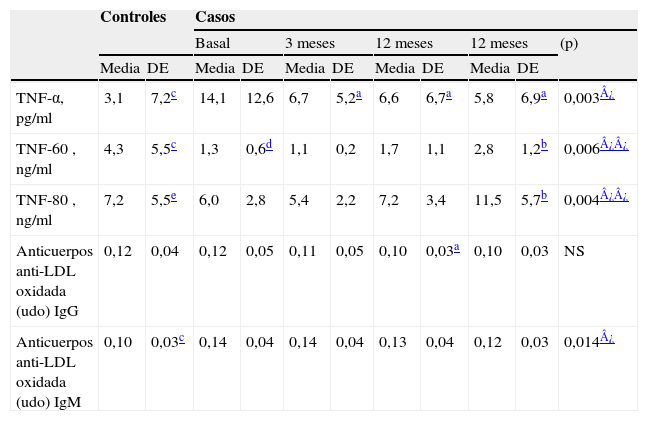
En los pacientes no se encontraron diferencias significativas entre el momento basal y al año de tratamiento en los niveles de lípidos, glucosa, insulinemia y péptido C basal y tras sobrecarga de glucosa, Hb glucosilada, somatomedina C, albúmina, grasa y nitrógeno en heces, porcentaje de absorción de grasas, vitaminas liposolubles (A, D y E) o Ig totales (IgA, IgG, IgM y IgE). Basalmente, los porcentajes de AG palmitoleico, esteárico, oleico y monoinsaturados totales estaban significativamente descendidos en los sujetos con FQ, comparados con los controles sanos. Estas diferencias desaparecieron tras el año con suplementación dietética, con la excepción del ácido esteárico. En los pacientes, respecto al momento basal y de forma significativa, hubo cambios en el perfil de AGFS, con incremento lineal en los niveles de DHA, de AG-n-3 y de LIN (modelo cuadrático), y con descenso lineal en los niveles de ácido oleico, AG monoinsaturados y en el cociente araquidónico/DHA y, al seguir un modelo cuadrático, de palmitoleico y ácido araquidónico (AA) (tabla 5). En el momento basal se encontraron diferencias estadísticamente significativas para el TNF-α y para los anticuerpos anti-LDL tipo IgM (más altas) y el receptor soluble 60 (más bajas) con respecto al grupo control, que desaparecieron tras el año de suplementación. En el grupo de FQ (basal vs. 12 meses) se observó una disminución lineal y significativa de los niveles del TNF-α y un aumento (al seguir un modelo cuadrático) de los receptores solubles del TNF-α 60 y 80. Los anticuerpos anti-LDL oxidada tipo IgM descendieron de forma lineal y estadísticamente significativa, mientras que los de tipo IgG descendieron, pero sin alcanzar significación estadística (salvo a los 6 meses, donde sí se alcanzó significación con respecto al momento basal) (tabla 6).
Evolución del perfil de ácidos grasos de los fosfolípidos séricos
| Controles | Casos | ||||||||||
| Basal | 3meses | 6meses | 12meses | (p) | |||||||
| AGFS, % | Media | DE | Media | DE | Media | DE | Media | DE | Media | DE | |
| Ácido mirístico (14:0) | 0,4 | 0,4 | 0,7 | 0,5 | 0,3 | 0,1a | 0,3 | 0,1a | 0,4 | 0,4 | NS |
| Ácido palmítico (16:0) | 33,7 | 8,2 | 31,6 | 2,7 | 32,6 | 2,1 | 33,2 | 1,9 | 32,3 | 2,5 | NS |
| Ácido palmitoleico (16:1) | 0,6 | 0,4c | 1,4 | 1,4 | 0,7 | 0,3 | 0,7 | 0,2 | 0,7 | 0,4 | 0,05¿ |
| Ácido esteárico (18:0) | 14,1 | 2,1c,d | 17,4 | 2,4 | 17,1 | 1,6 | 17,1 | 1 | 17 | 1,6 | NS |
| Ácido oleico (18:1) | 11,4 | 2,8c | 13,5 | 1,9 | 12,3 | 1,8b | 12,2 | 1,8a | 11,7 | 2,0b | 0,001¿ |
| LIN (18:2) | 25,1 | 3,5c | 21,1 | 3,3 | 23,3 | 3,4b | 22,4 | 3,6 | 22,8 | 3,9 | 0,021¿¿ |
| AA (20:4) | 9,8 | 2,5 | 10,5 | 2,1 | 9,2 | 1,9 | 9,2 | 1,7a | 9,9 | 1,5 | 0,010¿¿ |
| EPA (20:5) | 0,7 | 0,8 | 0,9 | 0,6 | 1,2 | 0,4a | 1,2 | 0,4 | 1,2 | 0,7 | NS |
| DHA (22:6) | 4,1 | 1,7c | 2,9 | 1,2 | 3,1 | 1,1 | 3,4 | 1,5 | 3,8 | 1,1a | 0,012¿ |
| AG saturados | 48,3 | 7,9 | 49,7 | 4,4 | 50 | 2,3 | 50,7 | 2,1 | 49,7 | 2,7 | NS |
| AG monoinsaturados | 11,9 | 2,9c | 15 | 3 | 13,0 | 1,5a | 12,9 | 1,8b | 12,4 | 2,1b | 0,02¿ |
| AG poliinsaturados | 39,7 | 6,1c | 35,4 | 3,1 | 36,9 | 2,7 | 36,3 | 2,4 | 37,8 | 3,3a | NS |
| AG-omega-3 | 4,8 | 2,1 | 3,8 | 1,6 | 4,3 | 1,4 | 4,6 | 1,5 | 5,0 | 1,8a | 0,014¿ |
| AG-omega-6 | 34,9 | 5,0c | 31,6 | 2,8 | 32,5 | 2,6 | 31,6 | 2,6 | 32,7 | 3,4 | NS |
| AA/DHA | 2,7 | 1,2c | 4,2 | 2,0 | 3,2 | 0,9 | 2,9 | 0,9a | 2,8 | 0,8b | 0,011¿ |
| Ole/lino | 0,4 | 0,1c | 0,7 | 0,1 | 0,5 | 0,1b | 0,5 | 0,1a | 0,5 | 0,2b | 0,005¿ |
AA: ácido araquidónico; AG: ácidos grasos; AGFS: ácidos grasos de los fosfolípidos séricos; DE: desviación estándar; DHA: ácido docosahexaenoico; EPA: ácido eicosapentaenoico; LIN: ácido linoleico; NS: no significativo; Ole/lino: relación ácido oleico/ácido linoleico; (p): ANOVA para medidas repetidas.
Evolución de los marcadores de inflamación y oxidación
| Controles | Casos | ||||||||||
| Basal | 3meses | 12meses | 12meses | (p) | |||||||
| Media | DE | Media | DE | Media | DE | Media | DE | Media | DE | ||
| TNF-α, pg/ml | 3,1 | 7,2c | 14,1 | 12,6 | 6,7 | 5,2a | 6,6 | 6,7a | 5,8 | 6,9a | 0,003¿ |
| TNF-60, ng/ml | 4,3 | 5,5c | 1,3 | 0,6d | 1,1 | 0,2 | 1,7 | 1,1 | 2,8 | 1,2b | 0,006¿¿ |
| TNF-80, ng/ml | 7,2 | 5,5e | 6,0 | 2,8 | 5,4 | 2,2 | 7,2 | 3,4 | 11,5 | 5,7b | 0,004¿¿ |
| Anticuerpos anti-LDL oxidada (udo) IgG | 0,12 | 0,04 | 0,12 | 0,05 | 0,11 | 0,05 | 0,10 | 0,03a | 0,10 | 0,03 | NS |
| Anticuerpos anti-LDL oxidada (udo) IgM | 0,10 | 0,03c | 0,14 | 0,04 | 0,14 | 0,04 | 0,13 | 0,04 | 0,12 | 0,03 | 0,014¿ |
DE: desviación estándar; Ig: inmunoglobulina; LDL: lipoproteina de baja densidad; NS: no significativo; (p): ANOVA para medidas repetidas; TNF-α: tumor necrosis factor α, ‘factor de necrosis tumoral-alfa’; TNF-60 y TNF-80: TNF-α soluble receptors, ‘receptores solubles del TNF-α’.
Se encontró una tendencia al descenso en las puntuaciones del cuestionario de St. George (mejora de la calidad de vida) tras la suplementación, pero sin alcanzar significación estadística (tabla 2).
DiscusiónEn este trabajo hemos observado mejoría de los parámetros respiratorios (espirométricos, reducción de las exacerbaciones y de las tandas de antibióticos), de los parámetros nutricionales (aumento de la masa magra corporal y dinamometría) y de los marcadores de inflamación y oxidación, mediante la suplementación con una combinación en bajas dosis de AG-n-3 y AG-n-6 durante 12 meses. Estos cambios ocurrieron al mismo tiempo que se normalizaba el patrón de los fosfolípidos del suero de nuestros pacientes adultos con FQ; es más, los cambios en los fosfolípidos fueron apreciables a los pocos meses de iniciar la suplementación. Estos datos son concordantes con los de otros trabajos realizados en personas sanas o con FQ, en los que se observó una incorporación, a corto plazo (incluso desde el primer mes), tanto a las membranas celulares como a los fosfolípidos del plasma, tras la suplementación con dosis bajas o medias de AG-n-34,9,18,34 y con otros trabajos en pacientes con FQ, que emplearon dosis mayores10–12,16,17,19.
El aumento del LIN y del DHA y la reducción de los niveles del AA en suero (con una disminución asociada del cociente AA/DHA), todos éstos propuestos como marcadores de gravedad de la enfermedad en la FQ3,7, podrían explicar la mejoría en los parámetros inflamatorios, clínicos y espirométricos observada en nuestro estudio. El descenso de las citoquinas proinflamatorias podría reducir la cantidad de moco, la quimiotaxis y activación de los neutrófilos y la respuesta inflamatoria, vaso y broncoconstrictora35. Los AG-n-3, al competir por las mismas elongasas y desaturasas que los de la serie n-6, favorecerían la liberación de eicosanoides menos proinflamatorios1. También la inhibición de la liberación del AA por la fosfolipasa A2 (que parece estar incrementada en los pacientes con FQ) podría reducir la respuesta inflamatoria y el recambio acelerado de los AG de la serie n-6 que se observa en estos pacientes35. Asimismo, el descenso en los niveles del AA en suero y, posiblemente, en la vía respiratoria podría incrementar el óxido nítrico de la vía aérea, que está descendido o normal en la FQ y tiene propiedades antimicrobianas36. Por último, podría incrementarse la liberación de las resolvinas, docosatrienos y neuroprotectinas que participan en la fase de resolución de la inflamación, aumentada en los pacientes con FQ.
La administración concomitante de ácido gammalinolénico (GLN) en nuestro estudio podría haber actuado sinérgicamente (junto con los n-3) al elevar el ácido dihomo-gammalinolénico que competiría también con el AA y favorecería la liberación de eicosanoides menos proinflamatorios1. Nuestros resultados en relación con la mejora pulmonar (FEV1 en ml y de FVC en ml y %, con menores reagudizaciones y descenso de las tandas de antibióticos) son concordantes con los publicados por De Vizia et al10, que emplearon dosis mayores de EPA y de DHA durante 8 meses. También Lawerence13, suplementado con EPA a corto plazo, encontró un descenso del volumen del esputo y mejoría del FEV1 y del Shwachman score. Estos resultados afianzarían nuestras observaciones y las de otros grupos3,7 que relacionan los niveles del LIN con el FEV1.
Por el contrario, otros trabajos no encontraron efecto sobre la función pulmonar, quizás por la menor duración de éstos (de 4 a 24 semanas)11,17–19 o por el pequeño número de pacientes evaluados4,15. Junto con la mejoría de los parámetros pulmonares, observamos un discreto aumento de peso, pero a expensas de la masa magra, con un incremento de la circunferencia braquial, del perímetro muscular del brazo y de los valores de la dinamometría de la mano. En concordancia con otros estudios publicados37,38, también hemos observado que los niveles del TNF-α estaban aumentados basalmente y en pacientes estables frente al grupo control. Estas diferencias desaparecieron tras el año de suplementación. Tanto en pacientes con FQ como con EPOC y bronquiectasias sin FQ se han encontrado niveles plasmáticos elevados del TNF-α (incluso en pacientes clínicamente estables) que se asocian a una reducción de la masa magra, a incremento de la proteolísis muscular, a incremento de las exacerbaciones respiratorias y a fenotipos más graves, con peor función pulmonar37–39. La reducción de los marcadores inflamatorios (TNF-α) y el aumento de sus receptores solubles (que actúan como factores contrarreguladores) observados en nuestro estudio tras la suplementación pueden haber facilitado la mejoría de los parámetros clínicos (menor número y gravedad de las exacerbaciones y aumento en la masa magra) y espirométricos. Por otro lado, los niveles elevados del TNF-α no parecen promover anorexia35, como lo corrobora el hecho de que los pacientes alcanzaron los requerimientos calóricos teóricos (según la fórmula de la Cystic Fibrosis Foundation) y que la ingesta dietética no se modificó, e incluso descendió ligeramente tras el año de la suplementación a pesar de observar un descenso continuo y significativo de los niveles del TNF-α desde los 3 meses hasta el fin de la suplementación. En la mayoría de los trabajos de suplementación con AG-n-3 en FQ no se han encontrado modificaciones significativas en el peso o en la velocidad de crecimiento en los niños11,16,18, posiblemente por la corta duración de éstos.
De Vizia observó una mejoría significativa del peso a los 4 primeros meses, que no se mantuvo al final del estudio10. Lepage et al sí observaron un incremento ponderal significativo en el grupo suplementado con galletas enriquecidas en n-32. Por el contrario, Durieu et al, en un trabajo en el que se administraban los n-3 por vía intravenosa durante 3 meses, observaron un descenso ponderal significativo en los 7 adultos estudiados, no así en los 6 niños evaluados19.
El estrés oxidativo está aumentado en los pacientes con FQ, a pesar de tener una ingesta normal de antioxidantes en la dieta; posiblemente la respuesta inmunitaria podría desempeñar un papel muy importante en su desarrollo40. Este estado podría favorecer un incremento en la producción de anticuerpos anti-LDL oxidada y podría estar implicado en el desequilibrio de los AG. En nuestro estudio hemos observado un aumento de los anticuerpos anti-LDL oxidada en pacientes respecto a controles (IgM) que, tras la suplementación, han descendido (tanto tipo IgG como IgM). En el contexto del descenso de otros parámetros inflamatorios y la mejoría clínica, la medida de estos anticuerpos podría ser útil como marcador de oxidación-inflamación en estos pacientes. Hemos encontrado una tendencia al descenso en las puntuaciones del cuestionario de St. George (mejora de la calidad de vida) en nuestra población tras la suplementación, pero sin alcanzar significación estadística, en los ítems: “síntomas” (que incluye aspectos como la presencia de disnea, tos y expectoración y la frecuencia con la que se presentan), “actividad” (donde se valora la limitación de la actividad debida a la disnea) y en la puntuación total. Quizás si la muestra fuera mayor, podríamos haber observado cambios más evidentes. Aunque no se hicieron cambios en las estrategias de tratamiento durante el estudio, al ser un estudio no controlado es imposible descartar la posibilidad de que la leve mejoría observada en la calidad de vida se deba a otras intervenciones en el tratamiento de los pacientes.
A diferencia de otros estudios realizados con suplementación en dosis más altas12,13, no observamos efectos secundarios importantes (diarrea, esteatorrea o necesidad de incrementar las dosis de enzimas pancreáticas). No obstante, 2 pacientes seleccionados para el estudio abandonaron el tratamiento en la primera semana por intolerancia digestiva (tipo eructos y regurgitación con sabor a pescado). Quizás con la administración de otras formas farmacéuticas podrían minimizarse estos efectos.
El trabajo no está exento de limitaciones: en primer lugar, al no ser aleatorizado ni controlado con placebo no pueden descartarse sesgos a favor del tratamiento. No obstante, la mejora global de la mayoría de las variables evaluadas (clínicas, espirométricas y analíticas) que habrían previsiblemente empeorado (al seguir el curso normal de la enfermedad), da consistencia a los resultados y hacen poco probable este efecto. En segundo lugar, al realizarse en un único centro y al emplear criterios de inclusión estrictos, se ha seleccionado a una muestra relativamente pequeña de pacientes que, posiblemente, se adhieran mejor al tratamiento que la media. Además, aunque la precisión de la muestra fue suficiente para la mayoría de las variables relevantes estudiadas, la posibilidad de un error tipo 1 no puede descartarse para algunas de las conclusiones. En tercer lugar, no hemos medido la composición de los AG en las membranas celulares de tejidos; no obstante, la medición de los AG en los fosfolípidos del suero parece reflejar adecuadamente la de los tejidos y, además, sirve como marcador de la ingesta y del cumplimiento del tratamiento3,34. En cuarto lugar, con el diseño del estudio no es posible conocer qué componentes de la mezcla de los AG son los causantes de los efectos observados ni cuáles son las dosis más apropiadas. Sin embargo, también tiene otras fortalezas, como la utilización de un grupo control de similares características para la comparación de los AGFS y marcadores de oxidación e inflamación, el amplio tiempo de seguimiento y el estudio simultáneo de múltiples efectos (pruebas de función pulmonar, puntuaciones clínicas, radiológicas, bioquímicas y nutricionales, número de reagudizaciones, duración de los tratamientos antibióticos, calidad de vida y niveles de mediadores inflamatorios y de oxidación).
En resumen, la suplementación con una combinación en dosis bajas de AG-n-3 y AG-n-6 mantenida durante 12 meses permite normalizar el patrón de AGFS y mejorar parámetros clínicos (reducción de reagudizaciones y tandas de antibióticos), espirométricos, nutricionales (masa magra y dinamometría) y marcadores de inflamación y oxidación. Estos resultados abren la puerta a la realización de estudios multicéntricos, controlados y aleatorizados con un número suficiente de pacientes que permitan establecer conclusiones basadas en la evidencia41.
FinanciaciónLa Consejería de Salud de la Junta de Andalucía (05/0342), el CIBERDEM (CIBER de Diabetes y Enfermedades Metabólicas Asociadas) y el CIBER de Fisiopatología de la Obesidad y Nutrición del Instituto de Salud Carlos III (España) han financiado parcialmente este estudio.
Queremos agradecer al laboratorio Nutergia S. A. el suministro gratuito de las cápsulas suplementadas en este trabajo.