El diafragma es el principal músculo respiratorio. Sus especiales características han dificultado el diseño de instrumentos capaces de evaluar su estructura y función de forma no invasiva en humanos. El presente estudio fue diseñado para evaluar la potencial utilidad de la ecografía como un método no invasivo para cumplir dichos objetivos.
MétodosEl estudio incluyó tres fases: 1) estudio ecográfico en muestras necrópsicas (n=10) de un segmento de pared toraco-abdominal, incluyendo desde piel hasta peritoneo parietal (e.d., estructuras de pared torácica, diafragma, pleura y peritoneo); 2) estudio ecográfico estático de las estructuras anteriores y el diafragma en individuos sanos (n=10) a volúmenes pulmonares normalizados, y 3) estudio ecográfico dinámico de la contracción-relajación del diafragma en los mismos individuos, con cálculo de la velocidad máxima de relajación (VMARdi, mm/seg) en el curso de una prueba específica de resistencia inspiratoria.
ResultadosLa ecografía permitió identificar con claridad los límites pleural y peritoneal del diafragma, y cuantificar su grosor (Gdi), en todos los casos, tanto ex-vivo como in-vivo. El estudio dinámico del Gdi mostró un incremento lineal en relación directa con el volumen pulmonar de medición, además de un incremento cíclico durante los movimientos inspiratorios en reposo. En la prueba de resistencia, la VMARdi fue máxima ante cargas bajas y disminuyó progresivamente hasta alcanzar un nadir mínimo (Δ≈−70% del valor inicial) en la claudicación (fatiga). La medición de VMARdi tiene una alta precisión diagnóstica de claudicación.
ConclusionesLa ecografía transtorácica del diafragma es un método no invasivo que ofrece resultados prometedores en la evaluación estructural y funcional (e.d., riesgo de fatiga) de dicho músculo. Estos hallazgos son de interés fisiopatológico y podrían ser de utilidad en el contexto asistencial clínico.
The diaphragm is the principal respiratory muscle. Its special characteristics have made it difficult to design instruments capable of performing a non-invasive evaluation of its structure and function in humans. The present study was designed to evaluate the potential use of echography as a non-invasive method to fulfil these objectives.
MethodsThe study consisted of three phases: (1) echographic study in autopsy samples (n=10) of a segment of the thoracic-abdominal wall, from the bottom to the parietal peritoneum (i.e., thoracic wall, diaphragm, pleura and peritoneum structures), (2) static echographic study of the previous structures and the diaphragm in healthy subjects (n=10) to standardised lung volumes; and (3) dynamic echographic study of the contraction-relaxation of the diaphragm in the same subjects, calculating its maximum velocity of relaxation (MVrdi, mm/sec) during a specific inspiratory resistance test.
ResultsThe echography enabled the pleural and peritoneal limits of the diaphragm to be identified, and quantitate its thickness (Tdi), both ex-vivo and in-vivo, in all cases. The dynamic study of the Tdi showed a linear increase directly associated with the lung volume measurement, as well as a cyclical increase during inspiratory movements at rest. In the resistance test, the MVrdi was maximal with low loads and gradually decrease until reaching a minimum nadir (Δ≈−70% of the initial value) in claudication (fatigue). The MVrdi has a high precision in diagnosing claudication.
ConclusionsTransthoracic echography of the diaphragm is a non-invasive method that gives promising results in the structural and functional evaluation (i.e. fatigue risk) of that muscle. These findings are of pathophysiological interest and could be of use in the clinical care context.
Los músculos respiratorios son elementos contráctiles que permiten generar el flujo de aire necesario para el intercambio pulmonar de gases. Desde el punto de vista embriológico y funcional, los músculos respiratorios son músculos esqueléticos y por tanto, poseen dos características funcionales fundamentales: fuerza y resistencia. El diafragma es el principal músculo respiratorio. Su contracción hace ascender las costillas inferiores y desplaza con sentido caudal el contenido abdominal. En consecuencia, disminuye la presión intratorácica y favorece que se establezca un flujo aéreo inspiratorio. Anatómicamente se divide en dos porciones, una costal y otra crural, embriológica y funcionalmente relacionadas1,2.
Para la evaluación global de la fuerza de los músculos inspiratorios se suele utilizar la determinación de la presión inspiratoria máxima medida en la boca3 (PI,mmax) o el esófago (PI,esmax)4; sin embargo, la evaluación específica de la fuerza del diafragma es más difícil de realizar por cuanto exige una técnica algo más invasiva. Esta consiste en la determinación de la presión transdiafragmática máxima (Pdimax), mediante la colocación de sendas sondas en esófago y estómago, generalmente por vía nasal5. A su vez, la determinación de la resistencia de los músculos respiratorios implica el uso de pruebas de respiración ante cargas inspiratorias6 y/o espiratorias7, tanto de carácter incremental (máximas) como constante (submáximas), hasta la claudicación o fatiga muscular.
Se conoce como fatiga muscular la incapacidad temporal de un músculo de llevar a cabo el esfuerzo contráctil. La fatiga es reversible con el reposo8, lo que la diferencia de la debilidad muscular. Para la detección de fatiga se han propuesto varias técnicas, pero todas ellas implican un cierto grado de invasividad, lo que ha dificultado su aplicación en la clínica9,10. Entre ellas, y utilizando una sonda esofágica, Moxham et al11 lograron demostrar que la velocidad de relajación de los músculos inspiratorios (tasa máxima de relajación o MRR) puede representar un indicador precoz de su fatiga.
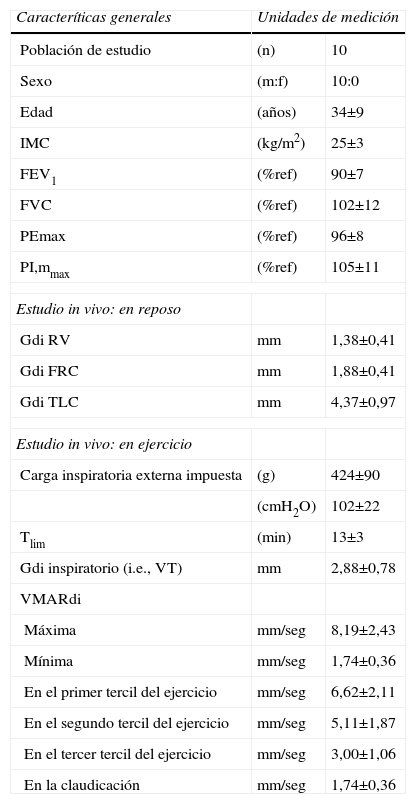
La ecografía (e.d., ultrasonografía) es una técnica de imagen que se ha demostrado útil en muchas especialidades médicas para evaluar la estructura y función muscular12. Como ventajas tiene su bajo costo, reproducibilidad, inocuidad y carácter no invasivo. La introducción del modo M permite analizar la dinámica de contracción y relajación de músculos como el miocardio13. Del mismo modo, la ecografía transtorácica ha sido ocasionalmente utilizada para evaluar el desplazamiento del diafragma con los movimientos respiratorios14. A partir de estos conceptos existen, por una parte la plausibilidad biológica, y por otra los fundamentos técnicos, para postular que la ecografía transparietal torácica pueda identificar el diafragma humano a nivel de su zona de aposición torácica, cuantificar su grosor como un índice del estado trófico del diafragma y cuantificar la velocidad de contracción y relajación del músculo15. En consecuencia, el objetivo general del presente estudio fue estimar la capacidad de la ecografía transtorácica en modos bidimensional y M para la evaluación específica de la estructura y estado funcional del diafragma en humanos a partir de la medición de su grosor y la velocidad máxima de relajación, tanto en situación de reposo como durante un protocolo de inducción experimental de fatiga muscular inspiratoria en individuos sanos (tablas 1 y 2).
Características demográficas, función pulmonar, función muscular respiratoria y características ecográficas del diafragma in vivo
| Caracteríticas generales | Unidades de medición | |
| Población de estudio | (n) | 10 |
| Sexo | (m:f) | 10:0 |
| Edad | (años) | 34±9 |
| IMC | (kg/m2) | 25±3 |
| FEV1 | (%ref) | 90±7 |
| FVC | (%ref) | 102±12 |
| PEmax | (%ref) | 96±8 |
| PI,mmax | (%ref) | 105±11 |
| Estudio in vivo: en reposo | ||
| Gdi RV | mm | 1,38±0,41 |
| Gdi FRC | mm | 1,88±0,41 |
| Gdi TLC | mm | 4,37±0,97 |
| Estudio in vivo: en ejercicio | ||
| Carga inspiratoria externa impuesta | (g) | 424±90 |
| (cmH2O) | 102±22 | |
| Tlim | (min) | 13±3 |
| Gdi inspiratorio (i.e., VT) | mm | 2,88±0,78 |
| VMARdi | ||
| Máxima | mm/seg | 8,19±2,43 |
| Mínima | mm/seg | 1,74±0,36 |
| En el primer tercil del ejercicio | mm/seg | 6,62±2,11 |
| En el segundo tercil del ejercicio | mm/seg | 5,11±1,87 |
| En el tercer tercil del ejercicio | mm/seg | 3,00±1,06 |
| En la claudicación | mm/seg | 1,74±0,36 |
BMI: índice de masa corporal; FEV1: volumen espiratorio orzado en el 1.er seg.; FRC: capacidad residual funcional; FVC: capcidad vital forzada; Gdi: grosor del diafragma; PEmax: presión espiratoria máxima, medida en boca; PI,mmax, presión inspiratoria máxima medida en boca (maniobra de valsalva y Müller), respectivamente; RV: volumen residual; TLC: capacidad pulmonar total; Tlim: tiempo de resistencia inspiatoria; VMARdi: velocidad máxima de relajación del diafragma; VT: volumen corriente.
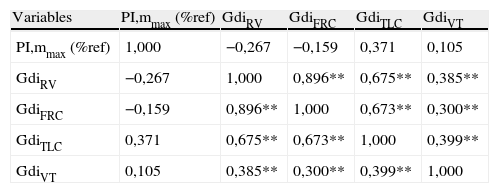
Matriz de correlaciones entre la fuerza muscular inspiratoria (PI,mmax) y las variables ecográficas del diafragma
| Variables | PI,mmax (%ref) | GdiRV | GdiFRC | GdiTLC | GdiVT |
| PI,mmax (%ref) | 1,000 | −0,267 | −0,159 | 0,371 | 0,105 |
| GdiRV | −0,267 | 1,000 | 0,896** | 0,675** | 0,385** |
| GdiFRC | −0,159 | 0,896** | 1,000 | 0,673** | 0,300** |
| GdiTLC | 0,371 | 0,675** | 0,673** | 1,000 | 0,399** |
| GdiVT | 0,105 | 0,385** | 0,300** | 0,399** | 1,000 |
FRC: capacidad residual funcional; Gdi: grosor del dafragma; PI,mmax: presión inspiratoria máxima medida en boca (maniobra de Müller); RV: volumen residual; TLC: capacidad pulmonar total; VT: volumen corriente.
**p<0,001.
Ámbito de estudio. El presente estudio se llevó a cabo en un hospital de tercer nivel (Hospital del Mar, IMAS, Barcelona), con la participación de los servicios de neumología, cardiología, radiología y anatomía patológica, y un instituto de investigación asociado (IMIM, Barcelona).
Aspectos éticos y diseño del estudio. El estudio, transversal y analítico, fue diseñado de acuerdo con la legislación y normativa para la investigación en humanos (Declaración de Helsinki)16, y aprobado por el Comité de Ética e Investigación Clínica del centro. Todos los sujetos aceptaron participar en el estudio y firmaron la hoja de consentimiento informado. Para el modelo ex vivo se obtuvo el consentimiento del familiar responsable. El estudio constó de tres fases definidas según las características técnicas y los objetivos específicos. Fase I, modelo ex vivo. Se realizó sobre diez piezas anatómicas humanas, procedentes de necropsias de cadáveres de sexo masculino. Para minimizar los efectos del rigor mortis, el estudio se desarrolló dentro de las primeras cuatro horas tras haberse confirmado la defunción. En todos los casos el procedimiento se realizó en la sala de necropsias de nuestra institución y por parte de un patólogo especialista. Los fragmentos incluían pared torácica y abdominal (aproximadamente 20×20cm), desde piel y tejido celular subcutáneo, incluyendo costillas, músculos, y pleura parietal, hasta peritoneo parietal. Los límites en el plano axial para el corte de los fragmentos los delimitaron las líneas axilar anterior y posterior. El límite superior lo delimitaba una línea horizontal a nivel del 8.o espacio intercostal y el inferior, la cresta ilíaca ipsilateral. Los fragmentos fueron sumergidos en una cubeta con suero fisiológico a temperatura ambiente, y estudiados a continuación mediante la técnica ecográfica de inmersión que se describe más adelante. Los diferentes componentes de los fragmentos (piel, tejido celular subcutáneo, costillas, músculos, pleura parietal, peritoneo parietal) fueron disecados secuencialmente para verificar su apariencia ecográfica y precisar específicamente la identificación. Fase II, modelo in vivo estático. En diez voluntarios sanos se determinó la imagen ecográfica correspondiente a las distintas estructuras identificadas en la fase anterior, así como sus eventuales cambios en relación a cinco volúmenes pulmonares normalizados desde volumen residual (RV) hasta capacidad pulmonar total (TLC), a intervalos equivalentes al 20% de la capacidad vital forzada (FVC). Todos los voluntarios eran varones sanos, sin entrenamiento específico en la realización de pruebas de fuerza y resistencia musculares. Fase III, modelo in vivo dinámico. En los mismos voluntarios de la fase anterior, se evaluó ecográficamente la dinámica de relajación del diafragma durante una prueba de resistencia muscular inspiratoria (desde el inicio hasta la claudicación). La prueba se realizó mediante una válvula de tipo umbral, respirando contra una carga submáxima constante equivalente al 60% de la PI,mmax17, tal y como se especifica abajo. En esta fase se utilizó la ecografía en modo M para cuantificar la velocidad de relajación diafragmática, con una metodología paralela a la descrita previamente para los registros de presión intratorácica.
Intervenciones y técnicas. A todos los voluntarios sanos se les realizó un estudio antropométrico, espirometría forzada, evaluación de la fuerza y resistencia muscular inspiratorias.
- 1.
Antropometría. Se incluyeron las variables convencionales: peso, talla, índice de masa corporal (BMI), índice de masa muscular magra (FFMI), así como del perímetro torácico a nivel del tercio inferior de dicho compartimento [normalización en apnea y a capacidad residual funcional (FRC)].
- 2.
Espirometría forzada. Mediante un espirómetro Datospir 92 (SIBEL, Barcelona), y de acuerdo a las normativas de la SEPAR18. Los valores obtenidos se expresaron como porcentajes relativos a los valores de referencia19.
- 3.
Fuerza muscular inspiratoria global (medición de la PI,mmax). Los sujetos realizaron un esfuerzo inspiratorio máximo desde RV y contra la vía aérea ocluida (Biopac Systems, Inc. Santa Barbara, CA.). El valor máximo de cinco maniobras válidas se expresó como porcentaje del valor de referencia20.
- 4.
Prueba específica de resistencia inspiratoria. Los voluntarios respiraron contra cargas inspiratorias submáximas equivalentes al 60% de su PI,mmax21. Brevemente, durante la prueba respiraron a través de una válvula de dos vías, a cuyo circuito inspiratorio se conectó una segunda válvula con apertura de tipo umbral, similar a la descrita por Nickerson et al22. El patrón respiratorio fue dejado a libre elección del sujeto. Durante la realización de la prueba se registró de manera continua la presión en boca mediante manómetro (Biopac Systems® Inc. Santa Barbara, CA, EE.UU.) conectado a la parte común del circuito. El final de la prueba estuvo determinado por la claudicación, definida como la incapacidad para establecer flujo en al menos tres esfuerzos inspiratorios máximos21. Se realizaron mediciones de PI,mmax a los 1, 5 y 10min posteriores a la claudicación con tal de identificar la recuperación de la fuerza inspiratoria tras la prueba de resistencia inspiratoria.
- 5.
Ecografía transtorácica del diafragma. En las tres fases del estudio se utilizó un transductor de señal ecográfica de fase curvilínea, con frecuencia de 7,5MHz (Toshiba®, SSH140A; Japan). El transductor se colocó perpendicular al plano de la piel (tanto en el estudio ex vivo como in vivo), a nivel de la zona de aposición del diafragma. Esta última se definió por la porción muscular caudal al «punto de pulmón» (e.d., ángulo costofrénico, aproximadamente a nivel del 10o espacio intercostal del lado no dominante) y la línea axilar media del lado dominante. El estudio fue realizado bajo inmersión en el caso del modelo ex vivo, mientras que en el estudio in vivo se utilizó una interfase de gel transductor aplicado sobre la piel. Las variables evaluadas utilizando el modo bidimensional fueron: primero, el grosor del músculo diafragma (Gdi), tanto en el modelo ex vivo como in vivo; segundo, se cuantificaron los cambios del Gdi en los voluntarios sanos, mientras realizaban ciclos de inspiración y espiración con glotis permeable, a los diferentes volúmenes pulmonares antes descritos. El Gdi fue definido como la distancia existente entre los puntos medios de las líneas ecorrefringentes pleural y peritoneal (límite externo e interno, respectivamente), en las imágenes ecográficas del músculo obtenidas con orientación transversal. Finalmente, y mediante la ecografía en modo M se calculó la tercera variable definida por la velocidad (máxima) de relajación del diafragma (VMARdi) durante la realización de esfuerzos inspiratorios en la prueba de cargas externas. La cuantificación de esta variable se realizó en unidades de mm/seg en cada ciclo respiratorio mediante el programa informático incorporado al equipo de ecocardiografía. La velocidad estuvo definida como la hipotenusa del triángulo rectángulo cuyo cateto vertical (altura) lo determinó el cambio del Gdi (mm) y el cateto de la base representa el tiempo (fig. 4).
Análisis estadístico. Los datos se expresan como media±desviación estándar. El grado de relación entre las variables cuantitativas se ha evaluado mediante el coeficiente de correlación de Pearson. Los cambios de la VMARdi se evaluaron mediante análisis de la varianza para medidas repetidas (ANOVA). La estimación de las probabilidades condicionales en cada punto temporal en que tiene lugar la claudicación y el límite del producto de esas probabilidades para estimar la tasa de claudicación en cada punto temporal se cuantificó mediante el modelo de Kaplan-Meier. La precisión de la técnica para la detección de claudicación se evaluó mediante el análisis de curvas ROC. El análisis de fiabilidad de las mediciones tanto intra- como inter-observador se realizó mediante el cálculo de los coeficientes de correlación intraclase, utilizando un modelo de acuerdo absoluto de dos factores (efectos mixtos). Se estableció la significación estadística en un valor de p<0,05 en todos los casos.
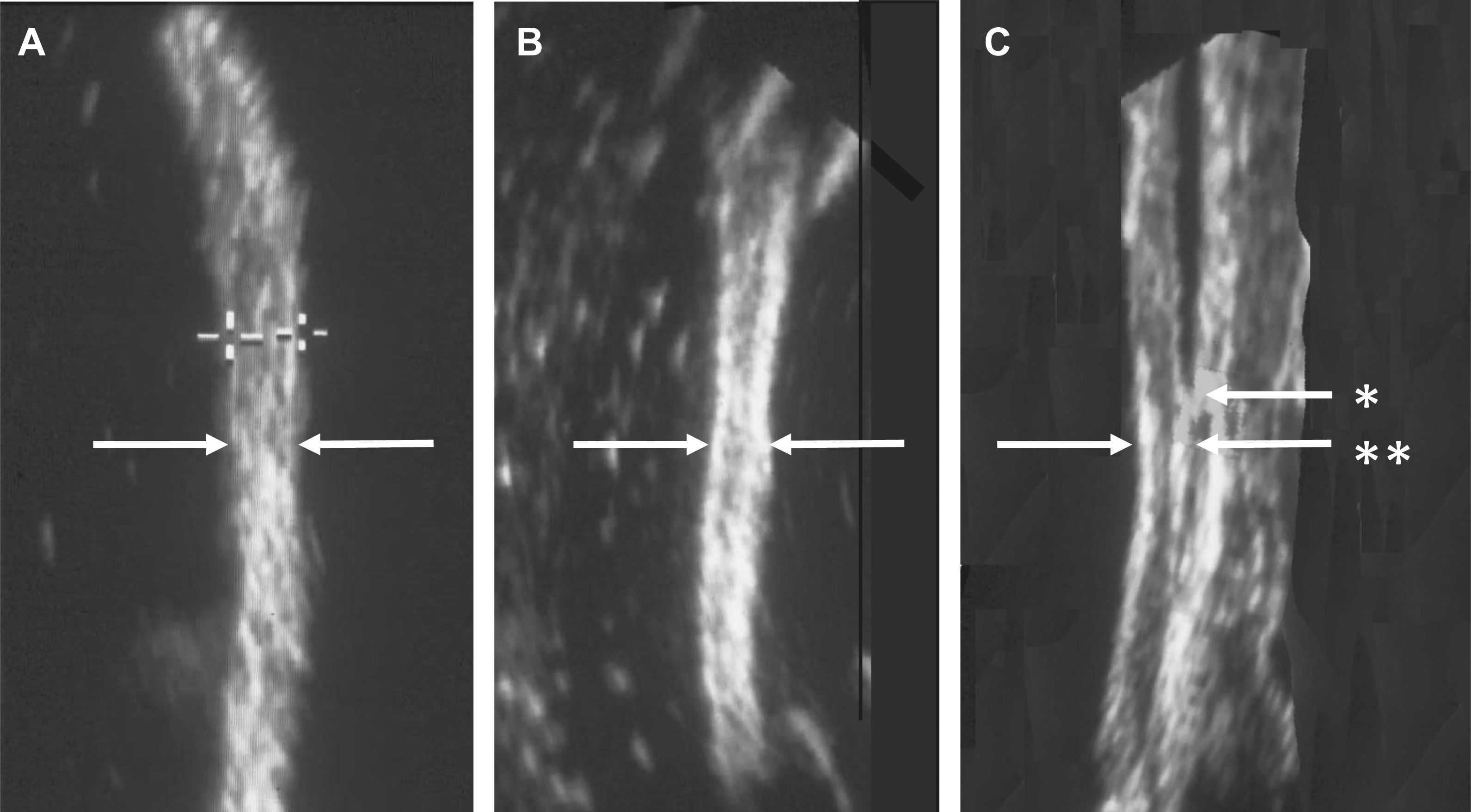
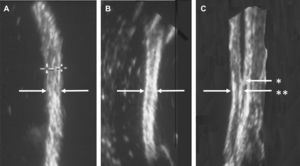
ResultadosGrosor del músculo diafragma (Gdi). La ecografía ex vivo de las piezas anatómicas permitió identificar, en todos los casos, los diferentes planos que conforman las estructuras de la pared torácica a nivel de la zona de aposición. La figura 1 muestra una imagen representativa del diafragma tanto en relación con las demás estructuras de la pared como tras el procedimiento de disección del músculo. El diafragma mostró una ecorefringencia típica de tejido muscular (fig. 1A), con límites que pudieron ser claramente precisados. Así, las interfases peritoneal y pleural permitieron precisar los límites medial y lateral del diafragma, lo que a su vez permitió cuantificar su grosor (fig. 1B). En la pieza ex vivo íntegra, el músculo mostró un grosor medio de 4,1±0,1mm, que no se modificó significativamente tras la disección (cambios <0,1mm).
Fase de estudio ex vivo. Imágenes representativas del diafragma y estructuras vecinas a nivel de la zona de aposición torácica del músculo obtenidas mediante la ecografía en medio líquido. El diafragma disecado muestra una ecorrefringencia típica de tejido muscular (A), cuyos límites pueden ser precisados (indicadores en cruz). Dos límites de mayor densidad aparecen determinados por la serosa pleural y peritoneal (B). En la pieza íntegra (C), el punto inferior del pulmón indica el ángulo costofrénico lateral (*). Las interfases peritoneal y pleural permiten precisar los límites medial y lateral del diafragma (**).
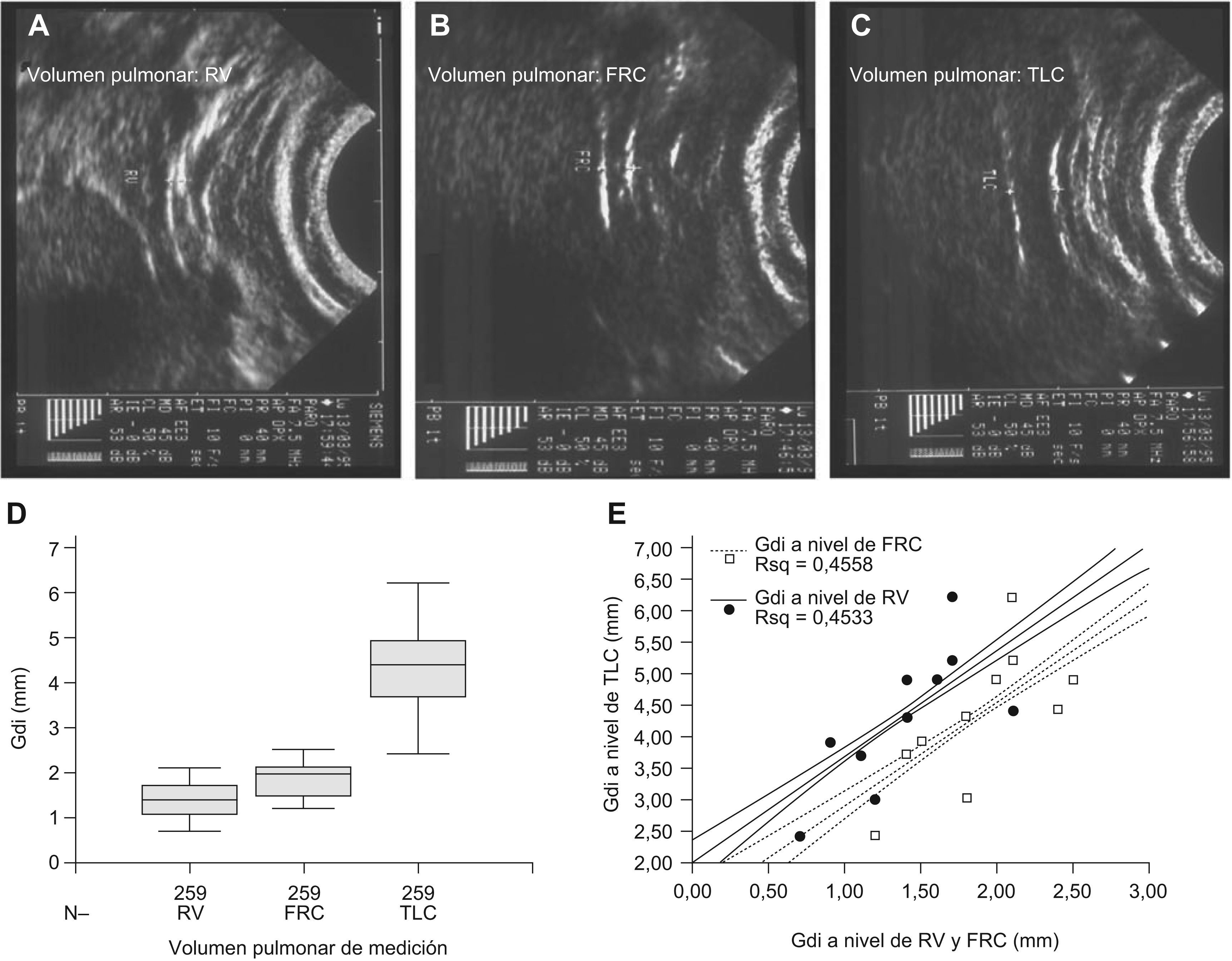
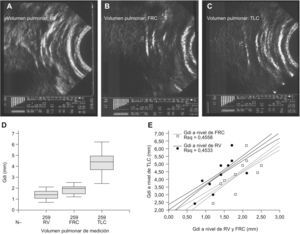
Cambios de grosor del diafragma durante el ciclo ventilatorio. Los voluntarios sanos seleccionados (n=10, de género masculino y 34±9 años) presentaban una antropometría normal (límites de peso, 63–77kg, BMI 25±3kg/m2). Su espirometría también se hallaba dentro de la normalidad (FEV1, 87±4% pred; FEV1/FVC, 76±3%). La imagen ecográfica del diafragma se pudo identificar con claridad en todos los individuos, siendo el Gdi a FRC de 1,88±0,41mm. Los movimientos respiratorios se asociaron a cambios en el grosor del diafragma (fig. 2), con una correlación directa (r=0,865, p<0,001) entre su grosor y el volumen pulmonar al que se realizaba la medición. Así, los valores mínimos observados correspondieron a RV (1,38±0,41mm) y los máximos a TLC (4,37±0,97mm) (fig. 3).
Fase de estudio estática in vivo. Imágenes representativas del diafragma y estructuras vecinas a nivel de la zona de aposición torácica del músculo obtenidas mediante ecografía bidimensional en voluntarios sanos. El diafragma muestra un grosor mínimo a volumen residual (RV) (A), intermedio a capacidad funcional residual (FRC) (B), y máximo a capacidad pulmonar total (TLC) (C). La figura 2D muestra los valores absolutos obtenidos en estos volúmenes pulmonares. La figura 2E muestra la correlación lineal y su IC95% entre el Gdi máximo (a nivel de TLC) y el obtenido durante las maniobras de apnea a FRC y RV (p<0,05 ambos). Abreviaturas: N: número de mediciones; Gdi: grosor del diafragma; RV: volumen residual; TLC: capacidad pulmonar total; FRC: capacidad funcional residual.
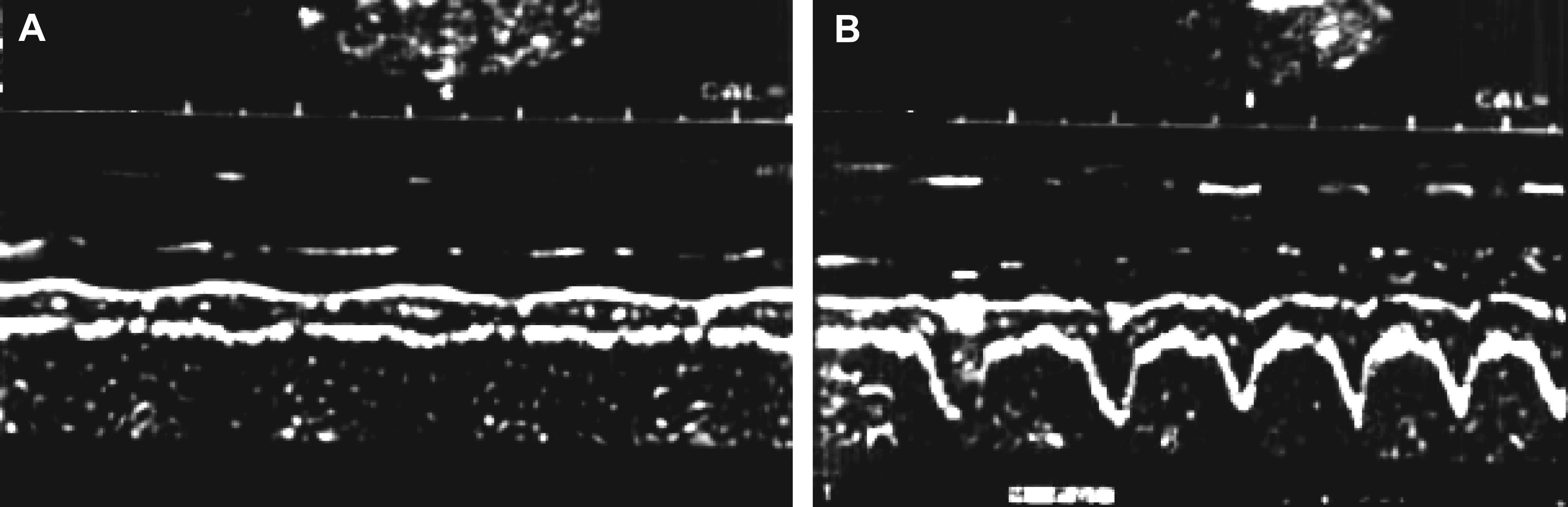
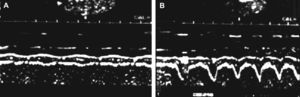
Fase de estudio in vivo y dinámico Imágenes típicas obtenidas mediante la ecografía en modo M (guiada por el modo B) de los cambios de grosor del diafragma (Gdi) durante la respiración en reposo (A) y durante la respiración ante cargas inspiratorias específicas (B). El cambio (%) en el grosor durante las cargas no mostró correlación con el grosor en reposo (C). Abreviaturas: Gdi: grosor del diafragma; FRC: capacidad funcional residual.
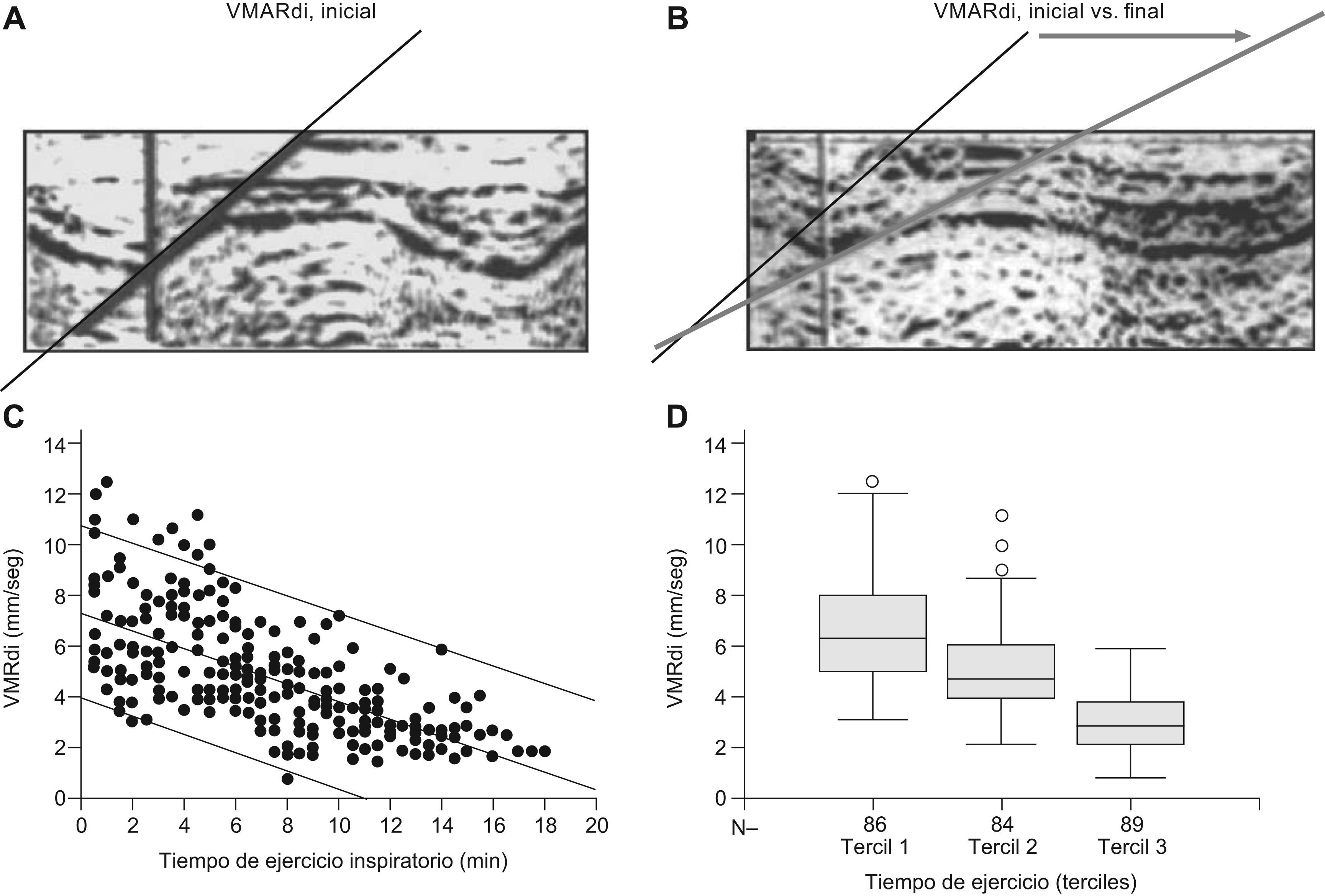
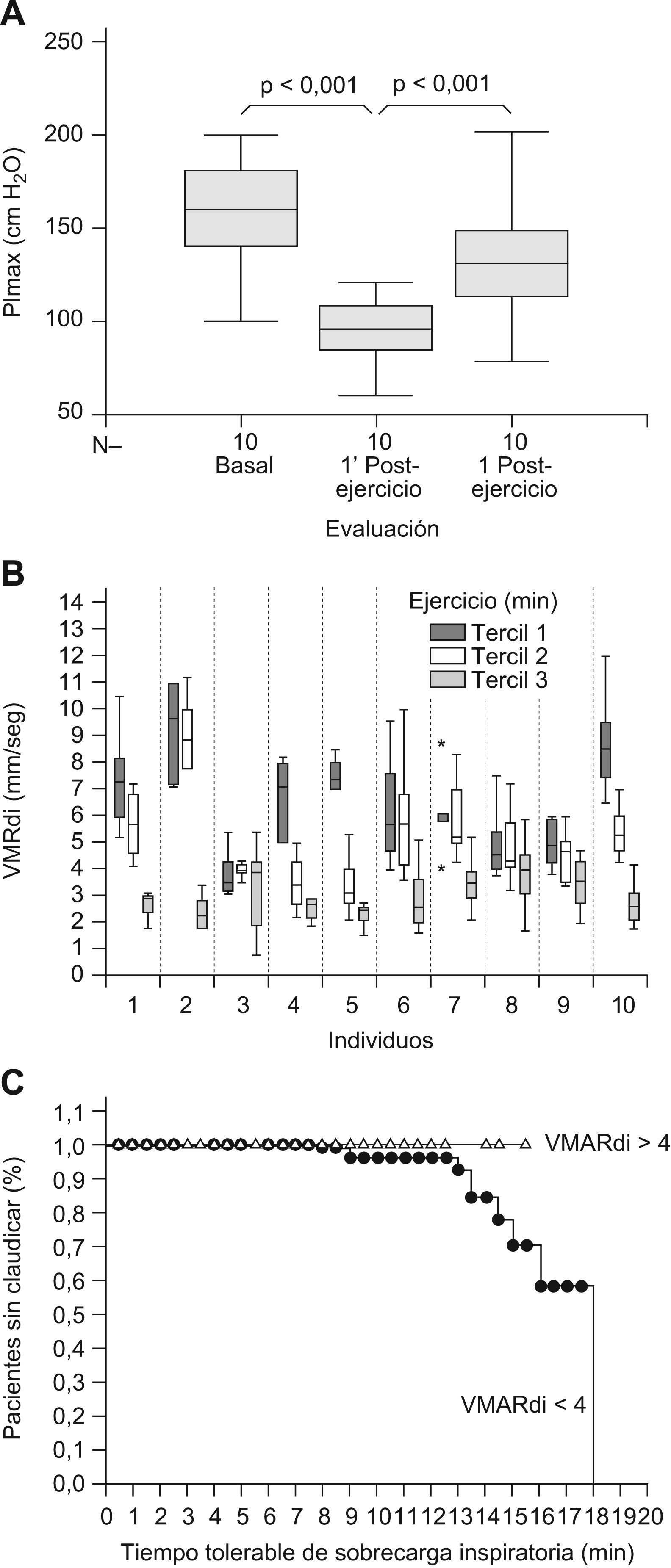
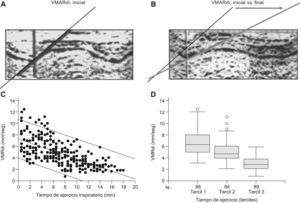
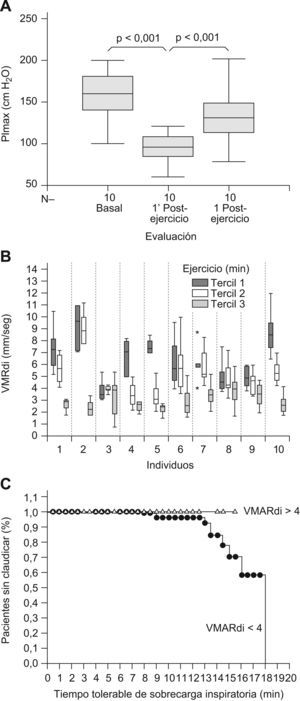
Determinación de la velocidad máxima de relajación del diafragma (VMARdi). La ecografía en modo M permitió cuantificar y monitorizar la VMARdi durante la prueba de resistencia. Esta última tuvo una duración media de 13±3 (límites, 8–18) min. Los valores iniciales de la VMARdi (primer tercil de duración de la prueba) fueron de 6,62±2,11 (límites, 6,17 a 7,07) mm/seg, mostrando una disminución progresiva y lineal en el resto de la prueba (segundo tercil, VMARdi 5,11±1,87mm/seg; tercer tercil, VMARdi 3,00±1,06mm/seg; p<0,001). Se observó una correlación lineal directa (r=0,658, p<0,000) entre el tiempo de respiración ante la carga inspiratoria externa y la VMARdi, con un decremento medio de 0,28mm/seg por cada minuto de respiración ante las cargas inspiratorias. El valor mínimo alcanzado por la VMARdi fue de 3,00±1,06mm/seg, y correspondió en todos los casos con la claudicación ventilatoria (figs. 4 y 5). La claudicación inspiratoria se asoció en todos los casos con un deterioro reversible de la fuerza máxima inspiratoria (PI,mmax). Esta última se asoció siempre a valores de VMARdi inferiores a 4mm/seg (p<0,001; fig. 5) y por debajo del 70% del valor de VMARdi inicial. La PI,mmax recuperó sus valores iniciales a los 10min de la claudicación, lo cual representa un signo clínicamente aceptado de que la claudicación estuvo justificada, parcial o totalmente, por fatiga inspiratoria global (incluyendo el diafragma). El análisis ROC entre la VMARdi y la claudicación mostró un área bajo la curva de 0,978, con un intervalo de confianza del 95% de 0,947–0,994, y un valor p<0,0001. A partir de las coordenadas de la curva ROC, el punto de corte de 2,1mm/seg de VMARdi permite resumir los resultados de la escala continua con la máxima sensibilidad (100%, IC 95%=59,0–100) y especificidad (93,8%, IC 95%=89,4–96,7) para detectar el fenómeno (claudicación). Todos estos aspectos indican que la técnica diagnóstica tiene una alta precisión, lo que se corrobora con una curva muy cercana al extremo superior izquierdo.
Cuantificación de la velocidad de relajación del diafragma (VMARdi), estudio in vivo. Imágenes representativas del diafragma obtenidas mediante la ecografía transtorácica en modo M en voluntarios sanos mientras realizaban la prueba de resistencia. Mediciones tipo obtenidas al inicio (A) y al final (claudicación, B) de la prueba. Existe una correlación lineal (r=0,658, p<0,000) entre el tiempo de esfuerzo inspiratorio y la VMARdi (C). La división de la prueba en terciles según su duración (D), demuestra que la VMARdi tiene valores progresivamente más bajos al aproximarse la claudicación. Abreviaturas: Gdi: grosor del diafragma; RV: volumen residual; TLC: capacidad pulmonar total; VMARdi: velocidad máxima de relajación del diafragma.
Riesgo de claudicación del diafragma y VMARdi. La claudicación ante la prueba de resistencia muscular se asoció a una disminución transitoria de la fuerza muscular inspiratoria (e.d., fatiga muscular inspiratoria) (A). La cuantificación continua de la VMARdi durante la prueba de resistencia demostró que sus valores son máximos en las fases iniciales del ejercicio (e.d., primer tercil del tiempo de ejercicio en la respiración sin cargas adicionales y disminuye progresivamente (B). La claudicación se asocia a valores de VMARdi hasta un 70% por debajo de los iniciales. En ningún caso se produjo claudicación por encima de 4mm/seg (función de supervivencia, Kaplan Meier, p=0,217) (C). Abreviaturas: Gdif: grosor del diafragma; VMARdi: velocidad máxima de relajación del diafragma.
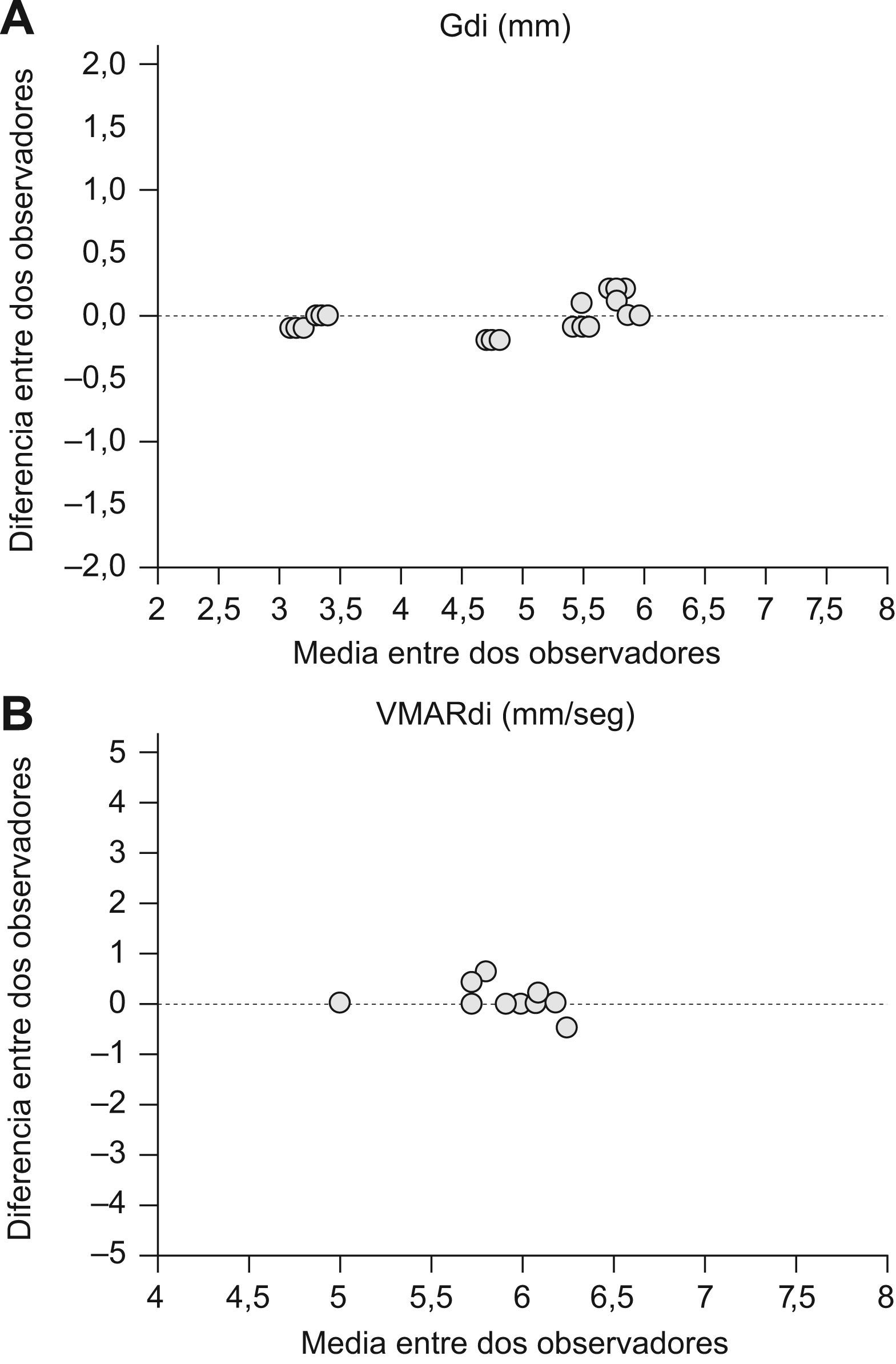
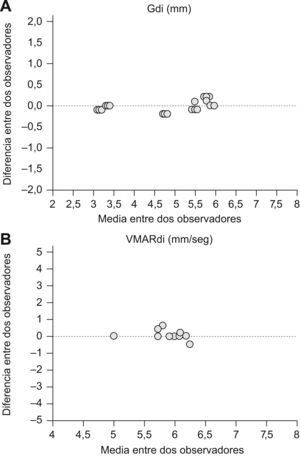
Análisis de la fiabilidad de las mediciones. La concordancia entre resultados obtenidos por un mismo observador así como la comparación con un segundo observador, muestran un alto coeficiente de correlación intraclase (CCI) tanto para las determinaciones del Gdi como para las mediciones de VMARdi. Específicamente, las mediciones del Gdi a distintos volúmenes pulmonares mostraron un CCI intra-observador de 0,996 (IC 95%: 0,991–0,998), y un CCI inter-observador de 0,992 (IC 95%: 0,992–0,998). VMARdi. El análisis inter-observador de la medición de la VMARdi mostró un CCI de 0,859 (IC 95%: 0,658–0,943).
DiscusiónLa información aportada por el presente estudio puede ser resumida en cuatro hallazgos fundamentales. Primero, la ecografía permite identificar con claridad los límites y grosor del diafragma tanto en piezas de necropsia como en voluntarios sanos. El segundo hallazgo está representado por la evidencia de que el grosor del diafragma medido con la ecografía se modifica significativamente durante el ciclo respiratorio, traduciendo la contracción muscular. En tercer lugar, nuestro estudio confirma que el grosor del diafragma guarda una relación directa con el volumen pulmonar en que se realiza la medición del mismo. Finalmente, nuestro estudio demuestra que la velocidad máxima de relajación del diafragma disminuye progresivamente y con tendencia lineal durante la respiración ante cargas inspiratorias externas, llegando a valores mínimos que coinciden con la claudicación ventilatoria.
La ecografía es una técnica ampliamente utilizada como medio diagnóstico en múltiples patologías y en varios escenarios en distintas especialidades médicas. Así, por ejemplo, en cardiología la ecocardiografía adquiere un papel predominante con gran desarrollo en la valoración funcional de la dinámica cardíaca. Nuestro estudio confirma parte de los resultados de Ueki et al23 en términos de que existen cambios del Gdi en relación con los movimientos respiratorios. Esta información del grosor, sin embargo, es limitada si lo que se intenta es evaluar la función muscular y la reserva ante la fatiga. Siguiendo el razonamiento empleado desde hace unos años para el análisis de la función diastólica del ventrículo izquierdo a partir de la pendiente de relajación de su pared posterior en ecografía en modo M, nos acercamos a la valoración de la función diafragmática de la misma forma, es decir, midiendo su pendiente de relajación15. Nuestro estudio aporta dos conceptos novedosos. Primero, es el primero en evaluar (e.d., fase 1) la imagen ultrasonográfica del diafragma mediante el estudio de piezas necrópsicas (ex vivo, n=10) bajo inmersión en medio líquido. Estos hallazgos validan la metodología utilizada in vivo. Y segundo, es el primero en proponer y evaluar la evaluación de la velocidad máxima de relajación diafragmática utilizando el modo M, como un índice de función muscular y reserva ante la fatiga, a la cual hemos denominado con el acrónimo VMARdi.
Estudios en necropsias: Validación de la ecoestructura del diafragma. La metodología utilizada en el estudio de los fragmentos obtenidos por necropsia permitió identificar y caracterizar con precisión la apariencia ecográfica del diafragma y de las diferentes estructuras adyacentes en la zona de aposición. Esto lo permitió el estudio tanto de las piezas ad integrum como tras la disección secuencial que se realizó de los diferentes tejidos. Solo tras la validación ex vivo se procedió a la evaluación in vivo. Dado que no se realizaron estudios histológicos ni moleculares, no podemos precisar el estado trófico subcelular (ej., tamaño de fibras, número de fibras, espacio interfibrilar) del músculo. Sin embargo, en el caso de las piezas de necropsias, la apariencia del diafragma era la de un músculo normal, sin signos macroscópicos de atrofia o hipertrofia. Un punto a destacar es que las piezas necrópsicas pueden presentar artefactos de contracción con posibles cambios en la ecorrefringencia por necrosis y/o debidas al rigor mortis. Por esta razón, todos los fragmentos fueron estudiados dentro de las primeras horas tras la defunción de los pacientes.
Estudios in vivo: Cambios dinámicos del diafragma determinados con ecografía durante los movimientos ventilatorios y fatiga muscular. Se sabe que el diafragma se acorta durante la contracción, lo que implica secundariamente un aumento de grosor (reflejo de la superposición de los miofilamentos de actina y miosina)24. El presente estudio ha demostrado que este cambio de grosor efectivamente se produce y que es posible cuantificarlo mediante la ecografía. Estos resultados son coherentes con estudios previos que han demostrado que el diafragma incrementa su grosor al realizar movimientos inspiratorios en condiciones normales, y que su cinética se altera si se cambia la resistencia inspiratoria (p.ej., oclusión de la nariz)25. Nuestros resultados resaltan que el cambio en Gdi guarda una relación lineal con el volumen pulmonar al que se realiza la medición, lo que parece lógico a tenor de que el músculo se acorta y aumenta su grosor de forma progresiva permitiendo el incremento del volumen pulmonar. Recientemente Boussuguess et al describieron la ecografía en modo M como una técnica muy reproducible para evaluar la excursión cráneo-caudal del diafragma tanto durante la respiración tranquila como máxima (sniff)26.
Uno de los puntos innovadores es que el presente estudio ha permitido valorar funcionalmente el ciclo de contracción-relajación con especial énfasis en el análisis de esta última, durante la ejecución de un protocolo experimental normalizado de inducción de fatiga muscular inspiratoria. En nuestro conocimiento, el presente es el primer estudio que establece un método basado en la velocidad de relajación como potencialmente útil para estimar el estado funcional del músculo y el riesgo de fracaso ante cargas ventilatorias. En este sentido, el estudio fue guiado por el conocimiento de que la relajación muscular es una fase activa tanto desde el punto de vista metabólico como estructural, que incluye consumo de energía y eventos celulares y moleculares específicos. Los cambios en la relajación muscular representa uno de los eventos más precoces al aproximarse la fatiga muscular9,11. En ese sentido, ya se había demostrado que la fatiga de los músculos respiratorios condiciona cambios en su velocidad de relajación, expresada por la variable de la maximal relaxation rate (MRR, ‘tasa máxima de relajación’)11. Esta variable se ha descrito para el registro de la curva de presión esofágica y la curva de presión nasal, pero se ha difundido poco en el ámbito asistencial clínico habitual. Sin embargo, cualquier registro temporal de la fase de relajación podría ser potencialmente útil para ese objetivo. Nuestros acercamientos a través del registro ecográfico del músculo en el modo M parecen confirmar esta hipótesis. La VMARdi (variable que podría considerarse expresión ecográfica de la MRR), disminuyó de forma progresiva en todos los individuos a medida que progresó la prueba de resistencia ventilatoria. Más aún, este decremento alcanzó un valor mínimo en el momento de la claudicación, cercano a un cambio medio de −70% respecto del valor inicial.
En toda prueba de sobrecarga muscular aguda se asume que existen factores de diversa índole tales como los perceptuales y neuropsicológicos que también pueden participar en la finalización de la prueba (aprendizaje de la prueba, sensación de disnea, percepción de presión, etc.)27. En este primer estudio no podemos asegurar taxativamente que la claudicación se haya producido por fatiga diafragmática en todos los casos. Sin embargo, tanto la disminución en la PI,mmax inicial como su rápida recuperación sugieren la presencia de fatiga muscular respiratoria5. Además, nuestro esquema de sobrecarga muscular respiratoria fue similar a la utilizada en estudios previos que han confirmado que la claudicación en estas pruebas se suele producir por fatiga de los músculos inspiratorios28,29. Por tanto, podemos sugerir razonablemente que los cambios en la variable ecográfica VMARdi estarían reflejando alteraciones asociadas al desarrollo y aparición de la fatiga del diafragma.
Potenciales implicaciones clínicas. Los hallazgos del presente estudio sugieren que la ecografía transtorácica pueda tener un papel clínicamente útil en la evaluación no invasiva de los músculos respiratorios, y del diafragma en particular. Un valor añadido en relación con nuestro estudio es el hecho de que hasta la fecha no existen técnicas alternativas que permitan evaluar la estructura y función diafragmáticas en la práctica clínica habitual. Tras el estudio en sujetos sanos, parece justificada la necesidad de evaluar la reproducibilidad y aplicabilidad de la ecografía del diafragma en el ámbito de la atención de pacientes, sobre todo, aquellos con alto riesgo de disfunción del diafragma. Nos parece especialmente llamativa la posibilidad de que la ecografía diafragmática pueda aportar información novedosa respecto de las relaciones entre la sobrecarga del músculo y la presencia de patologías como la malnutrición, la Enfermedad Pulmonar obstructiva crónica (EPOC), la insuficiencia cardíaca crónica, la cifoescoliosis, o situaciones agudas que imponen a dicho músculo un alto riesgo de fracasar (ej., destete de ventilación mecánica).
Aunque las variables propuestas (Gdi para el grosor, y VMARdi para la competencia funcional) tienen un carácter no invasivo y son relativamente fáciles de realizar, existen algunas consideraciones que limitan su aplicación inmediata en el entorno clínico. Una de ellas tiene que ver con la ausencia de información respecto a la reproducibilidad interdiaria de los hallazgos en un mismo sujeto. También faltan estudios que valoren la aplicabilidad de la técnica de evaluación ante otras situaciones de sobrecarga diafragmática tales como ejercicio general, situaciones de estímulo hipoxémico o hipercápnico agudos o crónicos, o situaciones de sobrecarga ventilatoria exógena (p.ej. sepsis). Otra potencial limitación de la ecografía del diafragma estriba en las dificultades que su realización pudiera tener en determinadas situaciones, como algunas configuraciones torácicas (cifoescoliosis, enfisema pulmonar), secuelas de neumonectomía, neumonía subyacente o presencia de derrame pleural. Desconocemos en qué medida la posición corporal puede afectar la fiabilidad de la técnica ecográfica del diafragma. Finalmente, un grado importante de hiperinflación pulmonar puede conllevar el desplazamiento caudal de la zona de aposición, dificultando además el acceso transverso a un diafragma muy aplanado. Sin embargo, esta limitación parece poco probable ya que en nuestro estudio el grosor del diafragma se pudo evaluar con facilidad incluso a TLC en todos los individuos. Finalmente, debemos mencionar que la ecocardiografía es una técnica operador-dependiente. Esta característica forma parte de las limitaciones del estudio. Hemos incluido el análisis de la correlación inter- e intra-observador, los cuales muestran excelentes resultados en términos de concordancia. Se debe tener en cuenta que esta concordancia está analizada en mediciones obtenidas por especialistas en dicha técnica. En consecuencia consideramos que, para su aplicación general, es imprescindible un periodo de entrenamiento y aprendizaje específicos (fig. 6).
Gráficas de Bland y Altman de la concordancia de las mediciones inter-observadores. Las mediciones del Gdi a nivel de múltiples volúmenes pulmonares mostraron un CCI intraobservador de 0,996 (IC 95%: 0,991–0,998) e interobservador de 0,992 (IC 95%: 0,992–0,998) (A). El análisis inter-observador de la medición de la VMARdi mostró un CCI de 0,859 (IC 95%: 0,658-0,943) (B).
El presente estudio demuestra que la ecografía transtorácica del diafragma es un método no invasivo que permite la evaluación estructural genérica a través del grosor del músculo en las diferentes fases del ciclo contracción-relajación, mientras que el modo M permite una aproximación prometedora sobre su estado funcional a través de la velocidad máxima de relajación como un estimador potencial del riesgo de claudicación inspiratoria ante cargas. Estos hallazgos son de indudable interés fisiopatológico y podrían ser de utilidad en el contexto asistencial clínico.
FinanciaciónSubvenciones: Financiado en parte por becas CIBER de Enfermedades Respiratorias; Instituto de Salud Carlos III, FIS código PI081612, Spain; SEPAR 2009, ARMAR.