La prueba de marcha de 6 minutos (PM6M) es ampliamente utilizada en la evaluación de la enfermedad pulmonar intersticial difusa (EPID) y en la hipertensión pulmonar (HP). Sin embargo, sus determinantes fisiológicos no han sido bien caracterizados.
ObjetivoEvaluar los cambios fisiológicos que ocurren durante la PM6M en la EPID y en la HP y compararlos con la prueba de esfuerzo cardiopulmonar (PECP).
Material y métodosSe estudiaron 13 pacientes con EPID y 14 con HP mediante PM6M y PECP en cicloergómetro. Durante la PM6M se registraron las variables respiratorias mediante telemetría.
ResultadosEl consumo de oxígeno (VO2), la ventilación y la frecuencia cardiaca mostraron una meseta desde el minuto 3 de la PM6M en ambas patologías. El valor de VO2 no difirió del valor pico en la PECP (14±2 y 15±2ml/kg/min, respectivamente, en la EPID; 16±6 y 16±6ml/kg/min, en la HP). En ambas patologías, disminuyó la saturación arterial de oxígeno, aunque más marcadamente en la EPID (−12±5%, p<0,01). En la HP, el equivalente ventilatorio de CO2 (VE/VCO2) durante la PM6M estaba fuertemente relacionado con la clase funcional (CF) (85±14 en CF III-IV, 44±6 en CF I-II; p<0,001).
ConclusionesEn la EPID y en la HP la PM6M se comporta como una prueba de esfuerzo máxima, con valores de VO2 similares a la PECP, poniendo de manifiesto limitación de la capacidad de transporte de oxígeno. La monitorización mediante telemetría durante la PM6M puede ser útil para la evaluación clínica de los pacientes con EPID o con HP.
The six-minute walk test (6MWT) is widely used in evaluating diffuse interstitial lung disease (ILD) and pulmonary hypertension (PH). However, their physiological determining factors have not been well defined.
ObjectiveTo evaluate the physiological changes that occur in ILD and PH during the 6MWT, and compare them with the cardiopulmonary exercise test (CPET).
Material and methodsThirteen patients with ILD and 14 with PH were studied using the 6MWT and CPET on an ergometer cycle. The respiratory variables were recorded by means of telemetry during the 6MWT.
ResultsOxygen consumption (VO2), respiratory and heart rate reached a plateau from minute 3 of the 6MWT in both diseases. The VO2 did not differ from the peak value in the CPET (14±2 and 15±2ml/kg/min, respectively, in ILD; 16±6 and 16±6ml/kg/min, in PH). The arterial oxygen saturation decreased in both diseases, although it was more marked in ILD (−12±5%, p<0,01). The ventilatory equivalent for CO2 (VE/VCO2) in PH during the 6MWT was strongly associated with functional class (FC) (85±14 in FC III-IV, 44±6 in FC I-II; p<0,001).
ConclusionsThe 6MWT in ILD and PH behaves like a maximal effort test, with similar VO2 to the CPET, demonstrating a limit in oxygen transport capacity. Monitoring using telemetry during the 6MWT may be useful for the clinical evaluation of patients with ILD or PH.
La evaluación de la capacidad aeróbica proporciona importante información sobre el diagnóstico y el pronóstico de muchas enfermedades respiratorias1,2. En consecuencia, los protocolos de ejercicio sencillos, como la prueba de marcha de 6 minutos (PM6M), se están utilizando con mayor frecuencia en el escenario clínico para monitorizar la progresión de la enfermedad y evaluar los efectos de las intervenciones terapéuticas3,4. Sin embargo, en su aplicación rutinaria, la PM6M no informa de las variables fisiológicas que explican la limitación funcional al esfuerzo. Los continuos avances tecnológicos potencian la solidez de las mediciones telemétricas del consumo de O2 (VO2) y la producción de CO2 (VCO2) que pueden incrementar sustancialmente el potencial de la PM6M en la evaluación de pacientes con trastornos cardiopulmonares crónicos. En pacientes con enfermedad pulmonar intersticial difusa (EPID), la PM6M ha demostrado recientemente ser un factor predictivo de mortalidad con una gran influencia en el proceso de toma de decisiones para el trasplante pulmonar5,6. En consecuencia, es altamente recomendable la inclusión de la PM6M en el seguimiento de estos pacientes7. En la hipertensión pulmonar (HP), la PM6M se está utilizando de forma sistemática como variable principal en la mayoría de ensayos clínicos que evalúan nuevos tratamientos8–10. Sin embargo, la evaluación del esfuerzo mediante la PM6M incorporando la medición de las variables fisiológicas tales como VO2, ventilación (VE), VCO2… puede mejorar la comprensión de las respuestas al ejercicio durante la misma en la HP11,12.
Los mecanismos responsables de la limitación de la tolerancia al ejercicio en la EPID13–15 y en la HP4 se han detallado y correlacionado con la evolución y el pronóstico de dichas enfermedades. Recientemente, Deboeck et al16 han publicado la existencia de una meseta en la curva del consumo de oxígeno durante la PM6M en pacientes con HP similar a la que se observó en pacientes con EPOC17,18, con valores cercanos a los observados en la prueba de ejercicio cardiopulmonar incremental (PECP). Hasta la fecha no hay información disponible sobre el comportamiento de las variables de esfuerzo en la EPID durante la prueba de marcha. Posiblemente, al igual que en la HP16, en la EPID, la PM6M puede generar un consumo de oxígeno cercano al consumo de oxígeno máximo limitado por síntomas.
Este estudio tiene como objetivo describir el curso de las respuestas fisiológicas durante la PM6M en pacientes con enfermedad parenquimatosa pulmonar o con enfermedad vascular pulmonar. En el mismo hemos comparado los resultados obtenidos durante la PM6M con los obtenidos durante la PECP en cicloergómetro. A la vista de los resultados de estudios previos16, consideramos que en los pacientes con EPID, la PM6M puede generar una demanda metabólica superior a la capacidad de transporte de oxígeno, a diferencia de lo que ocurre en sujetos sanos y en la EPOC.
La utilidad clínica del estudio es aumentar nuestro conocimiento de las respuestas en la PM6M en estas dos condiciones para comprender mejor los factores limitantes del ejercicio en las patologías parenquimatosas y vasculares del pulmón.
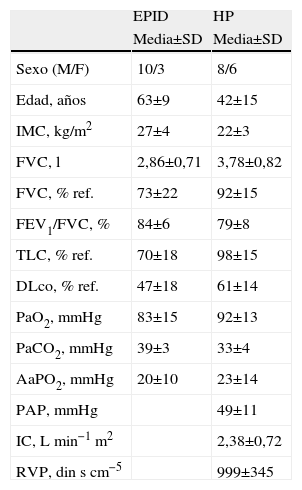
Pacientes y métodosSujetosEn este estudio se incluyeron un total de 27 pacientes, 13 de ellos (10 hombres/3 mujeres) con diagnostico de EPID y los 14 restantes (8 hombres/6 mujeres) con diagnostico de HP efectuado mediante estudio hemodinámico pulmonar. Las características de ambos grupos se describen en la tabla 1.
Características antropométricas y funcionales de la población
| EPID | HP | |
| Media±SD | Media±SD | |
| Sexo (M/F) | 10/3 | 8/6 |
| Edad, años | 63±9 | 42±15 |
| IMC, kg/m2 | 27±4 | 22±3 |
| FVC, l | 2,86±0,71 | 3,78±0,82 |
| FVC, % ref. | 73±22 | 92±15 |
| FEV1/FVC, % | 84±6 | 79±8 |
| TLC, % ref. | 70±18 | 98±15 |
| DLco, % ref. | 47±18 | 61±14 |
| PaO2, mmHg | 83±15 | 92±13 |
| PaCO2, mmHg | 39±3 | 33±4 |
| AaPO2, mmHg | 20±10 | 23±14 |
| PAP, mmHg | 49±11 | |
| IC, Lmin−1m2 | 2,38±0,72 | |
| RVP, dinscm−5 | 999±345 |
AaPO2: gradiente alveolo-arterial de oxígeno en reposo; DLCO: capacidad de difusión del monóxido de carbono; EPID: enfermedad pulmonar intersticial difusa; FEV1: volumen espiratorio forzado en el primer segundo; FEV1/FVC: cociente volumen espiratorio forzado en el primer segundo y capacidad vital forzada expresada como porcentaje absoluto; FVC: capacidad vital forzada; HP: hipertensión pulmonar; IC: índice cardíaco; IMC: índice de masa corporal; PaCO2: presiónparcial de dióxido de carbono en sangre arterial; PaO2: presión parcial de oxígeno en sangre arterial; PAP: presión arterial pulmonar; RVP: resistencia vascular pulmonar; TLC: capacidad pulmonar total.
Los datos se presentan como media±SD (desviación estándar).
El diagnóstico de EPID se estableció de acuerdo con el documento de consenso de la ATS y la ERS19. En 12 casos el diagnostico fue de fibrosis pulmonar idiopática (FPI) y el restante fue una sarcoidosis con infiltrados pulmonares. El diagnóstico histológico de neumonía intersticial usual (NIU) se obtuvo en 10 pacientes (77%). En todos los pacientes con EPID, se realizó una ecocardiografía en el momento del diagnóstico, que descartó la existencia de HP y otros signos de disfunción ventricular derecha tales como la dilatación de cavidades derechas y/o el movimiento paradójico del septo interventricular.
La HP se definió como presión arterial pulmonar media ≥25mmHg en reposo y presión de oclusión pulmonar 15mmHg. Los diagnósticos subyacentes en los pacientes con HP fueron: hipertensión arterial pulmonar idiopática (n=5), asociada al VIH (n=4), hipertensión porto-pulmonar (n=3) y enfermedad pulmonar tromboembólica crónica (n=2).
La caracterización de los pacientes para el estudio incluyó: 1. Historia clínica y examen físico; 2. Pruebas de la función pulmonar y; 3. Mediciones diagnósticas llevadas a cabo para apoyar el diagnóstico. Los pacientes portadores de oxigenoterapia continua domiciliaria 24h al día se excluyeron del estudio. El Comité Ético a del Hospital Clínic, de la Universidad de Barcelona, aprobó el estudio y los pacientes firmaron sus respectivos consentimientos informados.
Diseño del estudioLos sujetos realizaron dos protocolos de ejercicio en el mismo día, una PECP y una PM6M, con una diferencia mínima entre ambas pruebas de 1 hora para asegurar el retorno a las condiciones basales antes de iniciar el segundo protocolo de ejercicio. El orden de los dos protocolos de ejercicio (PECP y PM6M) fue aleatorizado.
Función pulmonar en reposo. Todos los pacientes realizaron determinaciones de espirometría forzada, volúmenes pulmonares por pletismografía, y capacidad de difusión de monóxido de carbono (DLco) (Jaeger, MasterScreen; Wüerzburg, Germany)20,21. En todos ellos se analizó en una muestra de sangre arterial, la presión parcial de oxígeno (PaO2), la presión de dióxido de carbono (PaCO2), el pH y el lactato en sangre (Ciba Corning 800, USA).
Ecocardiografía. Los pacientes diagnosticados de EPID se sometieron a una prueba de cribaje mediante ecocardiografía transtorácica Doppler color-flow (ACUSON, Sequoia C256, Siemens, CA, USA) para excluir la existencia de HP. Todos los pacientes con HP tenían una ecocardiografía de sospecha de HP con presión arterial pulmonar sistólica mayor de 40mmHg.
Hemodinámica pulmonar. El cateterismo cardiaco derecho se practicó solo en pacientes con sospecha de HP y previo a la inclusión en el estudio. Las mediciones hemodinámicas se realizaron solo en reposo22.
PM6M. Se realizó la PM6M23 con registro simultáneo de frecuencia cardiaca (FC), VE, VO2, VCO2, cociente respiratorio (RER), relación entre ventilación minuto y VCO2 (VE/VCO2) y relación entre ventilación minuto y consumo de O2 (VE/VO2), mediante la utilización de un sistema telemétrico portátil (K4b2; Cosmed; Pavona di Albano, Italia). El valor de las variables fisiológicas durante la PM6M corresponde al promedio de los últimos 30 segundos de cada minuto. Se tomaron muestras de sangre arterial en reposo al final de la prueba utilizando un catéter arterial para el análisis de los gases respiratorios (PaO2 y PaCO2) y el ácido láctico. También se midió la saturación de oxígeno por pulsioximetría (SpO2) durante ambos protocolos de ejercicio (PulsoX-31, Minolta, Japan). En la PM6M, la extracción de la muestra de sangre arterial para efectuar la medición gasométrica se realizó de forma inmediata al finalizar la prueba. Todos los pacientes habían realizado anteriormente la PM6M como parte de su seguimiento rutinario.
Prueba de ejercicio cardiopulmonar. Se realizó la prueba de ejercicio incremental en bicicleta en todos los pacientes24, con el cálculo respiración a respiración de las variables descritas en la PM6M con el mismo sistema telemétrico portátil. Se utilizó un cicloergómetro controlado electrónicamente (CardiO2 cycle Medical Graphics Corporation, St. Paul, Mn, USA). El valor de las variables fisiológicas durante la PECP corresponde al promedio de intervalos de 15 segundos. Se tomaron muestras de sangre arterial en reposo (al inicio), al minuto y cada 3 minutos durante la prueba para medir los gases respiratorios y los niveles de lactato.
Análisis de los datosLos resultados en el texto están expresados como media±desviación estándar (SD). Las comparaciones entre los protocolos de ejercicio (PM6M y PECP) se hicieron mediante una t-Student pareada. Además, se comparó el VO2 pico en la PECP y durante los 3 últimos minutos de la PM6M mediante el análisis de Bland & Altman. La significación estadística se fijó para valores de p <0,05 en todos los casos.
ResultadosCaracterísticas en reposoLas características antropométricas y funcionales de los pacientes con EPID y con HP se muestran por separado en la tabla 1. En reposo, los pacientes con HP presentaban HP severa, con índice cardíaco bajo y aumento de la resistencia vascular pulmonar, de severa intensidad de (tabla 1). Diez de los 14 pacientes con HP estaban en clase funcional (CF) I-II de la escala de la World Health Organisation-New York Heart Association (WHO-NYHA)25 y los 4 restantes estaban en CF III-IV. Los dos grupos de pacientes diagnosticados de EPID y de HP presentaban una reducción similar de la capacidad aeróbica, como se muestra en la tabla 2. En la PECP, la carga máxima alcanzada representó el 44% (hombres) y el 56% (mujeres) de los valores de referencia26 en los pacientes con EPID, y el 46% y el 59%, respectivamente, en los casos de HP. En la PM6M, la distancia final recorrida representó el 62% y el 67% de los valores de referencia27 para hombres y mujeres, respectivamente, en la EPID, y el 64% y 68% en la HP.
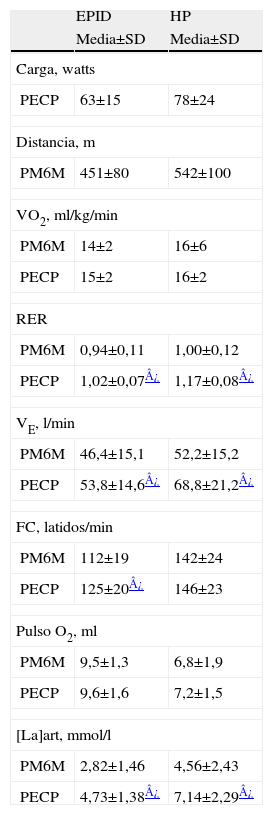
Respuestas fisiológicas durante la prueba de marcha de 6 minutos y la prueba de esfuerzo cardiopulmonar en la enfermedad pulmonar intersticial difusa y en la hipertensión pulmonar
| EPID | HP | |
| Media±SD | Media±SD | |
| Carga, watts | ||
| PECP | 63±15 | 78±24 |
| Distancia, m | ||
| PM6M | 451±80 | 542±100 |
| VO2, ml/kg/min | ||
| PM6M | 14±2 | 16±6 |
| PECP | 15±2 | 16±2 |
| RER | ||
| PM6M | 0,94±0,11 | 1,00±0,12 |
| PECP | 1,02±0,07¿ | 1,17±0,08¿ |
| VE, l/min | ||
| PM6M | 46,4±15,1 | 52,2±15,2 |
| PECP | 53,8±14,6¿ | 68,8±21,2¿ |
| FC, latidos/min | ||
| PM6M | 112±19 | 142±24 |
| PECP | 125±20¿ | 146±23 |
| Pulso O2, ml | ||
| PM6M | 9,5±1,3 | 6,8±1,9 |
| PECP | 9,6±1,6 | 7,2±1,5 |
| [La]art, mmol/l | ||
| PM6M | 2,82±1,46 | 4,56±2,43 |
| PECP | 4,73±1,38¿ | 7,14±2,29¿ |
EPID: enfermedad pulmonar intersticial difusa; FC: frecuencia cardiaca; HP: hipertensión pulmonar; [La]art: lactato en sangre arterial; PECP: prueba de esfuerzo cardiopulmonar; PM6M: prueba de marcha de 6 minutos; Pulso O2: pulso de oxígeno; RER: Cociente respiratorio; VE: ventilación por minuto; VO2: Consumo de oxígeno.
Los datos se presentan como media±SD (desviación estándar). Los valores registrados en la PM6M corresponden al valor promedio de los últimos 30 segundos de la prueba. En la PECP los valores representados corresponden al ejercicio máximo.
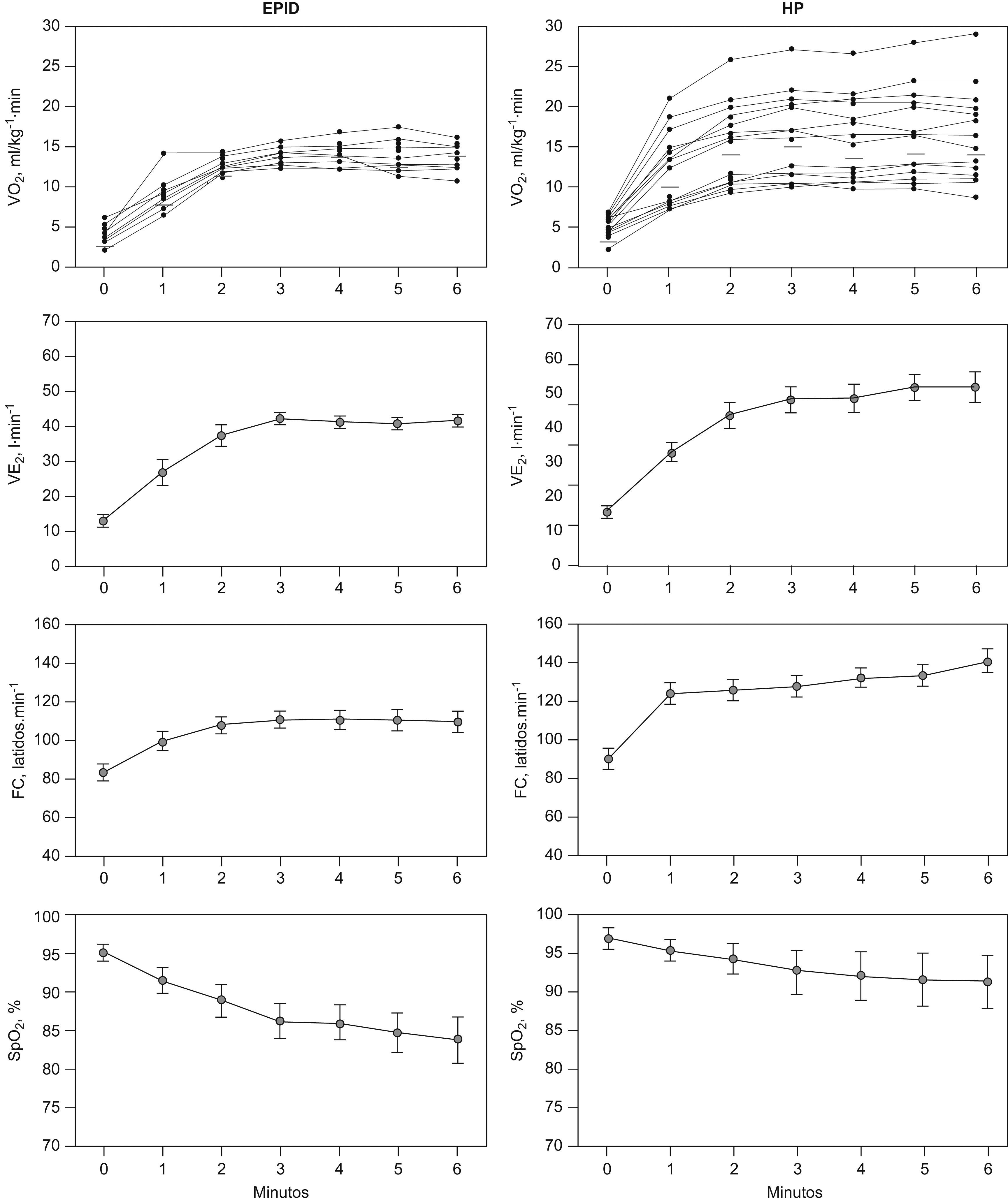
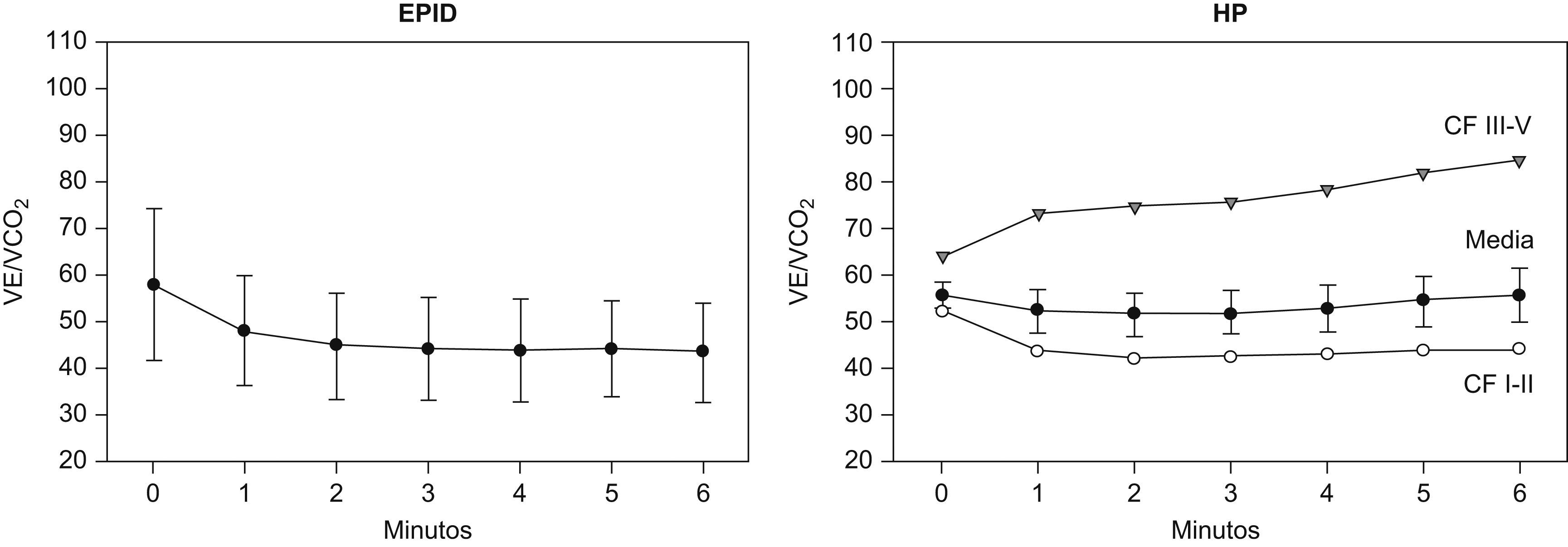
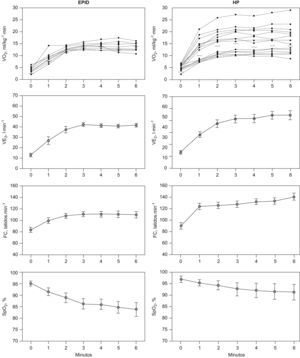
El VO2, la VE y la FC presentaron una meseta en las respectivas curvas en relación al tiempo durante los últimos 3 minutos de la PM6M (fig. 1, paneles izquierdos). La SpO2 disminuyó marcadamente durante la marcha, desde un valor medio en reposo de 95±2% hasta 84±10%, al final de la prueba (ΔSpO2 −12±5%) (p<0,01). El valor de PaO2 durante la PM6M cayó hasta 64±19mmHg (p=0,001), sin cambios en la PaCO2 comparado con el valor en reposo. Durante el ejercicio, el cociente VE/VCO2 mostró una tendencia decreciente en la PM6M (fig. 2). Sin embargo, los valores alcanzados al final de la prueba (43±11) fueron significativamente más altos que los valores de referencia para esta variable en el umbral anaeróbico (29±4) (p<0,05)28–30. El VO2 alcanzado durante los últimos 3 minutos en la PM6M (14±2ml/kg/min) se acercó al valor máximo de VO2 en el cicloergómetro (15±2ml/kg/min) (tabla 2). El umbral láctico durante la PECP se identificó en el 34±9% del VO2 máximo previsto. Como era de esperar, la VE, el RER y los niveles de lactato arterial fueron claramente más bajos durante la PM6M que los alcanzados durante la PECP (p<0,05). A pesar de que no hubo diferencias en la SpO2 inicial entre la PM6M y la PECP, esta variable fue significativamente más baja al final de la PM6M (84±10% versus 88±8%) (p< 0,005). En la PECP, la incapacidad del pulmón para realizar el intercambio de gases se puso de manifiesto por el significativo aumento del gradiente alveolo-arterial de oxígeno (AaPO2), que alcanzó una diferencia máxima al final del ejercicio (ΔAaPO2 23±11mmHg) (p<0,001).
Respuesta cardiopulmonar durante la prueba de marcha de 6 minutos (PM6M) en la enfermedad pulmonar intersticial difusa (EPID), paneles izquierdos, y en la hipertensión pulmonar (HP), paneles derechos. Los resultados se expresan como media±desviación estándar para todas las variables. En el caso de los valores de consumo de oxígeno (VO2) se muestran las respuestas individuales.
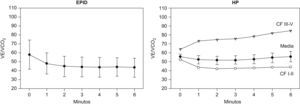
Equivalente ventilatorio de CO2 en la enfermedad pulmonar intersticial difusa (EPID), panel izquierdo, y en la hipertensión pulmonar (HP), panel derecho. Los resultados se expresan como media±desviación estándar. En la HP, los resultados también se expresan agrupados por CF (CF: I–II y III–IV).
Las curvas del VO2 y VE en función del tiempo también alcanzaron una meseta durante la PM6M en pacientes con HP, pero no la FC (fig. 1, paneles derechos). No se observaron diferencias en el VO2 entre la PM6M (16±6ml/kg/min) y la PECP (16±6ml/kg/min). El umbral láctico durante la PECP se identificó al 34±13% del VO2 máximo previsto. La PaO2 durante la PM6M cayó moderadamente hasta 80±20mmHg (p<0,05) con un descenso significativo de la PaCO2 hasta 31±5mmHg (p<0,05), respecto a la situación de reposo. El cociente respiratorio y los niveles de lactato en sangre durante la PM6M fueron también significativamente más bajos que en la PECP (p<0,01). Estos pacientes también presentaron un aumento significativo del AaPO2 durante la PECP (ΔAaPO2 14±15mmHg) (p<0,05). El descenso en la SpO2 durante el ejercicio fue menor durante la PECP (desde 98±1% hasta 95±3%, ΔSpO2 −3±3%) que durante la PM6M (ΔSpO2 −5±3%) (p<0,05).
Como se muestra en la figura 2 (panel derecho), los valores de la relación VE/VCO2 en los pacientes con HP fueron marcadamente superiores a los valores de referencia en el umbral anaeróbico durante la PECP28–30. El aumento de la relación VE/VCO2 fue mayor en los pacientes en CF III-IV (85±14), que en aquellos en CF I-II (44±6) (p<0,01). Además, la relación VE/VCO2 mostró una correlación negativa significativa con el índice cardiaco (r=−0,65) (p<0,05).
Comparaciones entre EPID e HP en las pruebas de esfuerzoLas respuestas individuales de VO2 durante la PM6M fueron más heterogéneas en la HP que en el grupo de pacientes con EPID (fig. 1). La VE fue más baja en la EPID (44±13l/min) que en los pacientes con HP (52±15l/min). La frecuencia cardiaca también alcanzó valores más altos en los pacientes con HP respecto a los pacientes con EPID. A pesar de que la oxigenación arterial en reposo fue similar en los dos grupos de pacientes con EPID e HP, la caída de la SpO2 al final de la PM6M fue significativamente menor en los pacientes con HP (ΔSpO2 −5±3%, p<0,001) que en el grupo con EPID (ΔSpO2 −12±5%).
DiscusiónEl presente estudio demuestra que la PM6M generó una capacidad aeróbica máxima en los dos grupos de pacientes, con EPID y con HP. Esta afirmación se basa en dos observaciones principales; en primer lugar, existe una clara limitación de la capacidad de transporte de oxígeno evaluada por la desaturación de la oxihemoglobina arterial inducida por el ejercicio (fig. 1). Segundo, y no menos importante, los valores de VO2 al final de los dos protocolos de ejercicio fueron similares (tabla 2), a pesar de que las cargas de trabajo generadas por los 2 protocolos de ejercicio seguramente fueron diferentes1. La limitación de la capacidad de transporte de oxigeno observada en ambas patologías (EPID y HP) indica que los factores pulmonares y no pulmonares que determinan la oxigenación arterial son incapaces de satisfacer la demanda de oxígeno del músculo durante el ejercicio.
Las respuestas de VO2 descritas en el presente estudio representan una aportación nueva en los pacientes con EPID, mientras que la información obtenida en la HP es coherente con la información publicada por Deboeck et al16. Los resultados en la EPID y la HP en nuestro grupo de sujetos muestran una importante diferencia con los resultados observados en los pacientes con EPOC18 en los que la PM6M se comporta de forma consistente como un ejercicio submáximo de alta intensidad. Del mismo modo, se observó una asociación aceptable entre el VO2 máximo y el VO2 al final de la PM6M, evaluada mediante el análisis de Bland & Altman.
En las dos enfermedades estudiadas, las diferencias en las respuestas fisiológicas entre los dos protocolos de ejercicio (tabla 2) fueron similares a los que ya se han publicado en la literatura médica en otras patologías29. La consistencia interna de nuestras observaciones supone una contribución relevante para replantear el uso clínico de la PM6M en estos las dos enfermedades estudiadas. Parece razonable asumir que la realización durante la PM6M del tipo de mediciones fisiológicas efectuadas en este estudio pueda mejorar el proceso de toma de decisiones tanto en la EPID como en la HP.
Pacientes con enfermedad pulmonar intersticial difusaEn la EPID, las alteraciones producidas a nivel del intercambio de gases durante el ejercicio constituyen un factor pronóstico a tener en cuenta para monitorizar el progreso de la enfermedad y modular las intervenciones terapéuticas5,6,15,31. El presente estudio indica que la PM6M mostró, de una forma sistemática, una mayor señal de ineficacia en el intercambio de gases que el ejercicio cardiopulmonar incremental. Tanto el aumento del AaPO2 inducido por el ejercicio como la caída en la SpO2 fueron más pronunciados durante la PM6M que durante la PECP, lo que podría explicarse parcialmente por el hecho de que durante la PM6M se ejercita más masa muscular. Está aceptado que la limitación del ejercicio en los pacientes con EPID se explica por la alteración en la oxigenación arterial14. Los mecanismos pulmonares principales que causan la hipoxia arterial en la EPID son el desequilibrio entre las relaciones de ventilación-perfusión (VA/Q) y la limitación de la difusión de oxígeno de los alveolos a los capilares13. Durante el ejercicio persiste el desequilibrio de las relaciones VA/Q, empeora la difusión del oxígeno y disminuye la presión parcial de oxígeno en sangre venosa mixta. Todos estos factores juntos explican la caída de la PaO2, inducida por el ejercicio, observada en pacientes con EPID que, como se ha comentado anteriormente, constituye un marcador de mal pronóstico de la enfermedad.
Pacientes con hipertensión pulmonarLa respuesta al ejercicio de los pacientes con HP indica una limitación cardiovascular debida a un incremento de la poscarga del ventrículo derecho que juega un papel importante a la hora de modular la tolerancia al ejercicio en pacientes con enfermedad vascular pulmonar. En estos pacientes, también juega un papel importante la existencia de un desequilibrio de las relaciones de VA/Q; sin embargo, en este caso, el impacto sobre la oxigenación arterial está amplificado por una menor presión parcial de oxígeno en sangre venosa mixta causada por una reducción del gasto cardiaco, que se acentúa durante el ejercicio con el aumento de la demanda de oxígeno32. Cabe destacar también que el cociente VE/VCO2 durante el ejercicio fue anormalmente elevado en la HP que en los pacientes con EPID. Además, los pacientes con HP presentaron una correlación negativa significativa entre dicho cociente y el índice cardiaco, coherente con los mecanismos fisiológicos. Del mismo modo, los pacientes con HP más severa (CF III-IV) presentaron valores del cociente VE/VCO2 marcadamente más altos que aquellos con limitación leve- moderada (CF I-II). Un estudio retrospectivo reciente publicado por Hoeper et al33 revela que tanto la distancia recorrida en la PM6M, la presión en la aurícula derecha como la existencia de una PaCO2 baja, en reposo y durante el esfuerzo son factores de predicción independientes de supervivencia en los pacientes con HP. Nuestros resultados sugieren que el cociente VE/VCO2 durante la PM6M podría constituir una medida indirecta, útil y no invasiva del gasto cardiaco y, en consecuencia, podría constituir un marcador práctico y eficaz para la monitorización clínica de estos pacientes. Se necesitan más estudios para confirmar si la mejoría clínica y el incremento de la distancia recorrida en la PM6M observado con los nuevos tratamientos8,34 está acompañado por un incremento del VO2 junto con una caída del cociente VE/VCO2.
A pesar de que las dos patologías muestran una alteración similar a nivel pulmonar como intercambiador de oxígeno evaluado mediante la diferencia del AaPO2, la caída de la oxigenación arterial durante la PM6M es más acentuada en la EPID que en la HP (fig. 1). En la EPID se justifica por el hecho de que la PaO2 durante el ejercicio está próxima al tramo más pronunciado de la curva de saturación de la oxihemoglobina, sin que se acompañe de cambios en la PaCO2 al pasar de reposo a ejercicio; en cambio, en los pacientes con HP se produjo una marcada caída de la PaCO2 durante el ejercicio que mantuvo la oxigenación arterial en la porción plana de la curva de saturación de la oxihemoglobina y previno parcialmente una caída de la SpO2 inducida por el ejercicio.
Limitaciones del estudioReconocemos que nuestro estudio presenta algunas limitaciones que condicionan la generalización de los resultados. En primer lugar, se evalúa una cohorte retrospectiva, ello puede introducir limitaciones en el análisis de los datos recolectados en el momento de la realización de las pruebas. Segundo, se estudian 2 grupos relativamente reducidos de pacientes heterogéneos con las consiguientes limitaciones de las comparaciones efectuadas y de la generalización de los resultados. Sin embargo el propósito principal del estudio es la descripción de variables fisiológicas en los 2 grupos de pacientes. En el primero de los cuales (EPID), las respuestas fisiológicas durante la PM6M no estaban descritas. En el segundo grupo de pacientes (HP) se comparó una cohorte propia con los resultados descritos por Deboeck et al16, confirmando los hallazgos de estos autores. En tercer lugar, la realización de los 2 protocolos de esfuerzo durante el mismo día puede influenciar el desarrollo del segundo. Sin embargo, por diseño la realización del segundo protocolo de ejercicio se retrasó hasta que los parámetros fisiológicos retornaron a los valores basales. Además, se aleatorizó el orden de los 2 protocolos de ejercicio con lo que este potencial problema tiene una influencia negligible en los resultados finales y no altera las conclusiones de la investigación.
Implicaciones clínicasNuestro estudio destaca el potencial de extender las mediciones fisiológicas durante la PM6M para la monitorización de los pacientes con EPID y HP en la práctica clínica. La limitación de la capacidad aeróbica durante la PM6M en los dos trastornos es claramente el resultado de diferentes mecanismos fisiológicos. En los pacientes con EPID, la caída de la SpO2 inducida por el ejercicio parece jugar un papel decisivo que limita el comportamiento mientras que el incremento de la poscarga del ventrículo derecho constituye el mecanismo que conduce a la limitación del ejercicio en los pacientes con HP. A pesar de que las actuales investigaciones se realizaron en un grupo de estudio bastante reducido, las características de los resultados apoyan firmemente la relevancia clínica de los mismos. La aplicabilidad clínica de la PM6M y su idoneidad para el control longitudinal tanto de la evolución de la enfermedad como de los efectos de las intervenciones terapéuticas da una gran relevancia clínica al presente estudio.
Los continuos avances en las tecnologías móviles facilitan mediciones remotas de las variables fisiológicas durante la marcha y las actividades de la vida cotidiana lo que abre nuevos caminos para la evaluación clínica de los pacientes, tanto en lo que respecta a terapias innovadoras como a su seguimiento. Sin embargo, somos conscientes de que el impacto clínico de las actuales observaciones necesitará posteriores ensayos prospectivos.
FinanciaciónFinanciado por la Fundació Catalana de Pneumologia (FUCAP 2005), el Comissionat per a Universitats i Recerca de la Generalitat de Catalunya (2005-SGR-00822); y el Fondo de Investigación Sanitaria (FIS 061510 y FIS PI060064, FIS-IDIBAPS CM05/00118).
Isabel Blanco es la beneficiaria de una beca de formación para la investigación de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR, 2006)
Claudio Villaquirán es el beneficiario de una beca conjunta para la investigación otorgada por la SEPAR y la Asociación Latinoamericana del Tórax (ALAT, 2005)