Las bronquiectasias no asociadas a la fibrosis quística (BNFQ) son neumopatías crónicas caracterizadas por exacerbaciones frecuentes. El uso de antibióticos inhalados en pacientes con BNFQ permite alcanzar concentraciones más elevadas en el lugar de la infección, sin efectos secundarios sistémicos. Sin embargo, la evidencia sobre la antibioterapia nebulizada en niños es escasa1,2.
Basándonos en el estudio de Maiz et al.3,4, el objetivo de este trabajo es analizar la efectividad y seguridad de la terapia con ampicilina inhalada en niños con BNFQ, colonizados por Haemophilus influenzae(H. influenzae) sensible a ampicilina, Streptococcuspneumoniae sensible a penicilina (SNPS), Staphylococcus aureus sensible a meticilina (SAMS) o flora polimicrobiana.
Se realizó una revisión de historias clínicas, entre el 31/07/2014 y el 31/03/2020. Se incluyeron pacientes menores de 18 años diagnosticados de BNFQ con las colonizaciones respiratorias previamente referidas, ≥3 exacerbaciones respiratorias al año, y/o síntomas persistentes sin cumplir criterios de exacerbación respiratoria5 (tos productiva prolongada, fiebre recurrente inexplicada, cambio cualitativo o cuantitativo de la expectoración) a los que se administró ampicilina inhalada, previo consentimiento de los padres o tutores para administración del antibiótico en condiciones diferentes a las autorizadas.
El fármaco se preparó diluyendo un vial de ampicilina sódica intravenosa en 4ml de agua para inyección. La osmolaridad resultante fue aproximadamente 650 mOsm/kg. La dosis empleada fue 500mg/12 h. La administración se realizó mediante nebulizador de malla vibrante (e-Flow®rapid) o de flujo alto (Pari Boy® SX), usando una mascarilla buconasal o una boquilla según edad y/o colaboración del paciente.
El tiempo mínimo de tratamiento fueron 4 meses. Los periodos de descanso se realizaron en los meses de menor circulación de virus respiratorios6.
Los criterios de suspensión fueron: resolución de los síntomas respiratorios; número de exacerbaciones respiratorias ≤ 1 cada 6 meses; aislamiento de Pseudomonas aeruginosa (PA) o gérmenes resistentes a aminopenicilinas; efectos adversos; rechazo del tratamiento.
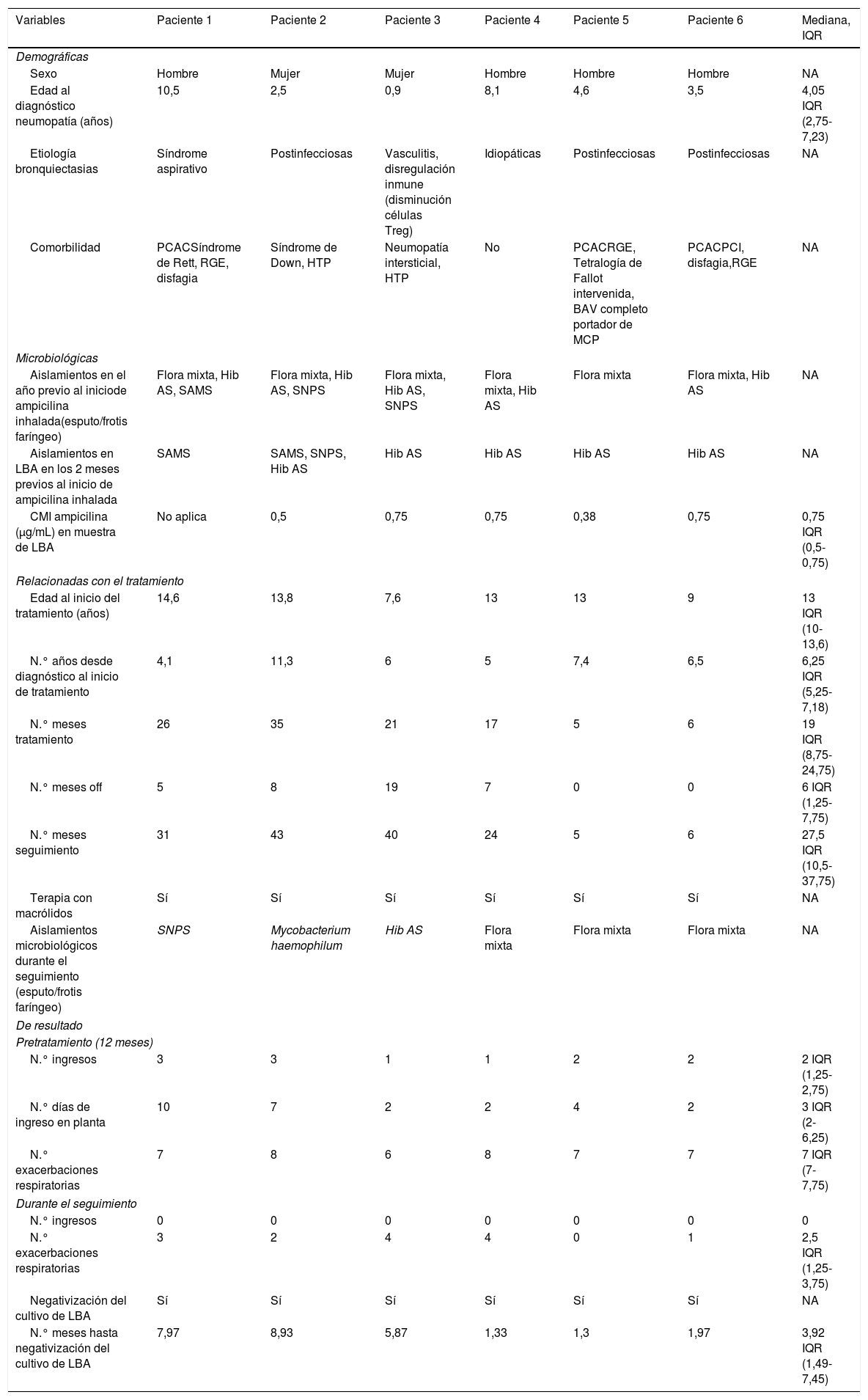
Se incluyeron 6 pacientes, 4 varones. La mediana de edad al inicio del tratamiento fue de 13 IQR (10-13,6) años. Cinco pacientes presentaron otras comorbilidades, siendo 3 de ellos (pacientes 1, 5 y 6) niños con patología crónica altamente compleja7 (tabla 1).
Resumen descriptivo de las principales variables recogidas y de los resultados obtenidos en el estudio
| Variables | Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | Mediana, IQR |
|---|---|---|---|---|---|---|---|
| Demográficas | |||||||
| Sexo | Hombre | Mujer | Mujer | Hombre | Hombre | Hombre | NA |
| Edad al diagnóstico neumopatía (años) | 10,5 | 2,5 | 0,9 | 8,1 | 4,6 | 3,5 | 4,05 IQR (2,75-7,23) |
| Etiología bronquiectasias | Síndrome aspirativo | Postinfecciosas | Vasculitis, disregulación inmune (disminución células Treg) | Idiopáticas | Postinfecciosas | Postinfecciosas | NA |
| Comorbilidad | PCACSíndrome de Rett, RGE, disfagia | Síndrome de Down, HTP | Neumopatía intersticial, HTP | No | PCACRGE, Tetralogía de Fallot intervenida, BAV completo portador de MCP | PCACPCI, disfagia,RGE | NA |
| Microbiológicas | |||||||
| Aislamientos en el año previo al iniciode ampicilina inhalada(esputo/frotis faríngeo) | Flora mixta, Hib AS, SAMS | Flora mixta, Hib AS, SNPS | Flora mixta, Hib AS, SNPS | Flora mixta, Hib AS | Flora mixta | Flora mixta, Hib AS | NA |
| Aislamientos en LBA en los 2 meses previos al inicio de ampicilina inhalada | SAMS | SAMS, SNPS, Hib AS | Hib AS | Hib AS | Hib AS | Hib AS | NA |
| CMI ampicilina (μg/mL) en muestra de LBA | No aplica | 0,5 | 0,75 | 0,75 | 0,38 | 0,75 | 0,75 IQR (0,5-0,75) |
| Relacionadas con el tratamiento | |||||||
| Edad al inicio del tratamiento (años) | 14,6 | 13,8 | 7,6 | 13 | 13 | 9 | 13 IQR (10-13,6) |
| N.° años desde diagnóstico al inicio de tratamiento | 4,1 | 11,3 | 6 | 5 | 7,4 | 6,5 | 6,25 IQR (5,25-7,18) |
| N.° meses tratamiento | 26 | 35 | 21 | 17 | 5 | 6 | 19 IQR (8,75-24,75) |
| N.° meses off | 5 | 8 | 19 | 7 | 0 | 0 | 6 IQR (1,25-7,75) |
| N.° meses seguimiento | 31 | 43 | 40 | 24 | 5 | 6 | 27,5 IQR (10,5-37,75) |
| Terapia con macrólidos | Sí | Sí | Sí | Sí | Sí | Sí | NA |
| Aislamientos microbiológicos durante el seguimiento (esputo/frotis faríngeo) | SNPS | Mycobacterium haemophilum | Hib AS | Flora mixta | Flora mixta | Flora mixta | NA |
| De resultado | |||||||
| Pretratamiento (12 meses) | |||||||
| N.° ingresos | 3 | 3 | 1 | 1 | 2 | 2 | 2 IQR (1,25-2,75) |
| N.° días de ingreso en planta | 10 | 7 | 2 | 2 | 4 | 2 | 3 IQR (2-6,25) |
| N.° exacerbaciones respiratorias | 7 | 8 | 6 | 8 | 7 | 7 | 7 IQR (7-7,75) |
| Durante el seguimiento | |||||||
| N.° ingresos | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| N.° exacerbaciones respiratorias | 3 | 2 | 4 | 4 | 0 | 1 | 2,5 IQR (1,25-3,75) |
| Negativización del cultivo de LBA | Sí | Sí | Sí | Sí | Sí | Sí | NA |
| N.° meses hasta negativización del cultivo de LBA | 7,97 | 8,93 | 5,87 | 1,33 | 1,3 | 1,97 | 3,92 IQR (1,49-7,45) |
BAV: bloqueo aurículo-ventricular; BQ: bronquiectasias; CMI: concentración mínima inhibitoria; Hib AS: Haemophilus influenzae sensible a ampicilina; LBA: lavado broncoalveolar; MCP: marcapasos; PCAC: paciente crónico altamente complejo; PCI: parálisis cerebral infantil; RGE: reflujo gastroesofágico; SAMS: Staphylococcus aureus sensible a meticilina; SNPS: S. pneumoniae sensible a penicilina; Treg: Regulatory T-cells o células T reguladoras.
Las medianas de duración de tratamiento y de seguimiento fueron 17,5 IQR (8,75-24) y 25,5 IQR (10,5-30) meses respectivamente. Solo el paciente 4 había discontinuado la ampicilina al finalizar el estudio.
Durante el seguimiento, no se aislaron microorganismos resistentes a aminopenicilinas o PA. En el paciente 2 hubo un aislamiento de Mycobacterium haemophilum que no se confirmó en cultivos posteriores ni fue clínicamente relevante.
Tras el inicio del tratamiento no se registraron ingresos (p=0,0003) y se objetivó una disminución significativa de la mediana del número de exacerbaciones (p=0,027) de 7 IQR (7-7,75) a 2,5 IQR (1,25-3,75). El paciente 4, en los 2 años posteriores a la interrupción del fármaco realizó más de 10 ciclos de antibioterapia por exacerbaciones respiratorias.
En todos los pacientes se negativizaron los cultivos de secreciones durante el tratamiento, con una mediana de meses hasta la negativización de 3,92 IQR (1,49-7,45).
No se detectaron efectos adversos. En la tabla 1 se resumen las características de los pacientes y resultados.
La terapia nebulizada con aminopenicilinas en pacientes con neumopatías crónicas ha sido estudiada por otros autores, obteniendo resultados favorables8. Asimismo, ensayos clínicos con amoxicilina-clavulánico inhalado han demostrado la seguridad y buena tolerancia de este tratamiento9. No obstante, este es el primer trabajo que estudia la ampicilina nebulizada en niños con BNFQ. En 2009, Maiz et al.3,4 publicaron una serie de 13 pacientes con BQ secundarias a fibrosis quística y colonización crónica por SAMS, objetivando una disminución del número de ingresos hospitalarios y del uso de antibióticos sistémicos, tras realizar tratamiento prolongado con ampicilina inhalada. Aunque los SAMS aislados en los cultivos de esputo fueron resistentes a penicilina, la eficacia del tratamiento se debió probablemente a las altas concentraciones que se alcanzaron a nivel pulmonar administrando el antibiótico por vía inhalatoria, más altas que la concentración mínima inhibitoria (CMI) para los microorganismos frente a los cuales iba dirigido10,11. En este estudio, todos los aislamientos de H. influenzae sensible a ampicilina en LBA fueron sensibles a ampicilina, si bien no se consiguió obtener la CMI para SAMS ni SNPS. Sin embargo, como se ha observado en otros trabajos, independientemente de ello y probablemente por el motivo previamente expuesto10–12, nuestros pacientes respondieron a la ampicilina nebulizada. A diferencia de los pacientes de Maiz, ninguno presentaba colonización crónica por estos gérmenes ya que, fuera de las reagudizaciones y durante el año previo al inicio de la ampicilina, se identificó en las muestras respiratorias flora polimicrobiana mixta o un único microorganismo. Por otro lado, algunas de estas reagudizaciones podrían haber sido iniciadas por virus respiratorios6. No obstante, el descenso en las exacerbaciones podría explicarse porque, más que erradicar un único patógeno, el tratamiento prolongado con ampicilina nebulizada disminuiría la carga bacteriana pulmonar, probablemente aumentada en pacientes con BQ13–15. Asimismo, los gérmenes identificados habitualmente en niños con BNFQ15 son en su mayoría sensibles a aminopenicilinas (más si por vía inhalatoria se alcanzan mayores concentraciones del fármaco), lo que también justificaría la mejoría de nuestros pacientes.
Aun siendo favorables los resultados objetivados en los trabajos previamente mencionados3,4,8,9 (por otro lado, realizados en adultos con patologías distintas a las de nuestros pacientes), referir que, el motivo principal de usar un fármaco fuera de ficha técnica que solo se ha probado en adultos, fue la escasez de opciones terapéuticas (por tratarse de pacientes la mayoría pluripatológicos y/o sin opción a tratamiento curativo) a pesar de haber intentado otros tratamientos, siguiendo las recomendaciones de las últimas guías de práctica clínica1,2,12,16.
Este estudio cuenta con limitaciones, entre ellas el ser un estudio retrospectivo, de antes y después, sin grupo de control, con un grupo reducido y heterogéneo de casos y con un grado variable de seguimiento. Aun así, se observa una disminución estadísticamente significativa de los ingresos y las exacerbaciones respiratorias.
Por ello, concluimos que la terapia prolongada con ampicilina inhalada parece ser una opción segura y efectiva en niños con BNFQ colonizados por gérmenes habituales que presentan reagudizaciones frecuentes. No obstante, son necesarios estudios más amplios, aleatorizados y homogéneos, que confirmen estos resultados y determinen la duración y régimen óptimo de tratamiento con ampicilina inhalada.