Introducción
El trasplante pulmonar puede constituir el tratamiento de determinados procesos pulmonares en fase terminal1,2, enfermedades en cuya etiopatogenia intervienen diversos factores como el tabaco, infecciones repetidas, procesos autoinmunitarios, alteraciones genéticas, etc., que pueden estar implicados, a su vez, en la aparición de procesos neoplásicos que constituirían, salvo rarísimas excepciones, una contraindicación en el procedimiento. Por otro lado, el progresivo incremento de candidatos a trasplante pulmonar, junto a la estabilización, en los últimos años, del número de donantes en nuestro país, hace que la selección de los primeros sea cada día más estricta. Se hace necesaria, por tanto, la aplicación de una gran cantidad de pruebas analíticas, funcionales y de imagen que optimicen el receptor ideal y descarten aquellos en los que existe una contraindicación absoluta o la suma de varias relativas3,4.
A pesar de todo ello, en ocasiones es prácticamente imposible descartar determinados procesos neoplásicos en sus fases iniciales. En esta nota clínica describimos 2 casos en los que se descubrió la presencia de un carcinoma pulmonar en el estudio anatomopatológico de la pieza quirúrgica explantada.
Observación clínica
Entre 1990 y 2005, en el Hospital Universitario La Fe de Valencia se sometió a trasplante pulmonar a 286 pacientes. En una revisión retrospectiva de los resultados anatomopatológicos de los órganos explantados a los receptores, se hallaron 2 piezas donde se describió la presencia de un carcinoma broncogénico no anaplásico de células pequeñas.
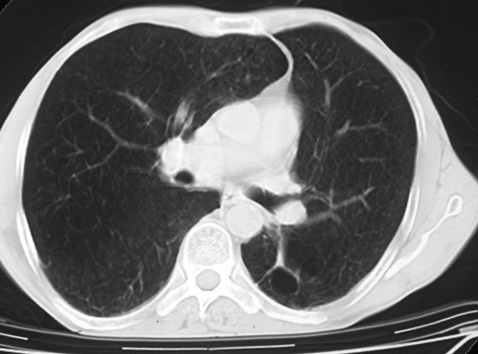
El primer caso era un varón de 57 años con antecedentes de hábito tabáquico y relación laboral con moldes de arena. Se le practicó un trasplante bipulmonar secuencial por un cuadro de silicosis en fase terminal. En la pieza quirúrgica se confirmó el diagnóstico de silicoantracosis, acompañado de abundantes áreas de enfisema bulloso pulmonar. Presentaba en el pulmón derecho un adenocarcinoma broncogénico moderadamente diferenciado, de 1,8 cm de diámetro máximo, en situación hiliar y muy próximo al bronquio principal, que afectaba por contigüidad a una adenopatía de dicha región y que fue clasificado como T1N1M0 (estadio IIa)5 (fig. 1). Transcurridos 6 meses desde el trasplante, se detectó la presencia de múltiples metástasis óseas en la columna vertebral y, 3 meses después, en el lóbulo izquierdo hepático. Se valoró al paciente desde el punto de vista de su enfermedad oncológica y se consideró únicamente su tratamiento paliativo con radioterapia por un cuadro de dolor persistente. Falleció a los 16 meses del trasplante por progresión de la enfermedad tumoral.
Fig. 1. Caso 1: adenocarcinoma broncogénico.
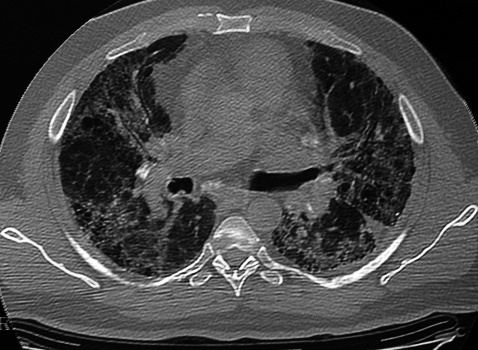
El segundo caso era otro varón de 46 años, sin antecedentes personales de interés, que presentaba fibrosis pulmonar idiopática como enfermedad de base. Tras recibir también un trasplante bipulmonar secuencial, el estudio histológico de los pulmones explantados demostró la presencia de alteraciones encuadrables dentro de una fibrosis pulmonar idiopática en estadio terminal, así como múltiples formaciones bronquiolares con atipismo celular que corresponderían a focos de carcinoma bronquioloalveolar bien diferenciado en su forma difusa (fig. 2). Tres meses después se diagnosticaron múltiples metástasis óseas en la pala ilíaca, fémur, calota y en distintos niveles de la columna. Tras radioterapia paliativa, el paciente falleció al cabo de 5 meses del trasplante.
Fig. 2. Caso 2: múltiples formaciones bronquiolares con atipismo celular que corresponderían a focos de carcinoma bronquioloalveolar.
En los 2 casos se confirmaron las metástasis mediante punción de las lesiones óseas más accesibles, columna vertebral en el primero y hueso ilíaco en el segundo.
Discusión
Son múltiples los trabajos que revisan la aparición de tumoraciones malignas tras la realización de un trasplante pulmonar6-9. Sin embargo, al igual que en nuestro estudio, son pocos los casos descritos en las series publicadas donde se analiza la presencia de neoplasias en los órganos explantados al receptor del trasplante.
De los 183 pulmones analizados por Stewart et al10 sólo se observó un caso con un adenocarcinoma. Dos son los hallazgos que se comunican en la publicación de Svendsen et al11, e igualmente son adenocarcinomas. Por último, Abrahams et al12, en una serie de 214 trasplantes, detectan 4 casos de carcinomas ocultos en la pieza quirúrgica explantada (3 adenocarcinomas y un carcinoma epidermoide). En este último estudio, que es el único donde se analizan tanto la incidencia de este fenómeno en una serie amplia como su impacto en la supervivencia, se comunica un fallecimiento postoperatorio y una supervivencia a largo plazo entre 2 y 6 años.
La presencia de estos tumores ocultos puede determinar en gran medida la supervivencia a largo plazo en un procedimiento ya de por sí dificultoso en sus distintas fases evolutivas. Por ello, y dada la escasez de donantes, es necesario seleccionar a los posibles receptores y descartar a aquellos que, por su teórico mal pronóstico, no rentabilicen un "bien tan preciado".
En el exhaustivo estudio realizado a un paciente para determinar si puede ser beneficiario de un trasplante pulmonar13 hay numerosas pruebas analíticas y de imagen que pretenden, entre otros objetivos, detectar la presencia de una enfermedad neoplásica oculta, que contraindicaría el procedimiento14. A pesar de la importante información que aporta la tomografía axial computarizada (TAC)15, algunas tumoraciones, por su pequeño tamaño o por lo abigarrado de las lesiones pulmonares de base, pasan inadvertidas. Igualmente, ni los valores analíticos ni los marcadores tumorales pueden predecir la presencia de tumoraciones malignas pulmonares. Como refieren Hadjiliadis et al16 en su estudio de 200 trasplantes pulmonares y cardiopulmonares, el antígeno carcinoembrionario, propuesto para detectar tumores ocultos, se encuentra elevado en las enfermedades pulmonares terminales, especialmente en la fibrosis pulmonar idiopática, y los autores señalan que los pacientes que desarrollaron neoplasias tras el trasplante no habían presentado unos valores elevados de dicho antígeno en el estudio prestrasplante.
Abrahams et al12 aconsejan la realización de una TAC de alta resolución poco antes del trasplante (menos de 24 h) como una manera de prevenir estos casos. En el esquema organizativo del trasplante pulmonar en nuestro país, esta propuesta sería muy difícil de llevar a cabo, dada la limitación de tiempos en cuanto al mantenimiento del posible donante, la coordinación de la llegada al hospital del receptor y la ejecución del propio acto quirúrgico.
Está por determinar qué aportarán al estudio pretrasplante las nuevas técnicas de diagnóstico por la imagen como la tomografía por emisión de positrones. Es mucha la reciente bibliografía que hace referencia al papel de ésta en el estudio del carcinoma broncogénico17-19, pero no hemos hallado ninguna publicación en que se estudie su incorporación a la batería de pruebas en el trasplante pulmonar. Por otro lado, al ser muy pocos los casos descritos donde se localiza un carcinoma pulmonar oculto, y dada la probabilidad de falsos positivos en procesos inflamatorios e infecciosos, la aplicación sistemática de esta prueba es, desde el punto de vista clínico y económico, poco rentable, al menos de momento. Posiblemente sí sea de utilidad en los pacientes en que los antecedentes, la clínica o la imagen de TAC sugieran una posible lesión maligna pulmonar.
Por último, una vez detectada la neoplasia en el pulmón nativo, no hay ninguna normativa que recomiende qué actitud adoptar ante este, al menos de momento, poco común acontecimiento. Probablemente serán la descripción de nuevos casos y las enseñanzas que aporte el devenir de su historia clínica las que nos ayuden a decidir cuál es la mejor conducta a seguir en su tratamiento.
Correspondencia: Dr. J.C. Peñalver Cuesta.
Servicio de Cirugía Torácica. Hospital Universitario La Fe.
Avda. Campanar, 21. 46009 Valencia. España.
Correo electrónico: jpenalve@ono.com
Recibido: 6-3-2006; aceptado para su publicación: 4-4-2006.