La pandemia por SARS-CoV-2 en la que estamos inmersos es una buena oportunidad para reflexionar sobre el uso de la oxigenoterapia en el manejo de la insuficiencia respiratoria aguda que con frecuencia acompaña a la COVID-19. En una época en la que la evidencia científica filtra toda práctica clínica, es fácil constatar que no hay respaldo para el modo en que, habitualmente, se emplea la oxigenoterapia en el enfermo con insuficiencia respiratoria aguda1.
Estudios retrospectivos ya demuestran que el uso excesivo de oxígeno no mejora el pronóstico de los enfermos críticos y que la hiperoxia se asocia a una mayor mortalidad2,3. En los años 70, Douglas et al.4 comprobaron que la oxigenoterapia a concentraciones elevadas (FiO2>0,7) incrementaba la proporción de mezcla venosa pulmonar debido a la aparición de atelectasias de absorción y a la abolición del reflejo de vasoconstricción pulmonar hipóxica. Otros autores han demostrado que FiO2 menores (incluso de solo 0,3) pueden provocar las mismas alteraciones en enfermos con enfermedad pulmonar prexistente5.
El aporte excesivo de oxígeno puede deteriorar el intercambio gaseoso al incrementar el estrés oxidativo y la inflamación (efecto Lorrain-Smith). En el contexto epidemiológico actual, el estrés oxidativo adquiere aún más relevancia con la descripción del denominado hyperinflammatory hypercytokinaemia syndrome, vinculado a la neumonía por SARS-CoV-26. Dosis excesivas de oxígeno incrementan la producción de especies reactivas de nitrógeno y de oxígeno (RNS, ROS), el reclutamiento y activación de células inflamatorias y la liberación de mediadores proinflamatorios (IL-1α, IL-6, IL-8 o TNF-α), lo que conlleva consecuencias locales (daño pulmonar) y a distancia (infección y sepsis, daño tisular y fallo multiorgánico). Aunque estos efectos son muy pronunciados con la administración de FiO2 elevadas a largo plazo (más allá de 12 a 24 h), la hiperoxemia de menor duración también se asocia con una mayor morbimortalidad7. Por tanto, la praxis de la hiperoxemia podría representar un marcador indirecto de mal pronóstico en pacientes graves3.
Paradójicamente, la hiperoxemia puede reducir el consumo sistémico de oxígeno, como probable consecuencia de la redistribución del flujo sanguíneo para proteger los órganos vitales de los efectos no fisiológicos de las FiO2 altas (shunt funcional). Además, las PaO2 suprafisiológicas promueven la vasoconstricción arteriolar por mecanismos locales, un fenómeno que podría explicar la peor evolución observada en algunos pacientes con infarto de miocardio, ictus, traumatismo craneoencefálico, paro cardíaco o sepsis, sin olvidar que la hiperoxia tisular favorece el desarrollo de lesiones en situaciones de isquemia-reperfusión8.
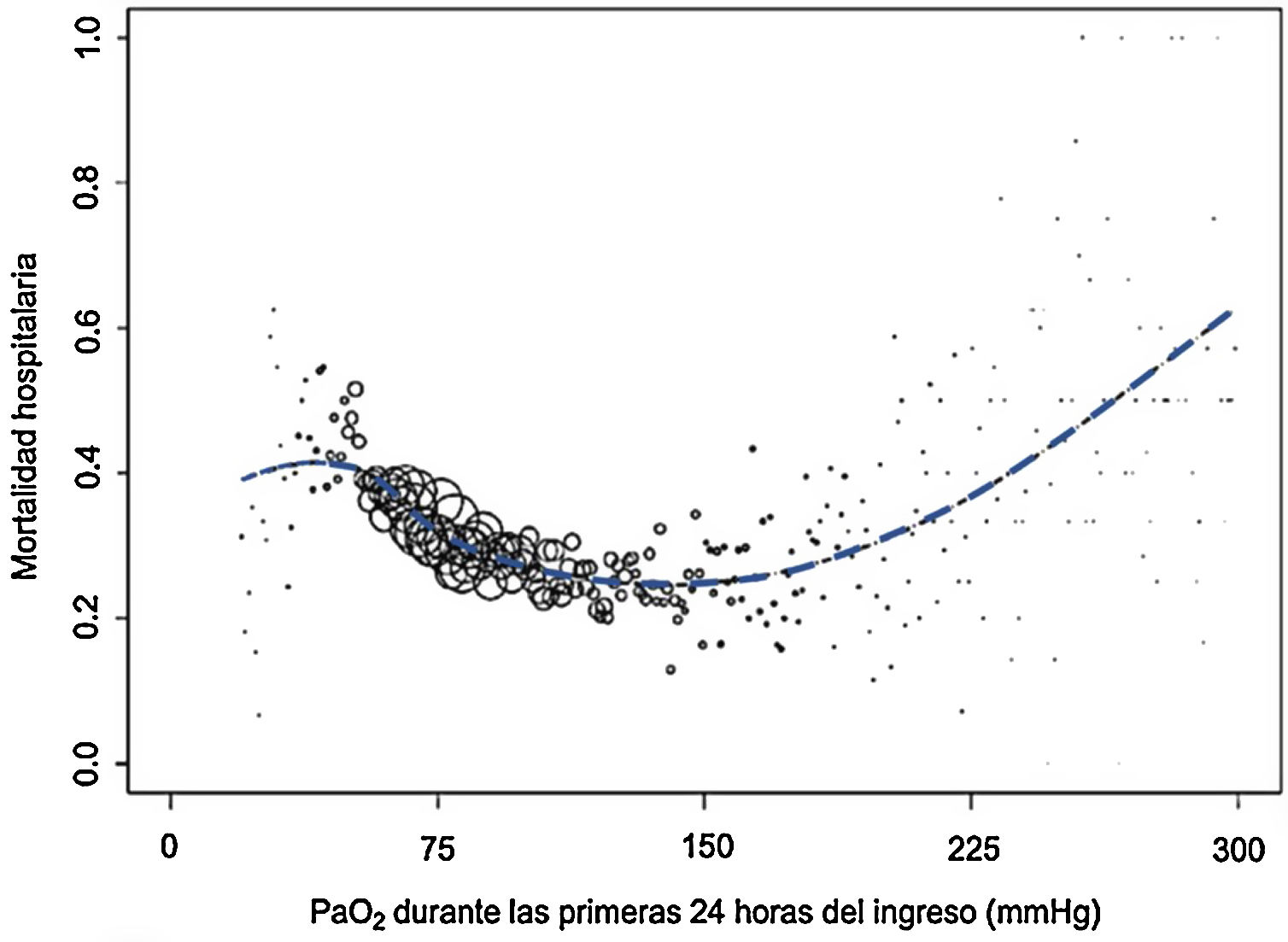
En definitiva, la hiperoxemia puede ser tan peligrosa como la hipoxemia. Un estudio retrospectivo multicéntrico con 36.307 pacientes hospitalizados en unidades de cuidados intensivos (UCI) demostró que los valores de la PaO2 durante las primeras 24 h del ingreso era predictor independiente de mortalidad hospitalaria2. La mortalidad relacionada con la PaO2 adoptaba la forma de U asimétrica con aparente meseta en el extremo de las PaO2 más bajas, incremento lineal en el lado de la hiperoxemia y nadir de mortalidad para un valor de PaO2 entre 110 y 150mmHg (fig. 1).
Valores de mortalidad hospitalaria según PaO2 (mmHg). Los tamaños de los círculos representan el número de pacientes con el mismo valor de PaO2. Tomado de De Jonge et al.2 con autorización.
Expresada como razón estandarizada de mortalidad, la hiperoxemia fue predictora de mortalidad a partir de valores2 de PaO2>125mmHg.
Un reciente ensayo clínico, realizado en pacientes con shock séptico, hubo de detenerse de forma prematura tras comprobar un exceso de mortalidad hospitalaria en los enfermos hiperoxémicos9. La hiperoxemia tampoco parece aportar mayor beneficio tras una parada cardíaca recuperada. Helmerhorst et al.3 demostraron en un estudio observacional que la mortalidad hospitalaria tras una parada cardiorrespiratoria no fue mayor en pacientes con normoxemia (PaO2 55-80mmHg).
La hiperoxemia no beneficia a los enfermos con insuficiencia respiratoria aguda grave. En un estudio con 2.994 pacientes con síndrome de distrés respiratorio agudo (SDRA), se analizó qué efecto producía la exposición a un exceso de FiO2 (FiO2>0,5 cuando el valor de PaO2 era>80mmHg). Se comprobó que, a mayor exposición acumulada a los 5 días, mayor era la mortalidad, el número de días con ventilación mecánica y la estancia hospitalaria. Además, esta mortalidad afectaba a pacientes con SDRA leve, moderado o grave, lo que suponía que la relación observada entre la mortalidad y la exposición acumulada a FiO2 altas era independiente de la gravedad de la enfermedad10. Un reciente ensayo multicéntrico, aleatorizado en pacientes con SDRA, ha confirmado que la oxigenoterapia controlada (PaO2 55-70mmHg o SpO2 88-92%) no aumentaba la mortalidad a los 28 días11.
En enfermos con insuficiencia respiratoria crónica agudizada, las evidencias también respaldan acotar los valores de la SpO2. Plant et al.12 demostraron que, en pacientes con exacerbación de enfermedad pulmonar obstructiva crónica, el uso excesivo de oxigenoterapia se asociaba con acidosis respiratoria y un mayor número de ingresos en UCI. Los autores enfatizaban que la prescripción debería centrarse en alcanzar valores acotados de PaO2 y SaO2 (PaO2 55-75mmHg; SaO2 85-92%). Un ensayo controlado posterior demostró una mayor mortalidad de estos pacientes cuando recibían oxigenoterapia no ajustada a valores de SaO2 entre 88 y 92%13.
Por tanto, la atención al paciente respiratorio agudo debería centrarse en mejorar la función pulmonar con el uso adecuado de la oxigenoterapia, enfoque que difiere de modo considerable de la práctica habitual. FiO2 innecesariamente altas reducen la ventana de oportunidad para introducir un cambio de tratamiento o la posibilidad de aporte adicional de FiO2 en caso de progresión del deterioro respiratorio6. En pacientes hipoxémicos en situación aguda, una SpO2 entre 90 y 94% parece un rango razonable para acomodar sus normales fluctuaciones y suficientemente seguro para evitar daños; además, resulta recomendable la administración de oxigenoterapia con sistemas de alto flujo (por ejemplo, mascarillas Venturi) que permitan regular y asegurar FiO2 estables. Se debería olvidar la idea de asegurar un valor mínimo de PaO2 para evitar la hipoxia tisular y poner énfasis en fijar un valor máximo de seguridad para evitar su toxicidad sistémica (PaO2 <120mmHg). En enfermos con insuficiencia respiratoria hipercápnica, los rangos de SpO2 deberían ser más bajos (88-92%) y considerar el soporte ventilatorio (mejor ventilación mecánica no invasiva) cuando precisen asegurar un mayor transporte de oxígeno (por ejemplo, fallo asociado de otros órganos) o persista la hipercapnia a pesar de FiO2 controladas (0,24-0,4). El alto flujo por cánula nasal puede ser una técnica alternativa y complementaria a la ventilación mecánica no invasiva en los pacientes más graves14. En el caso particular de los pacientes con exacerbación de enfermedad pulmonar obstructiva crónica, algunas guías recomiendan una FiO2 máxima de 0,28, una práctica que también es aconsejable en el entorno prehospitalario15. En ausencia de hipoxemia, debe evitarse el uso de la oxigenoterapia en pacientes con infarto agudo de miocardio, ictus, traumatismo craneoencefálico, tras una parada cardiorrespiratoria y en enfermos con sepsis. En pacientes ingresados en UCI, el uso de protocolos restrictivos de oxigenoterapia (dirigidos a mantener la PaO2 dentro del rango fisiológico) ha demostrado que se tolera bien y puede mejorar el pronóstico9.
En conclusión, la liberalidad en la prescripción de oxígeno contrasta con las exigencias que hoy en día se precisan para el desarrollo y aprobación de cualquier tratamiento. La implementación de dispositivos de titulación automática del flujo de oxígeno podría mejorar la morbimortalidad y reducir los costes del cuidado, aunque difícilmente sustituirá al control clínico16. Mientras tanto, es preciso reforzar la conciencia de que el oxígeno es un fármaco que debe prescribirse para indicaciones definidas en las que los beneficios superen los riesgos, y que se debe especificar la dosis, el sistema de administración, la duración del aporte y el control de la respuesta17.
FinanciaciónLos autores declaran no haber recibido financiación para elaborar este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.