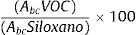Un factor de riesgo importante para el desarrollo de la enfermedad pulmonar obstructiva crónica (EPOC) es el humo del tabaco, que genera estrés oxidativo en las vías respiratorias, dando lugar a la producción de compuestos orgánicos volátiles (VOC). El objetivo del trabajo es su identificación en el aire exhalado y su posible utilidad como biomarcadores de la enfermedad.
MétodoSe analizó el aire exhalado de 100 voluntarios sanos, clasificados en 3grupos (no fumadores, exfumadores y fumadores activos) y un grupo de 57 pacientes con EPOC. La muestra de aire exhalado se recogió mediante BioVOC® y se traspasó a tubos de desorción para su posterior análisis por cromatografía de gases y espectrometría de masas. Los VOC analizados fueron aldehídos lineales y ácidos carboxílicos.
ResultadosHexanal mostró diferencias estadísticamente significativas entre el grupo EPOC y los controles sanos (no fumadores y exfumadores), y nonanal entre el grupo control no fumador y el grupo EPOC.
ConclusionesHexanal discrimina entre pacientes con EPOC y controles sanos no fumadores y exfumadores. Nonanal diferencia entre fumadores y exfumadores (con o sin EPOC) frente a controles no fumadores.
A major risk factor for chronic obstructive pulmonary disease (COPD) is tobacco smoke, which generates oxidative stress in airways, resulting in the production of volatile organic compounds (VOC). The purpose of this study was to identify VOCs in exhaled breath and to determine their possible use as disease biomarkers.
MethodExhaled breath from 100 healthy volunteers, divided into 3groups (never smokers, former smokers and active smokers) and exhaled breath from 57 COPD patients were analyzed. Samples were collected using BioVOC® devices and transferred to universal desorption tubes. Compounds were analyzed by thermal desorption, gas chromatography and mass spectrometry. VOCs analyzed were linear aldehydesand carboxylic acids.
ResultsThe COPD group and healthy controls (never smokers and former smokers) showed statistically significant differences in hexanal concentrations, and never smokers and the COPD group showed statistically significant differences in nonanal concentrations.
ConclusionsHexanal discriminates between COPD patients and healthy non-smoking controls. Nonanal discriminates between smokers and former smokers (with and without COPD) and never smokers.
La enfermedad pulmonar obstructiva crónica (EPOC) se define como una enfermedad respiratoria caracterizada por una limitación al flujo aéreo, crónica y progresiva, que no es totalmente reversible. Los síntomas principales son disnea y tos, acompañadas o no de expectoración. Los pacientes con EPOC presentan agudizaciones cuya gravedad varía en función de la comorbilidad1.
El factor de riesgo más importante en el desarrollo de la EPOC es el tabaco, y se ha demostrado que el riesgo es proporcional al consumo acumulado de cigarrillos2. En la población no fumadora, el 7,6% de los hombres y el 5,5% de las mujeres padecen EPOC en España3, cifra que se eleva hasta el 39,9% de los hombres y al 15,4% de las mujeres que han fumado más de 10años. También aparecen otros factores poco frecuentes, como el déficit de alfa-1-antitripsina o neumonías en la infancia1.
Según la Organización Mundial de la Salud (OMS), la EPOC provoca la muerte de al menos 2,9 millones de personas al año, y se estima que será la tercera causa de muerte mundial en 20304.
En el estudio epidemiológico de la EPOC en España (EPI-SCAN)5, el 73% de los casos confirmados no tenían un diagnóstico previo de EPOC, lo que evidencia un alto grado de infradiagnóstico. La espirometría es la técnica de referencia, pero comporta un riesgo de infradiagnóstico en estadios iniciales y de sobrediagnóstico en edades avanzadas. Existen otros métodos que, aunque útiles, son demasiado invasivos y se descarta su uso rutinario, como el lavado broncoalveolar o la biopsia abierta de pulmón6.
El diagnóstico de EPOC implica una continua búsqueda de técnicas y parámetros que favorezcan las decisiones clínicas. Los biomarcadores son parámetros biológicos que proveen información sobre el estado normal o patológico de un individuo o una población7. El empleo de estos para caracterizar la EPOC está en continuo estudio y recientemente se han investigado posibles biomarcadores en esputo8, en lavado broncoalveolar9 y en aire exhalado10-12.
El aire exhalado contiene multitud de compuestos orgánicos volátiles (VOC), algunos de los cuales podrían ser identificados como biomarcadores y serían de utilidad para caracterizar la EPOC. Su análisis es un procedimiento no invasivo y rápido que podría complementar a la espirometría tanto en el diagnóstico como en el seguimiento. Sin embargo, esta técnica depende de la contaminación de las muestras por la existencia de múltiples compuestos ambientales que es necesario caracterizar a la hora de interpretar los resultados.
El humo del tabaco contiene más de 2.000 compuestos y gran cantidad de radicales libres, especies reactivas de oxígeno y de nitrógeno, que incrementan el estrés oxidativo y la inflamación en los pulmones13. El incremento del estrés oxidativo es responsable de la peroxidación lipídica. El daño generado en esta reacción en cadena produce una gran cantidad de VOC como alcanos, aldehídos y ácidos carboxílicos, entre otros, que pueden ser excretados por las vías aéreas. La presencia de estos en el aire exhalado sugiere la existencia de estrés oxidativo en las vías aéreas y en los pulmones. Estos VOC se ajustan a la definición de biomarcador de inflamación antes comentada.
Existen una serie de estudios referentes14-18 en cuanto al uso de los VOC como biomarcadores para EPOC, comparando grupos con EPOC frente a grupos control clínicamente sanos. Realizan estudios parecidos sin llegar a conclusiones claras por disparidad de resultados.
El objetivo de nuestro estudio es determinar si realmente existen diferencias significativas entre determinados VOC presentes en el aire exhalado de pacientes con EPOC frente a controles sanos, de manera que pueden llegar a considerarse biomarcadores de la enfermedad.
Pacientes y métodosEstudio de casos control, con muestreo consecutivo no probabilístico. Se seleccionaron 157 personas, todos ellos voluntarios, entre trabajadores y pacientes, del Hospital Central de la Defensa «Gómez Ulla» y Cuartel General del Ejército del Aire desde octubre de 2014 a diciembre de 2015. Se establecieron 2 grupos de estudio, uno con 57 enfermos de EPOC en estabilidad clínica y otro de 100 controles sanos (no fumadores, exfumadores y fumadores activos).
Los criterios de inclusión, para los 2 grupos, exigieron la aceptación personal para participar en el estudio, mayores de 40años, ser no fumadores, exfumadores o fumadores activos (según criterios de OMS). A todos se les realizó un cuestionario y una exploración clínica complementaria, incluyendo una curva flujo/volumen. A los componentes del grupo EPOC se les realizaron las pruebas protocolarias para el diagnóstico y seguimiento de la enfermedad, que incluían radiografía de tórax, curva flujo/volumen, prueba broncodilatadora… La gravedad de los pacientes con EPOC fue clasificada según la escala GOLD.
Se consideraron criterios de exclusión la existencia de otra enfermedad pulmonar o tumoral, actual o previa, de cualquier aparato o sistema, o la negativa a participar en el estudio. No se aplicó restricción por razón de género.
Los participantes no estaban sometidos a condiciones ambientales especiales en su trabajo.
Se les informó de los objetivos, riesgos y beneficios, pruebas a realizar y técnicas empleadas para la realización del estudio. Se hizo entrega de un documento informativo previo a la firma del consentimiento informado. Todos los datos recogidos concernientes al estudio se hallan sujetos a lo establecido en la Ley Orgánica de Protección de Datos 15/1999, de 13 de diciembre, y en la Ley 41/2002 de Autonomía del Paciente y de Derecho y Obligaciones en el Manejo de la Información y Documentación Clínica, de 14 de noviembre. El protocolo de estudio fue autorizado por el Comité de Ética e Investigación Clínica del Hospital Central de la Defensa «Gómez Ulla».
Se trata de un trabajo de cromatografía dirigido, es decir, con exigencia previa de selección de compuestos a estudiar. La selección de los VOC se ha basado en:
- 1)
No ser contaminantes ambientales ni del humo del tabaco.
- 2)
Conocer su procedencia metabólica para que puedan cumplir criterios de biomarcador.
Así pues, de más 250 VOC descritos en el aire exhalado en la bibliografía consultada, solo se preseleccionaron 50 en función de su frecuencia. Algunos de ellos eran endógenos procedentes de la peroxidación lipídica. Otros eran contaminantes ambientales y, finalmente, otro grupo constituido por compuestos de origen incierto. Estos 2 últimos grupos se eliminaron, siendo necesario su conocimiento para poder seleccionar los VOC verdaderamente importantes candidatos a posibles biomarcadores.
Finalmente seleccionamos 5 VOC: 3 aldehídos lineales, hexanal, heptanal y nonanal (metabolitos conocidos de la peroxidación lipídica de los ácidos grasos omega3, omega6 y omega9), que cumplían los criterios exigidos, y 2 ácidos carboxílicos, ácido propanoico y ácido nonanoico (igualmente metabolitos de la peroxidación lipídica de ácidos grasos)11,12.
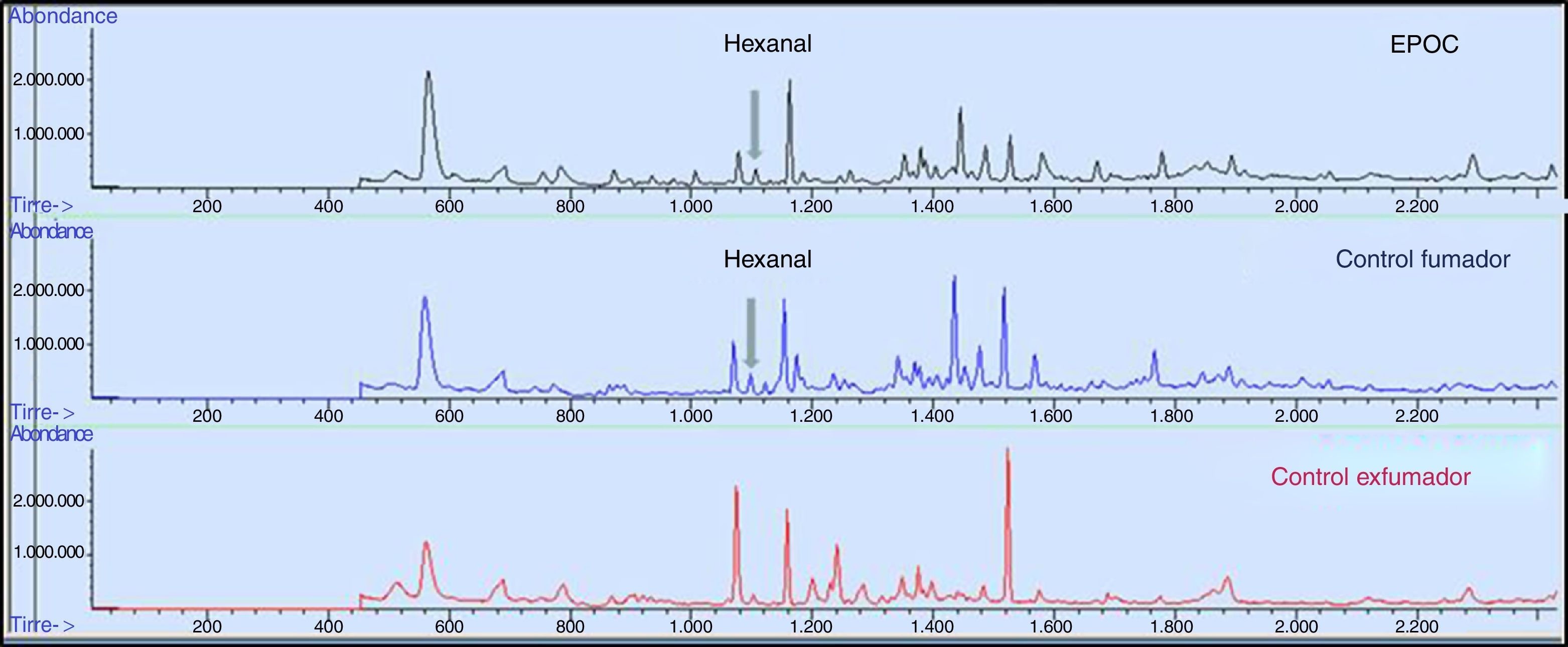
Tras una hora de reposo, ayuno y sin fumar, se recogió la muestra de aire exhalado mediante cámaras BioVOC®, que no ofrecen resistencia al paso del aire, de fácil manejo y permiten analizar un volumen fijo. La muestra de aire exhalado se obtuvo mediante una maniobra de espiración forzada. El aire correspondiente al espacio muerto anatómico pasa a través del BioVOC®, quedando recogida en la cámara la fracción más representativa posible del aire alveolar. Este proceso se repitió 3 veces para la preconcentración de los compuestos. El aire recogido se traspasó a un tubo de desorción térmica capaz de adsorber compuestos desde C2 hasta C20.
Igualmente, se recogió una muestra de aire ambiental de la sala procesándolo con la misma sistemática descrita para el aire exhalado, lo que permitió comparar los niveles de VOC del aire ambiente y del exhalado, y establecer su origen endógeno o exógeno.
Todas las muestras se conservaron a temperatura ambiente (pudiendo permanecer estables hasta 6días, según el fabricante), aunque fueron analizadas en un tiempo máximo de 24h desde su obtención, a fin de minimizar las posibles reacciones cruzadas entre los compuestos, dada la elevada presencia de agua en el aire exhalado.
La metodología de muestreo se halla descrita en publicación previa de nuestro grupo12.
Se obtuvieron 2 tipos de resultados, dependiendo del límite de detección (LOD): compuestos no detectados, aquellos cuyo valor se encontraba por debajo de su LOD, y compuestos detectados, aquellos que superaban su LOD.
La asignación de un compuesto como detectado se realizó mediante 3 etapas:
- 1.
Integración del área del ion cuantificador del espectro de masas para cada uno de los VOC.
- 2.
Normalización del área de cada compuesto con respecto al área del ion 207 (correspondiente al hexametilciclotrisiloxano). Compuesto no orgánico, procedente de los tubos de desorción que no interfiere con los VOC y utilizado como compuesto de referencia interno.
Para normalizar los compuestos se midió el área bajo la curva con la fórmula:
donde Abc: área bajo la curva de cada compuesto. - 3.
Segunda normalización entre aire exhalado y aire ambiental ya normalizados. Se asumió como compuesto detectado cuando mostraba relación de valor en aire exhalado/aire ambiental mayor a 1, o cuando se detectaba en aire exhalado y no en aire ambiental.
Se consideró variable independiente el diagnóstico de EPOC.
Las variables dependientes cualitativas fueron los diferentes VOC, clasificados como no detectados y detectados. Variables sociodemográficas fueron el género y la edad.
Tras la verificación del test de Kolmogorof-Smirnov en las distribuciones de los VOC, se emplearon como índice de tendencia central y de dispersión la mediana y el rango intercuartílico (IQR). Las variables dependientes se expresaron mediante sus frecuencias relativas.
La asociación entre variables independientes y dependientes categóricas se verificó mediante la odds ratio, basada en la regresión logística y su correspondiente intervalo de confianza del 95%.
Para valorar la determinación de VOC como prueba diagnóstica de EPOC se calcularon sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN).
Como grado de significación estadística se consideró un valor de p<0,05 y la aplicación estadística utilizada fue SPSS® versión 20.
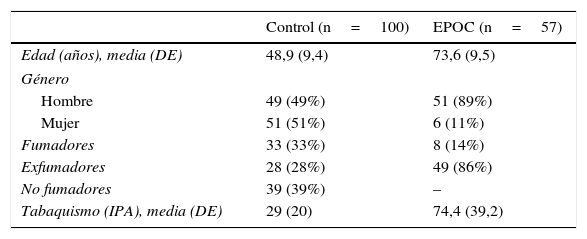
ResultadosEn la tabla 1 se recogen las características demográficas de la población de estudio. El grupo control consta de 100 voluntarios sanos, edad media de 49 (9) años y el grupo EPOC compuesto por 57 pacientes, edad media de 73,6 (9,5) años. La distribución por género fue 49% hombres y 51% mujeres en el grupo control y 89% hombres y 11% mujeres en el grupo EPOC. En el grupo control, el 33% eran fumadores, el 28% exfumadores y el 39% no fumadores, con un índice de paquetes año (IPA) de 29 (20). En el grupo EPOC, un 14% eran fumadores y un 86% exfumadores, IPA 74,4 (39,2). El 14% de los enfermos eran GOLD1, el 31,6% GOLD2, el 24,6% GOLD3 y el 29,8% GOLD4.
Características demográficas de los grupos de estudio
| Control (n=100) | EPOC (n=57) | |
|---|---|---|
| Edad (años), media (DE) | 48,9 (9,4) | 73,6 (9,5) |
| Género | ||
| Hombre | 49 (49%) | 51 (89%) |
| Mujer | 51 (51%) | 6 (11%) |
| Fumadores | 33 (33%) | 8 (14%) |
| Exfumadores | 28 (28%) | 49 (86%) |
| No fumadores | 39 (39%) | – |
| Tabaquismo (IPA), media (DE) | 29 (20) | 74,4 (39,2) |
DE: desviación estándar.
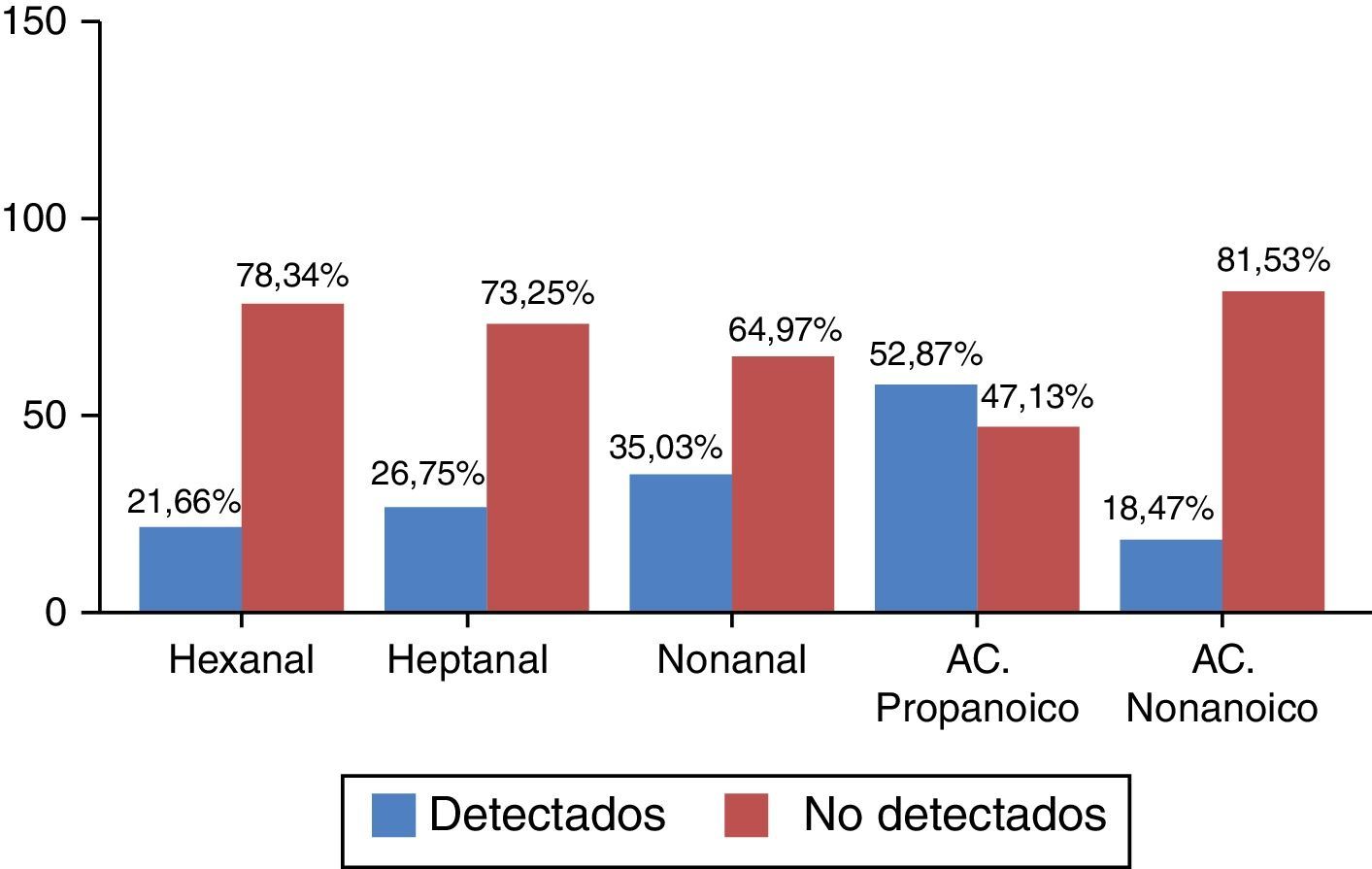
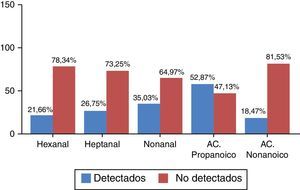
Se distinguieron 2 categorías según los valores obtenidos fueran a) detectados y b) no detectados, por criterios definidos en el apartado «Pacientes y métodos». La distribución de frecuencias, que vulnera la normalidad, en porcentaje se recoge en la figura 1.
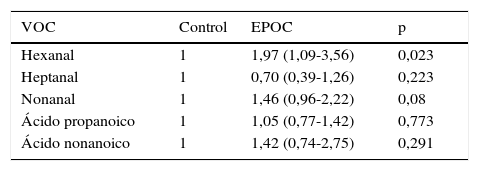
En la tabla 2 se muestran los valores de p calculados mediante la odds ratio basada en la regresión logística, observándose que el hexanal presenta diferencias estadísticamente significativas, con una p=0,023 entre pacientes del grupo EPOC y controles sanos. La probabilidad de encontrar hexanal en el grupo EPOC es 1,97 veces mayor que en el grupo control (IC95%: 1,09-3,56) (sensibilidad 31,57%, especificidad 84%, VPP 52,29% y VPN 68,29%). En los VOC restantes no se encontraron diferencias estadísticamente significativas entre los pacientes con EPOC y el grupo control. No se encontró relación entre la detección de hexanal y la edad (p=0,114), ni con el género (p=1.001) (t de Student y prueba exacta de Fischer, respectivamente).
Relación entre la presencia de marcadores y la presencia de EPOC frente al grupo control
| VOC | Control | EPOC | p |
|---|---|---|---|
| Hexanal | 1 | 1,97 (1,09-3,56) | 0,023 |
| Heptanal | 1 | 0,70 (0,39-1,26) | 0,223 |
| Nonanal | 1 | 1,46 (0,96-2,22) | 0,08 |
| Ácido propanoico | 1 | 1,05 (0,77-1,42) | 0,773 |
| Ácido nonanoico | 1 | 1,42 (0,74-2,75) | 0,291 |
OR e intervalo de confianza al 95% basado en la regresión logística.
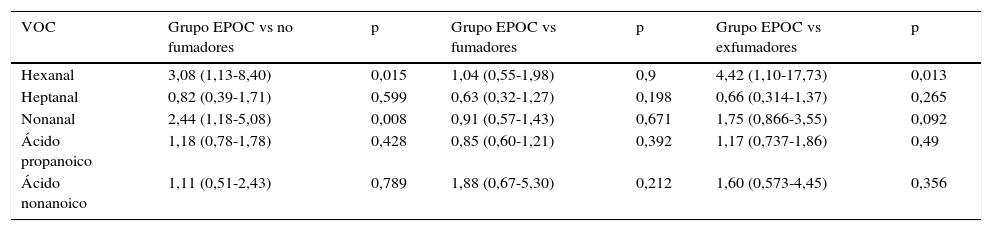
Comparando grupo EPOC frente al subgrupo control no fumador (tabla 3), el hexanal vuelve a mostrar diferencias significativas (p=0,015), con una probabilidad 3,08 veces superior de detectar este VOC en pacientes con EPOC que en las personas no fumadoras (IC95%: 1,13-8,40) (sensibilidad 31,58%, especificidad 89,74%, VPP 81,82% y VPN 47,30%). El nonanal también presenta diferencias estadísticamente significativas (p=0,008) entre controles sanos no fumadores y el grupo EPOC (grupo fumador y exfumador en su totalidad), con una probabilidad 2,44 veces superior de detectar nonanal en pacientes con EPOC (IC95%: 1,17-5,08).
Relación entre la presencia de marcadores y la presencia de EPOC frente a subgrupos control divididos en función del tabaquismo
| VOC | Grupo EPOC vs no fumadores | p | Grupo EPOC vs fumadores | p | Grupo EPOC vs exfumadores | p |
|---|---|---|---|---|---|---|
| Hexanal | 3,08 (1,13-8,40) | 0,015 | 1,04 (0,55-1,98) | 0,9 | 4,42 (1,10-17,73) | 0,013 |
| Heptanal | 0,82 (0,39-1,71) | 0,599 | 0,63 (0,32-1,27) | 0,198 | 0,66 (0,314-1,37) | 0,265 |
| Nonanal | 2,44 (1,18-5,08) | 0,008 | 0,91 (0,57-1,43) | 0,671 | 1,75 (0,866-3,55) | 0,092 |
| Ácido propanoico | 1,18 (0,78-1,78) | 0,428 | 0,85 (0,60-1,21) | 0,392 | 1,17 (0,737-1,86) | 0,49 |
| Ácido nonanoico | 1,11 (0,51-2,43) | 0,789 | 1,88 (0,67-5,30) | 0,212 | 1,60 (0,573-4,45) | 0,356 |
OR e intervalo de confianza al 95% basado en la regresión logística.
Comparando el grupo EPOC y el subgrupo control fumador activo (tabla 3, fig. 2), no presenta significación estadística en los VOC estudiados. Sin embargo, enfrentando el grupo EPOC con el subgrupo control exfumador (tabla 3) se objetiva significación estadística para el hexanal (p=0,013). La probabilidad de detectar hexanal en el grupo EPOC es 4,42 veces superior que en el subgrupo control exfumador (IC95%: 1,10-17,73), (sensibilidad 31,57%, especificidad 92,85%, VPP 90% y VPN 40%).
DiscusiónEl objetivo principal de este trabajo ha sido determinar si existen diferencias entre los 5 VOC seleccionados (hexanal, heptanal, nonanal, ácido propanoico y ácido nonanoico) entre un grupo EPOC y un grupo control presuntamente sano.
Se han encontrado diferencias estadísticamente significativas en el hexanal, siendo la probabilidad de encontrar este VOC 1,97 veces superior en los pacientes con EPOC. Este aldehído es un metabolito final de la peroxidación lipídica de los fosfolípidos que forman las membranas celulares19. Su hallazgo en pacientes con EPOC frente a la no detección en el grupo control indica que es superior el estrés oxidativo presente en las vías respiratorias inferiores de las personas que padecen EPOC. Para comprender mejor estas diferencias entre el grupo control y el grupo EPOC se realizó una subdivisión de los controles en «subgrupo control no fumador», «subgrupo control exfumador» y «subgrupo control fumador» y se enfrentaron por separado al grupo EPOC.
En la primera comparación entre el subgrupo control no fumador y el grupo EPOC, el hexanal mostró diferencias significativas entre ambos grupos, con una probabilidad de detección 3,08 veces mayor en el grupo EPOC. Igualmente, el nonanal presentó diferencias significativas (p=0,008). Este último hallazgo concuerda con los resultados obtenidos en un trabajo anterior donde nonanal se asociaba con tabaquismo12.
Comportamiento similar para el hexanal se observó al comparar el grupo EPOC y el subgrupo control exfumador (p=0,013).
Por el contrario, entre el grupo EPOC y el subgrupo control fumador activo no se encontraron diferencias significativas. Interpretamos que la inflamación secundaria al tabaquismo activo podría enmascarar la inflamación propia de la EPOC, y así la producción de VOC debida a la enfermedad quedaría en segundo término.
Por la misma razón, es lógico pensar que las diferencias significativas en la determinación de hexanal entre los grupos EPOC y control exfumador se deba a que, generalmente, los pacientes abandonan el tabaco en el momento de ser diagnosticados con EPOC, desapareciendo el efecto inflamatorio directo del tabaco.
Este hallazgo complica la valoración del hexanal como biomarcador discriminante de EPOC e imposibilita su aplicación para detectar EPOC en fumadores asintomáticos, uno de los objetivos del trabajo. No obstante, el escaso porcentaje de EPOC en fumadores activos (8 de 57) obliga al estudio posterior de esta subpoblación con n aumentada.
El VPP y la especificidad son elevados para el hexanal entre el grupo EPOC y los subgrupos control no fumador y control exfumador. En relación con este último, este hallazgo podría tener aplicación clínica como cribado, aunque en la actualidad la relación coste/beneficio es alta en comparación con la espirometría convencional.
La gran variedad de métodos analíticos e instrumentales empleados ha conducido a resultados dispares. Por ejemplo, Corradi et al.14 utilizan cromatografía de líquidos de alta resolución y espectrometría de masas, mientras que Basanta et al.15 utilizan cromatografía de gases y espectrometría de masas y tiempo de vuelo. Ambas técnicas, aun estando admitidas, presentan características que no apoyan su utilización. La primera de ellas requiere una disolución de los gases en medio líquido, y la segunda, presenta un alto coste/eficacia. En cambio, nuestra técnica —cromatografía de gases y espectrometría de masas (GC/MS)—, empleada por la gran mayoría de los autores, ofrece buenos resultados a un coste/eficacia mucho menor12,18,20.
La gran cantidad de materiales empleados para la toma de muestra (BioVOC®, SPME, bolsa Tedlar®, tubos de desorción…) genera una amplia variabilidad en los resultados. Nuestro estudio opta por un método general que permite detectar un gran abanico de compuestos (desde C2 hasta C20), manteniendo la sostenibilidad del estudio.
Teniendo en cuenta todo lo anterior, nuestros resultados serían comparables con el trabajo realizado por Phillips et al.18, que utilizaron la misma metodología e instrumentación. Sin embargo, solo hallaron diferencias en el isopreno, compuesto relacionado con la síntesis del colesterol y que no proviene de la peroxidación lipídica, considerándose un factor de confusión, razón por la que se desechó de nuestro estudio.
Hay que ser cauto con los compuestos que se proponen como marcadores. El estudio realizado por Van Berkel et al.17 entre pacientes con EPOC y controles sanos encuentra diferencias en un perfil de 13 VOC, alcanzando una sensibilidad del 100% y una especificidad del 81% cuando se ciñe a 6 de ellos. En nuestra opinión, no deberían valorarse como biomarcadores ni los hidrocarburos ramificados, todos ellos de origen incierto, ni los contaminantes ambientales ni los que provienen del humo del tabaco. Kischkel et al.20 publican un trabajo en el que indican, igual que nosotros, que los VOC que vayan a ser incluidos en los modelos predictivos han de tener un origen bien definido. La existencia de compuestos que muestren significación estadística no es suficiente para su inclusión como biomarcadores. La identificación de biomarcadores ha de estar bien fundada para que la normalización y el procesamiento de datos proporcionen información clínica relevante.
La mayoría de los estudios de EPOC emplean modelos matemáticos con varios compuestos, mientras que en el nuestro solo obtenemos un marcador capaz de diferenciar entre EPOC y subcontroles sanos no fumadores activos. Por el contrario, el modelo propuesto por Basanta et al.15 aumenta notablemente la sensibilidad (90%) cuando seleccionan exclusivamente personas fumadoras activas de los grupos de estudio, EPOC y control. Este aumento se deriva de que la potencia estadística se ve disminuida al reducir considerablemente el tamaño poblacional, pasando de 39 a 20 EPOC fumadores, y de 32 controles fumadores a tan solo 6. Estos resultados, aparentemente tan notables, tienen un sesgo estadístico importante en el tamaño muestral y en la división en subgrupos.
En resumen, el hexanal discrimina entre pacientes con EPOC y controles sanos no fumadores y exfumadores. Nonanal diferencia entre fumadores y exfumadores (con o sin EPOC) frente a controles no fumadores. Es fundamental establecer un consenso en la sistemática de la metodología y selección de compuestos propuestos como biomarcadores.
FinanciaciónEste estudio fue financiado por el Instituto de Salud CarlosIII (PI07/1116), SEPAR 2013 (registro n.° 135).
Conflicto de interesesLos autores declaran que no existe conflicto de intereses potenciales con cualquiera de las empresas cuyos productos o servicios pueden ser discutidos en este artículo.
A la Inspección General de Sanidad (IGESAN) por facilitar la utilización de sus instalaciones.
Al Hospital Central de la Defensa «Gómez Ulla» por la aportación de pacientes y voluntarios al estudio.
Al Cuartel General del Aire por la colaboración por parte de voluntarios al estudio.